4.6: Halógenos y haluros
- Page ID
- 71788
El origen del halógeno es la palabra griega que significa la producción de sal por reacción directa con un metal. Dado que su reactividad es muy alta, los halógenos se encuentran en la naturaleza solo como compuestos. Las propiedades básicas de los halógenos se muestran en Tabla\(\PageIndex{6}\) y Tabla\(\PageIndex{7}\). La configuración electrónica de cada átomo de halógeno es ns 2 np 5, y carecen de un electrón de la estructura de caparazón cerrado de un gas raro. Así, un átomo de halógeno emite energía cuando gana un electrón. A saber, el cambio de entalpía de la reacción $$X\; (g) + e^ {-}\ fila derecha X^ {-}\; (g) $$es negativo. Aunque la afinidad electrónica se define como el cambio de energía de obtener un electrón, habitualmente se usa un signo positivo. Para ser congruente con el cambio de entalpía, sería apropiado un signo negativo.
| Energía de ionización (kJ mol -1) |
Electronegatividad \(\chi_{P}\) |
Radio iónico r (X -) (pm) |
|
|---|---|---|---|
| F | 1680.6 | \ (\ chi_ {P}\) ">3.98 | 133 |
| Cl | 1255.7 | \ (\ chi_ {P}\) ">3.16 | 181 |
| Br | 1142.7 | \ (\ chi_ {P}\) ">2.996 | 196 |
| I | 1008.7 | \ (\ chi_ {P}\) ">2.66 | 220 |
| Distancia interatómica r (X-X) (pm) |
mp °C |
bp °C |
Color | |
|---|---|---|---|---|
| F 2 | 143 | -218.6 | -188.1 | Gas incoloro |
| Cl 2 | 199 | -101.0 | -34.0 | Gas verde amarillo |
| Br 2 | 228 | -7.75 | 59.5 | Líquido rojo oscuro |
| I 2 | 266 | 113.6 | 185.2 | Sólido violeta oscuro |
La afinidad electrónica del cloro (348.5 kJ mol -1) es la mayor y el flúor (332.6 kJ mol -1) se encuentra entre el cloro y el bromo (324.7 kJ mol -1). La electronegatividad del flúor es la más alta de todos los halógenos.
Dado que los halógenos se producen como sales metálicas, las sustancias simples se fabrican por electrólisis. El flúor solo toma el número de oxidación -1 en sus compuestos, aunque el número de oxidación de otros halógenos puede variar de -1 a +7. Astadino, At, no tiene nucleido estable y poco se sabe sobre sus propiedades químicas.
a) Fabricación de halógenos
El flúor tiene el mayor potencial de reducción (E = +2.87 V) y el poder oxidante más fuerte entre las moléculas halógenas. También es el elemento no metálico más reactivo. Dado que el agua es oxidada por F 2 a un potencial de electrodo mucho menor (+1.23 V), el gas flúor no puede fabricarse mediante la electrólisis de soluciones acuosas de compuestos de flúor. Por lo tanto, pasó mucho tiempo antes de que se aislara el flúor elemental, y F. F. H. Moisson finalmente logró aislarlo mediante la electrólisis de KF en HF líquido. El flúor se sigue fabricando por esta reacción.
El cloro, que es especialmente importante en la química industrial inorgánica, se fabrica junto con hidróxido de sodio. La reacción básica para la producción de cloro es la electrólisis de una solución acuosa de NaCl mediante un proceso de intercambio iónico. En este proceso, se genera gas cloro en una celda anódica que contiene salmuera y Na + se mueve a través de una membrana de intercambio iónico hasta la celda catódica donde se empareja con OH - para convertirse en una solución acuosa de NaOH.
Ejercicio\(\PageIndex{5}\)
¿Por qué se puede fabricar el cloro por electrólisis de una solución acuosa de cloruro de sodio?
- Contestar
-
A pesar del mayor potencial de reducción del cloro (+1.36 V) que el del oxígeno (+1.23 V), el potencial de reducción del oxígeno puede elevarse (sobretensión) dependiendo de la elección del electrodo utilizado para el proceso de electrólisis.
El bromo se obtiene por la oxidación de Br- con gas cloro en agua salina. El yodo se produce de manera similar haciendo pasar gas cloro a través de agua salina que contiene iones I. Dado que el gas natural se encuentra en Japón junto con el agua salina subterránea que contiene I - Japón es uno de los principales países productores de yodo.
Anomalías del flúor
Los compuestos moleculares de flúor tienen puntos de ebullición muy bajos. Esto se debe a la dificultad de polarización como resultado de que los electrones son fuertemente atraídos hacia los núcleos de los átomos de flúor. Dado que la electronegatividad del flúor es más alta (\(\chi\)= 3.98) y los electrones se desplazan a F, dando como resultado la alta acidez de los átomos unidos a F. Debido al pequeño radio iónico de F -, los estados de oxidación altos se estabilizan, y por lo tanto se desconocen compuestos de baja oxidación como el CuF, en contraste con los compuestos tales como IF 7 y PtF 6.
Pseudohalógenos
Dado que el ion cianuro CN -, el ion azida N 3-, y el ion tiocianato SCN -, etc. forman compuestos similares a los de los iones haluro, se denominan iones pseudohaluro. Forman moléculas psudohalógenas como cianógeno (CN) 2, cianuro de hidrógeno HCN, tiocianato de sodio NASCN, etc. afinando efectos electrónicos y estéricos que son imposibles con solo iones haluro hacen que los pseudohalógenos sean útiles también en la química de complejos de metales de transición.
Polihalógenos
Además de las moléculas halógenas habituales, también existen moléculas mixtas de halógenos y polihalógenos como BrCl, IbR, iCl, ClF 3, BrF 5, IF 7 etc. También se conocen aniones y cationes polihalógenos como I 3 -, I 5 -, I 3 +, y I 5 +.
b) Compuestos oxigenados
Aunque se conocen muchos óxidos binarios de halógenos (que consisten únicamente en halógeno y oxígeno), la mayoría son inestables. El difluoruro de oxígeno DE 2 es el compuesto más estable de este tipo. Este es un agente fluorante muy potente y puede generar hexafluoruro de plutonio PuF 6 a partir de plutonio metálico. Si bien el cloruro de oxígeno, Cl 2 O, se utiliza para blanquear pulpa y tratamiento de agua, se genera in situ a partir de ClO 3 -, ya que es inestable.
Ácido hipocloroso, HClO, ácido cloroso, HClO 2, ácido clórico, HClO 3 y ácido perclórico, HClO 4 son oxoácidos de cloro y especialmente el ácido perclórico es un agente oxidante fuerte además de ser un ácido fuerte. Aunque desde hace muchos años se conocían ácidos e iones análogos de otros halógenos, BrO 4 - se sintetizó tan tarde como 1968. Una vez que se preparó resultó no menos estable que ClO 4 -o IO 4 -, lo que provocó que algunos se preguntaran por qué no se había sintetizado antes. Aunque ClO 4 - se utiliza a menudo para cristalizar complejos de metales de transición, es explosivo y debe manejarse con mucho cuidado.
c) Halouros de no metales
Se conocen haluros de casi todos los no metales, incluyendo fluoruros de incluso los gases inertes criptón, Kr, y xenón, Xe. Aunque los fluoruros son interesantes por sus propios caracteres únicos, los haluros son generalmente muy importantes como compuestos de partida para diversos compuestos de no metales al reemplazar halógenos en síntesis inorgánicas (Tabla\(\PageIndex{8}\)).
| 1 | 2 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|
| 2 | LiCl | BecL 2 | BF 3 | CCl 4 | NF 3 | DE 2 | |||
| 3 | NaCl | MgCl 2 | AlCl 3 | SiCl 4 | PCl 3 PCl 5 |
S 2 Cl 2 SF 6 |
CLF 3 CLf 5 |
||
| 4 | KCl | CaCl 2 | ZnCl 2 | GACL 3 | GEF 2 GECl 4 |
AScl 3 ASf 5 |
Se 2 Cl 2 SeF 5 |
BrF 3 BrF 5 |
KRF 2 |
| 5 | RBCl | SrCl 2 | CdCl 2 | Incl 3 |
SnCl 2 SnCl 4 |
SbCl 3 SbF 5 |
Te 4 Cl 16 TeF 6 |
SI 5 SI 7 |
XeF 2 xEF 6 |
| 6 | CsCl | BacL | Hg 2 Cl 2 HgCl 2 |
TlCl 3 |
PbCl 2 PbCl 4 |
BiCl 3 BiF 5 |
El trifluoruro de boro, BF 3, es un gas incoloro (mp -127 °C y bp -100 °C) que tiene un olor irritante y es venenoso. Es ampliamente utilizado como catalizador industrial para reacciones de tipo Friedel-Crafts. También se utiliza como catalizador para la polimerización catiónica. Existe en la fase gaseosa como una molécula monomérica triangular, y forma aductos de base de Lewis con amoníaco, aminas, éteres, fosfinas, etc. debido a su fuerte acidez de Lewis. El aducto de éter de dietilo, (C 2 H 5) 2 O:BF 3, es un líquido destilable y se utiliza como reactivo común. Es un compuesto de partida para la preparación de diborano, B 2 H 6. Tetrafluoroborato, BF 4 -, es un anión tetraédrico formado como aducto de BF 3 con una base F -. Las sales de metales alcalinos, una sal de plata y NOBF 4 así como el ácido libre HBF 4 contienen este anión. Dado que su capacidad de coordinación es muy débil, se utiliza en la cristalización de complejos catiónicos de metales de transición como un contra-anión como ClO 4 -. AgBF 4 y NOBF 4 también son útiles para la oxidación de complejos por 1 electrón.
El tetraclorosilano, SiCl 4, es un líquido incoloro (mp -70 °C y pb 57.6 °C). Es una molécula tetraédrica regular, y reacciona violentamente con el agua formando ácido silícico y ácido clorhídrico. Es útil como materia prima para la producción de silicio puro, compuestos orgánicos de silicio y siliconas.
El trifluoruro de fósforo, PF 3, es un gas venenoso incoloro, inodoro y mortal (mp -151.5 °C y bp -101.8 °C). Se trata de una molécula piramidal triangular. Debido a que es tan atrayente de electrones como el CO, actúa como un ligando formando complejos metálicos análogos a los carbonilos metálicos.
El pentafluoruro de fósforo, PF 5, es un gas incoloro (mp -93.7 °C y bp -84.5 °C). Es una molécula bipiramidal triangular y debe tener dos tipos distintos de átomos de flúor. Estos fluorinos intercambian posiciones tan rápidamente que son indistinguibles por 19 F NMR. Fue el primer compuesto con el que se descubrió la famosa pseudorotación de Berry como mecanismo de intercambio de átomos de flúor axiales y ecuatoriales (consultar la Sección 6.1). El ion hexafluorofosfato, PF 6 -, así como BF 4 - se utiliza a menudo como contra-anión para complejos catiónicos de metales de transición. LiPF 6 y R 4 NPF 6 se pueden utilizar como electrolitos de soporte para mediciones electroquímicas.
El tricloruro de fósforo, PCl 3, es un líquido fumante incoloro (mp -112 °C y bp 75.5 °C). Es una molécula piramidal triangular e hidroliza violentamente. Es un soluble en solventes orgánicos. Se utiliza en grandes cantidades como materia prima para la producción de compuestos orgánicos de fósforo.
El pentacloruro de fósforo, PCl 5, es una sustancia cristalina incolora (sublima pero se descompone a 160 °C) Es una molécula bipiramidal triangular en fase gaseosa, pero existe como un cristal iónico [PCl 4] + [pCl 6] - en el sólido fase. Aunque reacciona violentamente con el agua y se convierte en ácido fosfórico y ácido clorhídrico, se disuelve en disulfuro de carbono y tetracloruro de carbono. Es útil para la cloración de compuestos orgánicos.
El pentafluoruro de arsénico, AsF 5, es un gas incoloro (mp -79.8 °C y bp -52.9 °C). Se trata de una molécula bipiramidal triangular. Aunque se hidroliza, es soluble en solventes orgánicos. Al ser un aceptor de electrones fuerte, puede formar complejos donador-aceptor de electrones con donadores de electrones.
El hexafluoruro de azufre, SF 6, es un gas incoloro e inodoro (mp -50.8 °C y punto de sublimación -63.8 °C) Es una molécula octaédrica hexacoordinada. Es químicamente muy estable y apenas soluble en agua. Debido a su excelente propiedad de resistencia al calor, incombustibilidad y resistencia a la corrosión, se utiliza como aislante de alto voltaje.
El cloruro de azufre, S 2 Cl 2, es un líquido naranja (mp -80 °C y bp 138 °C). Tiene una estructura similar al peróxido de hidrógeno. Es fácilmente soluble en solventes orgánicos. Es importante como compuesto inorgánico industrial, y se utiliza en grandes cantidades para la vulcanización de caucho etc.
d) Halogenuros metálicos
Muchos haluros metálicos se elaboran por la combinación de aproximadamente 80 elementos metálicos y cuatro halógenos (Tabla\(\PageIndex{8}\), Tabla\(\PageIndex{9}\)). Dado que hay más de un estado de oxidación especialmente en los metales de transición, se conocen varios tipos de haluros para cada metal de transición. Estos haluros son los más importantes como materiales de partida para la preparación de compuestos metálicos, y la química inorgánica de los compuestos metálicos depende de los haluros metálicos. Hay haluros moleculares, de cadena unidimensional, de capa bidimensional y haluros tridimensionales, pero pocos de ellos son moleculares en estados cristalinos. Cabe señalar que los haluros de metales de transición anhidros suelen ser compuestos sólidos y los hidratos son compuestos de coordinación con ligandos de agua. Como la dimensionalidad de las estructuras es una de las facetas más interesantes de la química estructural o sintética, se describen haluros típicos en orden de su dimensionalidad.
| Número de Oxidación | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|---|---|---|---|---|---|---|---|---|---|
| +1 | SCCl YCl LacL |
ZrCl HfCl |
CuCl AgCl AUCl |
||||||
| +2 | TiCL 2 | VCl 2 | CrCl 2 MoCl 2 WCl 2 |
MnCl 2 | FeCl 2 RuCl 2 |
CoCl 2 | NiCl 2 PdCl 2 PdCl 2 |
CuCl 2 | |
| +3 | SCf 3 YCl 3 LaF 3 |
TiCl 3 ZrCl 3 |
VCl 3 | CrCl 3 MoCl 3 WCl 3 |
RecL 3 | FeCl 3 RuCl 3 OscL 3 |
CoF 3 RHCl 3 IrCl 3 |
AUCl 3 | |
| +4 | TiCl 4 ZrCl 4 HfCl 4 |
VCl 4 NbCl 4 TacL 4 |
CrF 4 MoCl 4 WCl 4 |
RecL 4 | PTCl 4 | ||||
| +5 | MBC 5 NbCl 5 TaCl 5 |
CrF 5 MoCl 5 WCl 5 |
RecL 5 | OsF 5 | IRF 5 | PtF 5 | |||
| +6 | ReF 6 | OsF 6 | IRF 6 | PtF 6 | |||||
| +7 | ReF 7 | OsF 7 |
Halouros moleculares
Cloruro de mercurio (II), HgCl 2
Es un cristal incoloro soluble en agua y etanol. Se trata de una molécula recta, tres atómica en estado libre. Sin embargo, además de dos átomos de cloro unidos al mercurio, cuatro átomos de cloro adicionales de moléculas adyacentes ocupan sitios de coordinación y el mercurio está casi hexacoordinado en estado cristalino. El compuesto es muy tóxico y se utiliza para conservar la madera, etc.
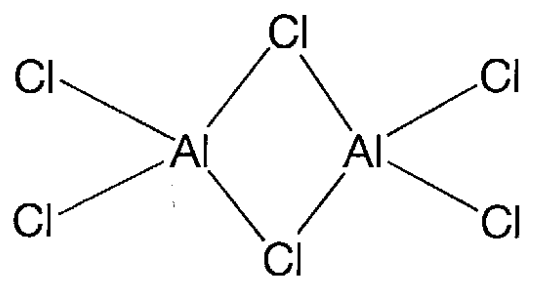
Tricloruro de aluminio, AlCl 3.
Un cristal incoloro (mp 190 °C (2.5 atm) y bp 183 °C) que sublima cuando se calienta. Es soluble en etanol y éter. Es un ácido de Lewis y forma aductos con diversas bases. Es una molécula que consiste en el dímero de aluminio tetracoordinado con puentes de cloro en las fases líquida y gaseosa (Figura\(\PageIndex{21}\)), y toma una estructura laminar cuando es cristalina. Se utiliza como catalizador ácido de Lewis de reacciones de Friedel-Crafts, etc.
Cloruro de estaño (IV), SnCl 4
Un líquido incoloro (mp -33 °C y bp 114 °C). En estado gaseoso, es una molécula tetraédrica.
Cloruro de titanio (IV), TiCl 4
Un líquido incoloro (mp -25 °C y bp 136.4 °C). La molécula gaseosa es un tetraedro similar al cloruro de estaño (IV). Se utiliza como componente del catalizador Ziegler Natta (consulte la Sección 8.1 (a)).
Haluros en forma de cadena
yoduro de oro (I), AUI
Sólido amarillo blanco. Dos yodinas se coordinan con el oro, y el compuesto tiene una estructura de cadena unidimensional en zigzag.
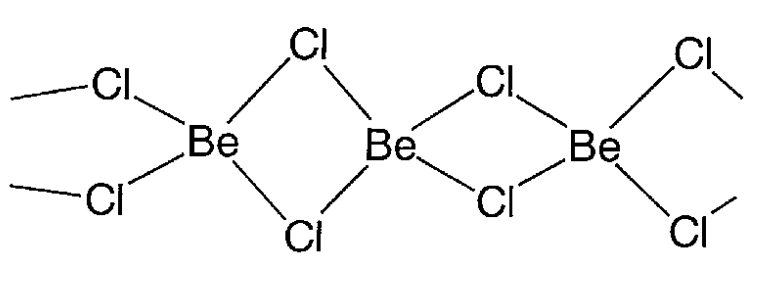
Cloruro de berilio, BeCl 2
Un cristal incoloro (mp 405 °C y bp 520 °C). Es delicuescente y soluble en agua y etanol. El berilio tetracoordinado forma una cadena unidimensional a través de puentes de cloro (Figura\(\PageIndex{22}\)). En la fase gaseosa, es una molécula recta de dos coordenadas. Es un ácido de Lewis y se utiliza como catalizador para las reacciones de Friedel-Crafts.
Cloruro de paladio, PdCl 2
Un sólido rojo oscuro. En el\(\alpha\) tipo, el paladio de cuatro coordenadas forma una cadena unidimensional con dobles puentes de cloros. El dihidrato es delicuescente y soluble en agua, etanol, acetona, etc. cuando se disuelve en ácido clorhídrico, se convierte en cuatro coordenadas cuadrado-planares [PdCl 4] 2-. Se utiliza como catalizador para el proceso Wacker, que es un proceso de oxidación de olefinas, o en diversos catalizadores para síntesis orgánica.
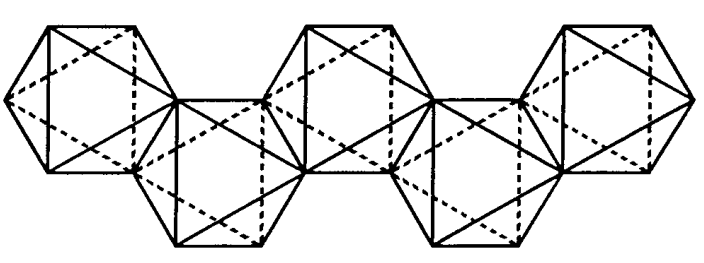
Tetracloruro de circonio, (IV) ZrCl 4
Un cristal incoloro (sublima por encima de 331 °C). El circonio está coordinado octaédricamente y forma una cadena en zigzag a través de puentes de cloro (Figura\(\PageIndex{23}\)). Es higroscópico y soluble en agua, etanol, etc. Se utiliza como catalizador Friedel-Crafts y como componente de catalizadores de polimerización de olefinas.
Halouros estratificados
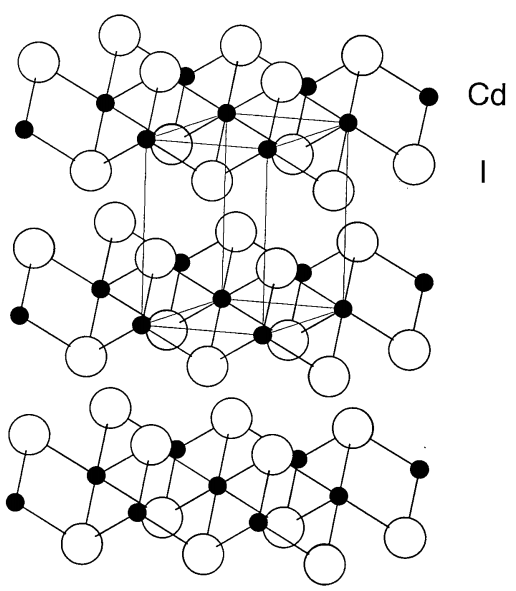
yoduro de cadmio, CDI 2
Un cristal incoloro (mp 388 °C y bp 787 °C). Tiene una estructura de yoduro de cadmio donde se estratifican las capas de unidades octaédricas CdI 6 de borde compartido (Figura\(\PageIndex{24}\)). En la fase gaseosa, comprende tres moléculas atómicas rectas. Se disuelve en agua, etanol, acetona, etc.
Cloruro de cobalto (II), COCl 2
Cristales azules (mp 735 °C y bp 1049 °C). Tiene la estructura de cloruro de cadmio. Es higroscópico y se vuelve rojo claro cuando se absorbe el agua. Es soluble también en etanol y acetona. El hexahidrato es rojo y es un compuesto de coordinación en el que las moléculas de agua son ligandos.
Cloruro de hierro (II), FeCl 2
Cristales de color amarillo verdoso (pf 670-674 °C). Tiene la estructura de cloruro de cadmio, y es soluble en agua y etanol. Los hidratos, que están coordinados por diversos números (6, 4, 2) de moléculas de agua, se precipitan a partir de soluciones acuosas de ácido clorhídrico.
Cloruro de hierro (III), FeCl 3
Cristales de color marrón oscuro (p.f. 306 °C y sublima). Tiene una estructura laminar en la que el hierro está rodeado octaédricamente por seis ligandos de cloro. En la fase gaseosa, tiene una estructura dimérica puenteada por átomos de cloro similar a la del cloruro de aluminio.
Halouros de estructura tridimensional
Cloruro de sodio, NaCl
Un cristal incoloro (mp 801 °C y bp 1413 °C). Es la estructura original tipo sal de roca. En la fase gaseosa, esta es una molécula de dos átomos. Aunque es soluble tanto en glicerol como en agua, apenas se disuelve en etanol. Los monocristales grandes se utilizan como prismas para espectrómetros de infrarrojos.
Cloruro de cesio, CsCl
Un cristal incoloro (mp 645 °C, bp 1300 °C). Aunque tiene la estructura tipo cloruro de cesio, cambia a la estructura de sal de roca a 445 °C; en la fase gaseosa, es una molécula de dos átomos.
Cloruro de cobre (I), CuCl
Un cristal incoloro (mp 430 °C y bp 1490 °C) Tiene la estructura de blenda de zinc y cuatro cloros se coordinan tetraédricamente con el cobre.
Cloruro de calcio, CaCl 2
Un cristal incoloro (mp 772 °C y pb por encima de 1600 °C). Tiene una estructura tipo rutila deformada y el calcio está rodeado octaédricamente por seis cloros. Es soluble en agua, etanol y acetona. Es delicuescente y se utiliza como desecante. Se conocen hidratos en los que se coordinan 1, 2, 4 o 6 moléculas de agua.
Fluoruro de calcio, CaF 2
Un cristal incoloro (mp 1418 °C y bp 2500 °C). Tiene la estructura tipo fluorita. Es la materia prima más importante para los compuestos de flúor. Cristales de buena calidad se utilizan también como prismas espectrómetro y en lentes fotográficas.
Cloruro de cromo (II), CrCl 2
Un cristal incoloro (mp 820 °C y sublima). Tiene una estructura deformada tipo rutilo. Se disuelve bien en agua dando una solución azul.
Cloruro de cromo (III), CrCl 3
Cristal rojo purpúreo (mp 1150 °C y se descompone a 1300 °C). Cr 3 + ocupa dos tercios de las cavidades octaédricas en cada otra capa de iones Cl -, las cuales están hexagonalmente empaquetadas. Es insoluble en agua, etanol y acetona.
Ejercicio\(\PageIndex{6}\)
¿Por qué los haluros metálicos sólidos se disuelven en agua?
- Contestar
-
Esto se debe a que el agua reacciona con haluros rompiendo los puentes halógenos en las estructuras sólidas y se coordina con los complejos moleculares resultantes.

