5.1: Metales del Grupo 1
- Page ID
- 71639
Los metales del grupo 1 se denominan metales alcalinos. Los metales alcalinos abundan en minerales y agua de mar. Especialmente el contenido de sodio, Na, en la corteza terrestre es cuarto después de Al, Fe y Ca. Si bien la existencia de iones de sodio o potasio fue reconocida por muchos años, una serie de intentos de aislar los metales de soluciones acuosas de sus sales fracasaron debido a su alta reactividad con el agua. El potasio (1807) y posteriormente el sodio fueron aislados por la electrólisis de sal fundida de KOH o NaOH por H. Davy en el siglo XIX. El litio Li fue descubierto como un nuevo elemento (1817), y Davy pronto lo aisló por electrólisis de sal fundida de Li 2 O. Rubidio, Rb y Cesio, Cs, fueron descubiertos como nuevos elementos por espectroscopia en 1861. Francium, Fr, fue descubierto usando una técnica radioquímica en 1939. Su abundancia natural es muy baja.
| mp (°C) |
bp (°C) |
d (20 °C) (g cm -3) |
E 0 (V) M + + e - |
I (kJ mol -1) |
|
|---|---|---|---|---|---|
| Li | 181 | 1342 | 0.534 | -3.04 | 520 |
| Na | 98 | 883 | 0.968 | -2.71 | 496 |
| K | 63 | 759 | 0.856 | -2.93 | 419 |
| Rb | 39 | 688 | 1.532 | -2.98 | 403 |
| Cs | 28 | 671 | 1.90 | -3.03 | 376 |
Como se muestra en la Tabla\(\PageIndex{1}\), los puntos de fusión, los puntos de ebullición y las densidades de los metales alcalinos son bajos, y son metales blandos. Dado que la capa externa contiene solo un electrón s, la energía de ionización es muy baja y se forman fácilmente mono cationes de metales alcalinos. El análisis cualitativo de metales alcalinos es posible mediante reacciones a la llama utilizando líneas de luminiscencia características. Especialmente la línea D naranja de sodio se utiliza en la lámpara de sodio. Los metales alcalinos son oxidados por el agua que desprende gas hidrógeno debido a sus bajos potenciales de reducción. Excepto el litio, los metales alcalinos más pesados reaccionan violentamente con el agua, y se debe tener suficiente precaución en su manejo.
Ejercicio\(\PageIndex{1}\)
Describir la reactividad de los metales alcalinos en el agua.
- Contestar
-
La reactividad del litio es la más baja, el sodio reacciona violentamente y el potasio, el rubidio y el cesio reaccionan explosivamente.
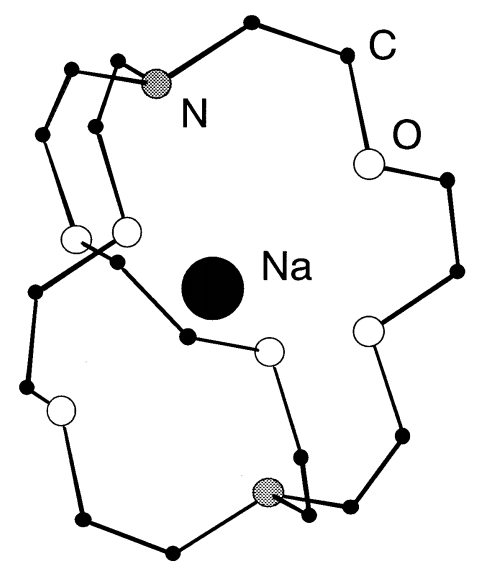
Los metales alcalinos también son altamente reactivos al oxígeno o halógenos. Como los metales alcalinos son muy reductores, se utilizan ampliamente como agentes reductores. Debido a la alta afinidad de los metales alcalinos a los halógenos, son importantes en las síntesis orgánicas e inorgánicas que producen haluros de metales alcalinos como resultado de reacciones de condensación y metátesis. Aunque generalmente es difícil disolver metales en solventes para hacer dipersiones atómicas, los metales alcalinos se pueden dispersar en soluciones líquidas de amoníaco, amalgamas y como criptand (Figura\(\PageIndex{1}\)), naftaleno o benzofenona (C 6 H 5) 2 complejos de CO.
El amoníaco hierve a -33.35 °C pero el amoníaco líquido se puede manejar fácilmente. Los metales alcalinos se disuelven fácilmente en amoníaco líquido y las soluciones diluidas son azules pero las concentradas muestran un color bronce. El metal se recupera cuando el amoníaco se evapora de las soluciones metálicas. Las soluciones de metales alcalinos muestran el mismo color independientemente del tipo de metales alcalinos que el color se debe a los electrones solvatados. A saber, la disolución va acompañada de la separación de los átomos de metal alcalino en cationes metálicos y electrones solvatados por amoníaco, de acuerdo con la siguiente ecuación.
\[M + n\; NH_{3} \rightarrow M^{+} [e^{-} (NH_{3})]\]
La solución de amoníaco líquido de un metal alcalino es conductora y paramagnética. La solución altamente reductora se utiliza para reacciones especiales de reducción o síntesis de complejos de metales alcalinos y polihaluros.

