6.3: Estructura Electrónica de Complejos (Parte 2)
- Page ID
- 71728
Teoría orbital molecular de los complejos de metales de transición
Las características de los enlaces metal-ligando de transición se ponen de manifiesto mediante un análisis de los orbitales moleculares de un metal 3d coordinado por seis ligandos idénticos en complejos octaédricos [ML 6]. Como resultado de la interacción entre el metal d y los orbitales del ligando, se forman orbitales moleculares complejos de unión, no unión y antiunión.
Generalmente, los niveles de energía de los orbitales del ligando son menores que los de los orbitales metálicos, los orbitales de unión tienen más carácter de ligando y los orbitales no enlazantes y antiadherentes tienen más carácter metálico. Los procesos de formación de los orbitales\(\sigma\) y\(\pi\) moleculares se describen paso a paso a continuación.
\(\sigma\)bono
En primer lugar, considerar el\(\sigma\) enlace M-L entre las interacciones de los orbitales de metal s, p, d y ligando asumiendo la posición de un metal en el origen del sistema de coordenadas cartesianas y localizando ligandos en los ejes de coordenadas. Como el\(\sigma\) enlace es un enlace sin nodos a lo largo de los ejes de unión, el metal s orbital (a 1g, no degenerado), p x, p y, p z orbitales (t 1u, triply-degenerado), y d x 2 -y 2, d z 2 orbitales (e g, doblemente degenerados) encajan simetría (+, - signos) y formas orbitales con los\(\sigma\) orbitales de los ligandos (Figura\(\PageIndex{9}\)).
Cuando los orbitales del ligando son\(\sigma_{1}\) y\(\sigma_{2}\) a lo largo del eje x,\(\sigma_{3}\) y\(\sigma_{4}\) a lo largo del eje y,\(\sigma_{5}\) y\(\sigma_{6}\) a lo largo del eje z en la Figura\(\PageIndex{5}\), seis orbitales atómicos del ligando se agrupan haciendo combinaciones lineales de acuerdo con la simetría de los orbitales metálicos. Entonces el orbital para encajar con el metal a 1g orbital es un 1g (\(\sigma_{1} + \sigma_{2} + \sigma_{3} + \sigma_{4} + \sigma_{5} + \sigma_{6}\)), el que encaja con los orbitales de metal t 1u es t 1u (\(\sigma_{1} - \sigma_{2}, \sigma_{3} - \sigma_{4}, \sigma_{5} - \sigma_{6}\)) y el que encaja con el metal e g orbitales es e g (\(\sigma_{1} + \sigma_{2} - \sigma_{3} - \sigma_{4}, \sigma_{5} + \sigma_{6} − \sigma_{1} - \sigma_{2} - \sigma_{3} - \sigma_{4}\)). Existe una interacción de unión entre los orbitales e g metálicos y los orbitales del grupo ligando y se forman orbitales moleculares de unión y antiunión. La relación se muestra en la Figura\(\PageIndex{10}\).
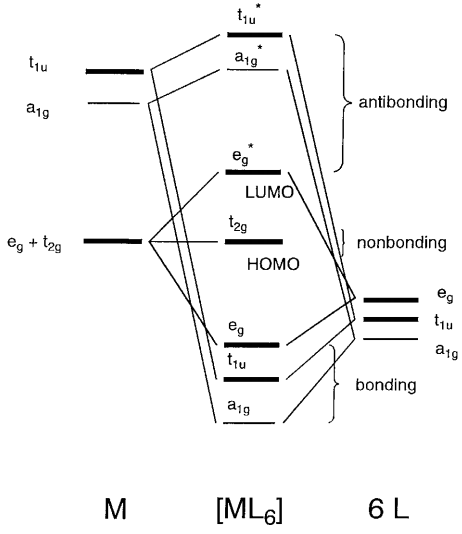
Los niveles de los orbitales moleculares de la energía más baja son la unión (a 1g < t 1u < e g) < no unión (t 2g) < anti-unión (e g * < a 1g * < t 1u *). Por ejemplo, en un complejo como [Co (NH 3) 6] 3+, 18 electrones de valencia, 6 de cobalto y 12 de amoníaco, ocupan 9 orbitales de abajo hacia arriba, y t 2g es el HOMO y e g * el LUMO. La diferencia de energía entre los dos niveles corresponde a la división del campo del ligando. A saber, el conjunto e g (d x 2 -y 2, d z 2) y los ligandos en la esquina del octaedro forman los orbitales σ de unión pero el conjunto t 2g (d xy, d yz, d xz) permanecen sin unión porque los orbitales no están dirigidos a los\(\sigma\) orbitales del ligando.
\(\pi\)bono
Cuando los orbitales atómicos del ligando tienen\(\pi\) simetría (es decir, con nodos) a través del eje del enlace, los orbitales e g (d x 2 -y 2) son no enlazantes y los orbitales t 2g (d xy, d yz, d xz) tienen vinculando interacciones con ellos (Figura\(\PageIndex{11}\)). En los iones haluro, X -, o ligandos aqua, H 2 O, los orbitales p\(\pi\) simétricos tienen menor energía que los orbitales metálicos t 2g y un orbital molecular de unión, que es más bajo que el orbital t 2g, y un orbital molecular antienlace, que es mayor que los orbitales t 2g, forma. En consecuencia, la diferencia de energía\(\Delta_{o}\) entre e g y los orbitales antiadherentes se vuelve más pequeña. Por otro lado, para los ligandos que tienen\(\pi\) orbitales antienlace dentro de la molécula, como el monóxido de carbono o etileno, los\(\pi^{*}\) orbitales coinciden con la forma y simetría de los orbitales t 2g y los orbitales moleculares mostrados en la figura 6.12 (b) forma. Como resultado, el nivel de energía de los orbitales de unión disminuye y\(\Delta_{o}\) se hace más grande.
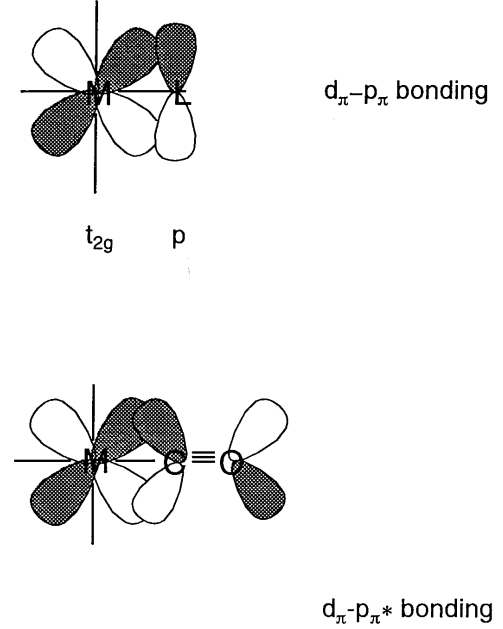
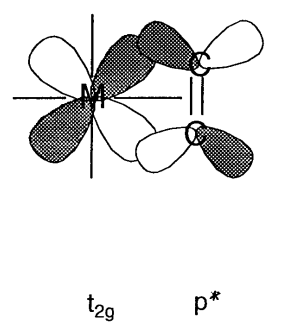
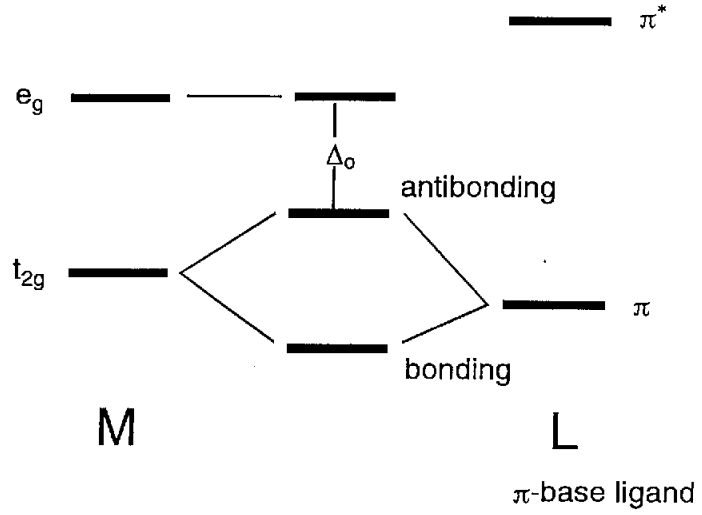
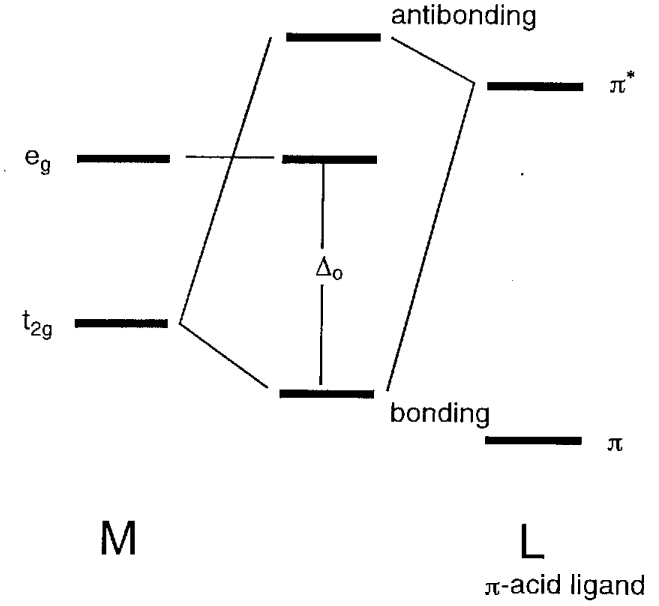
Usando estas simples consideraciones orbitales moleculares, los efectos\(\sigma\) y las interacciones\(\pi\) orbitales entre el metal y los ligandos sobre los orbitales moleculares son cualitativamente comprensibles.
(c) Espectros
Muchos complejos de metales de transición tienen colores característicos. Esto significa que hay absorción en la parte visible del espectro resultante de que un electrón es excitado por la luz visible desde un nivel ocupado por un electrón en un orbital molecular del complejo hasta un nivel vacío. Si la diferencia de energía entre los orbitales capaces de transición se establece en\(\Delta\) ε, la frecuencia de absorción ν viene dada por\(\Delta Ε = h \nu\). Las transiciones electrónicas por bombeo óptico se clasifican ampliamente en dos grupos. Cuando ambos orbitales moleculares entre los cuales es posible una transición tienen principalmente carácter d metálico, la transición se denomina transición d-d o transición de campo de ligando, y la longitud de onda de absorción depende fuertemente de la división del campo ligando. Cuando uno de los dos orbitales tiene principalmente carácter metálico y el otro tiene un gran grado de carácter ligando, la transición se denomina transición de transferencia de carga. Las transiciones de transferencia de carga se clasifican en transferencias de carga de metal (M) a ligando (L) (MLCT) y transferencias de carga de ligando a metal (LMCT).
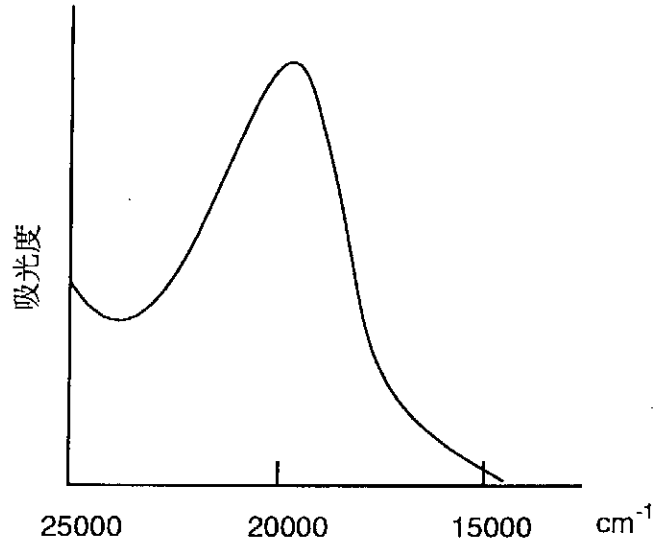
Dado que el análisis de los espectros de los complejos octaédricos es comparativamente fácil, se han estudiado en detalle durante muchos años. Cuando un complejo tiene solo un electrón d, el análisis es sencillo. Por ejemplo, Ti en [Ti (OH 2) 6] 3+ es un ion d 1, y un electrón ocupa el orbital t 2g producido por la división octaédrica del campo ligando. El complejo es púrpura como resultado de tener una absorción a 492 nm (20300 cm -1) (Figura\(\PageIndex{13}\)) correspondiente al bombeo óptico de un electrón d al eg orbital. Sin embargo, en un complejo con más de un d electrones, hay interacciones repelentes entre los electrones, y el espectro de transición d-d tiene más de una absorción. Por ejemplo, un complejo d 3 [Cr (NH 3) 6] 3+ muestra dos absorciones d-d en la región de 400 nm (25000 cm -1), lo que sugiere que el complejo tiene dos grupos de orbitales moleculares entre los cuales es posible una transición electrónica con un alto grado de probabilidad de transición. Esto significa que, cuando tres electrones en el orbital t 2g se excitan al orbital e g, hay dos diferencias de energía debido a interacciones repelentes entre los electrones.
Los diagramas Tanabe-Sugano se construyen a partir de cálculos basados en la teoría de campos de ligandos y han sido ampliamente utilizados en el análisis de espectros de absorción de iones d 1 a d 9. El análisis se vuelve cada vez más difícil para iones con muchos electrones. En cualquier caso, la existencia de un espectro d-d requiere que la diferencia de energía de un orbital ocupado y un orbital vacío sea equivalente a la energía del espectro UV-visible, la transición es permitida por la regla de selección, y la probabilidad de transición es lo suficientemente alta. Generalmente, una absorción de transferencia de carga es más fuerte que una absorción de campo de ligando. Un LMCT surge cuando los ligandos tienen un par de electrones no enlazantes de energía comparativamente alta o el metal tiene orbitales vacíos de baja energía. Por otro lado, un MLCT tiende a aparecer cuando los ligandos tienen\(\pi^{*}\) orbitales de baja energía, y los complejos de bipiridina son buenos ejemplos de ello. Dado que la vida del estado excitado de un complejo de rutenio [Ru (bipy) 3] 2+ es extraordinariamente larga, se han realizado muchos estudios sobre sus reacciones fotorredox.
Serie espectroquímica
La magnitud del parámetro de división del campo del ligando\(\Delta_{o}\) está determinada principalmente por la identidad de los ligandos. Una regla empírica llamada serie espectroquímica fue propuesta por un científico japonés Ryutaro Tsuchida. La regla se construyó a partir de datos empíricos recolectados cuando se midieron espectros de complejos que tienen el mismo metal central, estado de oxidación, número de coordinación, etc. Es de destacar que los ligandos con propiedades\(\pi\) aceptoras se encuentran en una posición superior en la serie.
I - < Br - < S 2- < SCN - < Cl - < NO 3 - < F - < OH - < H 2 O < NH 3 < NO 2 < PPh 3 < CN - < CO
Aunque se\(\Delta_{o}\) hace más grande en este orden, también depende de la identidad del metal central y su estado de oxidación. A saber,\(\Delta_{o}\) es más grande para los metales 4d y 5d que para los metales 3d y se vuelve más grande a medida que aumenta el número de oxidación. La magnitud de\(\Delta_{o}\) está estrechamente relacionada con su posición de absorción en el espectro electromagnético, y es un factor clave para determinar la posición de un ligando en la serie espectroquímica. Un ligando\(\pi\) donante (halógeno, aqua, etc.) hace que la longitud de onda de absorción sea más larga, y un ligando\(\pi\) aceptor (carbonilo, olefina, etc.) más corto por contribución del\(\pi\) enlace.
d) Magnetismo
La magnetización, M, (momento dipolar magnético por unidad de volumen) de una muestra en un campo magnético, H, es proporcional a la magnitud de H, y la constante de proporcionalidad,\(\chi\), depende de la muestra.
\[M = \chi H\]
\(\chi\)es la susceptibilidad volumétrica y el producto\(\chi\) y el volumen molar V m de una muestra es la susceptibilidad molar\(\chi_{m}\). A saber,
\[\chi_{m} = \chi V_{m}\]
Todas las sustancias tienen diamagnetismo, y además de esto, las sustancias con electrones desapareados exhiben paramagnetismo, cuya magnitud es aproximadamente 100 veces mayor que la del diamagnetismo. La ley de Curie muestra que el paramagnetismo es inversamente proporcional a la temperatura.
\[\chi_{m} = A + \frac{C}{T}\]
donde T es la temperatura absoluta y A y C son constantes. En los métodos de Gouy o Faraday, los momentos magnéticos se calculan a partir del cambio de peso de una muestra suspendida entre imanes cuando se aplica un campo magnético. Además de estos métodos, recientemente se ha utilizado el SQUID (dispositivo de interferencia cuántica superconductora) altamente sensible para llevar a cabo tales mediciones.
El paramagnetismo es inducido por el momento magnético permanente de un electrón desapareado en una molécula y la susceptibilidad molar es proporcional al momento angular del espín electrónico. Los complejos paramagnéticos de metales de transición de bloque d tienen electrones desapareados de número cuántico de espín 1/2, y la mitad del número de electrones desapareados es el número cuántico de espín total S. Por lo tanto, el momento magnético basado solo en espines puede derivarse teóricamente.
\[\mu = 2 \sqrt{2S(S+1)} \mu_{B} = \sqrt{n(n+2)} \mu_{B}\]
Aquí\(\mu_{Β}\) = 9.274 x 10 -24 JT -1 es una unidad llamada el magnetón Bohr.
Muchos complejos metálicos 3d muestran una buena concordancia entre los momentos magnéticos de los complejos paramagnéticos medidos por un equilibrio magnético con los valores calculados por la fórmula anterior. La relación entre el número de electrones desapareados y la susceptibilidad magnética de un complejo se muestra en la Tabla\(\PageIndex{3}\). Debido a esta concordancia con la teoría, es posible determinar el número de electrones desapareados a partir de valores experimentales de mediciones magnéticas. Por ejemplo, se puede suponer que un complejo Fe 3 + d 5 con un momento magnético de aproximadamente 1.7\(\mu_{Β}\) es un complejo de bajo giro con un giro desapareado pero un complejo Fe 3 + d 5 con un momento de aproximadamente 5.9\(\mu_{Β}\) es un complejo de alto giro con 5 electrones desapareados.
| Ion metálico | Electrón desapareado | Momento magnético de solo giro (\(\frac{\mu}{\mu_{B}}\)) | |
|---|---|---|---|
| n | \ (\ frac {\ mu} {\ mu_ {B}}\)) "> Calculado | Medido | |
| Ti 3 + | 1 | \ (\ frac {\ mu} {\ mu_ {B}}\)) ">1.73 | 1.7~1.8 |
| V 3+ | 2 | \ (\ frac {\ mu} {\ mu_ {B}}\)) ">2.83 | 2.7~2.9 |
| Cr 3 + | 3 | \ (\ frac {\ mu} {\ mu_ {B}}\)) ">3.87 | 3.8 |
| Mn 3 + | 4 | \ (\ frac {\ mu} {\ mu_ {B}}\)) ">4.90 | 4.8~4.9 |
| Fe 3+ | 5 | \ (\ frac {\ mu} {\ mu_ {B}}\)) ">5.92 | 5.9 |
Sin embargo, el momento magnético medido ya no concuerda con el valor calculado de solo giro cuando la contribución del momento angular orbital al momento magnético se vuelve grande. Especialmente en complejos metálicos 5d, esta discrepancia entre los valores medidos y calculados aumenta.
Ejercicio\(\PageIndex{3}\)
Calcule los momentos magnéticos de solo giro de los complejos Fe 3 + de alto y bajo giro.
- Contestar
-
Dado que son complejos d 6, un complejo de espín alto tiene cuatro electrones desapareados con el momento magnético es 4.90\(\mu_{B}\) y un complejo de espín bajo no tiene electrones desapareados y es diamagnético.
Algunos materiales sólidos paramagnéticos se vuelven ferromagnéticos a bajas temperaturas al formar dominios magnéticos en los que miles de espines de electrones se alinean paralelos entre sí. La temperatura a la que se produce la transición de fase paramagnética-ferromagnética se denomina temperatura de Curie. Cuando los espines están alineados antiparalelos entre sí, el material cambia a una sustancia antiferromagnética, y esta temperatura de transición se llama la temperatura de Néel. El material se vuelve ferrimagnético cuando los giros se cancelan de forma incompleta. Recientemente, se han hecho intentos de sintetizar complejos polinucleares multi-espín con ligandos especiales que hacen que los iones metálicos paramagnéticos se alineen para inducir interacciones ferromagnéticas entre los espines. Este efecto es imposible en complejos mononucleares.

