6.4: Química Organometálica de Metales en Bloque d (Parte 1)
- Page ID
- 71749
La química organometálica de los metales de transición es comparativamente nueva. Si bien en el siglo XIX se preparó un complejo de etileno de platino llamado sal de Zeise, K [PtCl 3 (C 2 H 4)], tetracarbonilníquel, Ni (CO) 4 y pentacarbonilron, Fe (CO) 5, que hoy en día se clasifican como compuestos organometálicos, se desconocían sus uniones y estructuras. La investigación de W. Hieber y otros sobre compuestos carbonílicos metálicos fue importante en la década de 1930, pero los resultados de estos estudios fueron limitados debido a las técnicas subdesarrolladas de análisis estructurales disponibles en ese momento.
El descubrimiento del ferroceno, Fe (C 5 H 5) 2, en 1951 fue época para la química de este campo. El modo de unión muy singular de este complejo se hizo evidente mediante análisis estructural de rayos X monocristalinos, espectros de RMN, espectros infrarrojos, etc., y sirvió como punto de partida para desarrollos posteriores en el campo. Fue un descubrimiento importante que el ferroceno exhibió una estabilidad térmica muy alta a pesar de la visión general de que los enlaces metal-carbono de transición eran muy inestables. También se demostró claramente que el compuesto tenía una estructura sándwich en la que los cinco átomos de carbono de los grupos ciclopentadienilo se unieron simultáneamente al hierro metálico central. Si bien los diversos modos de coordinación de los ligandos hidrocarbonados se determinaron uno tras otro, la importancia industrial de los compuestos organometálicos de metales de transición aumentó con los descubrimientos de catalizadores de polimerización de olefinas (catalizador Ziegler), catalizadores de hidrogenación homogéneos (catalizador Wilkinson), y desarrollo de catalizadores para la síntesis asimétrica, etc. El premio Nobel otorgado a K. Ziegler, G. Natta (1963), E. O. Fischer, y G. Wilkinson (1973) fue en reconocimiento de esta importancia.
De acuerdo con la definición de un compuesto organometálico, debería existir al menos un enlace directo entre un metal y un átomo de carbono, pero los complejos CN etc. sin carácter organometálico generalmente se excluyen de los compuestos organometálicos. Los compuestos carbonílicos metálicos son organometálicos en diversos aspectos de su unión, estructura y reacciones, y son un buen sistema modelo para comprender la esencia de la química organometálica de metales de transición.
a) Compuestos carbonílicos metálicos
Los compuestos carbonílicos metálicos binarios que consisten únicamente en un metal y ligandos de CO se preparan generalmente mediante la reacción directa del polvo de un metal altamente reactivo y monóxido de carbono, o por la reducción de una sal metálica a cenefa cero seguida de reacción con monóxido de carbono de alta presión. Sin embargo, el tetracarbonilníquel, descubierto por primera vez a finales del siglo XIX, se forma por la reacción del metal níquel y el monóxido de carbono a presión atmosférica y a temperatura ambiente. La preparación de otros compuestos carbonílicos metálicos, por otro lado, requiere altas temperaturas y altas presiones.
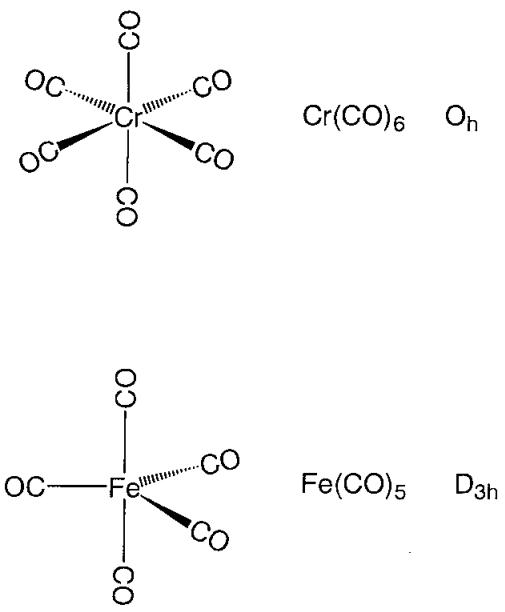
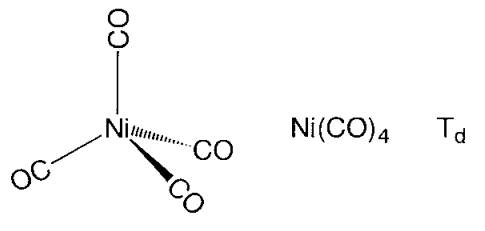
Los compuestos de carbonilo de metal mononucleares toman estructuras de coordinación poliédricas altamente simétricas. Hexa-coordenadas de cromo, molibdeno y hexacarbonilo de tungsteno, M (CO) 6, asumen un pentacarbonilron octaédrico regular, pentacarbonilón pentacoordenado, Fe (CO) 5, una bipirámide triangular, y tetracarbonilníquel, Ni (CO) 4, una estructura de coordinación tetraedro regular (Figura\(\PageIndex{14}\)). Los átomos de carbono de los ligandos de carbonilo se coordinan con el metal, y los restos CO están orientados a lo largo de la dirección del eje metal-carbono. El carbonilo metálico binuclear Mn 2 (CO) 10 tiene un enlace Mn-Mn que une dos partes piramidales cuadradas de Mn (CO) 5. En Fe 2 (CO) 9, dos subunidades Fe (CO) 3 están puenteadas por tres ligandos de CO, y en Co 2 (CO) 8, dos subunidades de Co (CO) 3 están conectadas por tres puentes de CO y un enlace Co-Co.
Hay una serie de compuestos carbonílicos metálicos en racimo con enlaces metal-metal que unen tres o más metales, y el CO terminal,\(\mu\) -CO (un puente entre dos metales) y\(\mu_{3}\) -CO (un puente que cubre tres metales) se coordinan con los marcos metálicos (consulte la Sección 6.3 (f)). Muchos carbonilos de racimo se forman por una reacción de pirólisis de compuestos carbonílicos mononucleares o binucleares. Los compuestos carbonílicos metálicos típicos y sus propiedades se muestran en la Tabla\(\PageIndex{4}\).
| 5 | 6 | 7 | 8 | 9 | 10 | |
|---|---|---|---|---|---|---|
| 4 | V (CO) 6 Negro sólido d.70 |
Cr (CO) 6 Blanco sólido d.130 |
Mn 2 (CO) 10 Amarillo sólido mp 154 |
Fe (CO) 5 Líquido amarillo bp 103 |
Co 2 (CO) 8 Rojo sólido mp 51 |
Ni (CO) 4 Líquido incoloro bp 42.1 |
| 5 | Mo (CO) 6 Blanco sólido sublime |
Tc 2 (CO) 10 Blanco sólido mp 160 |
Ru 3 (CO) 12 Naranja sólido d.150 |
Rh 6 (CO) 16 Negro sólido d.220 |
||
| 6 | W (CO) 6 Blanco sólido sublime |
Re 2 (CO) 10 Blanco sólido mp 177 |
Os 3 (CO) 12 Naranja sólido mp 224 |
Ir 4 (CO) 12 Amarillo sólido d.220 |
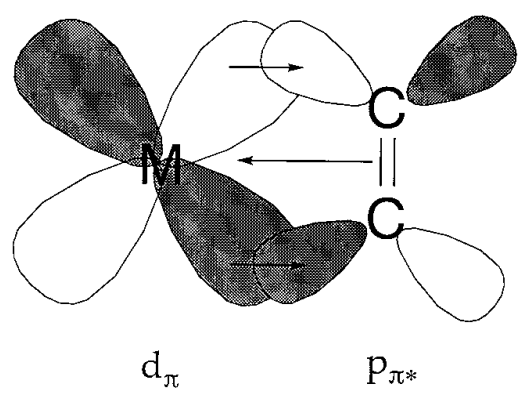
Donación de espalda
Un compuesto carbonílico metálico consiste en monóxido de carbono coordinado a un metal de valencia cero. Durante mucho tiempo, no había quedado claro por qué ese vínculo era posible, y mucho menos estable en absoluto. La creencia de que los enlaces de coordinación normales se formaron por la donación de electrones de ligandos altamente básicos a un metal formó la base de la teoría de coordinación de A. Werner. Debido a que la basicidad del monóxido de carbono es muy baja, y los enlaces metal-carbono de transición generalmente no son muy estables, se buscó una explicación adecuada para la estabilidad de los compuestos carbonílicos metálicos. Si la forma y simetría de la órbita del metal d y del orbital CO\(\pi\) (antiadherentes) para el enlace carbono-oxígeno son adecuadas para el solapamiento, se espera una interacción de unión entre el metal y el carbono. Desde este punto de vista se\(\PageIndex{15}\) propuso el esquema de unión mostrado en la Figura. El mecanismo por el cual los electrones son donados a la\(\pi^{*}\) órbita de monóxido de carbono vacante del metal d orbital lleno se llama donación de retorno. Dado que se evita la acumulación de electrones superfluos en un átomo metálico de bajo estado de oxidación, la retrodonación conduce a la estabilización del enlace M-C.
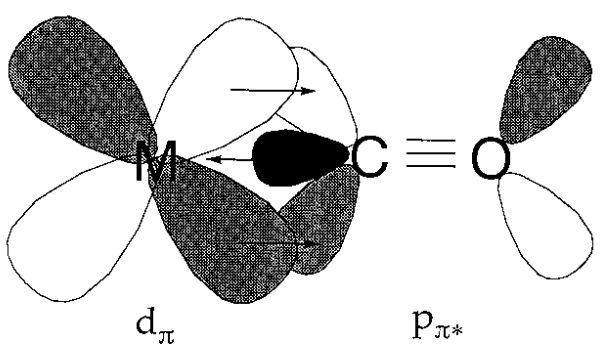
Fig 6.15 - Donación de espalda en carbonilos metálicos.
Un aumento en el orden del enlace metal-carbono se refleja en el incremento del M-C y disminución del C-O, estirando las frecuencias en los espectros vibracionales. Los espectros infrarrojos son útiles porque las frecuencias de carbonilo son fácilmente detectables. La disminución del estado de oxidación de un metal por el flujo de carga negativa de sus ligandos coordinados se refleja en la reducción de las frecuencias de estiramiento C-O.
b) Complejos hidrocarbonados
Un compuesto organometálico es uno que tiene enlaces metal-carbono, y entre uno y ocho átomos de carbono en un ligando de hidrocarburo se une a un metal. Hapticidad describe el número de átomos en un ligando que tienen interacción coordinativa directa con el metal y el número se agrega a\(\eta\). Un ejemplo es\(\eta^{5}\) (pentahapto) -ciclopentadienilo (Tabla\(\PageIndex{5}\)).
Un ligando que dona un número impar de electrones a un metal es formalmente un radical y se estabiliza uniéndose al metal. Un ligando que dona un número par de electrones a un metal es generalmente una molécula neutra y es estable aunque no esté unido al metal. Carbeno o ligandos de carbino son excepciones a esta regla. La fórmula química de un compuesto organometálico se expresa en muchos casos sin usar los corchetes [] habituales para tal complejo, y seguiremos esta convención en este libro.
| Nombre | Hapticidad | Número de electrones | Ejemplo |
|---|---|---|---|
| Alquílico | \(\eta^{1}\) | 1 | W (CH3) 6 |
| Alquilideno | \(\eta^{1}\) | 2 | Cr (CO) 5 {C (OCH 3) C 6 H 5} |
| Alqueno | \(\eta^{2}\) | 2 | K [PtCl 3 (C 2 H 4)] |
| \(\pi\)-alilo | \(\eta^{3}\) | 3 | Ni (\(\eta^{3}\)-C 3 H 5) 2 |
| Diene | \(\eta^{4}\) | 4 | Fe (CO) 3 (\(\eta^{4}\)-C 4 H 6) |
| Ciclopentadienilo | \(\eta^{5}\) | 5 | Fe (\(\eta^{5}\)-C 5 H 5) 2 |
| Arene | \(\eta^{6}\) | 6 | Cr (\(\eta^{6}\)-C 6 H 6) 2 |
| Tropylium | \(\eta^{7}\) | 7 | V (CO) 3 (\(\eta^{8}\)-C 7 H 7) |
| Ciclooctatetraeno | \(\eta^{8}\) | 8 | U (\(\eta^{8}\)-C 8 H 8) 2 |
Ejercicio\(\PageIndex{4}\)
Describir la diferencia entre ligandos de ciclopentadieno y ciclopentadienilo.
- Contestar
-
La fórmula química del ciclopentadieno es C 5 H 6 y está unido a un metal como un\(\eta^{2}\)\(\eta^{4}\) ligando. La fórmula química del ciclopentadienilo es C 5 H 5 y está unido a un metal como a\(\eta^{1}\)\(\eta^{3}\), o\(\eta^{5}\) ligando.
Ligandos alquílicos
Los compuestos de metales de transición alquílicos o arílicos tienen enlaces sencillos M-C. A pesar de muchos intentos en la mayor parte del curso de la historia química, su aislamiento no tuvo éxito y se consideró durante mucho tiempo que todos los enlaces M-C eran esencialmente inestables. Los complejos alquílicos estables comenzaron a prepararse gradualmente solo a partir de la década de 1950. Cp 2 ZrCl (Pr), WMe 6, CpFeMe (CO) 2, CoE (py) (dmg) 2, (dmg = dimetilglioximato), IrCl (X) (Et) (CO) (PPh 3) 2, NiEt 2 (bipy), PTCl (Et) (pET 3) 2 son algunos compuestos representativos. Entre los diversos procesos sintéticos desarrollados hasta ahora, las reacciones de compuestos que contienen enlaces M-halógeno con compuestos metal-alquilo del grupo principal, tales como un reactivo de Grignard o un compuesto de organolitio, son rutas sintéticas comunes. Especialmente la vitamina B 12, de la cual D. Hodgkin (Premio Nobel de 1964) determinó la estructura, se sabe que tiene un enlace Co-C muy estable. Los compuestos de alquilo metálico que tienen solo ligando de alquilo, como WMe 6, se denominan alquilos homolépticos.
Se acepta gradualmente que una causa principal de la inestabilidad de los complejos alquílicos es la baja energía de activación de su descomposición en lugar de una baja energía de enlace M-C. El camino de descomposición más general es\(\beta\) la eliminación. Es decir, la interacción de unión de un ligando hidrocarbonado con el metal de transición central tiende a dar como resultado la formación de un hidruro metálico y una olefina. Tal interacción se llama interacción agóstica. Aunque un ligando alquilo y un arilo son ligandos de 1 electrón, se consideran aniones cuando se cuenta el número de oxidación del metal. El ligando hidruro, H, se asemeja al ligando de alquilo en este aspecto.
\(\pi\)complejos de alilo
Si un grupo alilo, CH 2 =CH-CH 2 -, está unido a un metal a través de un átomo de carbono, es un ligando de 1 electrón como un grupo alquilo. Si el doble enlace se deslocaliza, tres átomos de carbono se unen al metal simultáneamente como un ligando de 3 electrones. Este también es un electrón impar y un ligando formalmente aniónico y se estabiliza al coordinarse con el metal.
Pd (C 3 H 5) (Ac) (PPh 3), Co (C 3 H 5) 3, etc. son ejemplos bien conocidos. Dado que\(\eta^{1}\),\(\eta^{2}\), y los modos de\(\eta^{3}\) coordinación son posibles en las reacciones catalíticas de hidrocarburos insaturados, ocurren diversas reacciones.
\(\pi\)complejos de ciclopentadienl
El ligando ciclopentadi-nilo, C 5 H 5, se abrevia como Cp. C 5 Me 5, en el que los átomos de hidrógeno de Cp son reemplazados por grupos metilo, es un ligando útil llamado estrella Cp y se denota por Cp*. El ferroceno, Cp 2 Fe, es un compuesto de hierro de color naranja muy estable en el que dos grupos ciclopentadienilo están unidos al hierro. Fue descubierto de forma independiente en dos laboratorios, pero los descubridores propusieron estructuras incorrectas. La estructura correcta fue aclarada por el grupo de G. Wilkinson, quien ganó el Premio Nobel (1973). La preparación de ferroceno generalmente se lleva a cabo de acuerdo con la siguiente ruta de reacción:
\[ \ce{2 C_{5} H_{6} + 2 Na \rightarrow 2 Na(C_{5}H_{5}) + H_{2}}\]
\[\ce{FeCl_{2} + 2 Na(C_{5}H_{5}) \rightarrow Fe(C_{5}H_{5})_{2} + 2 NaCl}\]
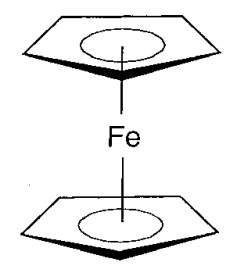
El análisis de la estructura de rayos X monocristalino mostró que la estructura del ferroceno es un átomo de hierro intercalado entre dos anillos C 5 H 5 (Figura\(\PageIndex{16}\)). Cinco átomos de carbono se unen al hierro simultáneamente en ferroceno, y los enlaces C-C insaturados se deslocalizan en los anillos de cinco miembros. Dado que este tipo de enlace no se conocía antes, despertó interés, se prepararon muchos compuestos derivados, y desde entonces se ha estudiado una amplia gama de química (Tabla\(\PageIndex{6}\)).
| 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
|---|---|---|---|---|---|---|---|
| 4 | Cp 2 TiCl 2 Rojo mp 230 |
Cp 2 V Negro mp 167 |
Cp 2 Cr Escarlata mp 173 |
Cp 2 Mn Marrón mp 193 |
Cp 2 Fe Naranja mp 174 |
Cp 2 Co Negro mp 173 |
Cp 2 Ni Verde d.173 |
| 5 | Cp 2 ZrCl 2 Blanco mp 248 |
Cp 2 NbCl 2 Marrón |
Cp 2 MoCl 2 Verde d.270 |
Cp 2 TCh Amarillo mp 150 |
Cp 2 Ru Amarillo mp 200 |
||
| 6 | Cp 2 HfCl 2 Blanco mp 234 |
Cp 2 TaCl 2 Marrón |
Cp 2 WCl 2 Verde d.250 |
Cp 2 ReH Amarillo mp 161 |
Cp 2 Os Blanco mp 229 |
El ligando de ciclopentadienilo es un ligando de 5 electrones y formalmente aniónico. Si solo uno de los cinco átomos de carbono está unido a un metal, es un ligando de 1 electrón como un grupo alquilo. Se convierte en un ligando de 3 electrones en casos raros y se coordina a un metal como un sistema\(\pi\) -alilo que se extiende sobre 3 átomos de carbono. El grupo Cp del ferroceno tiene reactividad análoga a la de los compuestos aromáticos. Dado que el grupo Cp ha jugado un papel significativo como ligando estabilizante para realizar la preparación de nuevos compuestos con nuevos modos de unión metal-ligando, se puede afirmar razonablemente que este ligando ha hecho la mayor contribución a la química organometálica de cualquier otro ligando. Aunque dos anillos Cp están unidos al metal en paralelo en ferroceno, Cp 2 TiCl 2 y Cp 2 MoH 2 tienen ligandos Cp curvados y se denominan compuestos de sándwich doblado.
Complejos de olefina
La sal de Zeise, K [PtCl 3 (C 2 H 4)], es el compuesto organometálico más antiguo conocido y fue sintetizado y analizado en ca. 1825 por Zeise, aunque su estructura de coordinación fue asumida sólo en 1954 y confirmada por la difracción de neutrones en 1975. El modo de coordinación de una olefina a un metal de transición se describe por el modelo Dewar-Chatt-Ducanson y el enlace entre el metal y la olefina se estabiliza por la contribución de la donación de d \(\pi\)-p \(\pi^{*}\). Una olefina es un ligando de 2 electrones y hay muchos complejos de olefina en los que el metal central está en un estado de oxidación relativamente bajo. Los dienos o trienos con dos o más dobles enlaces se coordinan con un metal como ligandos de 4 o 6 electrones. Fe (CO) 3 (C 4 H 6) y Ni (bacalao) 2, en los que un butadieno o ciclooctadienos (bacalao) están coordinados con el metal, son ejemplos bien conocidos. Dado que los ciclooctadienos se eliminan fácilmente del Ni (cod) 2, se usa convenientemente para generar níquel atómico de valencia cero. A este complejo se le llama a veces níquel desnudo.
Complejos de areno
Los compuestos aromáticos son donantes de 6 electrones que se coordinan a metales de transición en el modo de\(\eta^{6}\) coordinación con seis átomos de carbono. El bisbencenocromio, Cr (C 6 H 6) 2, es un ejemplo típico de dicho compuesto. El compuesto se prepara reduciendo el cloruro de cromo en benceno y tiene una estructura sándwich en la que se inserta un átomo de cromo entre dos anillos de benceno. Cuando un ligando de benceno es reemplazado por tres carbonilos, se obtiene Cr (CO) 3 (C 6 H 6).
Regla de 18 electrones
Contar electrones de valencia es de suma importancia en la química. Los cambios en el número de electrones de valencia tienen una profunda influencia en la unión, estructura y reacciones de un compuesto. Dado que tanto los restos metálicos como los orgánicos están involucrados en compuestos organometálicos, contar el número de electrones se vuelve complicado. Los ligandos de hidrocarbilo se clasifican como moléculas neutras que se coordinan con el metal o radicales que se unen al metal, y los radicales, tales como alquilos y ciclopentadienilo, generalmente se denominan ligandos aniónicos. La transferencia de un electrón del metal al ligando radical hace que el ligando sea formalmente aniónico. Sin embargo, es menos confuso considerar que tanto el metal como los ligandos son neutros al contar el número de electrones de valencia. Los números de electrones donadores en los ligandos de carbono típicos desde este punto de vista se enumeran en la Tabla\(\PageIndex{5}\). Es importante señalar que incluso en el mismo ligando, el número de electrones donantes suministrados por el ligando difiere dependiendo del número de átomos ligantes que tienen interacciones coordinativas con el metal. Por ejemplo, se pueden donar 1, 3 o 5 electrones a partir de un ligando de ciclopentadienilo, dependiendo del tipo de interacciones coordinativas con el metal.
Cuando el número total de electrones de valencia del metal y ligandos es 18, un compuesto organometálico de metal de transición suele tener una alta estabilidad térmica. Por ejemplo Cr (CO) 6, Fe (CO) 5, Ni (CO) 4, Fe (C 5 H 5) 2, Mo (C 6 H 6) (CO) 3 etc. satisfacen la regla de 18 electrones, pero las partes monoméricas de Mn 2 (CO) 10, Co 2 (CO) 8 o [Fe (C 5 H 5) (CO) 2] 2 tienen solo 17 electrones y el electrón extra proviene del metal asociado al formar un enlace metal-metal. A diferencia de la regla de 8 electrones en los compuestos del grupo principal, la aplicabilidad de la regla de 18 electrones es limitada. Es decir, es una condición suficiente pero los compuestos con alta estabilidad térmica no son necesariamente compuestos de 18 electrones.
Aunque existen muchos compuestos organometálicos del Grupo 6 (grupo cromo) al Grupo 9 (grupo cobalto) con ligandos carbonilo o ciclopentadienilo que satisfacen la regla de los 18 electrones, muchos compuestos de los metales de transición tempranos (Grupo 3 - 5) y Grupo 10 (grupo níquel) no se ajustan a esta regla. Por ejemplo, W (CH 3) 6 (12e), TiCl 2 (C 5 H 5) 2 (16e) e IrCl 2 (CO) (PPh 3) 2 (16e), V (CO) 6 (17e), Co (C 5 H 5) 2 (19e), Ni (C 5 H 5) 2 (20e), etc. no satisfacen la regla de 18 electrones. Sin embargo, la regla de 18 electrones proporciona pistas útiles en cuanto a los modos de unión presentes en un complejo dado. Por ejemplo, Fe (C 5 H 5) 2 (CO) 2 con dos ligandos pentahapto ciclopentadienilo tiene formalmente 22 electrones pero si uno de los ligandos es monohapto, el compuesto tiene 18 electrones. El análisis estructural ha demostrado que esta es la coordinación real de este complejo.
Ejercicio\(\PageIndex{5}\)
Calcular el número de electrones de valencia de CPMn (CO) 3.
- Contestar
-
Son un total de 18 electrones de Mn (7), Cp (5) y tres CO (6).
c) Complejos de fosfina
Las fosfinas terciarias, PX 3, son muy útiles como ligandos de estabilización en complejos de metales de transición y se coordinan con los metales en estados de oxidación relativamente altos a bajos. Las fosfinas se utilizan frecuentemente como ligandos de carbonilo o ciclopentadienilo en la química de complejos organometálicos. PX 3 son bases de Lewis y se coordinan con el metal usando el par solitario sobre fósforo y muestran\(\pi\) acidez cuando llevan sustituyentes X incluyendo Ph, Cl o F que tienen fuertes propiedades aceptoras de electrones. La flexibilidad electrónica de PX 3 es la razón por la que forma tantos complejos. Generalmente, la acidez π se vuelve más pequeña en el orden PF 3 > PCl 3 > PPh 3 > PR 3. La trifenilfosfina y la trietilfosfina son fosfinassustituidas típicas. Los complejos de fosfina terciaria principalmente de haluros metálicos se listan en la Tabla\(\PageIndex{7}\). Manganeso, Mn y los metales de transición tempranos forman muy pocos complejos de fosfina.
| 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | |
|---|---|---|---|---|---|---|---|---|
| 4 | [TiCL 4 (PPh 3) 2] | [VCl 3 (PMe Ph 2) 2] |
[CrCl 2 (dmpe) 2] |
[Mn (CO) 4 (PPh 3)] |
[FeCl 2 (PPh 3) 2] |
[CoCl 2 (PPh 3) 2] |
[NiCl 2 (pET 3) 2] | [CuBr (PET 3)] 4 |
| 5 | [ZrCl 4 (dppe)] | [NbCl 4 ( pET Ph 2) 2] |
[MoCl 3 (PMe Ph 2) 3] |
[TcCl 3 (PMe 2 Ph) 3] |
[RuCl 2 (PPh 3) 3] |
[RHCl (PPh 3) 3] | [PdCl 2 (P Ph 3) 2] |
[AgCl (PPh 3)] |
| 6 | [HfCl 4 (dppe)] | [TacL 4 (pET 3) 2] | [WCl 4 (PPh 3) 2] | [RecL 3 (PMe 2 Ph) 3] |
[OscL 3 (PPh 3) 3] |
[IrCl 3 (PPh 3) 3] | [PtCl 2 (P Ph 3) 2] |
[AUCl (PPh 3)] |
Muchos derivados se pueden preparar sustituyendo los halógenos de los complejos de fosfina. Se han preparado varios de los complejos de fosfinaspolidentadas con más de dos sitios de coordinación, así como los de fosfinasmonodentadas, y se utilizan también como ligandos de estabilización encomplejos de hidruro, alquilo, dinitrógeno y dihidrógeno. Los complejos de rodio o rutenio, en los que se coordinan fosfinasópticamente activas, son excelentes catalizadores para la síntesis asimétrica.

