4.4: Compuestos Organometálicos de Magnesio
- Page ID
- 69481
Mientras que el berilio produce una variedad de compuestos organometálicos, su naturaleza peligrosa ha limitado su estudio. Por el contrario, la naturaleza iónica de los compuestos de calcio, estroncio y bario limita el número de derivados organometálicos estables. Sin embargo, la química organometálica del magnesio es rica y extensa. La importancia de los compuestos Grignards (RMGx, donde X = haluro) y dialquil magnesio (R 2 Mg) se debe a su uso en síntesis orgánica y como sintones para una gama de compuestos organometálicos.
Reactivos Grignard
Los reactivos de Grignard (y la reacción de Grignard usando estos compuestos) llevan el nombre de Victor Grignard (Figura\(\PageIndex{4}\) .45). Después de estudiar matemáticas en Lyon se trasladó a la química, convirtiéndose en profesor en la Universidad de Nancy en 1910. Durante la Primera Guerra Mundial, estuvo involucrado en el campo de la guerra química; sin embargo, es por su importante contribución a la química orgánica que se le recuerda.
Preparación
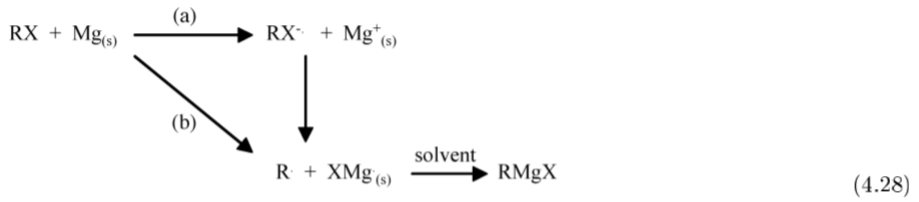
El general la síntesis de un reactivo de Grignard implica la reacción de un haluro de alquilo (RX, donde X = Cl, Br, I) con magnesio metálico en un disolvente éter adecuado, (4.4.1).
\[ RX + Mg \rightarrow RMgX \]
Mientras que el éter dietílico (Et 2 O) y el tetrahidrofurano (THF) se usan comúnmente como disolventes, otros disolventes polares no próticos son adecuados, entre ellos: trietilamina (NEt 3), sulfuro de dimetilo (Me 2 S), dimetilseleniuro (Me 2 Se) y dimetiltelururo (Me 2 Te).
En general el haluro de alquilo se añade a un exceso de magnesio suspendido en el disolvente. En la mayoría de los casos es necesario activar el magnesio, mediante la adición de yodo (I 2), 1,2-dibromoetano, o sonicación. Si el haluro es muy inerte, la reacción puede ser promovida por la cocondensación de magnesio y THF al vacío.
A menudo hay un periodo de inducción después de la adición inicial de haluro de alquilo. Sin embargo, dado que la reacción, (4.4.1), es altamente exotérmica, se debe tener cuidado para que la reacción no se desprenda. Por esta razón es normal añadir inicialmente una pequeña cantidad del haluro de alquilo para asegurar que se inicie la reacción. Una vez iniciada la reacción, la adición de haluro de alquilo se mantiene a una velocidad adecuada para asegurar que la reacción se mantenga hasta que se consuma todo el haluro de alquilo. El exceso de magnesio de reacción se elimina de la mezcla de reacción por filtración.
No siempre es necesario utilizar un haluro líquido o sólido disuelto en el disolvente. El burbujeo de cloruro de metilo (MeCl) a través de una suspensión Et 2 O de magnesio produce MeMgCl. La ventaja de un haluro de alquilo gaseoso es que la reacción es muy limpia ya que se consume todo el magnesio y se burbujea el exceso de haluro de alquilo.
La pureza del magnesio es muy importante. Para sus experimentos originales Grignard utilizó magnesio de una pureza de 99.2%. Sin embargo, ahora es más típico usar 99.8% de magnesio puro. Es importante que el magnesio no sea demasiado puro ya que se piensa que las impurezas de los metales de transición catalizan la reacción.
El orden relativo de reactividad del haluro de alquilo sigue la tendencia:
\[ I > Br > Cl > F \]
De hecho, los oruros de alquilo son suciamente inertes que deben usarse disolventes polares altamente coordinantes como THF o dimetilformamida (DMF).
Si se permite que la reacción se caliente demasiado entonces pueden ocurrir varias reacciones secundarias posibles. En THF se produce la reacción con el disolvente:
\[ RMgX + THF \rightarrow RH + H_2C=CH_2 + H_2C=C(H)MgX \]
Alternativamente, se observa un acoplamiento radical catalizado por metal de transición entre el Grignard y el haluro de alquilo sin reaccionar independientemente de la identidad del disolvente, (4.4.4).
\[ RMgX + RX \rightarrow R-R + MgX_2 \]
Se cree que el mecanismo para la formación de Grignard es de naturaleza radical; sin embargo, un estudio de la superficie del magnesio durante la reacción ha demostrado la presencia de pozos de corrosión. Generalmente se acepta que la iniciación ocurre en las dislocaciones superficiales, pero la reacción principal ocurre en una superficie pulida.
La cinética de la reacción es de primer orden con respecto a la concentración de haluro de alquilo, pero también se ha reivindicado que es de 1 er orden con respecto a la concentración de disolvente. Por lo tanto, se ha concluido que la etapa de determinación de la velocidad involucra la interfaz metal solvente.
La reacción del magnesio con bromidos de arilo ha sido estudiada y se propone que ocurra por dos reacciones. El primero implica la transferencia de electrones entre el haluro de arilo y el metal, mientras que el segundo implica la formación de radicales arilo.
Se utilizan varias rutas sintéticas alternativas con hidrocarburos polihalogenados, (4.4.5) y (4.4.6), y donde el radical alquilo es inestable, (4.4.7).
\[ X_3CH + ^iPrMgX \rightarrow (X_3C)MgX + ^iPrH \]
\[ C_6Br_6 + EtMgX \rightarrow (C_6Br_5)MgX + EtBr \]
\[ RX + R'MgX' \rightarrow RMgX' + R'X \]
Estructura
La estructura en estado sólido de los reactivos de Grignard está controlada por la presencia e identidad del disolvente utilizado en la síntesis. En este sentido es importante el tamaño y la basicidad del disolvente. Por ejemplo, la estructura de EtMgBr cristalizado a partir de éter dietílico existe como un monómero de 4-ccordinato (Figura\(\PageIndex{4}\) .46a), mientras que el uso del THF estericamente menos exigente da como resultado una estructura monomérica de 5 coordenadas (Figura\(\PageIndex{4}\) .46b). En contraste, el uso de trietilamina produce una estructura puenteada con bromuro dimérico (Figura\(\PageIndex{4}\) .46c), y el uso de una amina bidentada quelato da una estructura (Figura\(\PageIndex{4}\) .46d) similar a la observada con éter dietílico (Figura\(\PageIndex{4}\) .46a).
En solución, los Grignards son fluxionales de tal manera que no hay una sola estructura definida presente. Las series de reacciones de intercambio se conocen como un equilibrio Schlenk extendido (Figura\(\PageIndex{4}\) .47).
Se observa que las soluciones de Grignard también son ligeramente conductoras, y el magnesio se deposita tanto en el ánodo como en el cátodo sugiriendo la formación de rMg + y [rMgX 2] -. Se cree que el intercambio alquil/haluro ocurre a través de un intermedio puente (Figura\(\PageIndex{4}\) .48).
Dialquil magnesio (R 2 Mg)
Los compuestos de dialquil magnesio son sólidos blancos no volátiles. Generalmente tienen reactividad similar a sus análogos de Grignard.
Síntesis
La síntesis más común de R2Mg es por la reacción de un Grignard con dioxano (C 4 H 8 O 2), (4.32), donde la precipitación del dihaluro es la fuerza impulsora de la reacción.

Este método es útil para la síntesis de compuestos cíclicos, (4.33).
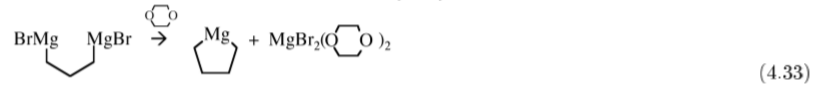
Una síntesis alternativa que no requiere dioxano implica la reacción de intercambio de metales entre magnesio metálico y un compuesto de dialquil mercurio.
\[ R_2Hg + Mg \rightarrow R_2Mg + Hg \]
Finalmente, en casos seleccionados, el magnesio reaccionará con hidrocarburos ácidos como el ciclopentadienilo a altas temperaturas (600 ◦ C).
Estructura
En la fase vapor, los compuestos de dialquil magnesio son generalmente compuestos lineales monoméricos. En solución, en ausencia de disolventes coordinantes R2 Mg forman una variedad de oligómeros (Figura\(\PageIndex{4}\) .49a-c) en solución según lo determinado por mediciones de peso molecular. En presencia de disolventes coordinantes predominan los monómeros de 4 coordenadas (Figura\(\PageIndex{4}\) .49d).
Como tendencia similar se observa en el estado sólido, donde los polímeros se han caracterizado en ausencia de disolventes coordinantes (Figura\(\PageIndex{4}\) .50a), mientras que los monómeros o atenuadores se observan generalmente cuando se cristalizan a partir de un disolvente coordinante (Figura\(\PageIndex{4}\) .50b y c).
El uso de compuestos organomagnesio en la síntesis orgánica
Hidrólisis y reacciones relacionadas
Los compuestos de Grignard reaccionan con el agua para dar el hidrocarburo, (4.4.9), también reaccionan con otros compuestos hidroxílicos como alcoholes y ácidos carboxílicos. Un uso importante de la reacción de hidrólisis es específicamente la deuteración, (4.4.10).
\[ CH_3MgBr + H_2O \rightarrow CH_4 + BrMgOH \]
\[ CH_3CH_2(CH_3)_2CMgBr + D_2O \rightarrow CH_3CH_2(CH_3)_2CD + BrMgOD \]
El átomo de hidrógeno en un alquino terminal es suciamente ácido que la reacción con Grignards ocurre de manera análoga a la de la hidrólisis.
\[ C_6H_5C=CH + C_2H_5MgBr \rightarrow C_6H_5C=CMgBr + C_2H_6\]
Una vez formado el alquinilo Grignard experimenta la misma reacción de hidrólisis.
\[ C_6H_5C=CMgBr + D_2O \rightarrow C_6H_5C=CD + BrMgOD \]
Reacción con CO 2
Los Grignards reaccionan fácilmente con el dióxido de carbono para formar el carboxilato, que produce el ácido carboxílico asociado tras la hidrólisis, (4.4.13).
\[ RMgX + CO_2 \rightarrow RCO_2MgX \xrightarrow{H_2O} RCO_2H + HOMgX \]
Reacción con carbonilos
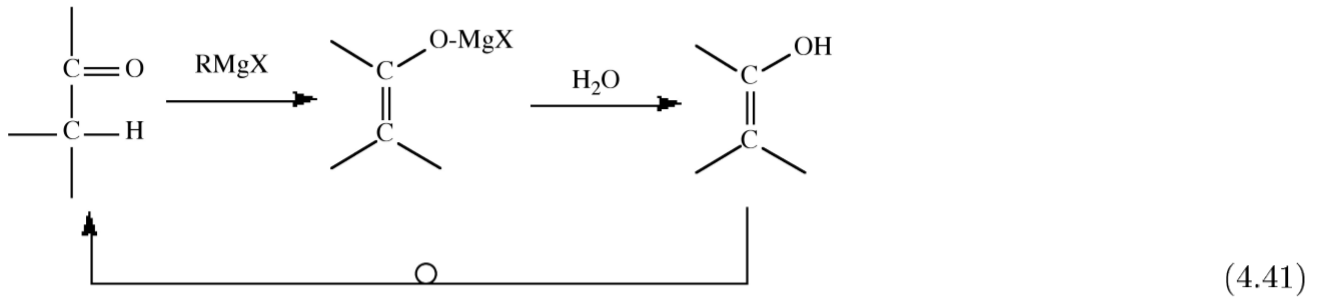
Los compuestos de organomagnesio reaccionan con carbonilos orgánicos (aldehídos, cetonas y ésteres) para producir el alcohol en la hidrólisis, (4.4.14). Esta ruta sintética es útil para la formación de alcoholes primarios, secundarios y terminales.
\[ RMgX + R'_2C=O \rightarrow R'_2(R)COMgX \xrightarrow{H_2O} R'_2(R)COH + HOMgX \]
Desafortunadamente, para algunos carbonilos hay una reacción secundaria competitiva de enolización, donde la cetona de partida se reforma tras la hidrólisis.
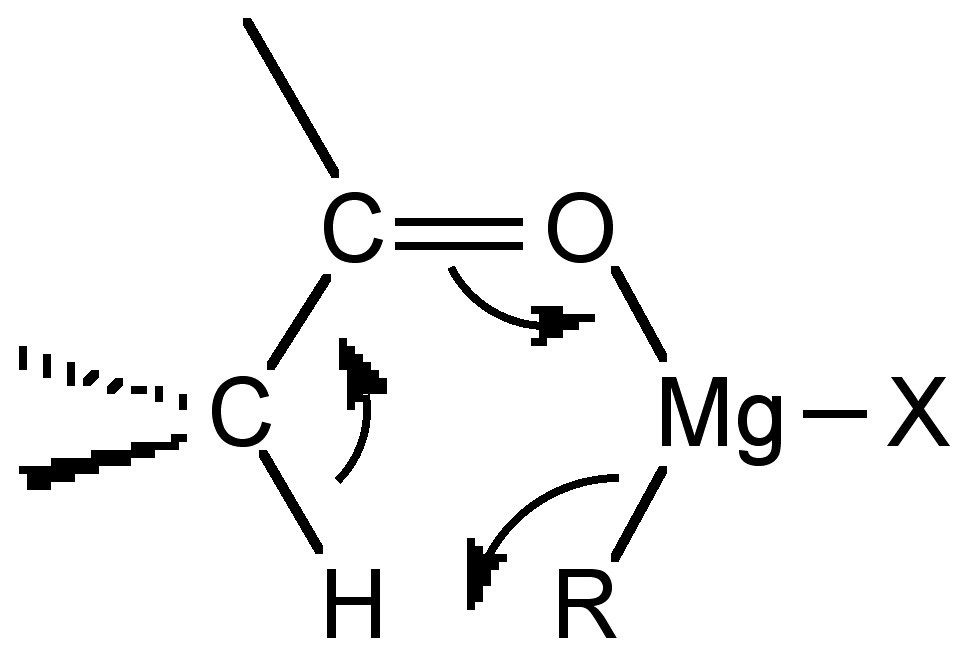
Cuando el reactivo de Grignard tiene un β -hidrógeno se produce otra reacción secundaria en la que se reduce el grupo carbonilo y se forma un alqueno.
\[R_2C=O + (CH_3CH_2)MgX \rightarrow R_2(H)COH + H_2C=CH_2 \]
Tanto la enolización como la reducción ocurren a través de estados de transición cíclicos similares de 6 miembros (Figura\(\PageIndex{4}\) .51).
Los Grignards reaccionan con cetonas α, β-insaturadas para dar el producto de adición 1,2-o el producto de adición 1,4-, o ambos.
\[\text{Ph(H)C=C(H)-C(O)Me + EtMgBr} \xrightarrow{H_2O} \text{Ph(H)C=C(H)-C(OH)EtMe} + \text{Ph(H)EtC-CH}_2\text{-C(O)Me}\]
Reacción con haluros de acilo
Los haluros de acilo reaccionan con Grignards para dar cetonas (4.4.16). Los mejores resultados se obtienen si la reacción se lleva a cabo a baja temperatura y en presencia de un catalizador ácido de Lewis (por ejemplo, (FeCl 3).
\[\text{CH}_3\text{C(O)Cl + RMgX} \rightarrow \text{CH}_3\text{C(O)R + XMgCl} \]
Reacción con epóxidos
Los anillos de oxirano (epóxido) son abiertos por Grignards en una reacción útil que extiende la cadena de carbono del Grignard por dos átomos de carbono. Esta reacción se realiza mejor con óxido de etileno ya que el haluro de magnesio formado es un catalizador ácido de Lewis para reacciones posteriores en el caso de oxiranos sustituidos.

Reacción con sales
Uno de los métodos más útiles para preparar compuestos organometálicos es la reacción de intercambio de un compuesto organometálico con una sal de un metal diferente, Ecuación. Se trata de un proceso de equilibrio, cuya constante de equilibrio se define por el potencial de reducción de ambos metales. En general la reacción procederá de manera que cuanto más metal electropositivo forme más sal iónica (generalmente cloruro).
\[\text{RM + M'X} \leftrightharpoons \text{RM' + MX}\]
Los reactivos de Grignard son particularmente útiles a este respecto, y pueden usarse para preparar una amplia gama de compuestos organometálicos. Por ejemplo:
\[ \text{2 CH}_3\text{CH}_2\text{MgCl + CdCl}_2 \rightarrow \text{Cd(CH}_2\text{CH}_3\text{)}_2 \text{ + 2 MgCl}_2\]
\[ \text{4 CH}_3 \text{MgCl + SiCl}_4 \rightarrow \text{Si(CH}_3\text{)}_4 \text{ + 4 MgCl}_2\]
La reacción con un Grignard es más leve que la reacción análoga con reactivos de litio, y conduce a un menor incidente de subproductos.
Bibliografía
- H. Bader y N. M. Smyth, J. Org. Chem. , 1964, 29, 953.
- C. L. Hill, J. B. Vander Sade, G. M. Whitesides, J. Org. Chem. , 1980, 45, 1020.
- E. Weiss, J. Organomet. Chem. , 1964, 2, 314.
- A. R. Barron, J. Chem. Soc., Dalton Trans. , 1989, 1625.


