6.1: El Grupo 13 Elementos
- Page ID
- 69460
En la tabla se\(\PageIndex{1}\) enumera la derivación de los nombres de los elementos del Grupo 13 (IIIA).
| Element | Símbolo | Nombre |
| Boro | B | De la palabra árabe buraq o la palabra persa burah para el bórax mineral |
| Aluminio (Aluminio) | Al | De alumbre |
| Galio | Ga | De Nombrado después de la palabra latina para Francia (Galia) Gallia |
| Indio | En | Rubidus latino que significa rojo más profundo |
| Talio | Tl | Del latín thallus que significa brotar ramita verde |
Cuadro\(\PageIndex{1}\): Derivación de los nombres de cada uno de los elementos de metal alcalino.
Nota
El aluminio es la ortografía internacional estandarizada por la IUPAC, pero en Estados Unidos se deletrea más comúnmente como aluminio.
Descubrimiento
Boro
El bórax (una mezcla de Na 2 B 4 O 7 .4H 2 O y Na 2 B 4 O 7 .10H 2 O) se conocía desde hace miles de años. En el Tíbet se conocía con el nombre sánscrito de tincal. Los esmaltes de bórax se utilizaron en China en el año 300 d.C., y los escritos del alquimista árabe Geber parecen mencionarlo en el año 700 d.C. Sin embargo, se sabe que Marco Polo trajo algunos esmaltes de bórax de regreso a Italia en el siglo XIII. En 1600 Agricola en su tratado De Re Metallica reportó el uso del bórax como fundente en metalurgia.


El boro no fue reconocido como elemento hasta su aislamiento por Sir Humphry Davy, Joseph Louis Gay-Lussac y Louis Jacques Thénard en 1808 a través de la reacción del ácido bórico y el potasio. Davy llamó al elemento boracium. Jöns Jakob Berzelius identificó al boro como elemento en 1824.




Aluminio
Los antiguos griegos y romanos usaban sales de aluminio como mordientes de teñido y como astringentes para el apósito de heridas; el alumbre (Kal (SO 4) 2 .12H 2 O) todavía se usa como estiptico (un agente antihemorrágico). En 1808, Sir Humphry Davy identificó la existencia de una base metálica de alumbre, a la que en un principio denominó alumio y posteriormente aluminio.
El metal fue producido por primera vez en 1825 (en forma impura) por Hans Christian Ørsted por reacción de cloruro de aluminio anhidro con amalgama de potasio. Friedrich Wöhler repitió los experimentos de Ørsted pero sugirió que Ørsted solo había aislado potasio. Por el uso del potasio (Ecuación 6.1.1), se le atribuye el aislamiento de aluminio en 1827. Si bien a Wöhler generalmente se le atribuye el aislamiento de aluminio, también se le debe dar crédito a Ørsted.
\[ \text{AlCl}_3 \text{ + 3 K} \rightarrow \text{Al + 3 KCl}\]

En 1846 Henri Deville mejoró el método de Wöhler, y describió sus mejoras en particular el uso de sodio en lugar del costoso potasio
\[ \text{AlCl}_3 \text{ + 3 Na} \rightarrow \text{Al + 3 NaCl}\]

Galio
El elemento galio fue predicho, como eka-aluminio, por Mendeleev en 1870, y posteriormente descubierto por Lecoq de Boisbaudran en 1875; de hecho, de Boisbaudran llevaba algunos años buscando el elemento faltante, con base en su propia teoría independiente. La primera indicación experimental de galio vino con la observación de dos nuevas líneas violetas en el espectro de chispa de una muestra depositada sobre zinc. Dentro de un mes de estos resultados iniciales de Boisbaudran había aislado 1 g del metal a partir de varios cientos de kilogramos de mineral de blenda de zinc crudo. El nuevo elemento fue nombrado en honor a Francia (Latin Gallia), y la sorprendente similitud de sus propiedades físicas y químicas con las predichas por Mendeleev hizo mucho para establecer la aceptación general de la Ley periódica; en efecto, cuando de Boisbaudran afirmó por primera vez que la densidad de Ga era de 4.7 g cm -3 en lugar del previsto 5.9 g/cm 3, Mendeleev le escribió sugiriendo que redetermine el valor (el valor correcto es 5.904 g/cm 3).


Indio
Mientras ensayaban minerales de las minas alrededor de Freiberg, Sajonia, Ferdinand Reich y Hieronymous Theodor Richter cuando disolvieron los minerales pirita, arsenopirita, galena y esfalerita en ácido clorhídrico, y como se sabía que los minerales de esa región contenían talio buscaron la emisión verde líneas por espectroscopía. Aunque las líneas verdes estaban ausentes, una línea azul estuvo presente en el espectro. Como no se conocía ningún elemento con una emisión de azul brillante concluyeron que un nuevo elemento estaba presente en los minerales. Llamaron al elemento con la línea espectral azul indio. Richter pasó a aislar el metal en 1864.


Talio
Después de la publicación de su método mejorado de espectroscopia de llama por Robert Bunsen y Gustav Kirchhoff, este método se convirtió en un método aceptado para determinar la composición de minerales y productos químicos. Dos químicos, William Crookes y Claude-Auguste Lamy, ambos comenzaron a utilizar el nuevo método y lo emplearon de manera independiente en su descubrimiento del talio.



Crookes estaba realizando determinaciones espectroscópicas sobre compuestos de selenio depositados en la cámara de plomo de una planta de producción de ácido sulfúrico cerca de Tilkerode en las montañas de Harz. Utilizando un espectrómetro similar al de Crookes', Lamy determinó la composición de una sustancia que contenía selenio que se depositó durante la producción de ácido sulfúrico a partir de pirita. Mediante espectroscopia ambos investigadores observaron una nueva línea verde el espectro de absorción atómica y lo asignaron a un nuevo elemento. Ambos se propusieron aislar el nuevo elemento. Afortunadamente para Lamy, había recibido su material en mayores cantidades y así pudo aislar cantidades suficientes de talio para determinar las propiedades de varios compuestos y preparar un pequeño lingote de talio metálico. Al mismo tiempo, Crookes pudo aislar pequeñas cantidades de talio elemental y determinar las propiedades de algunos compuestos. El reclamo de ambos científicos resultó en una controversia significativa durante 1862 y 1863; curiosamente esto terminó cuando Crookes fue elegido miembro de la Royal Society en junio de 1863.
Abundancia
La abundancia de los elementos del Grupo 13 se da en la Tabla\(\PageIndex{2}\). El aluminio es el metal más abundante en la corteza terrestre y se encuentra en una amplia gama de minerales. Si bien el boro no es tan común, también se encuentra en una variedad de minerales de borato. En contraste, el galio, el indio y el talio se encuentran como impurezas en otros minerales. En particular, el indio y el talio se encuentran en minerales de sulfuro o seleniuro en lugar de óxidos, mientras que el galio se encuentra tanto en sulfuros (ZnS) como en óxidos (bauxita). Aunque se conocen minerales de indio y talio, son raros: indita (FeIn 2 S 4), lorandita (TLass 2), crooquesita (Cu 7 TLSe 4).
| Element | Abundancia terrestre (ppm) |
| B | 10 (corteza terrestre), 20 (suelo), 4 (agua de mar) |
| Al | 82,000 (corteza terrestre), 100,000 (suelo), 5 x 10 -4 (agua de mar) |
| Ga | 18 (corteza terrestre), 28 (suelo), 30 x 10 -6 (agua de mar) |
| En | 0.1 (corteza terrestre), 0.01 (suelo), 0.1 x 10 -6 (agua de mar) |
| Tl | 0.6 (corteza terrestre), 0.2 (suelo), 10 x 10 -6 (agua de mar) |
Isótopos
Los isótopos naturalmente abundantes de los elementos del Grupo 13 se enumeran en la Tabla\(\PageIndex{3}\). El talio tiene 25 isótopos que tienen masas atómicas que van de 184 a 210. El talio-204 es el radioisótopo más estable, con una vida media de 3.78 años.
| Isótopo | Abundancia natural (%) |
| Borón-10 | 19.9 |
| Borón-11 | 80.1 |
| Aluminio-27 | 100 |
| Galio-69 | 60.11 |
| Galio-71 | 39.89 |
| Indio-113 | 4.3 |
| Indio-115 | 95.7 |
| Talio-203 | 29.52 |
| Talio-205 | 70.48 |
Los elementos del Grupo 13 ofrecen potencial como núcleos de RMN (Tabla\(\PageIndex{4}\)). En particular 11 B y 27 Al muestran promesa para la caracterización tanto en solución como en estado sólido.
| Isótopo | Spin | Abundancia natural (%) | Momento cuadripolo (10 -30 m 2) | Frecuencia de RMN (MHz) a un campo de 2.3488 T | Referencia |
| Borón-10 | 3 | 19.58 | 8.459 | -10.746 | BF 3 .Et 2 O |
| Borón-11 | 3/2 | 80.42 | 4.059 | -32.084 | BF 3 .Et 2 O |
| Aluminio-27 | 5/2 | 100 | 14.66 | -26.057 | Al (NO 3) 3 |
| Galio-69 | 3/2 | 60.4 | 17.1 | -24.003 | Ga (NO 3) 3 |
| Galio-71 | 3/2 | 39.6 | 10.7 | -30.495 | Ga (NO 3) 3 |
| Indio-113 | 9/2 | 4.28 | 79.9 | -21.866 | En (NO 3) 3 |
| Indio-115 | 9/2 | 95.72 | 81.0 | -21.914 | En (NO 3) 3 |
Producción industrial
El bórax se extrae como una mezcla de Na 2 B 4 O 7 .4H 2 O y Na 2 B 4 O 7 .10H 2 O. La acidificación da ácido bórico, B (OH) 3, que puede reducirse con amalgama de sodio (Na/Hg) para dar boro amorfo. El boro puro se puede preparar reduciendo los haluros de boro (p. ej., BF 3 y BCl3) con hidrógeno a altas temperaturas. El boro ultrapuro, para su uso en la industria de semiconductores, se produce por la descomposición del diborano (B 2 H 6) y posteriormente se purifica con los procesos de fusión de zona o Czochralski.
Las únicas dos fuentes económicas para el galio son como subproducto de la producción de aluminio y zinc. La extracción durante el proceso de Bayer seguida de electrólisis de celdas de mercurio e hidrólisis de la amalgama con hidróxido de sodio conduce a galato de sodio. La electrólisis luego da galio metálico.
La falta de depósitos minerales de indio y el hecho de que el indio esté enriquecido en sulfuros de plomo, estaño, cobre, hierro y zinc, hace que la producción de zinc sea la principal fuente de indio. El indio se lixivia de escoria y polvo de producción de zinc. Hasta 1924, solo había alrededor de un gramo de indio aislado en el planeta, sin embargo, hoy en día la producción mundial es actualmente mayor 476 toneladas al año de la minería y unas 650 toneladas anuales del reciclaje. Este aumento masivo de la demanda se debe a aplicaciones en pantallas LCD y aplicaciones de celdas solares.
Aluminio
Debido a la posición del aluminio como el elemento metálico más abundante en la corteza terrestre (7.5 - 8.1%) y su enorme importancia industrial amerita una discusión detallada de su producción industrial. El aluminio solo aparece en su forma elemental en la naturaleza en ambientes deficientes en oxígeno como el lodo volcánico. Ordinariamente, se encuentra en una variedad de minerales de óxido.
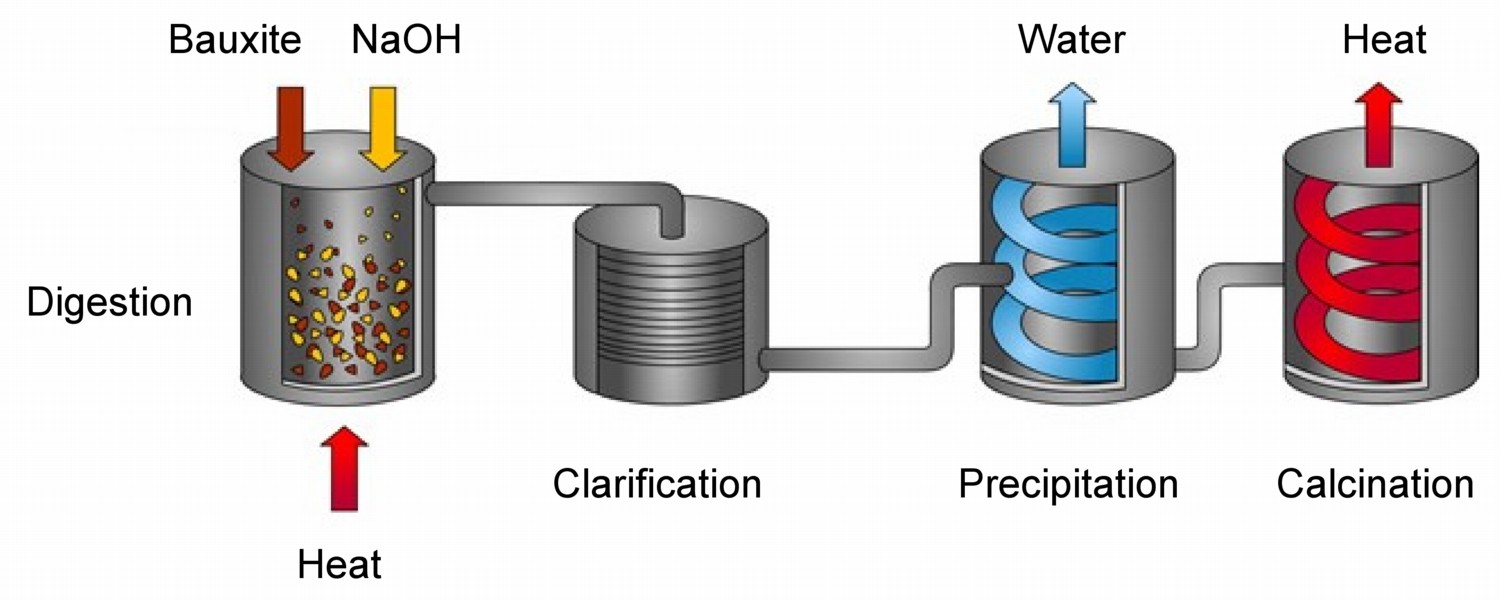
En comparación con otros metales el aluminio es difícil de extraer de sus minerales. A diferencia del hierro, los óxidos de aluminio no pueden ser reducidos por el carbono, por lo que la purificación solo es posible a escala económica mediante electrólisis. Previo a la electrólisis se obtiene óxido de aluminio purificado refinando bauxita en el proceso de desarrollado por Karl Bayer.

La bauxita, el mineral más importante de aluminio, contiene solo 30-50% de alúmina, Al 2 O 3, siendo el resto una mezcla de sílice, óxido de hierro y dióxido de titanio. Por lo tanto, la alúmina debe purificarse antes de que pueda usarse como óxido o refinarse en aluminio metálico. En el proceso de Bayer, la bauxita se digiere en solución caliente (175 °C) de hidróxido de sodio (NaOH) (Figura). Esto convierte la alúmina en hidróxido de aluminio, Al (OH) 3, que se disuelve en la solución de hidróxido.
\[ \text{Al}_2\text{O}_3 \text{ + 2 OH}^- \text{ + 3 H}_2\text{O} \rightarrow \text{2 [Al(OH)}_4\text{]}^- \]
Los demás componentes no se disuelven y se filtran. La solución de hidróxido se enfría y el hidróxido de aluminio disuelto precipita, el cual cuando se calienta a 1050 °C se calcina en alúmina.
\[ \text{2 Al(OH)}_3 \rightarrow \text{Al}_2\text{O}_3 \text{ + 3 H}_2\text{O}\]
Una vez que se forma una alúmina pura, se disuelve en criolita fundida (Na 3 AlF 6) y se reduce al metal puro a temperaturas elevadas (950 - 980 °C) mediante el proceso Hal-Héroult, desarrollado independientemente Charles Hall y Paul Héroult.


Ambos electrodos utilizados en la electrólisis del óxido de aluminio son de carbono. La reacción en el cátodo implica la reducción del Al 3+. El metal de aluminio luego se hunde hasta el fondo y se golpea, donde generalmente se funde en bloques grandes llamados palanquillas de aluminio.
\[\text{Al}^{3+} + \text{3 e}^- \rightarrow \text{Al}\]
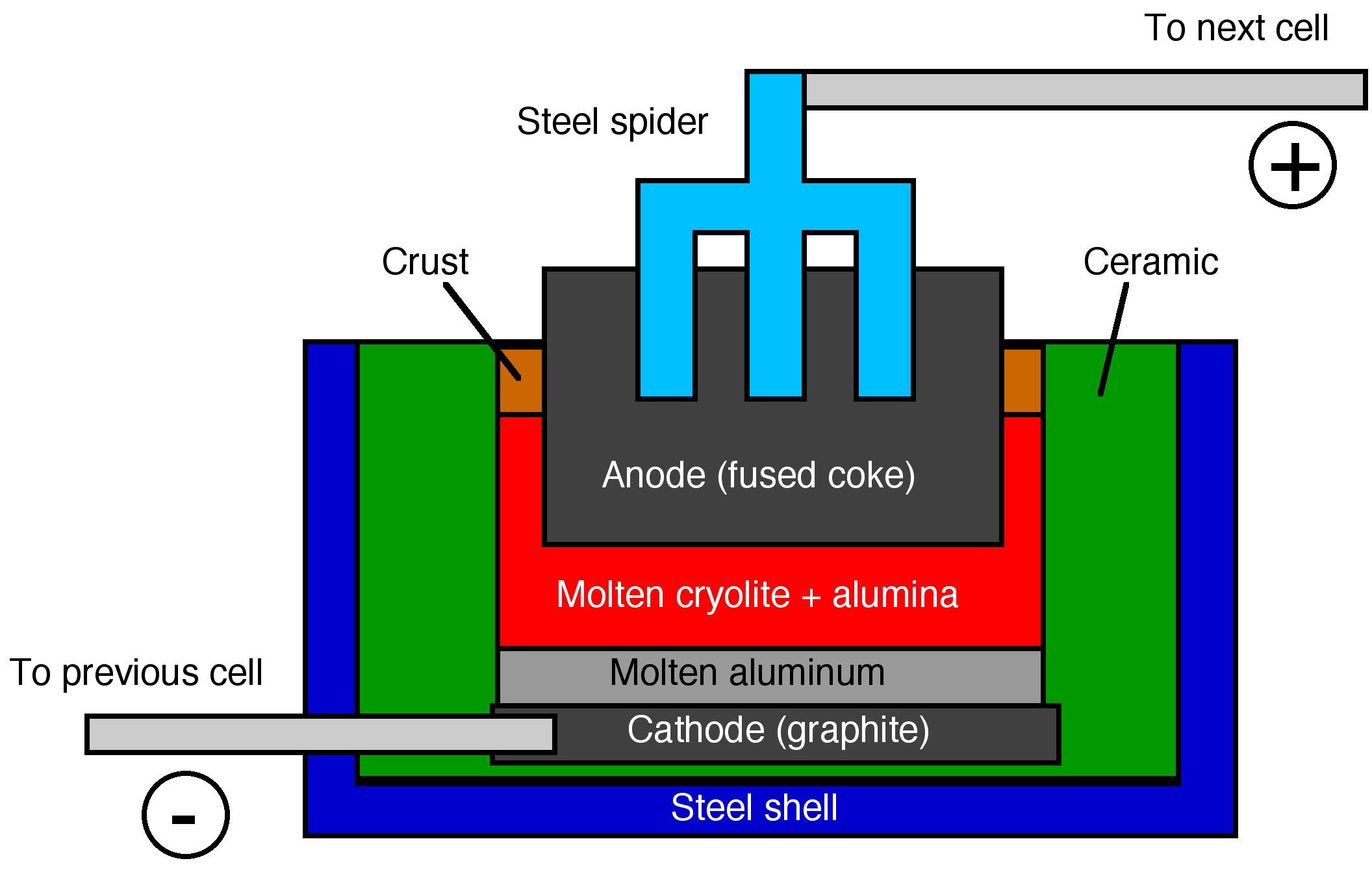
En el ánodo se forma oxígeno, (6.1.6), donde reacciona con el ánodo de carbono se oxida luego a dióxido de carbono, (6.1.7). Los ánodos deben ser reemplazados regularmente, ya que se consumen. Si bien los cátodos no se oxidan, sí se erosionan debido a los procesos electroquímicos y al movimiento del metal.
\[ \text{2 O}_2^- \rightarrow \text{O}_2 + \text{4 e}^-\]
\[ \text{C + O}_2 \rightarrow \text{CO}_2 \]
Aunque el proceso Hall Héroult consume mucha energía, los procesos alternativos siempre han resultado ser menos viables económica y ecológicamente.
Propiedades físicas
La tabla resume las propiedades físicas de los elementos del Grupo 13. Mientras que el aluminio, el indio y el talio tienen propiedades típicas del metal, el galio tiene la mayor gama de líquidos de cualquier elemento. El boro existe como compuesto molecular en estado sólido, de ahí su alto punto de fusión.
| Element | Mp (°C) | Bp (°C) | Densidad (g/cm 3) |
| B | 2300 | 3658 | 2.3 |
| Al | 661 | 2467 | 2.7 |
| Ga | 30 | 2403 | 5.9 (sólido), 6.1 (líquido) |
| En | 156 | 2080 | 7.3 |
| Tl | 304 | 1457 | 11.9 |
Cuadro\(\PageIndex{5}\): Propiedades físicas seleccionadas de los elementos del Grupo 13.
Bibliografía
- C. M. Salón. Proceso de reducción de aluminio a partir de sus sales de fluoruro por electrólisis. Patente de Estados Unidos 400,664 (1886).
- L. B. Alemany, S. Steuernagel, J.-P. Amoureux, R. L. Callender y A. R. Barron. Resonancia Magnética Nuclear de Estado Sólido, 1999, 14, 1.
- L. B. Alemany, R. L. Callender, A. R. Barron, S. Steuernagel, D. Iuga, y A. P. M. Kentgens, J. Phys. Chem., B., 2000, 104, 11612.
- M. Bishop, N. Shahid, J. Yang, y A. R. Barron, Dalton Trans., 2004, 2621.


