6.7: Óxidos, hidróxidos y oxianiones de boro
- Page ID
- 69461
Óxidos
El óxido de boro, B 2 O 3, se obtiene por la deshidratación del ácido bórico, (6.7.1). Es un sólido vítreo sin estructura regular, pero puede cristalizarse con extrema dificultad. La estructura consiste en cadenas infinitas de unidad triangular BO 3 (Figura\(\PageIndex{1}\)). El óxido de boro es ácido y reacciona con el agua para reformar el ácido bórico, (6.7.1).
\[\text{2 B(OH)}_3 \xrightleftharpoons{\Delta} \text{B}_2\text{O}_3 \text{ + H}_2\text{O}\]
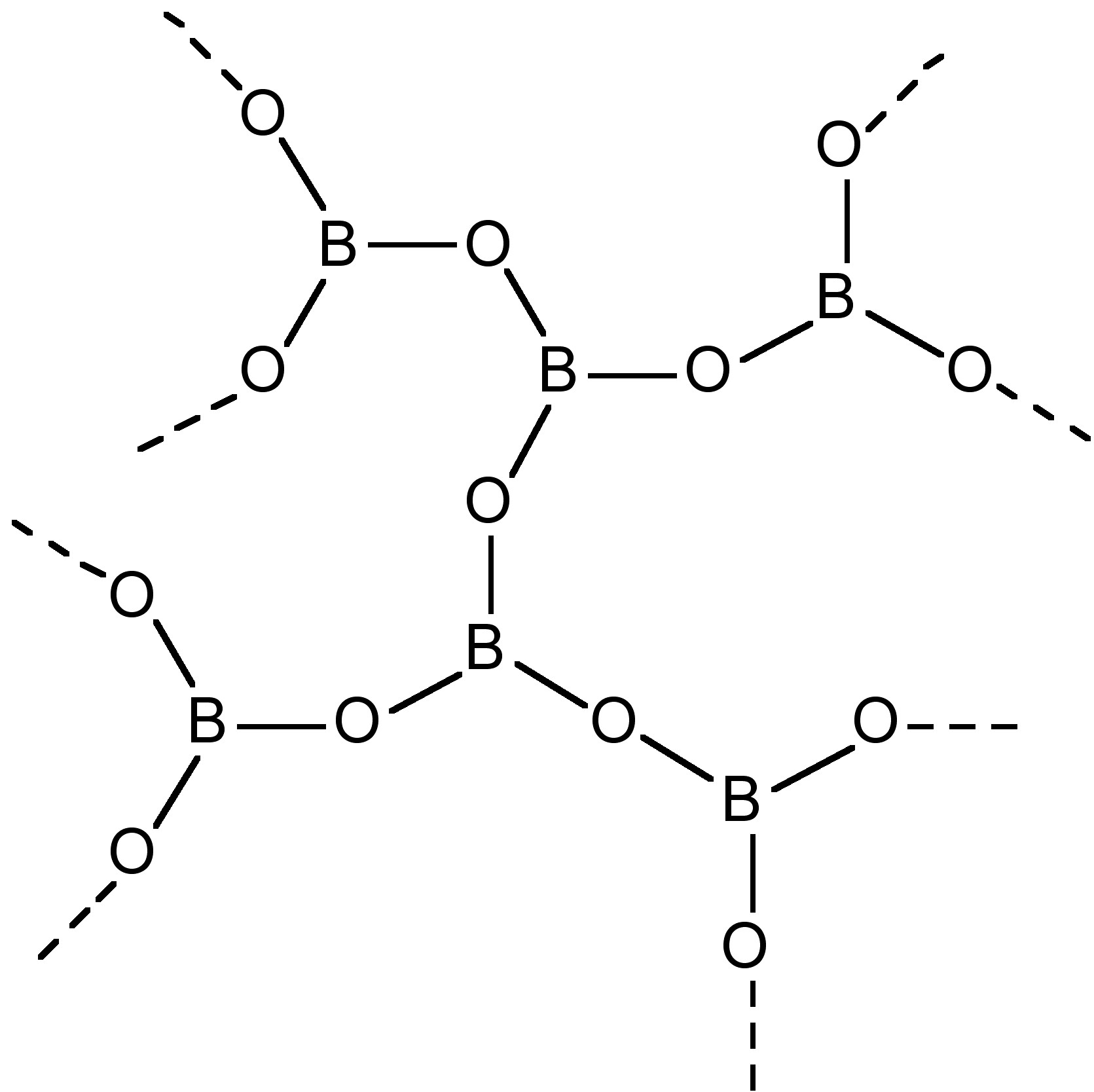
La reacción de B 2 O 3 con hidróxido produce el ion metaborato, (6.7.2), cuya estructura plana (Figura\(\PageIndex{2}\)) está relacionada con el ácido metabórico. El óxido de boro se fusiona con una amplia gama de óxidos metálicos y no metálicos para dar vidrios de borato.
\[\text{B}_2\text{O}_3\text{ + 6 KOH} \rightarrow \text{2 K}_3\text{[B}_3\text{O}_6\text{] + 3 H}_2\text{O}\]

Ácido bórico
El ácido bórico, B (OH) 3, generalmente obtenido de la disolución del bórax, Na 2 [B 4 O 5 (OH) 4], es un sólido plano con enlaces de hidrógeno intermoleculares que forma una estructura estratificada casi hexagonal, ampliamente similar al grafito (Figura\(\PageIndex{3}\)). La distancia entre capas es de 3.18 Å.
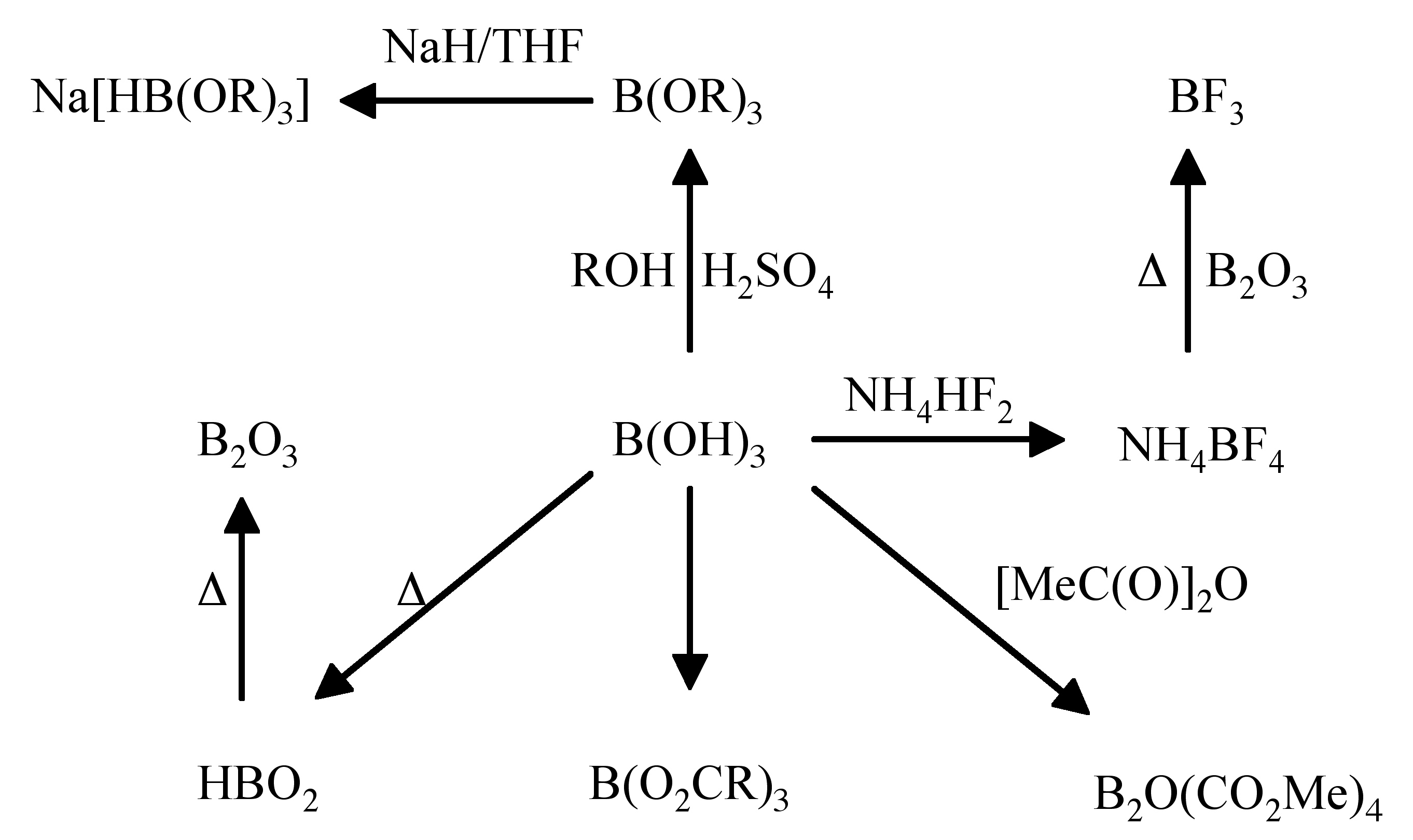
En la Figura se muestra un resumen de las reacciones de la reactividad del ácido bórico\(\PageIndex{4}\).
Al disolverse el ácido bórico en agua, el ácido bórico no actúa como ácido protónico, sino que reacciona como un ácido de Lewis, (6.7.3).
\[\text{B(OH)}_3 \text{ + 2 H}_2\text{O} \rightleftharpoons \text{B(OH)}_4^- \text{ + H}_3\text{O}^+ \]
La reacción puede ser seguida por espectroscopía de RMN 11 B a partir del cambio en el desplazamiento químico (Figura\(\PageIndex{5}\)).
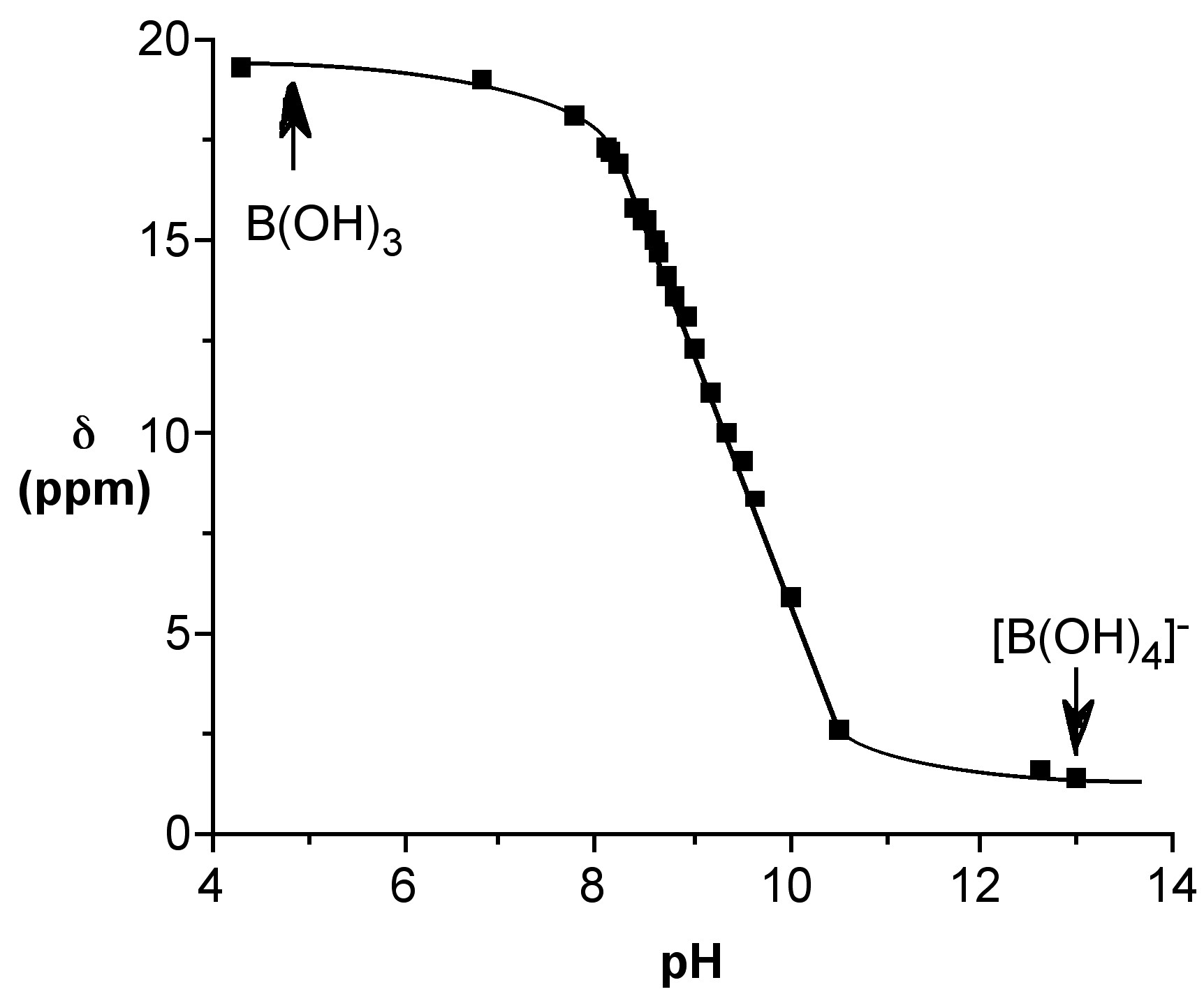
Dado que el desplazamiento de RMN de 11 B es directamente proporcional a la fracción molar de las especies totales presentes como anión borato (por ejemplo, [B (OH) 4] -), el desplazamiento químico de RMN 11 B a una temperatura dada, δ (obs), puede usarse para calcular tanto la fracción molar. del ácido bórico y del anión borato, es decir, (6.7.4) y (6.7.5), respectivamente. Mediante estas ecuaciones se puede calcular la especiación relativa en función del pH para ambos ácidos bórico (Figura\(\PageIndex{6}\)). El pH al que una mezcla 50:50 de ácido y anión para el ácido bórico es ca. 9.4.
\[ \chi_{\text{(acid)}} = \dfrac{\delta_{\text{(obs)}} - \delta_{\text{(anion)}}}{\delta_{\text{(acid)}} - \delta_{\text{(anion)}}}\]
\[ \chi_{\text{(acid)}} = \dfrac{\delta_{\text{(acid)}} - \delta_{\text{(obs)}}}{\delta_{\text{(acid)}} - \delta_{\text{(anion)}}}\]
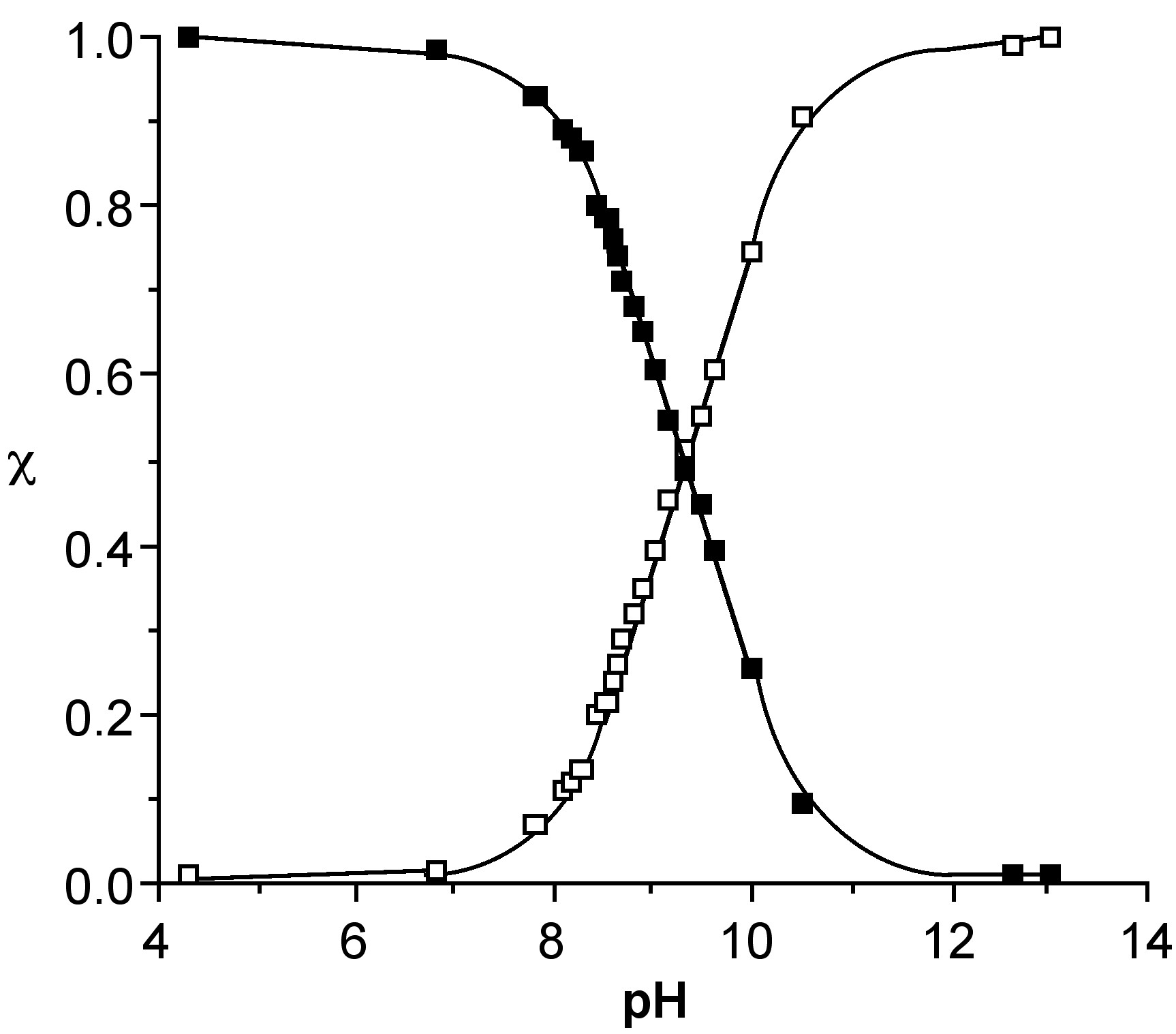
En soluciones concentradas, el ion borato reacciona más para formar iones poliborato. La identidad del poliborato depende del pH. Al aumentar el pH, se forman B 5 O 6 (OH) 4 -, (6.7.5), B 3 O 3 (OH) 4 -, (6.7.6), y B 4 O 5 (OH) 4 2 -, (6.7.7). La estructura de cada borato se muestra en la Figura\(\PageIndex{7}\). Una vez que la relación de B (OH) 3 a B (OH) 4 - es mayor al 50%, solo se observa el mono-borato.
\[ \text{4 B(OH)}_3 \text{ + B(OH)}^-_4 \rightleftharpoons \text{B}_5\text{O}_6\text{(OH)}_4^- \text{ + 6 H}_2\text{O}\]
\[ \text{4 B(OH)}_3 \text{ + B(OH)}^-_4 \rightleftharpoons \text{B}_3\text{O}_3\text{(OH)}_4^- \text{ + 3 H}_2\text{O} \]
\[ \text{2 B(OH)}_3 \text{ + 2 B(OH)}^-_4 \rightleftharpoons \text{B}_4\text{O}_5\text{(OH)}_4^{2-} \text{ + 5 H}_2\text{O} \]

El bórax, la forma mineral habitual del ácido bórico, es la sal sódica, Na 2 [B 4 O 5 (OH) 4], que al disolverse en agua se reequilibra a B (OH) 3.
Suficiente para hacer que tu cabello se riza
En 1906, un peluquero alemán, Charles Nessler que vivía en Londres, decidió ayudar a su hermana que estaba harta de tener que poner su pelo lacio en rulos. Mientras buscaba una solución, Nessler notó que un tendedero se contrajo en forma ondulada cuando estaba mojado. Nessler hirió el cabello de su hermana en tubos de cartón; luego cubrió el cabello con pasta de bórax. Después de envolver los tubos con papel (para excluir el aire) calentó toda la masa durante varias horas. Al quitar el papel y los tubos se obtuvo el pelo rizado. Después de mucho ensayo y error (presumiblemente ante el malestar de sus hermanas) Nessler perfeccionó el método para 1911, y llamó al proceso una onda permanente (o permanente). El proceso implicó el bórax alcalino suavizando el cabello lo suficiente para ser remodelado, mientras que el calentamiento rigidizó el bórax para mantener el cabello en forma. El bajo costo del bórax significó que los métodos de Nessler fueron un éxito inmediato.
Ácido metabórico
El calentamiento del ácido bórico resulta en la deshidratación parcial para producir ácido metabórico, HBO 2, (6.7.8). El ácido metabórico también se forma a partir de la hidrólisis parcial de B 2 O 3.
\[ \text{B(OH)}_3 \xrightleftharpoons[\text{H}_2\text{O}]{\Delta} \text{HBO}_2 \xrightleftharpoons[\text{H}_2\text{O}]{\Delta} \text{B}_2\text{O}_3 \]
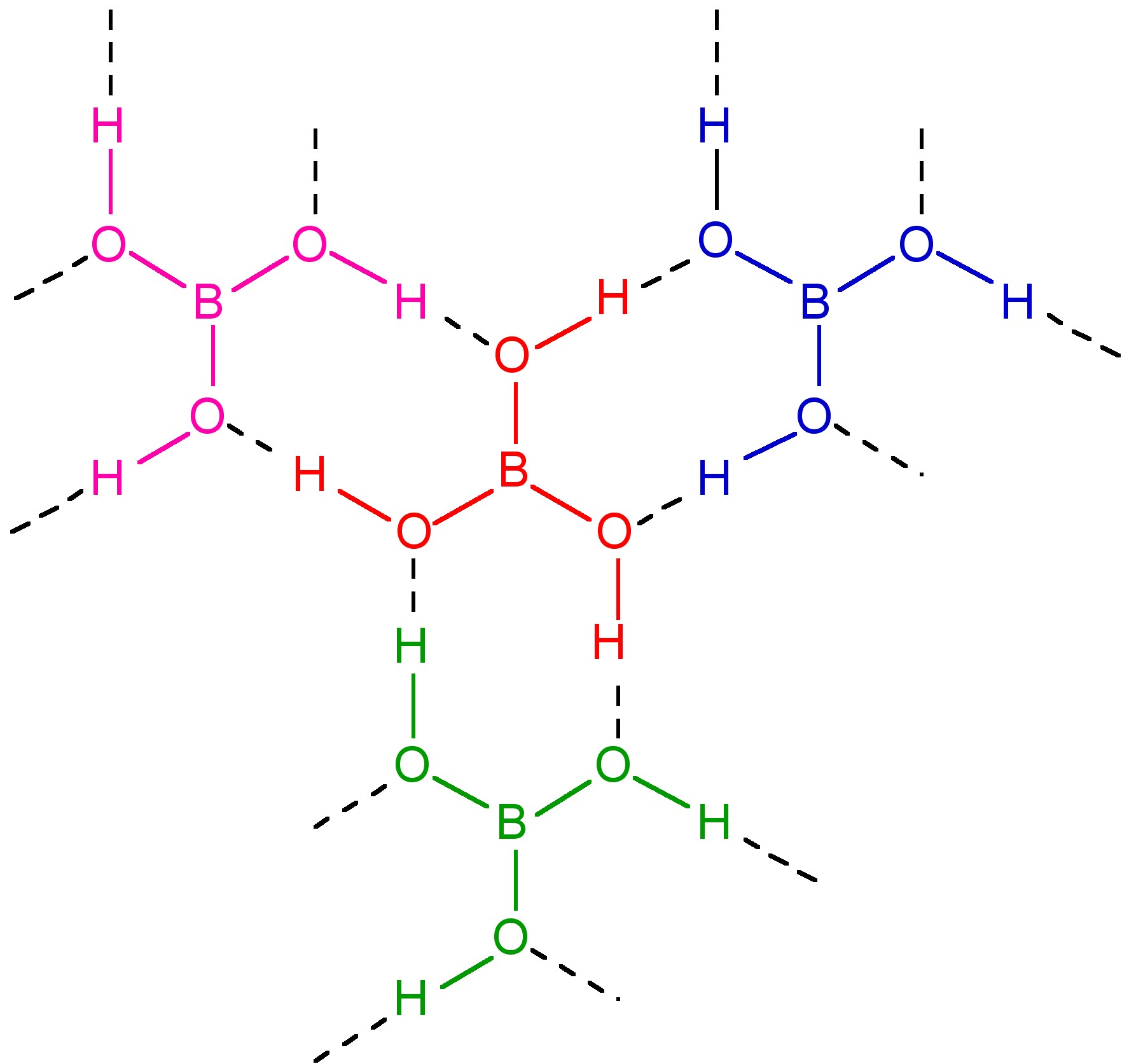
Si el calentamiento se realiza por debajo de 130 °C, se forma HBO 2 -III en el que los anillos B 3 O 3 se unen por enlaces de hidrógeno al hidróxido en cada átomo de boro (Figura\(\PageIndex{8}\)). El calentamiento continuado a 150 °C da como resultado HBO 2-II, cuya estructura consiste en tetraedros BO 4 y grupos B 2 O 5 unidos en cadena por enlaces de hidrógeno. Finalmente, el calentamiento por encima de 150 °C produce HBO 2-I cúbico con todos los átomos de boro tetraédricos.

Ésteres de borato
El ácido bórico reacciona con alcoholes en presencia de ácido sulfúrico para formar B (OR) 3 (Figura\(\PageIndex{4}\)). Esta es la base para una simple prueba de llama para boro. El tratamiento de un compuesto con metanol/ácido sulfúrico, seguido de colocar el producto de reacción en una llama da como resultado una llama verde debido a B (OMe) 3.
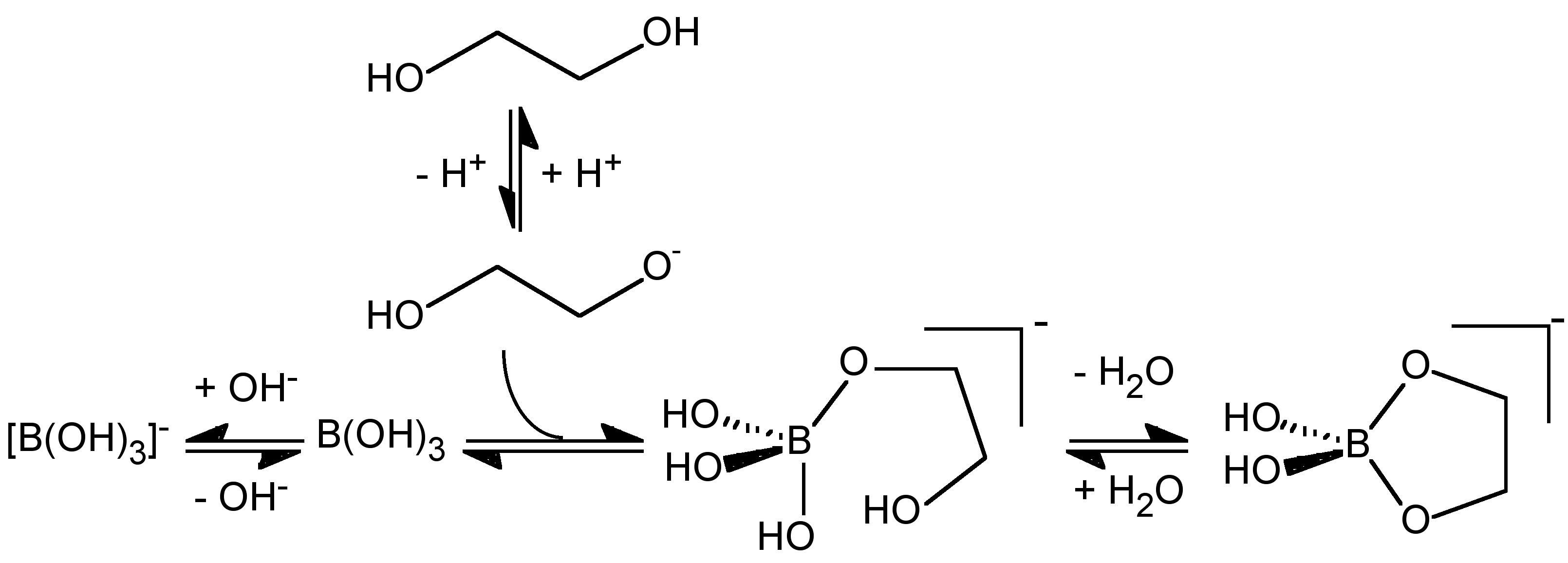
En presencia de dioles, polioles o polisacáridos, el ácido bórico reacciona para formar complejos de alcóxido. En el caso de los dioles, el mono-diol [B (OH) 2 L] - (Figura\(\PageIndex{9}\) a) y el bis - diol [BL 2] - (Figura\(\PageIndex{9}\) b) complejos.

Originalmente se propuso que los dioles reaccionan con el anión más que con el ácido bórico, (6.7.9). En contraste, se sugirió que el pH óptimo para la formación de complejos de ácido carboxílico es bajo la condición donde pK a (ácido carboxílico) < pH < pK a (ácido bórico). En estas condiciones es el ácido bórico, B (OH) 3, no el anión borato, [B (OH) 4] -, el que reacciona para formar el complejo.
\[ \text{[B(OH)}_4\text{]}^- \xrightleftharpoons{\text{+ LH}_2} \text{[B(OH)}_2\text{L]}^- \xrightleftharpoons{\text{+ LH}_2} \text{[BL}_2\text{]}^-\]
La conversión de ácido bórico en borato (6.7.3) debe ocurrir a través del ataque de hidróxido o la desprotonación de un ligando de agua coordinado, cualquiera de los cuales está relacionado con el pKa del agua. Se esperaría que la formación de [B (OH) 2 L] - a partir de B (OH) 3 ocurriera por lo tanto a través de una reacción inicial similar (ataque por RO - o desprotonación de ROH coordinado) seguida de una posterior eliminación de H 2 O y la formación de un quelato coordinación, y por lo tanto estaría relacionado con el pKa del alcohol. Así, el pH al que se forma [B (OH) 2 L] - con relación a [B (OH) 4] - dependerá de la acidez relativa del alcohol. El pK a de un alcohol simple (e.g., MeOH = 15.5, EtOH = 15.9) están cerca del valor para el agua (15.7) y el pH más bajo al que se forma [B (OH) 2 L] - debe ser comparable al que se forma [B (OH) 4] -. Así, la formación de [B (OH) 2 L] -en comparación con [B (OH) 4] - es una competencia entre la reacción de B (OH) 3 con RO - y OH - (Figura\(\PageIndex{10}\)), y al igual que con los ácidos carboxílicos es el ácido bórico no borato el que reacciona con el alcohol, (6.7.10).
\[ \text{B(OH)}_3 \xrightleftharpoons{\text{+ LH}_2} \text{[B(OH)}_2\text{L]}^- \xrightleftharpoons{\text{+ LH}_2} \text{[BL}_2\text{]}^- \]
Un tema clave en la caracterización estructural y comprensión del sistema diol/ácido bórico es la asignación de los cambios espectrales de 11 B RMN asociados a diversos complejos. En la Figura se muestra una representación gráfica de los intervalos de desplazamiento observados para los sistemas de quelatos de ácido bórico\(\PageIndex{11}\).

Reticulación con ácido bórico de goma guar para fluidos de fracturación hidráulica
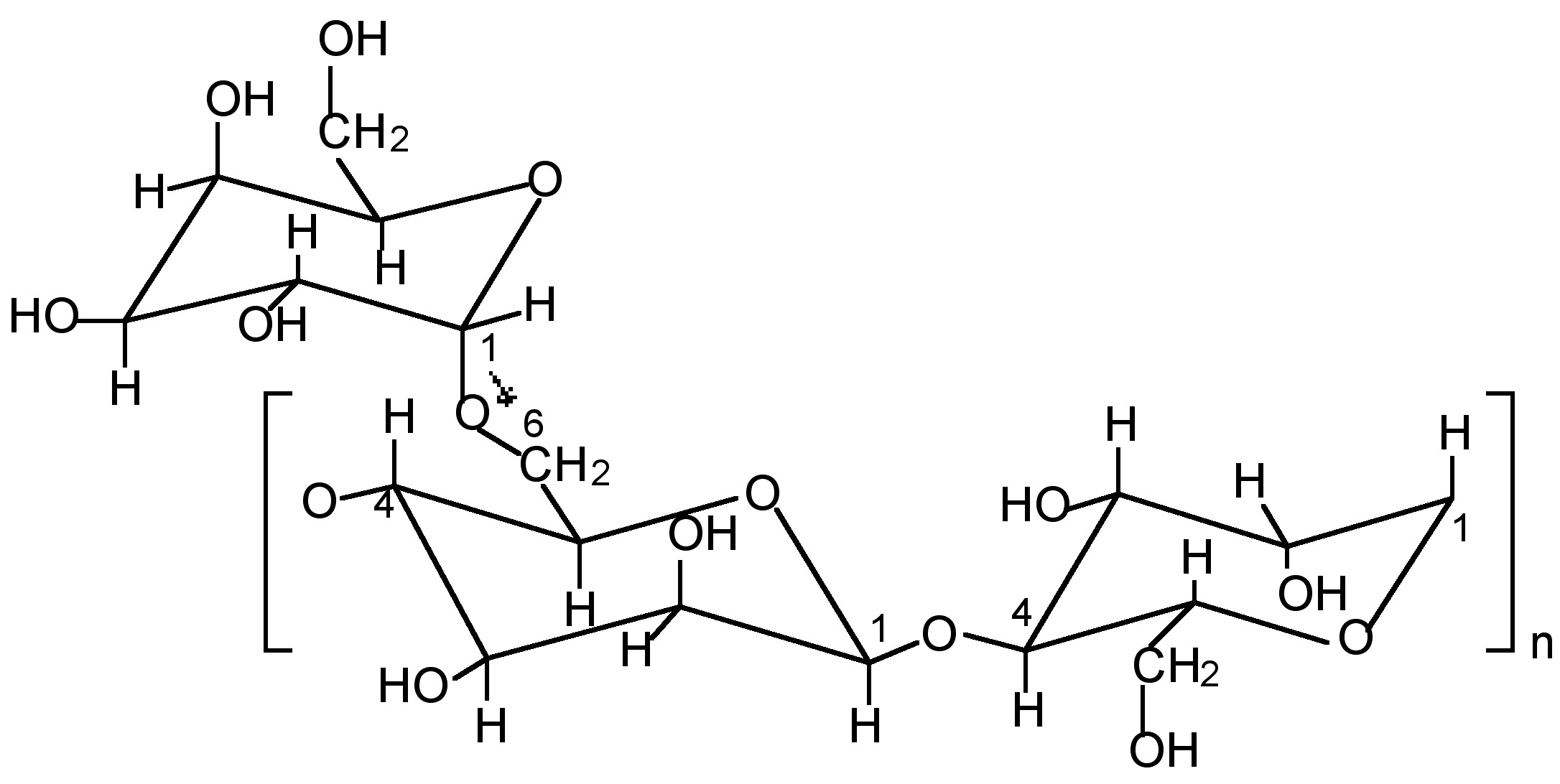
Los geles gruesos de goma guar reticulados con bórax o un complejo de metal de transición se utilizan en la industria de perforación de pozos petrolíferos como fluidos de fracturación hidráulica. El guarán polisacárido (M w ≈ 10 6 Da) es el componente principal (>85% en peso) de la goma guar, y consiste en una cadena principal (1→4) - β -D-manoppiranosilo con unidades de cadena lateral α -D-galactopiranosil unidas a través de enlaces (1→6). Aunque la relación exacta varía entre diferentes cultivos de goma guar, la estructura general es consistente con aproximadamente una galactosa a cada otra manosa (Figura\(\PageIndex{12}\)).
La síntesis de un gel típico de guar reticulado con ácido bórico, con propiedades de viscosidad adecuadas para su uso como fluido de fracturación, implica mezclar goma guar, agua y ácido bórico, B (OH) 3, en una relación peso/peso 10:2000:1. Ajustar el pH a entre 8.5 y 9 da como resultado un gel viscoso. La relación borón:guaran corresponde a casi 2 centros de boro por cada 3 unidades de repetición de monosacáridos. Un exceso tan grande de ácido bórico indica claramente que el sistema no está optimizado para la reticulación, es decir, una fracción significativa del ácido bórico es ineficaz como agente de reticulación.
Las razones de la ineficiencia del ácido bórico para reticular guaran (se requieren casi 2 iones borato por cada 3 unidades de repetición de monosacáridos para un gel viscoso adecuado como fluido de fracturación): los sitios más reactivos en los sacáridos componentes (manosa y galactosa) están impedidos de reacción por la naturaleza del estructura guar; la acidez comparable (pK a) de los sustituyentes restantes del alcohol guarano y el disolvente acuoso, da como resultado una competencia entre la reticulación y la formación de borato; una fracción significativa del ácido bórico es ineficaz en la reticulación del guar debido al modesto equilibrio (K eq).
Bibliografía
- F. A. Cotton y G. Wilkinson, Química Inorgánica Avanzada, 4ª Ed. Wiley Interscience (1980).
- M. Bishop, N. Shahid, J. Yang, y A. R. Barron, Dalton Trans., 2004, 2621.
- M. Van Duin, J. A. Peters, A. P. G. Kieboom, y H. Van Bekkum, Tetraedron, 1984, 40, 2901.
- Aislamiento Zonal, “Fluidos reticulados con borato”, de R. J. Powell y J. M Terracina, Halliburton, Duncan, OK (1998).
- R. Schechter, Estimulación de pozos de petróleo, Prentice-Hall Inc., Englewood Cliffs, NJ (1992).
- S. Kesavan y R. K. Prud'homme, Macromolecules, 1992, 25, 2026.

