6.10: Compuestos de boro con Donantes de Nitrógeno
- Page ID
- 69445
La unidad “B-N” es isoelectrónica (3 + 5 electrones de valencia) a la unidad “C-C” (4 + 4 electrones de valencia). Los dos restos también son isolobales, y como tales hay muchos de los tipos de compuestos formados por carbono que tienen derivados análogos en la química del boro-nitrógeno.
Compuestos de adición ácido-base de Lewis
Los compuestos de boro, BX 3, son ácidos de Lewis fuertes y como tales forman compuestos de adición estables con bases de Lewis, en particular aquellos con ligandos donadores de nitrógeno.
\[ \text{BF}_3 \text{ + NMe}_3 \rightarrow \text{F}_3\text{B-NMe}_3\]
En principio estos complejos ácido-base de Lewis deben ser similares a sus análogos de hidrocarburos isolobales, sin embargo, mientras que el dipolo en etano es cero (por simetría) el dipolo en H 3 NBH 3 es 5.2 D como consecuencia de la diferencia en las electronegatividades de Pauling (es decir, B = 2.04 y N = 3.04). Es este dipolo el que generalmente diferencia a los compuestos B-N de sus análogos C-C.
La escisión homolítica del enlace C-C en etano dará dos radicales metilo neutros, (6.7.2). En contraste, la escisión heterolítica dará como resultado la formación de dos especies cargadas, (6.7.3). Así, los productos o bien tienen un giro neto, (6.7.2), o un cargo neto, (6.7.3). Por el contrario, la escisión del enlace B-N en H 3 N-BH 3 produce productos tanto con espín como con carga, (6.7.5), o ninguno, (6.7.4). La escisión heterolítica del enlace B-N produce compuestos neutros, (6.7.4), mientras que la escisión hemolítica da como resultado la formación de iones radicales, (6.7.5).
\[\text{H}_3\text{C-CH}_3 \rightarrow \cdot\text{CH}_3 \text{ + } \cdot\text{CH}_3 \]
\[\text{H}_3\text{C-CH}_3 \rightarrow \text{CH}^+_3 \text{ + } \cdot\text{CH}^-_3\]
\[\text{H}_3\text{N-BH}_3 \rightarrow \text{NH}_3 \text{ + BH}_3 \]
\[\text{H}_3\text{N-BH}_3 \rightarrow \text{NH}^+_3\cdot \text{ + BH}^-_3\cdot\]
La diferencia en la fuerza de unión entre H 3 N-BH 3 y etano se refleja en la diferencia en longitudes de unión (Tabla\(\PageIndex{1}\)).
| Compuesto | Longitud de enlace (Å) | Fuerza de unión (kcal/mol) |
| H 3 C-CH 3 | 1.533 | 89 |
| H 3 N-BH 3 | 1.658 | 31 |
Aminoboranes
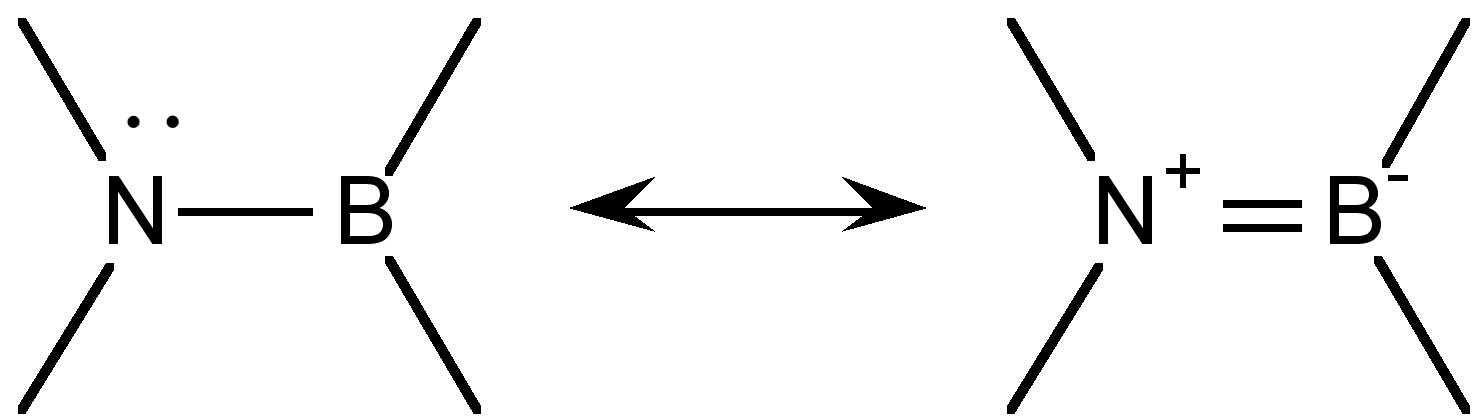
El grupo R' 2 N-BR 2 es isoelectrónico e isolobular a la subunidad olefínica R' 2 C=CR 2, e incluso hay un carácter de enlace π apreciable (Figura\(\PageIndex{1}\)). Una medida del carácter de enlace múltiple se puede ver a partir de una comparación del enlace B-N calculado en H 2 NBN 2 (1.391 Å) en comparación con una olefina típica (1.33 Å). Es interesante que una consideración de la posible forma de resonancia (Figura\(\PageIndex{1}\)) sugiere que el dipolo en el enlace σestá en la dirección opuesta a la del enlace π.
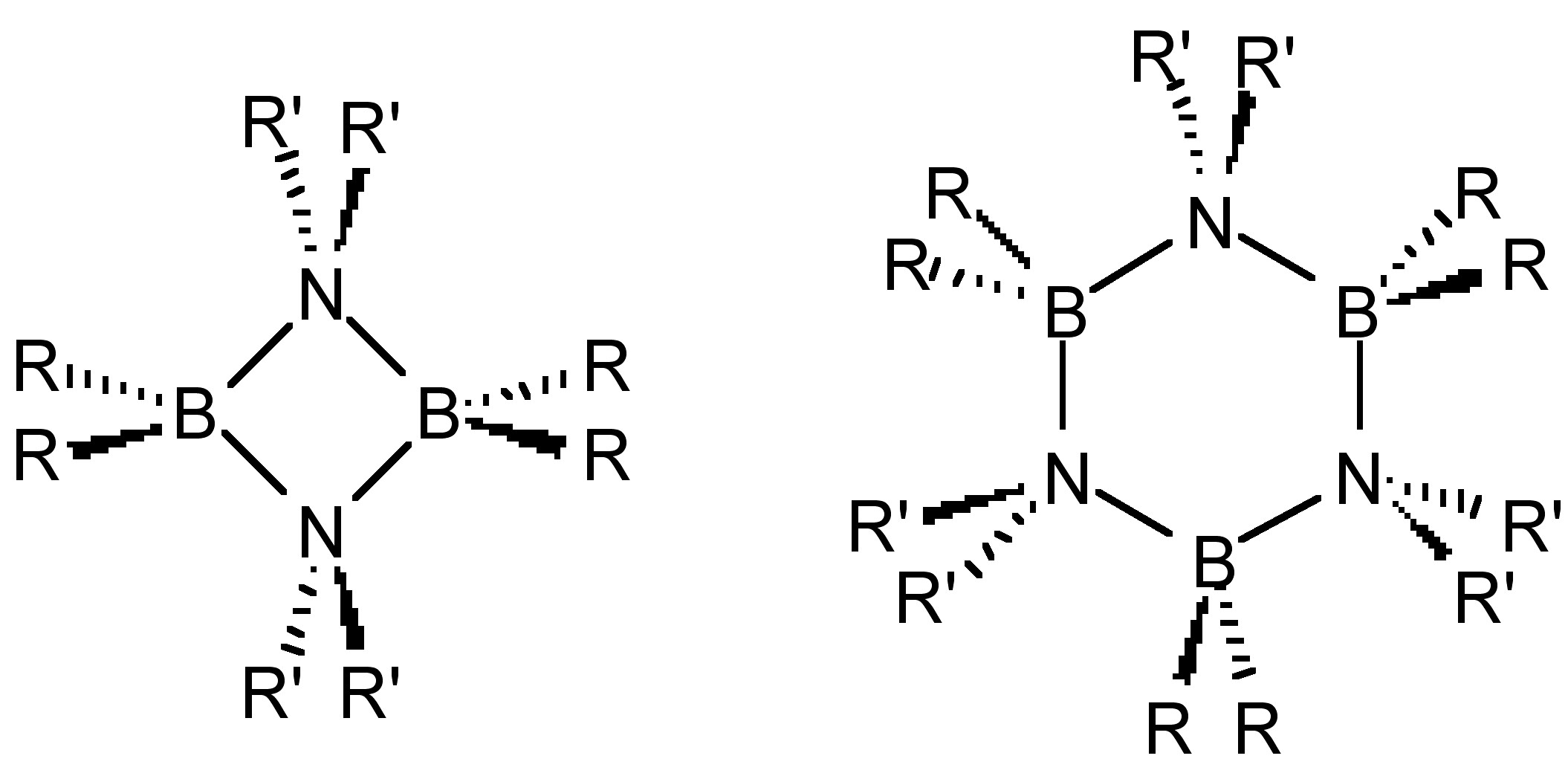
A diferencia de las olefinas, las borazinas se oligomerizan para formar dimmers y trímeros (Figura\(\PageIndex{2}\)) en ausencia de impedimento estérico significativo. También se observan estructuras análogas para los otros homólogos del Grupo 13-15 (R 2 AlNR' 2, R 2 GaPr' 2, etc.).
Borazines
La condensación de hidruro de boro con amoníaco da como resultado la formación de un análogo de benceno: borazina, (6.7.6). Los derivados sustituidos se forman por la reacción con aminas primarias.
\[ \text{BH}_3 \text{ + NH}_3 \rightleftharpoons \text{H}_3\text{B-NH}_3 \xrightarrow[\text{- H}_2]{\Delta} \text{[H}_2\text{B-NH}_2\text{]}_n \xrightarrow[\text{- H}_2]{\Delta} \text{[HBNH]}_6\]
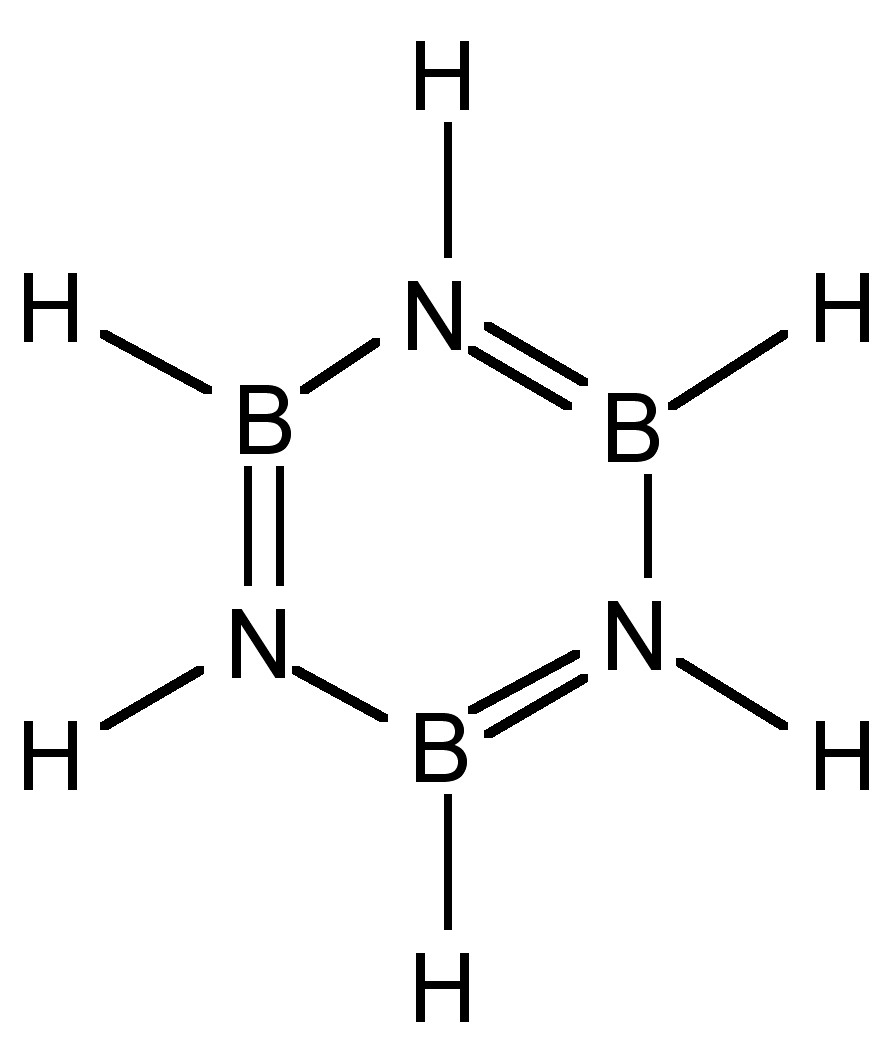
A pesar de la estructura cíclica (Figura\(\PageIndex{3}\)), la borazina no es un verdadero análogo del benceno. A pesar de que todas las distancias de enlace B-N son iguales (1.44 Å) consistentes con una estructura deslocalizada, la diferencia en electronegatividad de boro y nitrógeno (2.04 y 3.04, respectivamente) da como resultado una polarización de los enlaces (es decir, B δ+ -N δ-) y por lo tanto un límite a la deslocalización. Los orbitales moleculares del sistema π en borazina son grumosos en apariencia (Figura\(\PageIndex{4}\) a) en comparación con benceno (Figura\(\PageIndex{4}\) b). Esta distribución desigual hace que la borazina sea propensa a reacciones de adición, haciéndola como molécula menos estable que el benceno.
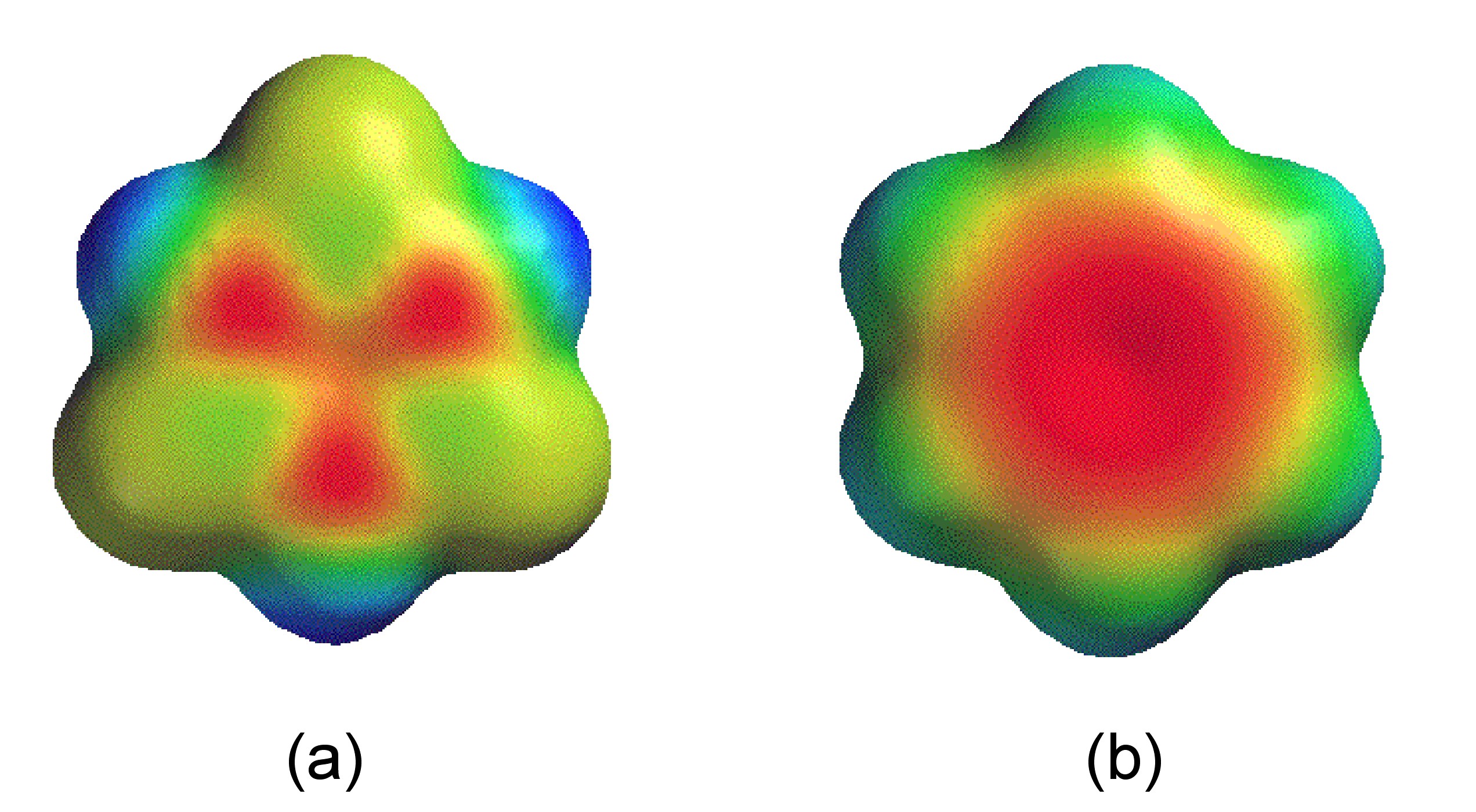
Iminoboranos: análogos de acetileno
Los iminoboranos, RB=NR', son análogos de alquinos, pero al igual que los aminoboranos solo se aíslan como monómeros con subsistentes estéricamente impedidos. En ausencia de suficiente oligomerización a granel estérico se produce, formando análogos de benceno sustituidos.
Nitruros de boro: análogos de carbono elemental
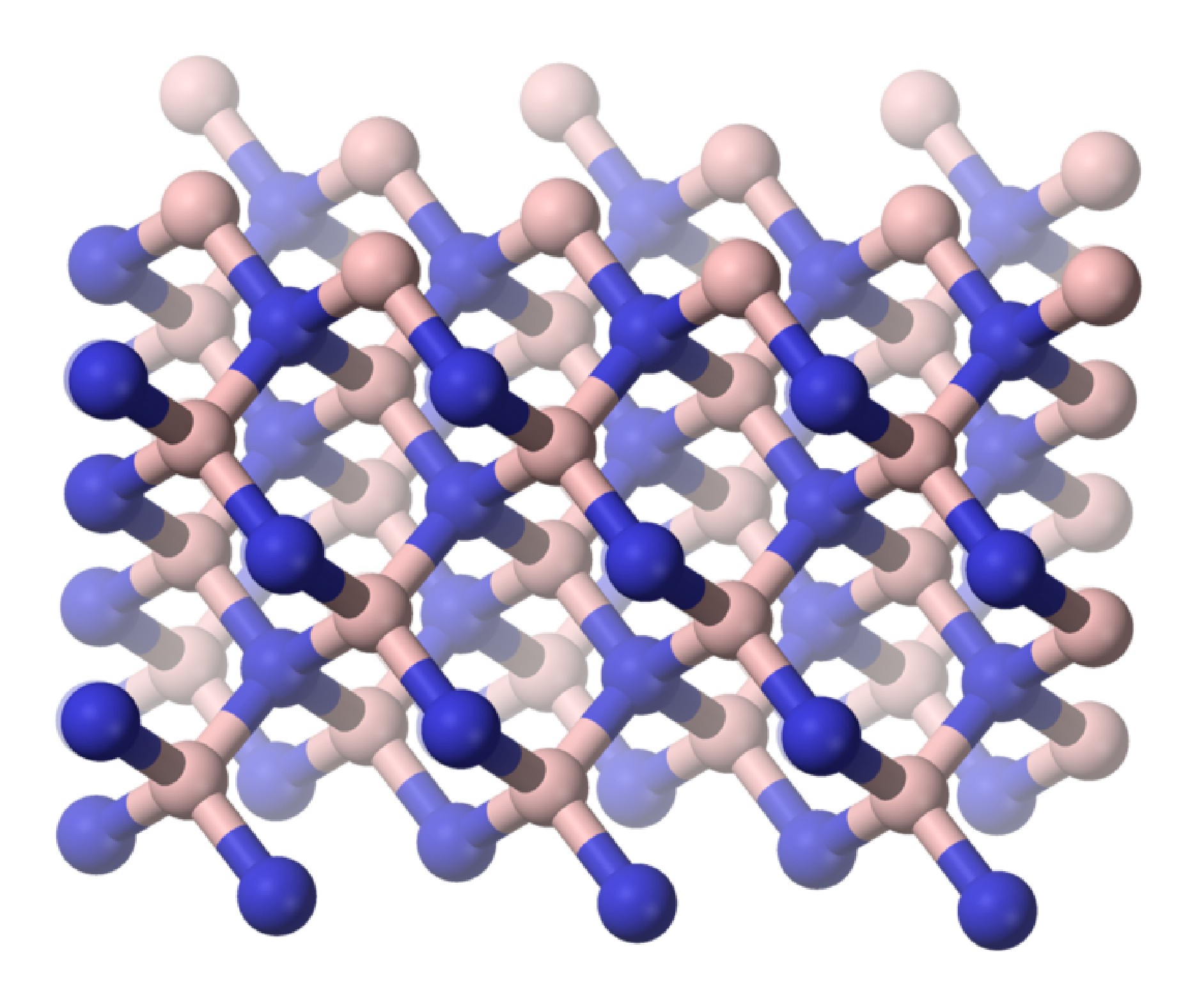
La fusión de bórax, Na 2 [B 4 O 5 (OH) 4] con cloruro amónico (NH 4 Cl) da como resultado la formación de nitruro de boro hexagonal (h-BN). Aunque h-BN tiene una estructura plana en capas que consiste en anillos de seis miembros similares al grafito (Figura\(\PageIndex{5}\)), es un sólido blanco. La diferencia de color es sintomática de la unión más localizada en BN que en grafito.

Como se encuentra para su análogo de carbono, el nitruro de boro hexagonal (h-BN o α-BN) se convierte a altas temperaturas (600 — 2000 °C) y presiones (50 — 200 kbar) a una fase cúbica (c-BN o β-BN). De manera similar al diamante, Cubic-BN es muy duro siendo realmente capaz de cortar diamante, y como consecuencia su uso principal es como agente de molienda industrial. La forma cúbica tiene la estructura cristalina de esfalerita (Figura\(\PageIndex{6}\)). Finalmente, se conoce una forma wurtzita de nitruro de boro (w-BN) que tiene una estructura similar a la lonsdaleita, raro polimorfo hexagonal de carbono. En el cuadro se\(\PageIndex{2}\) muestra una comparación de las propiedades de las fases hexagonal y cúbica de BN con sus análogos de carbono.
| Fase | Carbono | Nitruro de boro |
|---|---|---|
| Cúbico | Incoloro, duro, mp = 3550 °C. C-C = 1.514 Å | Incoloro, duro, B-N = 1.56 Å |
| Hexagonal | Sólido negro, capas planas, conductor, mp = 3652 — 3697 °C (sublima), C-C = 1.415 Å | Sólido blanco, capas planas, semiconductor (Eg = 5.2 eV), mp = 2973 °C (sublima), B-N = 1.45 Å |
La estructura parcialmente iónica de las capas de BN en h-BN reduce la covalencia y la conductividad eléctrica, mientras que la interacción entre capas aumenta dando como resultado una mayor dureza de h-BN en relación con el grafito.
Bibliografía
- K. M. Bissett y T. M. Gilbert, Organometálicos, 2004, 23, 850.
- P. Paetzold, Adv. Inorg. Chem. , 1987, 31, 123.
- L. R. Thorne, R. D. Suenram, y F. J. Lovas, J. Chem. Phys. , 1983, 78, 167.

