6.14: Halogenuros del Grupo 13
- Page ID
- 69468
Trihaluros, MX 3
Como se muestra en la Tabla\(\PageIndex{1}\) todas las combinaciones del elemento del Grupo 13 (M) y halógeno (X) existen para los trihaluros (MX 3), excepto el yoduro de talio (III). Cabe señalar que si bien existe un compuesto con la fórmula general TLi 3, en realidad es un compuesto de talio (I) de I 3 -.
| Element | Mp (°C) | Bp (°C) |
| BF 3 | -126.8 | -100.3 |
| BCl 3 | -107.3 | 12.6 |
| BBr 3 | -46.3 | 91.3 |
| BI 3 | 49.9 | 210 |
| AlF 3 | 1291 | - |
| AlCl 3 | 192.4 (anhidro), 0.0 (hexahidrato) | 120 (hexahidrato) |
| AlBr 3 | 97.8 | 265 |
| ALi 3 | 189.4 (anhidro) 185 dic. (hexahidrato) | 300 subl. |
| GaF 3 | 800 | 1000 |
| GACL 3 | 77.9 | 201 |
| GAbR 3 | 121.5 | 278.8 |
| Gai 3 | 212 | 345 |
| InF 3 | 1172 | - |
| Incl 3 | 586 | 800 |
| InBr 3 | 220 | - |
| INi 3 | 210 subl. | - |
| TLF 3 | 300 dic. | - |
| TLCl 3 | 40 dic. | - |
| TLBr 3 | 40 dic. | - |
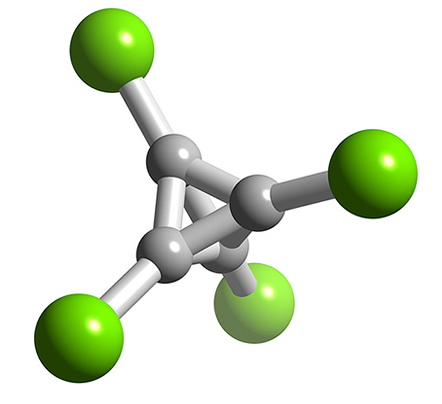
Los trihaluros de boro son todos monómeros con un número de coordinación de 3 (Cuadro\(\PageIndex{2}\)), como evidencia de sus bajos puntos de fusión (Cuadro\(\PageIndex{1}\)). En contraste, los fluoruros y cloruros de los elementos más pesados del Grupo 13 (excepto GACl 3) son generalmente iónicos o tienen un alto carácter iónico, con un número de coordinación de 6 (Cuadro\(\PageIndex{2}\), Figura\(\PageIndex{1}\) y Figura\(\PageIndex{2}\)). Los bromuros y yoduros (excepto InBr 3) son generalmente diméricos con un número de coordinación de 4 (Tabla\(\PageIndex{2}\)) y tienen estructuras moleculares que involucran ligandos de puente de haluro (Figura\(\PageIndex{3}\) y Tabla\(\PageIndex{3}\)). El AlCl 3 es inusual ya que en estado sólido tiene una estructura iónica, pero se sublima fácilmente, y en la fase vapor (y fase líquida) tiene una estructura dimérica (Figura\(\PageIndex{3}\)).
| Element | Fluoruro | Cloruro | Bromuro | yoduro |
| B | 3 | 3 | 3 | 3 |
| Al | 6 | 6 (4) | 4 | 4 |
| Ga | 6 | 4 | 4 | 4 |
| En | 6 | 6 | 6 | 4 |
| Tl | 6 | 6 | 4 | - |
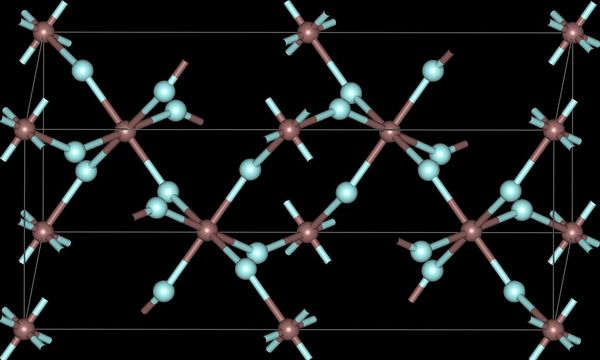


| Compuesto | M-X t (Å) a | M-X b (Å) a | X t -M-X t (°) a | X b -M-X b (°) a | M-X-M (°) |
| Al 2 Br 6 | 2.21 | 2.33 | 115 | 93 | 87 |
| En 2 I 6 | 2.64 | 2.84 | 125.1 | 93.7 | 86.3 |
Síntesis
El trifluoruro de boro (BF 3) se fabrica comercialmente por reacción de óxidos de boro con fluoruro de hidrógeno, (6.14.1). El HF se produce in situ a partir de ácido sulfúrico y fluorita (CaF 2). En escalas más pequeñas, el BF 3 se prepara mediante la descomposición térmica de sales de diazonio, (6.14.2).
\[ \text{B}_2\text{O}_3 \text{ + 6 HF} \rightarrow \text{2 BF}_3 \text{ + 3 H}_2\text{O}\]
\[ \text{PhN}_2\text{[BF}_4\text{]} \rightarrow \text{PhF + BF}_3 \text{ + N}_2 \]
El tricloruro de boro también está hecho de óxido de boro, pero en presencia de carbono, (6.14.3).
\[ \text{B}_2\text{O}_3 \text{ + 3 C + 3 Cl}_2 \rightarrow \text{2 BCl}_3 \text{ + 3 CO}\]
Muchos de los trihaluros se preparan fácilmente ya sea por la reacción directa del metal con el halógeno apropiado, (6.14.4) - (6.14.6), o el ácido, (6.14.7) y (6.14.8). El tribromuro de talio se puede preparar en CH 3 CN tratando una solución del monobromuro con gas bromo, (6.14.9).
\[ \text{2 Al + 3 Cl}_2 \rightarrow \text{2 AlCl}_3\]
\[ \text{2 Al + 3 Br}_2 \rightarrow \text{2 AlBr}_3\]
\[ \text{2 Al + 3 I}_2 \rightarrow \text{2 AlCl}_3\]
\[ \text{2 Al + 6 HCl} \rightarrow \text{2 AlCl}_3 \text{ + 3 H}_2\]
\[ \text{2 Al + 6 HBr} \rightarrow \text{2 AlBr}_3 \text{ + 3 H}_2\]
\[ \text{TlBr + Br}_2 \rightarrow \text{TlBr}_2 \]
Reactividad
La química de reacción de los trihaluros del Grupo 13 tiende a clasificarse en dos categorías:
- Formación del complejo ácido-base de Lewis.
- Hidrólisis.
Sin embargo, hay una serie de reacciones que implican reacciones de intercambio de haluro. El tribromuro de aluminio reacciona con tetracloruro de carbono a 100 °C para formar tetrabromuro de carbono, (6.14.10), y con fosgeno produce bromuro de carbonilo y clorobromuro de aluminio, (6.14.11).
\[ \text{4 AlBr}_3 \text{ + 3 CCl}_4 \rightarrow \text{4 AlCl}_3 \text{ + 3 CBr}_4 \]
\[ \text{AlBr}_3 \text{ + COCl}_2 \rightarrow \text{COBr}_2 \text{ + AlCl}_2\text{Br}\]
Los haluros del grupo 13 se utilizan como sintones para sus derivados organometálicos, (6.14.12) y (6.14.13).
\[ \text{MX}_3 \text{ + 3 RMgX} \rightarrow \text{MR}_3 \text{ + MgX}_2\]
\[ \text{2 MR}_3 \text{ + MX}_3 \rightarrow \text{3 MXR}_2\]
Complejos ácido-base de Lewis
Todos los trihaluros son ácidos de Lewis fuertes, y como tales reaccionan con compuestos base de Lewis para formar complejos ácido-base de Lewis, (6.14.12). La extensión del equilibrio depende de la acidez de Lewis del trihaluro y de la basicidad de la base de Lewis. Por ejemplo, con Bcl3, los ligandos donadores de oxígeno dan como resultado una relación aproximadamente 50:50 de Bcl3 y Bcl3 L, mientras que para los ligandos donadores de nitrógeno el equilibrio se desplaza a la formación del complejo.
\[ \text{MX}_3 \text{ + L} \rightleftharpoons \text{X}_3\text{M-L}\]
La estructura general de los complejos ácido-base de Lewis es tal que el elemento del Grupo 13 es cercano al tetraédrico (Figura\(\PageIndex{4}\)). Sin embargo, para el aluminio y los elementos más pesados del Grupo 13, más de un ligando puede coordinarse (Figura\(\PageIndex{5}\)) hasta un máximo de seis.
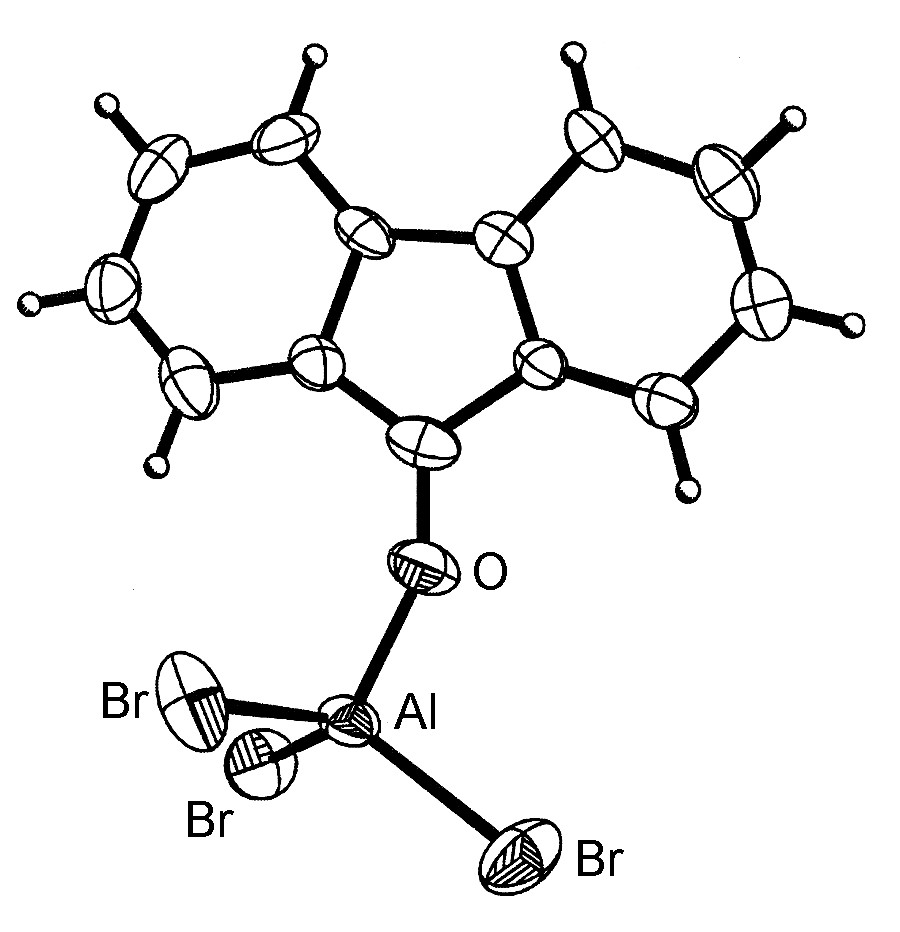
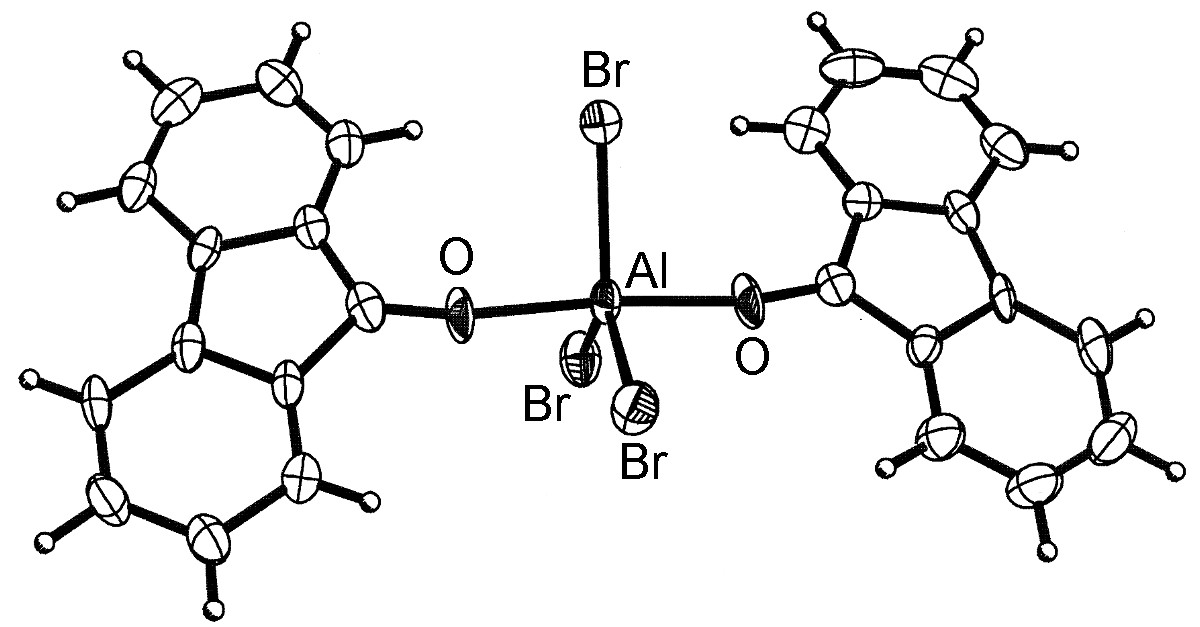
Cabe señalar que la forma dimérica de MX 3 (Figura\(\PageIndex{3}\)) puede considerarse como complejos ácido-base mutuos de Lewis, en los que un par solitario básico de Lewis de un haluro en una unidad MX 3 dona al metal ácido de Lewis en otra unidad MX 3.
Hidrólisis
Generalmente los fluoruros son insolubles en agua mientras que los haluros más pesados son más solubles. Sin embargo, BF 3, BCl3 y BBr 3 se descomponen en presencia de agua, (6.14.13). En el caso del fluoruro, el HF formado reacciona con BF 3 para formar ácido fluorobórico, (6.14.14). Sin embargo, también hay un equilibrio menor (2-3%) que resulta en la formación del complejo BF 3 de OH - y H 3 O +, (6.14.15).
\[ \text{BX}_3\text{ + H}_2\text{O} \rightarrow \text{B(OH)}_3\text{ + 3 HX}\]
\[ \text{HF + BF}_3 \rightarrow \text{HBF}_4\]
\[ \text{BF}_4 \text{ + H}_3\text{O} \rightleftharpoons \text{F}_3\text{B-OH}_2 \rightleftharpoons \text{[BF}_3\text{OH][BF}_3\text{(OH}_3\text{)]}\]
Mientras que los compuestos de boro (y AlBr 3) se descomponen incluso en aire húmedo, el AlCl 3 reacciona más lentamente para producir el clorohidrato de aluminio (ACH) el cual tiene la fórmula general Al n Cl 3n-m (OH) m. Si bien se ha propuesto que la ACH exista como una serie de especies de conglomerados, en realidad es una gama de nanopartículas.
ACH también se conoce como cloruro de polialuminio (PAC). Este último nombre se usa a menudo en la purificación de agua, donde se prefiere ACH sobre los derivados de alumbre (Al 2 (SO 4) 3). La combinación de ACH y un polímero de amonio cuaternizado de alto peso molecular (por ejemplo, cloruro de dimetil amonio (DADMAC)), se ha conocido como una combinación efectiva como floculante en el proceso de tratamiento de agua para eliminar la materia orgánica disuelta y las partículas coloidales presentes en suspensión.
El clorohidrato de aluminio (ACH) y los compuestos de aluminio-circonio, se utilizan frecuentemente como ingrediente activo en los antitranspirantes. El modo de acción de la mayoría de los compuestos a base de aluminio implica el cambio dramático en el tamaño de partícula de nano a micro en función de los cambios de pH y electrolitos en la piel (en comparación con la barra o suspensión antitranspirante) y por lo tanto formar un tapón de gel en el conducto de la glándula sudoríparas. Los tapones evitan que la glándula excrete líquido y se eliminan con el tiempo por el desprendimiento natural de la piel. Otro mecanismo de acción implica la absorción del ácido 3-metil-2-hexenoico (Figura\(\PageIndex{6}\)). La transpiración humana es inodora hasta que las bacterias la fermentan. Las bacterias prosperan en ambientes cálidos y húmedos como la axila. Cuando las axilas adultas se lavan con jabones de pH alcalino, la piel pierde su capa ácida (pH = 4.5 - 6), elevando el pH de la piel e interrumpiendo la barrera cutánea. Las bacterias prosperan en el ambiente básico, y se alimentan del sudor de las glándulas apocrinas y de la piel muerta y las células ciliadas, liberando ácido 3-metil-2-hexenoico, que es la principal causa de olor corporal. Al igual que con todos los ácidos carboxílicos, el ácido 3-metil-2-hexenoico, reacciona de manera fácil con la superficie de las nanopartículas de alúmina. Las sales de cloruro de aluminio también tienen un ligero efecto astringente en los poros; haciendo que se contraigan, evitando aún más que el sudor llegue a la superficie de la piel.

Trihaluros de boro: un caso especial
Los tres trihaluros de boro más ligeros, BX 3 (X = F, Cl, Br) forman aductos estables con bases comunes de Lewis. Sus acidedades relativas de Lewis pueden evaluarse en términos de la exotermicidad relativa de la reacción formadora de aducto:
\[ \text{BF}_3 \text{ < BCl}_3 \text{ < BBr}_3\text{(strongest Lewis acid)}\]
Esta tendencia es opuesta a la esperada basada en la electronegatividad de los halógenos. La mejor explicación de esta tendencia toma en cuenta el grado de donación-p que ocurre entre el orbital de par solitario lleno en los halógenos y el orbital p vacío en el boro plano (Figura\(\PageIndex{7}\)). Como tal, cuanto mayor es el enlace p, más estable es la configuración plana de BX 3 en oposición a la piramidalización del resto BX 3 tras la formación de un complejo ácido-base de Lewis, (6.4.12).
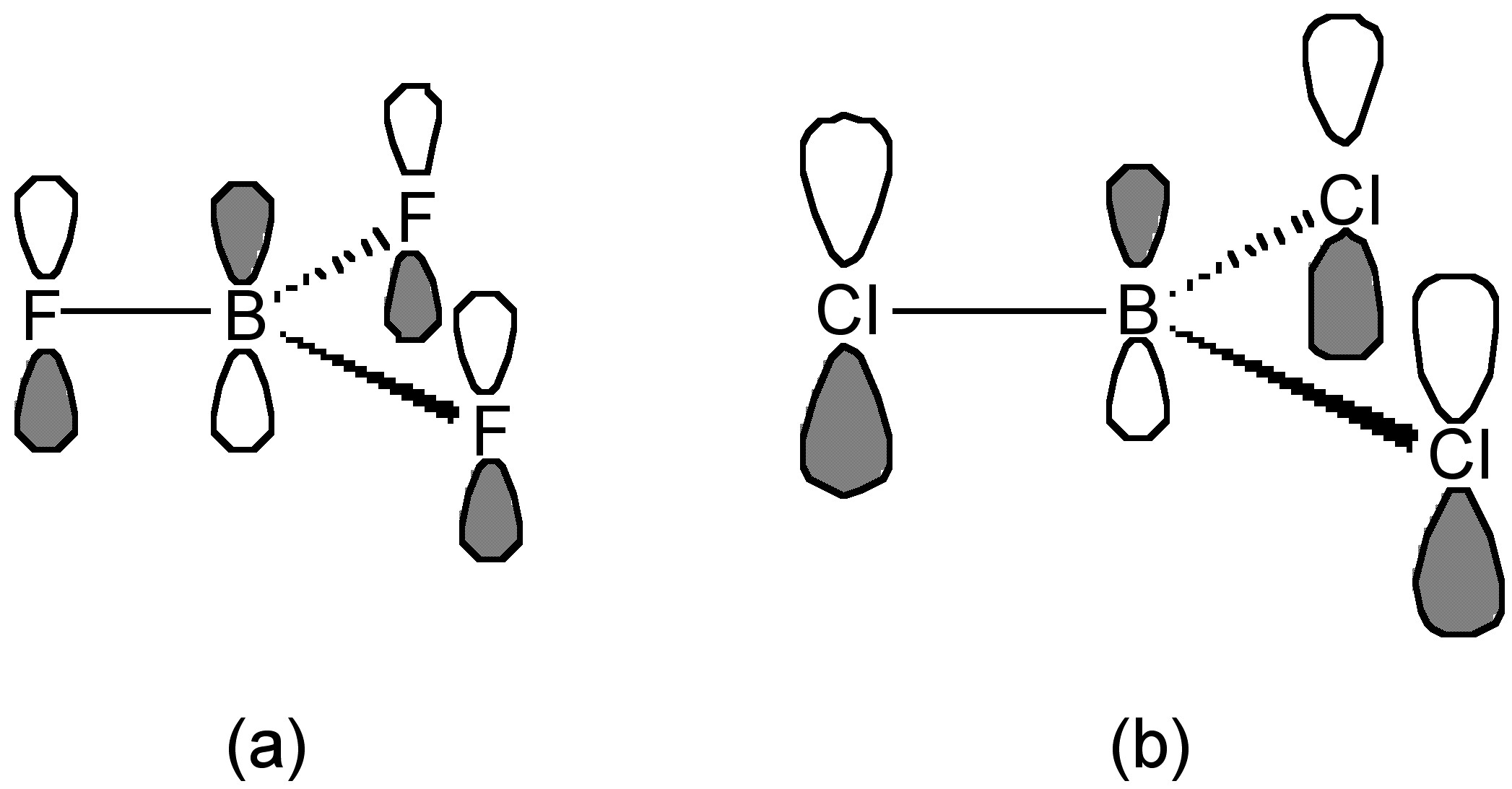
Los criterios para evaluar la fuerza relativa del enlace p no están claros, sin embargo, una sugerencia es que el átomo F es pequeño comparado con el átomo de Cl, y el electrón de par solitario en pz de F es fácil y fácilmente donado y solapado para vaciar p z orbital de boro (Figura\(\PageIndex{7}\) a). En contraste, el solapamiento para los orbitales p grandes (difusos) sobre el cloro es más pobre (Figura\(\PageIndex{7}\) b). Como resultado, la donación π-de F es mayor que la de Cl. Curiosamente, como puede verse en la Tabla\(\PageIndex{4}\), cualquier diferencia en la longitud del enlace B-X no sigue la tendencia esperada asociada con el acortamiento del enlace B-X con una unión π más fuerte. De hecho, la distancia B-Br es la más acortada en comparación con la esperada de los radios covalentes (Tabla\(\PageIndex{4}\)).
| Compuesto | B-X (Å) | X radio covalente (Å) | Suma de radios covalentes (Å) a | Δ (Å) |
| BF 3 | 1.313 | 0.57 (3) | 1.41 | 0.097 |
| BCl 3 | 1.75 | 1.02 (4) | 1.86 | 0.11 |
| BBr 3 | 1.898 | 1.20 (3) | 2.04 | 0.142 |
| BI 3 | 2.125 | 1.39 (3) | 2.23 | 0.105 |
En el nivel más simple, los requisitos para que se produzca la unión con base en el orbital molecular o atómico son:
- Relación direccional de los orbitales.
- Simetría relativa de los orbitales.
- Energía relativa de los orbitales.
- Alcance de la superposición orbital
En el caso de los trihaluros de boro, la dirección (paralela) y la simetría (orbitales p) son las mismas, y la única diferencia significativa será la energía relativa de los orbitales donantes (es decir, el par solitario en el halógeno) y la extensión del solapamiento. Este último dependerá de la longitud del enlace B-X (cuanto más corto sea el enlace, mayor será el solapamiento potencial) y la difusión de los orbitales (cuanto menos difusos sean los orbitales, mejor será el solapamiento). Ambos factores beneficiarán a B-F sobre B-Cl y B-Br. Así, el alcance del posible solapamiento seguiría el orden: (6.14.16). A pesar de estas consideraciones, aún no se conocen los detalles exactos de la racionalización de la baja basicidad de Lewis de BF 3 en comparación con BcL 3 y BBr 3.
Halouros aniónicos
Todos los trihaluros forman complejos ácido-base de Lewis con aniones haluro, (6.14.17), y como tales las sales de BF 4 -, AlCl 4 -, GAcL 4 -, e Incl 4 - son comunes.
\[ \text{MX}_3 \text{ + X}^- \rightarrow \text{MX}_4^-\]
En el caso del galio el anión Ga 2 Cl 7 - (Figura\(\PageIndex{8}\)) se forma a partir del equilibrio:
\[ \text{2 GaCl}_4^- \rightleftharpoons \text{Ga}_2\text{Cl}_7^- \text{ + Cl}^-\]
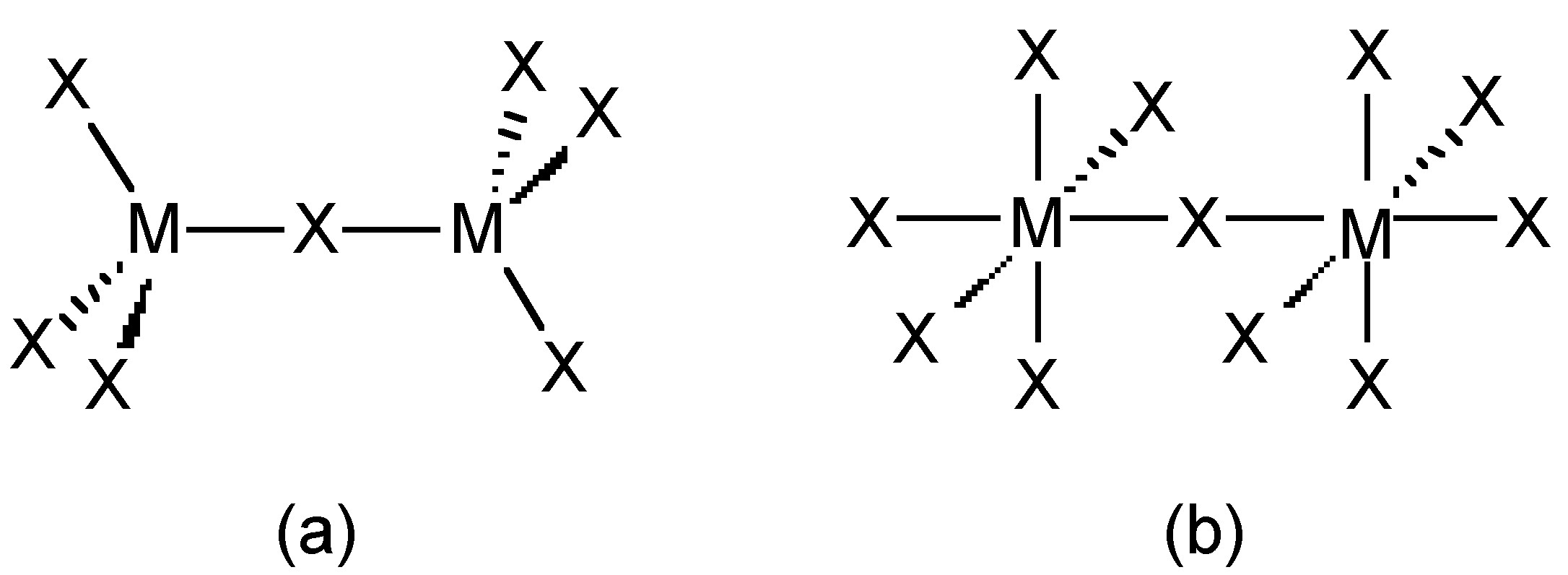
Como consecuencia de su mayor tamaño, el indio forma una amplia gama de compuestos de adición de haluros aniónicos con geometrías de coordinación trigonal bipiramidal, piramidal cuadrada y octaédrica. Por ejemplo, se han elaborado las sales de Incl 5 2-, InBr 5 2 -, InF 6 3 -, InCl 6 3- e InBr 6 3-. Se ha encontrado que el ión Incl 5 2- es piramidal cuadrado en la sal [NEt 4] 2 Incl 5, pero es trigonal bipiramidal en el solvato de acetonitrilo de [Ph 4 P] 2 Incl 5. Los haluros aniónicos oligoméricos En 2 X 7 - e In 2 X 9 3- (X = Cl y Br) contienen aniones binucleares con átomos de indio tetraédricos y octaédricos coordinados, respectivamente (Figura\(\PageIndex{8}\)).
Haluros de baja valencia
Estado de oxidación +2
El boro forma una serie de haluros de baja oxidación que contienen enlaces B-B en un estado de oxidación formal de +2. El paso de una descarga eléctrica a través de BCl3 usando electrodos de mercurio da como resultado la síntesis de B 2 Cl 4, (6.14.19). Una ruta alternativa es por la co-condensación de cobre como agente reductor con BCl3, (6.14.20).
\[ \text{2 BCl}_3\text{ + 2 Hg} \rightarrow \text{B}_2\text{Cl}_4 \text{ + Hg}_2\text{Cl}_2\]
\[ \text{2 BCl}_3\text{ + 2 Cu} \rightarrow \text{B}_2\text{Cl}_4 \text{ + 2 CuCl}\]
B 2 F 4 tiene una estructura plana (Figura\(\PageIndex{9}\)) con simetría D2h, mientras que B 2 Cl 4 tiene la misma estructura básica tiene una geometría escalonada (Figura\(\PageIndex{10}\)). La energía para la rotación del enlace alrededor del enlace B-B es muy baja (5 kJ/mol) que se puede comparar con el etano (12.5 kJ/mol). También se observa que el bromuro, B 2 Br 4, está escalonado en estado sólido. La conformación escalonada es favorable en terrenos estéricos, sin embargo, para B 2 F 4 la geometría plana se estabiliza por el tamaño más pequeño del haluro y, lo que es más importante, la presencia de enlaces π deslocalizados fuertes.


Estado de oxidación +1
El boro forma una serie de haluros con estructuras de racimo, B n Cl n donde n = 4 (Figura\(\PageIndex{11}\)), 8, 9, 10, 11 y 12. Cada compuesto se elabora por la descomposición de B 2 Cl 4. Para el galio, ninguno de los monohaluros es estable a temperatura ambiente, pero GAcL y GaBr se han producido en forma gaseosa a partir de la reacción de HX y galio fundido. La estabilidad del talio (I) en comparación con el talio (III) da como resultado que los monohaluros, TLCl, TLBr y Tli sean estables. Cada compuesto es insoluble en agua y fotosensible.
Haluros intermedios
Los dihaluros (MX 2) de galio, indio y talio en realidad no contienen el metal en el estado de oxidación +2. En cambio son en realidad compuesto de valencia mixta, es decir, M + [MX 4] -. Los dihaluros de galio son inestables en presencia de agua desproporcionándose a entidades de galio metálico y galio (III). Son solubles en disolventes aromáticos, donde se han aislado complejos de areno y el areno es η 6 -coordinado con el ion Ga +. InBr 2 e INi 2 son sólidos cristalinos verdosos y amarillos, respectivamente, los cuales se formulan En (I) [In (III) X 4]. TLCl 2 y TLBr 2 son de formulaciones similares.
Ga 2 X 3 (X = Br, I) y En 2 Br 3 se formulan M (I) 2 [M (II) 2 X 6]. Ambos aniones contienen un enlace M-M donde el metal tiene un estado de oxidación formal de +2. El anión Ga 2 Br 6 2- se eclipsa como el anión In2Br6 2, mientras que el anión Ga 2 I 6 2- es isoestructural con Si 2 Cl 6 con una conformación escalonada. En 2 Cl 3 es incoloro y se formula En (I) 3 [En (III) Cl 6].
Ga 3 Cl 7 contiene el ion Ga 2 Cl 7 -, el cual tiene una estructura similar al dicromato, el ion Cr 2 O 7 2-, con dos átomos de galio coordinados tetraedralmente que comparten una esquina (Figura). El compuesto puede formularse como heptaclorodigalato de galio (I) (III), Ga (I) [Ga (III) 2 Cl 7].

En 4 Br 7 es sensible a la luz (como TLCl y TLBr) decayendo a InBr 2 e In metal. Es una sal mixta que contiene los aniones InBr 4 - e InBr 6 3- balanceados por cationes In +. Se formula En (I) 5 [En (III) Br 4] 2 [En (III) Br 6]. En 5 Br 7 es un sólido amarillo pálido formulado como En (I) 3 [In (II) 2 Br 6] Br. El anión In (II) 2 Br 6 2- tiene una estructura tipo etano eclipsado con una longitud de enlace In-In de 2.70 Å. En 5 Cl 9 se formula En (I) 3 [In (III) 2 Cl 9], con el anión 2 In 2 Cl 9 - que tiene dos 6 átomos de indio coordinados con 3 átomos de cloro puente, bioctaedros que comparten la cara. Por último, en 7 Cl 9 y en 7 Br 9 tienen una estructura formulada como InX 6 [In (III) X 6] X 3.
Bibliografía
- P. M. Boorman y D. Potts, Can. J. Chem. , 1974, 52, 2016.
- A. Borovik y A. R. Barron, J. Am. Chem. Soc., 2002, 124, 3743.
- A. Borovik, S. G. Bott, y A. R. Barron, J. Am. Chem. Soc., 2001, 123, 11219.
- C. S. Branch, S. G. Bott, y A. R. Barron, J. Organomet. Chem., 2003, 666, 23.
- W. M. Brown y M. Treviño, patente estadounidense 5.395.536 (1995).
- S. K. Dentel, CRC Críticas Críticas en Control Ambiental, 1991, 21, 41.
- D. E. Hassick y J. P. Miknevich, patente estadounidense 4.800.039 (1989).
- M. D. Healy, P. E. Laibinis, P. D. Stupik y A. R. Barron, J. Chem. Soc. , Chem. Commun. , 1989, 359.
- K. Hedberg y R. Ryan, J. Chem. Phys. , 1964, 41, 2214.
- Y. Koide y A. R. Barron, Organometálicos, 1995, 14, 4026.
- G. Santiso-Quiñones e I. Krossing, Z. Anorg. Allg. Chem. , 2008, 634, 704.

