7.1: Los Elementos del Grupo 14
- Page ID
- 69511
El grupo alguna vez fue conocido también como los tetreles (del griego tetra significa cuatro), derivado de la anterior convención de nomenclatura de este grupo como Grupo IVA. En la tabla se enumera la derivación de los nombres de los elementos del Grupo 14.
| Element | Símbolo | Nombre |
| Carbono | C | Del latín carbo que significa carbón |
| Silicio | Si | Del latín silicis que significa pedernales |
| Germanio | Ge | De la Germania latina para Alemania |
| Estaño | Sn | Del anglosajón y del latín stannum significa que se derrite fácilmente |
| Plomo | Pb | Del anglosajón, y del latín plumbum que significa metal blando |
Descubrimiento
Carbono
El carbono se conocía en la prehistoria en forma de hollín; mientras que el carbón se hacía en la época romana (calentando la madera mientras excluía el aire) y los diamantes se conocían ya en 2500 a.C en China. En 1772, Antoine Lavoisier (Figura\(\PageIndex{1}\)) mostró que los diamantes eran una forma de carbono, cuando quemó muestras de carbono y diamante y demostró que ambos formaban la misma cantidad de dióxido de carbono por gramo de material. Carl Scheele (Figura\(\PageIndex{2}\)) mostró que el grafito era una forma de carbono más bien una forma de plomo.


Un nuevo alótropo de carbono, el fullereno, fue descubierto en 1985 por Robert Curl, Harry Kroto y Richard Smalley (Figura\(\PageIndex{3}\)) quienes posteriormente compartieron el Premio Nobel de Química en 1996. Los fullerenos han sido revelados para incluir formas nanoestructuradas como buckyballs y nanotubos. El renovado interés por nuevas formas lleva al descubrimiento de otros alótropos exóticos, incluido el carbono vítreo, y la comprensión de que el carbono amorfo no es amorfo.

Silicio
El silicio fue identificado por primera vez por Antoine Lavoisier (Figura\(\PageIndex{1}\)) en 1787 como un componente de pedernales, y luego fue confundido por Humphry Davy (Figura\(\PageIndex{4}\)) con un compuesto en lugar de un elemento. En 1824, Berzelius (Figura\(\PageIndex{5}\)) preparó silicio amorfo mediante la reacción del potasio con tetrafluoruro de silicio, (7.1.1).
\[ \text{SiCl}_4 \text{ + 4 K} \rightarrow \text{Si + 4 KCl}\]


Germanio
En 1869 Dmitri Mendeleev (Figura\(\PageIndex{6}\)) predijo la existencia de varios elementos desconocidos, entre ellos ekasilicon (Es) entre silicio y estaño.

En 1885 se encontró un nuevo mineral (llamado argrodita por su alto contenido de plata) en una mina cerca de Freiberg, Sajonia. Clemens Winkler (Figura\(\PageIndex{7}\)) aisló el elemento faltante de Mendeleev. Originalmente iba a nombrar neptunio porque al igual que este elemento, porque como ekasilicon, el planeta Neptuno había sido precedido por la predicción matemática de su existencia. No obstante, el nombre de neptunio ya se le había dado a un elemento y así Winkler nombró al nuevo germanio metálico en honor a su patria.

Winkler fue capaz de aislar suficiente germanio de 500 kg de mineral para determinar un número de propiedades, incluyendo un peso atómico de 72.32 g/mol mediante el análisis de tetracloruro de germanio puro (GeCl 4). Winkler preparó varios compuestos nuevos de germanio, incluyendo los fluoruros, cloruros, sulfuros, dióxido de germanio y tetraetilgermano (Ge (C 2 H 5) 4). Los datos físicos de estos compuestos, correspondieron con las predicciones de Mendeleev (Tabla\(\PageIndex{2}\)).
| Propiedad | Ekasilicon | Germanio |
| Masa atómica | 72 | 72.59 |
| Densidad (g/cm 3) | 5.5 | 5.35 |
| Punto de fusión (°C) | Alto | 947 |
| Color | Gris | Gris |
| Tipo de óxido | Dióxido refractario | Dióxido refractario |
| Densidad de óxido (g/cm 3) | 4.7 | 4.7 |
| Actividad de óxido | Deebly básico | Deebly básico |
| Punto de ebullición del cloruro (°C) | Menores de 100 | 86 (GeCL 4) |
| Densidad de cloruro (g/cm 3) | 1.9 | 1.9 |
Estaño
El estaño es uno de los primeros metales conocidos. Cuando la adición de aproximadamente 5% tim al cobre fundido produjo una aleación (bronce) que era más fácil de trabajar y mucho más dura que el cobre, revolucionó la civilización. El uso generalizado del bronce para fabricar herramientas y armas se convirtió en parte de lo que los arqueólogos llaman la Edad del Bronce. La Edad del Bronce llegó a Egipto, Mesopotamia y la cultura del Valle del Indo hacia el 3000 a.C.
Plomo
El plomo se ha utilizado comúnmente durante miles de años debido a su facilidad de extracción y su facilidad de fundición. Se han encontrado cuentas de plomo que datan del 6400 aC en Çatalhöyük, en la actual Turquía, mientras que el plomo se utilizó durante la Edad del Bronce.
Abundancia
El carbono y el silicio se encuentran entre los elementos más abundantes (Tabla\(\PageIndex{3}\)). El silicio es el segundo elemento más abundante (después del oxígeno) en la corteza terrestre, constituyendo el 28% de la corteza. El carbono es el cuarto elemento químico más abundante del universo después del hidrógeno, el helio y el oxígeno. En combinación con el oxígeno en el dióxido de carbono, el carbono se encuentra en la atmósfera terrestre (en cantidades de aproximadamente 810 gigatoneladas) y disuelto en todos los cuerpos de agua (aproximadamente 36 mil gigatoneladas). Alrededor de mil 900 gigatones están presentes en la biosfera. Los hidrocarburos (como el carbón, el petróleo y el gas natural) contienen cantidades de carbono de alrededor de 900 gigatoneladas. Los diamantes naturales se encuentran en la roca kimberlita, que se encuentra en antiguos “cuellos” volcánicos, o “pipas”. La mayoría de los depósitos de diamantes se encuentran en África, pero también hay depósitos en Canadá, el Ártico ruso, Brasil y Australia.
| Element | Abundancia terrestre (ppm) |
| C | 480 (corteza terrestre), 28 (agua de mar), 350 (atmósfera CO 2), 1.6 (atmósfera, CH 4), 0.25 (atmósfera, CO) |
| Si | 28,000 (corteza terrestre), 2 (agua de mar) |
| Ge | 2 (corteza terrestre), 1 (suelo), 5 x 10 -7 (agua de mar) |
| Sn | 2 (corteza terrestre), 1 (suelo), 4 x 10 -6 (agua de mar) |
| Pb | 14 (corteza terrestre), 23 (suelo), 2 x 10 -6 (agua de mar) |
Isótopos
La tabla\(\PageIndex{4}\) resume los isótopos naturales de los elementos del Grupo 14.
| Isótopo | Abundancia natural (%) |
| Carbon-12 | 98.9 |
| Carbono-13 | 1.1 |
| Carbono-14 | trazar |
| Silico-28 | 92.23 |
| Silico-29 | 4.67 |
| Silicio -30 | 3.1 |
| Germanio-70 | 21.23 |
| Germanio-72 | 27.66 |
| Germanio-73 | 7.73 |
| Germanio-74 | 35.94 |
| Germanio-76 | 7.44 |
| Estaño-112 | 0.97 |
| Estaño-114 | 0.66 |
| Estaño-115 | 0.34 |
| Estaño-116 | 14.54 |
| Tin-117 | 7.68 |
| Estaño-118 | 24.22 |
| Tin-119 | 8.59 |
| Estaño-120 | 32.58 |
| Estaño-122 | 4.63 |
| Estaño-124 | 5.79 |
| Plomo-204 | 1.4 |
| Plomo-24.1 | 24.1 |
| Plomo-207 | 22.1 |
| Plomo-208 | 52.4 |
Aunque radiactivo, el carbono-14 se forma en las capas superiores de la troposfera y la estratosfera, a altitudes de 9—15 km. Los neutrones térmicos producidos por los rayos cósmicos chocan con los núcleos de nitrógeno-14, formando carbono-14 y un protón. Debido a su vida media relativamente corta de 5730 años, el carbono-14 está ausente en rocas antiguas, pero se incorpora en organismos vivos.
Datación por carbono
La datación por carbono es un proceso mediante el cual la edad de un material que contiene carbono se puede determinar comparando la tasa de descomposición de ese material con la del material vivo..
El carbono-14 tiene una vida media (t 1/2) de 5.73 x 10 3 años para su desintegración a nitrógeno-14 por la pérdida de una partícula β, (7.1.2).
\[ ^{14}_6C \rightarrow ^{14}_7N + ^0_{-1}e\]
La tasa de desintegración radiactiva se puede expresar como una constante de velocidad (k):
\[ \text{k = } \dfrac{\text{ln[2]}}{\text{t}_{1/2}} \text{ = } \dfrac{\text{0.693}}{\text{t}_{1/2}}\]
Para el carbono-14, usando (7.1.3),
\[ \text{k = } \dfrac{\text{0.693}}{\text{ 5.73 x 10}^3} \text{ = 1.21 x 10}^{-4} \text{ year}^{-1} \]
En 1947 se analizaron muestras de los Rollos del Mar Muerto mediante datación por carbono. Se encontró que el carbono-14 presente tuvo una actividad de d/min.g (donde d = desintegración); por contraste en el material vivo la actividad es de 14 d/min.g.
\[ \text{ln}\dfrac{\text{14}}{\text{11}} \text{ = (1.21 x 10}^{-4}\text{) t}\]
\[ \text{t = } \dfrac{\text{ln 1.272}}{\text{1.21 x 10}^{-4}} \text{ = 2.0 x 10}^3\text{ years}\]
A partir de la medición realizada en 1947 se determinó que los Rollos del Mar Muerto tenían 2000 años dándoles una fecha del 53 a.C., y confirmando su autenticidad. Este descubrimiento contrasta con los resultados de datación por carbono para la Sábana Santa de Turín que se suponía que envolvió el cuerpo de Jesús. La datación por carbono ha demostrado que la tela se realizó entre 1260 y 1390 d.C. Así, la Sábana Santa de Turín es claramente una falsificación al haberse hecho más de mil años después de su supuesta fabricación.
Producción industrial
Debido a la importancia industrial del carbono y el silicio, así como a la amplia gama de materiales de fullereno, la producción de estos elementos se discute en otra parte. Sin embargo, la cadena de suministro de diamantes está controlada por un número limitado de preocupaciones comerciales, la mayor de las cuales es DeBeers en Londres (Figura). Los diamantes constituyen solo una fracción muy pequeña de roca que lleva mineral. El mineral se tritura y posteriormente las partículas se clasifican por densidad. Los diamantes se localizan en la fracción rica en diamantes por fluorescencia de rayos X, después de lo cual los pasos finales de clasificación se realizan a mano.

Los concentrados de mineral de germanio son en su mayoría sulfídicos, por ejemplo, como una impureza en la mezcla de zinc. Se convierten a los óxidos por calentamiento bajo aire (tostado), (7.1.7).
\[ \text{GeS}_2\text{ + 3 O}_2 \rightarrow \text{GeO}_2 \text{ + 2 SO}_2\]
Parte del germanio termina en el polvo producido durante este proceso, mientras que el resto se convierte en germanatos que son lixiviados junto con el zinc por el ácido sulfúrico. Después de la neutralización se precipitan el germanio y otros metales (dejando el Zn 2+ en solución). El dióxido de germanio se obtiene como precipitado y se convierte con gas cloro o ácido clorhídrico en tetracloruro de germanio, (7.1.8) (7.1.9), el cual tiene un punto de ebullición bajo y puede purificarse por destilación.
\[ \text{GeO}_2\text{ + 4 HCl} \rightarrow \text{GeCl}_4\text{ + 2 H}_2\text{O}\]
\[ \text{GeO}_2\text{ + 2 Cl}_2 \rightarrow \text{GeCl}_4\text{O}_2\]
El tetracloruro de germanio se hidroliza para dar óxido puro (GeO 2), que luego se convierte en vidrio de germanio para la industria de semiconductores, (7.1.10). El germanio utilizado en la producción de acero y otras aplicaciones que no requieren la alta pureza se produce por reducción con carbono, (7.1.11).
\[ \text{GeO}_2\text{ + 4 H}_2 \rightarrow \text{Ge + H}_2\text{O}\]
\[ \text{GeO}_2\text{ + C} \rightarrow \text{Ge + CO}_2\]
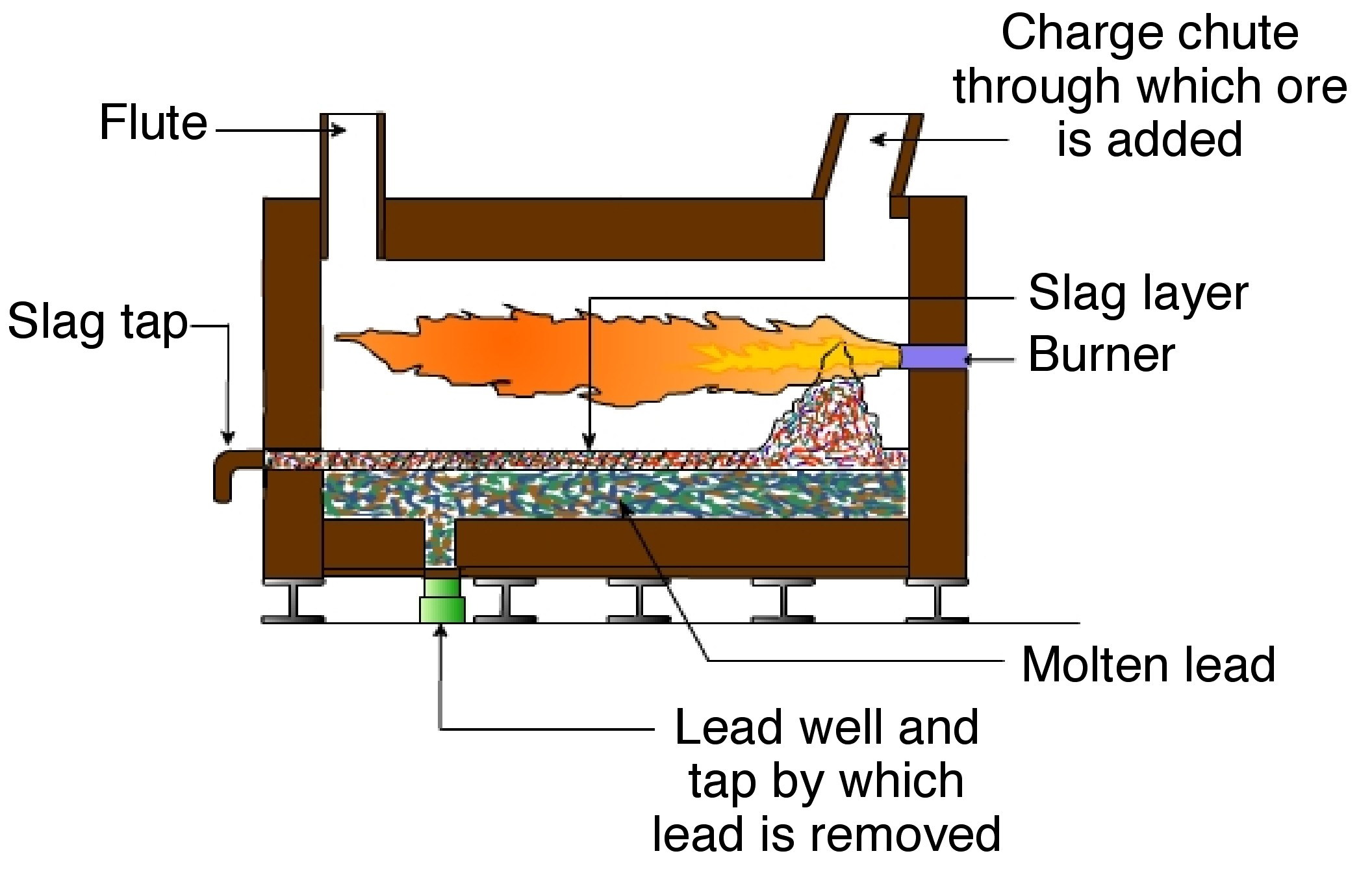
El estaño se extrae y posteriormente se funde, y su producción ha cambiado poco. En contraste, los minerales ricos en plomo contienen menos de 10% de plomo, pero los minerales que contienen tan poco como 3% de plomo pueden ser explotados económicamente. Los minerales se trituran y se concentran al 70%. Los minerales de sulfuro son tostados, produciendo óxido de plomo y una mezcla de sulfatos y silicatos de plomo. El óxido de plomo del proceso de tostado se reduce en un alto horno de coque. Esto convierte la mayor parte del plomo a su forma metálica. El plomo metálico que resulta de los procesos de tostado y alto horno aún contiene contaminantes significativos de arsénico, antimonio, bismuto, zinc, cobre, plata y oro. La masa fundida se trata en un horno de reverberación (Figura\(\PageIndex{9}\)) con aire, vapor y azufre, que oxida los contaminantes excepto plata, oro y bismuto.
Propiedades físicas
\(\PageIndex{5}\)La tabla proporciona un resumen de las propiedades físicas de los elementos del Grupo 14.
| Element | Mp (°C) | Bp (°C) | Densidad (g/cm 3) |
| C | 642 (sublima) | 2.267 (grafito), 3.515 (diamante), 1.8 - 2.1 (amorfo) | |
| Si | 1414 | 3265 | 2.3290 |
| Ge | 938 | 2833 | 5.323 |
| Sn | 232 | 2602 | 7.365 (blanco), 5.769 (gris) |
| Pb | 327 | 1749 | 11.34 |
Estructura cúbica
Los elementos carbono a través del estaño (en su forma α) existen todos en la estructura cúbica de diamante (Figura\(\PageIndex{10}\) a), mientras que el plomo cristaliza en una estructura cúbica empaquetada cerrada (Figura\(\PageIndex{10}\) b). Como se esperaba, el parámetro de celosía (a) aumenta con el aumento del radio atómico (Tabla\(\PageIndex{6}\)). El cambio de diamante cúbico a cúbico empaquetado cerrado puede racionalizarse por los tamaños atómicos relativos. La estructura cúbica de diamante comprende dos celosías cúbicas compactas interpenetrantes. A medida que aumenta el tamaño atómico, se producirían grandes vacantes intersticiales, resultando en una estructura desfavorable de baja densidad.
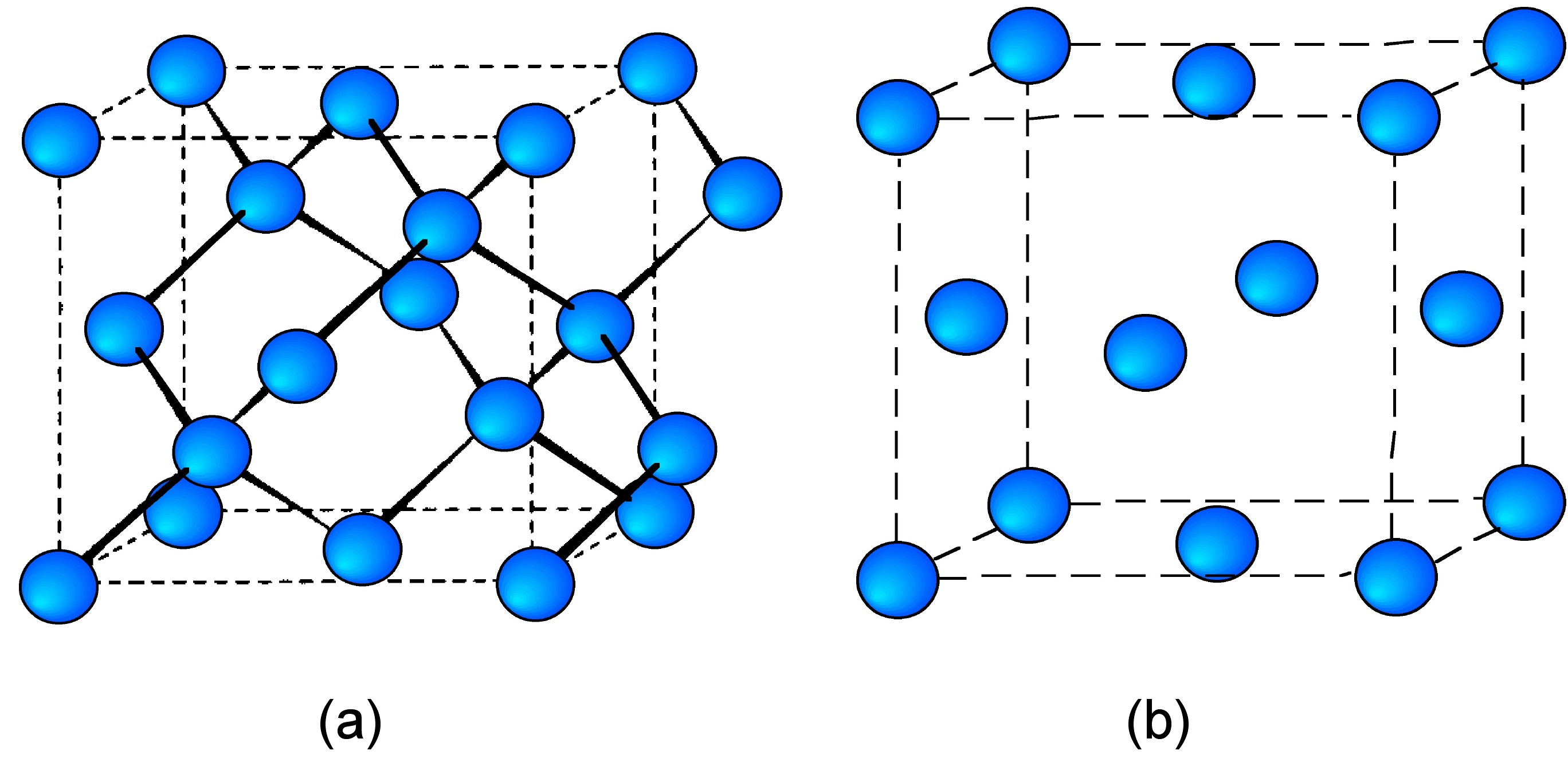
| Element | Estructura | a (Å) | Radio atómico (Å) |
| C | diamante cúbico | 3.566 | 0.70 |
| Si | diamante cúbico | 5.431 | 1.10 |
| Ge | diamante cúbico | 5.657 | 1.25 |
| α-SN (gris) | diamante cúbico | 6.489 | 1.45 |
| Pb | cúbico, embalado | 4.951 | 1.80 |


