7.3: Nanomateriales de Carbono
- Page ID
- 69526
Fullerenos y Nanotubos
Introducción
Aunque los nanomateriales se conocían desde hace muchos años antes del reporte de C 60, el campo de la ciencia a nanoescala se fundó indudablemente sobre este descubrimiento seminal. Parte de la razón de esta explosión en la nanoquímica es que si bien los materiales de carbono van desde moléculas de tamaño nano bien definidas (es decir, C 60) hasta tubos con longitudes de cientos de micras, no exhiben las inestabilidades de otros nanomateriales como resultado de las barreras de activación muy altas a su reordenamiento estructural. Como consecuencia son altamente estables incluso en sus formas infuncionalizadas. A pesar de esta gama de nanomateriales de carbono posibles, presentan una química de reacción común: la de la química orgánica.
El alótropo de carbono previamente desconocido: C 60, fue descubierto en 1985, y en 1996, Curl, Kroto y Smalley fueron galardonados con el Premio Nobel de Química por el descubrimiento. Los otros alótropos de carbono son grafito (sp 2) y diamante (sp 3). C 60, comúnmente conocido como “buckyball” o “Buckminsterfullerene”, tiene una forma esférica que comprende átomos de carbono sp 2 altamente piramidalizados. La variante C 60 suele compararse con el típico futbolín, de ahí el buckyball. Sin embargo, confusamente, este término se usa comúnmente para derivados superiores. Los fullerenos son similares en estructura laminar al grafito pero contienen anillos pentagonales (o a veces heptagonales) que impiden que la lámina sea plana. La inusual estructura de C 60 condujo a la introducción de una nueva clase de moléculas conocidas como fullerenos, que ahora constituyen el tercer alótropo de carbono. Los fullerenos se definen comúnmente como “cualquiera de una clase de compuestos de carbono aromáticos huecos cerrados que se componen de doce pentagonales y diferentes números de caras hexagonales”.
El número de átomos de carbono en un fullereno varía de C 60 a C 70, C 76 y superior. Los fullerenos de orden superior incluyen nanotubos de carbono que pueden describirse como fullerenos que se han estirado a lo largo de un eje de rotación para formar un tubo. Como consecuencia de las diferencias en la química de fullerenos como C 60 y C 70 en comparación con los nanotubos, estos se tratarán por separado en el presente documento. Además también se han reportado nanocuernos y nanofibras, sin embargo, estos pueden considerarse como variaciones sobre el tema general. Cabe señalar que los fullerenos y nanotubos han demostrado estar en llamas producidas por la combustión de hidrocarburos. Desafortunadamente, estas variedades naturales pueden ser altamente irregulares en tamaño y calidad, además de estar formadas en mezclas, haciéndolas inadecuadas tanto para investigación como para aplicaciones industriales.
Fullerenos
El carbono-60 (C 60) es probablemente el tipo individual de nanomaterial más estudiado. La forma esférica de C 60 se construye a partir de doce pentágonos y veinte hexágonos y se asemeja a un balón de fútbol (Figura\(\PageIndex{1}\) a). El siguiente fullereno estable más alto es C 70 (Figura\(\PageIndex{1}\) b) que tiene forma de rugby o fútbol americano. La progresión de fullerenos superiores continúa en la secuencia C 74, C 76, C 78, etc. La relación estructural entre cada uno implica la adición de anillos de seis miembros. Matemática (y químicamente) dos principios definen la existencia de un fullereno estable, es decir, el teorema de Euler y la regla del pentágono aislado (DPI). El teorema de Euler establece que para el cierre de cada red esférica, se requieren n (n ≥ 2) hexágonos y 12 pentágonos mientras que el IPR dice que no se pueden conectar dos pentágonos directamente entre sí ya que la desestabilización es causada por dos pentágonos adyacentes.

Aunque los fullerenos están compuestos de carbonos sp 2 de manera similar al grafito, los fullerenos son solubles en diversos solventes orgánicos comunes. Debido a su naturaleza hidrofóbica, los fullerenos son más solubles en CS 2 (C 60 = 7.9 mg/mL) y tolueno (C 60 = 2.8 mg/mL). Aunque los fullerenos tienen un sistema conjugado, su aromaticidad es distintiva del benceno que tiene todos los enlaces C-C de igual longitud, en los fullerenos existen dos clases distintas de enlaces. Los enlaces más cortos están en las uniones de dos hexágonos ([6, 6] enlaces) y los enlaces más largos en las uniones de un hexágono y un pentágono ([5,6] enlaces). Esta diferencia en la unión es responsable de parte de la reactividad observada de los fullerenos.
Síntesis de fullerenos
La primera observación de fullerenos fue en experimentos de haz molecular en la Universidad de Rice. Estudios posteriores demostraron que C 60 fue relativamente fácil producir gramos de fullerenos. Aunque la síntesis es relativamente sencilla, la purificación del fullereno sigue siendo un desafío y determina el precio comercial del fullereno. El primer método de producción de cantidades medibles de fullerenos utilizó la vaporización láser de carbono en una atmósfera inerte, pero esto produjo cantidades microscópicas de fullerenos. Las escalas de laboratorio de fullereno se preparan mediante la vaporización de barras de carbono en una atmósfera de helio. La producción comercial emplea normalmente un simple arco de CA o CC. Los fullerenos en el hollín negro recolectado se extraen en tolueno y se purifican por cromatografía líquida. El magenta C 60 sale primero de la columna, seguido del rojo C 70, y otros fullerenos superiores. Aunque el mecanismo de un arco de carbono difiere del de una varilla de carbono calentada resistivamente (porque involucra un plasma) la presión de He para la formación óptima de C 60 es muy similar.
Una relación entre la masa de fullerenos y la masa total de hollín de carbono define el rendimiento de fullereno. Los rendimientos determinados por la absorción UV-Vis son aproximadamente 40%, 10-15% y 15% en procesos láser, arco eléctrico y solares. Curiosamente, la técnica de ablación láser tiene tanto el mayor rendimiento como la menor productividad y, por lo tanto, un escalado a una mayor potencia es costoso. Por lo tanto, la producción comercial de fullereno es una tarea desafiante. La primera planta de producción de fullereno controlada por computadora del mundo ya está operativa en MER Corporation, quien fue pionera en la primera producción comercial de fullereno y productos de fullereno.
Fullerenos endoédricos
Los fullerenos endoédricos son fullerenos que han incorporado en su esfera interna átomos, iones o cúmulos. Los fullerenos endoédricos generalmente se dividen en dos grupos: metalofullerenos endoédricos y fullerenos dopados no metálicos. El primer metalofullerenos endoédricos se llamó La @C 60. El signo @ en el nombre refleja la noción de una pequeña molécula atrapada dentro de un caparazón.
El dopaje de fullerenos con metales se realiza in situ durante la síntesis de fullerenos en un reactor de arco o mediante evaporación láser. Una amplia gama de metales han sido encerrados dentro de un fullereno, es decir, Sc, Y, La, Ce, Ba, Sr, K, U, Zr y Hf. Desafortunadamente, la síntesis de metalofullerenos endoédricos es inespecífica porque además de un alto rendimiento de fullerenos sin llenar, se preparan compuestos con diferentes tamaños de jaula (por ejemplo, La @C 60 o La @C 82). Una característica de los metalofullerenos endoédricos es que los electrones se transferirán del átomo metálico a la jaula de fullereno y que el átomo metálico tome una posición descentrada en la jaula. El tamaño de la transferencia de carga no siempre es sencillo de determinar, pero suele estar entre 2 y 3 unidades (por ejemplo, La 2 @C 80) pero puede ser tan alto como 6 electrones (por ejemplo, Sc 3 N @C 80). Estas jaulas aniónicas de fullereno son moléculas muy estables y no tienen la reactividad asociada con los fullerenos vacíos ordinarios (ver más abajo). Esta falta de reactividad se utiliza en un método para purificar metalofullerenos endoédricos a partir de fullerenos vacíos.
El endoédrico He @C 60 y Ne @C 60 se forman cuando C 60 se expone a una presión de alrededor de 3 bar de los gases nobles apropiados. Bajo estas condiciones fue posible dopar 1 en cada 650,000 C 60 jaulas con un átomo de helio. También se han probado complejos endoédricos con He, Ne, Ar, Kr y Xe así como numerosos aductos del compuesto He @C 60 con presiones de operación de 3000 bares e incorporación de hasta 0.1% de los gases nobles. El aislamiento de N @C 60, N @C 70 y P @C 60 es muy inusual y a diferencia de los derivados metálicos no tiene lugar ninguna transferencia de carga del átomo de pnictida en el centro a los átomos de carbono de la jaula.
Fullerenos químicamente funcionalizados
Aunque los fullerenos tienen un sistema aromático conjugado, todos los carbonos son cuaternarios (es decir, no contienen hidrógeno), lo que resulta en hacer que muchas de las reacciones de sustitución características de los aromáticos planos sean imposibles. Así, solo existen dos tipos de transformaciones químicas: reacciones redox y reacciones de adición. De estas, las reacciones de adición tienen el mayor valor sintético. Otra característica notable de la química de adición de fullereno es la termodinámica del proceso. Dado que los átomos de carbono sp 2 en un fullereno están paramidalizados, existe una energía de deformación significativa. Por ejemplo, la energía de deformación en C 60 es de ca 8 kcal/mol, que es 80% de su calor de formación. Por lo que el alivio de esta energía de cepa que conduce a los átomos de C hibridados sp 3 es la principal fuerza impulsora para las reacciones de adición (Figura\(\PageIndex{2}\)). Como consecuencia, la mayoría de las adiciones a los fullerenos son reacciones exotérmicas.

Los estudios de voltamperometría cíclica (CV) muestran que C 60 puede reducirse y oxidarse reversiblemente hasta 6 electrones con procesos de transferencia de un electrón. Los aniones Fulleride se pueden generar por método electroquímico y luego ser utilizados para sintetizar derivados de organofullereno covalentes. Los metales alcalinos pueden reducir químicamente el fullereno en solución y estado sólido para formar M x C 60 (x = 3 - 6). El C 60 también se puede reducir con menos metales electropositivos como el mercurio para formar C 60 - y C 60 2-. Además, las sales también se pueden sintetizar con moléculas orgánicas, por ejemplo [TDAE +] [C 60 -] posee un interesante comportamiento electrónico y magnético.
El análisis geométrico y electrónico predijo que el fullereno se comporta en una poliolefina conjugada electropobre. De hecho, C 60 y C 70 experimentan una gama de reacciones nucleofílicas con nucleófilos de carbono, nitrógeno, fósforo y oxígeno. C60 reacciona fácilmente con organolitio y compuestos de Grignard para formar alquil, fenil o alcanyl fullerenos. Posiblemente las adiciones más utilizadas al fullereno es la reacción de Bingel (Figura\(\PageIndex{3}\)), donde se agrega un nucleófilo de carbono, generado por la desprotonación de ésteres o cetonas de α-halo malonato, para formar un producto de ciclopropanación. Los α-halo ésteres y cetonas también se pueden generar in situ con I 2 o CbR 4 y una base débil como 1,8-diazabiciclo [5.4.0] unde-7eno (DBU). La reacción de Bingel es considerada uno de los métodos más versátiles y eficientes para funcionalizar C 60.

La cicloadición es otra herramienta poderosa para funcionalizar los fullerenos, en particular por su selectividad con los enlaces 6,6, limitando los posibles isómeros (Figura\(\PageIndex{4}\)). La característica dienofílica de los [6,6] dobles enlaces de C 60 permite que la molécula sufra diversas reacciones de cicloadición en las que los monoaductos pueden generarse con altos rendimientos. Los mejores estudios de reacciones cicloaditónicas del fullereno son [3+2] adiciones con diazoderivados e iluros de azometina (reacciones de Prato). En esta reacción, los iluros de azometina pueden generarse in situ a partir de la condensación de α-aminoácidos con aldehídos o cetonas, los cuales producen 1,3 dipolos para reaccionar adicionalmente con C 60 en buenos rendimientos (Figura\(\PageIndex{5}\)). Cientos de bloques de construcción útiles han sido generados por esos dos métodos. Las reacciones de Prato también se han aplicado con éxito a nanotubos de carbono.
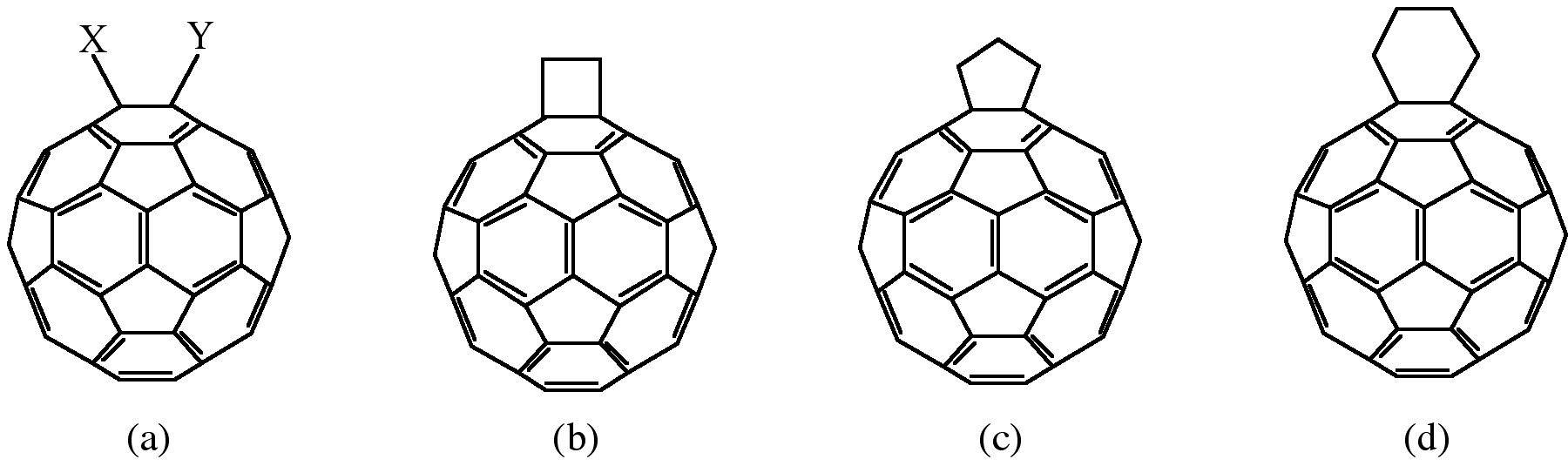

La oxidación de fullerenos, como el C 60, ha sido de creciente interés en cuanto a aplicaciones en dispositivos fotoeléctricos, sistemas biológicos y posible remediación de fullerenos. La oxidación de C 60 a C 60 O n (n = 1, 2) se puede lograr por fotooxidación, ozonólisis y epoxidación. Con cada uno de estos métodos, existe un límite para el producto oxigenado aislable, C 60 O n con n < 3. Fullerenos altamente oxigenados, C 60 O n con 3 ≤ n ≤ 9, han sido preparados por la oxidación catalítica de C 60 con RemEO 3/H 2 O 2.
Nanotubos de carbono
Un avance clave en la nanoquímica de carbono se produjo en 1993 con el informe de tubos similares a agujas hechos exclusivamente de carbono. Este material se conoció como nanotubos de carbono (CNT). Existen varios tipos de nanotubos. El primer descubrimiento fue de tubos de paredes múltiples (MWNT) que se asemejan a muchas tuberías anidadas entre sí. Poco después de que se descubrieran los MWNT, se observaron nanotubos de pared simple (SWNT). Los tubos de pared simple se asemejan a una sola tubería que está potencialmente tapada en cada extremo. Las propiedades de los tubos de pared simple y de pared múltiple son generalmente las mismas, aunque se cree que los tubos de pared simple tienen una resistencia mecánica y conductividad térmica y eléctrica superiores; también es más difícil fabricarlos.
Los nanotubos de carbono de pared simple (SWNT) son por definición materiales de fullereno. Su estructura consiste en una lámina de grafeno enrollada en un tubo y tapada por medio fullereno (Figura\(\PageIndex{6}\)). Los átomos de carbono en un SWNT, como los de un fullereno, son sp2 hibridados. La estructura de un nanotubo es análoga a tomar esta lámina de grafeno y enrollarla en un cilindro sin costura. Los diferentes tipos de SWNT se definen por su diámetro y quiralidad. La mayoría de los nanotubos de carbono de pared simple utilizados actualmente se han sintetizado mediante el método de vaporización láser pulsado, sin embargo, cada vez más SWNT se preparan mediante crecimiento catalizado por sólidos de vapor líquido.

Las propiedades físicas de los SWNTs los han convertido en un material extremadamente atractivo para la fabricación de nano dispositivos. Se ha demostrado que los SWNT son más fuertes que el acero, ya que las estimaciones para el módulo de Young se aproximan a 1 Tpa. Su conductancia eléctrica es comparable al cobre con densidades de corriente anticipadas de hasta 10 13 A/cm 2 y una resistividad tan baja como 0.34 x 10 -4 Ω.cm a temperatura ambiente. Finalmente, tienen una alta conductividad térmica (3000 - 6000 W.m/K).
Las propiedades electrónicas de una estructura SWNT particular se basan en su quiralidad o torsión en la estructura del tubo que se define por su valor n, m. Los valores de n y m determinan la quiralidad, o “torsión” del nanotubo. La quiralidad a su vez afecta la conductancia del nanotubo, su densidad, su estructura reticular y otras propiedades. Un SWNT se considera metálico si el valor n-m es divisible por tres. De lo contrario, el nanotubo es semiconductor. El ambiente externo también tiene un efecto sobre la conductancia de un tubo, por lo que moléculas como O 2 y NH 3 pueden cambiar la conductancia general de un tubo, mientras que se ha demostrado que la presencia de metales afecta significativamente las propiedades optoelectrónicas de los SWNT.
Los nanotubos de carbono de paredes múltiples (MWNT) van desde NT de doble pared, pasando por NTs de muchas paredes (Figura\(\PageIndex{7}\)) hasta nanofibras de carbono. Las nanofibras de carbono son el extremo de los tubos de paredes múltiples (Figura\(\PageIndex{8}\)) y son más gruesas y más largas que las SWNTs o MWNT, teniendo una sección transversal de ca. 500 Å 2 y tienen entre 10 y 100 μm de longitud. Se han utilizado ampliamente en la construcción de compuestos de alta resistencia.


Síntesis de nanotubos de carbono
Se han desarrollado una gama de metodologías para producir nanotubos en cantidades considerables, incluyendo descarga de arco, ablación láser, monóxido de carbono a alta presión (HiPCO) y crecimiento de sólidos líquidos de vapor (VLS). Todos estos procesos se llevan a cabo en vacío o a baja presión con un gas de proceso, aunque el crecimiento de VLS puede tener lugar a presión atmosférica. Se pueden sintetizar grandes cantidades de nanotubos mediante estos métodos; los avances en la catálisis y los procesos de crecimiento continuo están haciendo que los SWNTs sean más viables comercialmente.
La primera observación de nanotubos fue en el hollín de carbono formado durante la producción de fullerenos por descarga de arco. Las altas temperaturas provocadas por la descarga provocaron que el carbono contenido en el electrodo negativo se sublimara y los CNT se depositaran sobre el electrodo opuesto. Los tubos producidos por este método fueron inicialmente tubos de paredes múltiples (MWNT). Sin embargo, con la adición de cobalto al carbono vaporizado, es posible cultivar nanotubos de pared simple. Este método produce una mezcla de componentes, y requiere purificación adicional para separar los CNT del hollín y los metales catalíticos residuales. La producción de CNT con alto rendimiento depende de la uniformidad del arco de plasma y de la temperatura del depósito que se forma en el electrodo de carbono.
El mayor rendimiento y pureza de los SWNT se puede preparar mediante el uso de un láser de doble pulso. Los SWNT se pueden cultivar en un rendimiento del 50% mediante la vaporización directa de una varilla de grafito dopado con Co/Ni con un láser de alta potencia en un horno tubular que opera a 1200 °C. El material producido por este método aparece como una estera de “cuerdas”, de 10 a 20 nm de diámetro y hasta 100 μm o más de longitud. Cada cuerda consiste en un haz de SWNTs, alineados a lo largo de un eje común. Variando los parámetros del proceso como la composición del catalizador y la temperatura de crecimiento, se puede variar el diámetro promedio de los nanotubos y la distribución de tamaños. Aunque la descarga de arco y la vaporización láser son actualmente los principales métodos para obtener pequeñas cantidades de SWNT de alta calidad, ambos métodos presentan inconvenientes. El primero es que implican evaporar la fuente de carbono, haciendo que el escalamiento a nivel industrial sea difícil y energéticamente costoso. El segundo tema se relaciona con el hecho de que los métodos de vaporización cultivan SWNT en formas altamente enredadas, mezcladas con formas no deseadas de especies de carbono y/o metal. Los SWNT así producidos son difíciles de purificar, manipular y ensamblar para construir arquitecturas de nanotubos para aplicaciones prácticas.
Para superar algunas de las dificultades de estos procesos de alta energía, se desarrolló el método de catálisis química en el que se utiliza una materia prima hidrocarbonada en combinación con un catalizador metálico. El catalizador es típicamente, pero no limitado a hierro, cobalt o hierro/molibdeno, se calienta en condiciones reductoras en presencia de una materia prima de carbono adecuada, por ejemplo, etileno. Este método puede ser utilizado tanto para SWNTs como MWNT; la formación de cada uno está controlada por la identidad del catalizador y las condiciones de reacción. Un conveniente aparato a escala de laboratorio está disponible en Nanotech Innovations, Inc., para la síntesis de muestras de investigación altamente uniformes y consistentes que utilizan ampollas de catalizador/fuente de carbono previamente pesadas. Este sistema permite preparar muestras de 200 mg de MWNT para la investigación y prueba. El uso de CO como materia prima, en lugar de un hidrocarburo, condujo al desarrollo del procedimiento de monóxido de carbono de alta presión (HiPCO) para la síntesis de SWNT. Por este método, es posible producir cantidades en gramos de SWNTs, desafortunadamente, los esfuerzos por escalar más allá de eso no han tenido un éxito completo.
Inicialmente desarrollado para investigaciones a pequeña escala de la actividad del catalizador, el crecimiento de nanotubos de vapor líquido sólido (VLS) ha sido muy estudiado, y ahora es prometedor para la producción a gran escala de nanotubos. Los enfoques recientes han implicado el uso de nanopartículas o precursores moleculares bien definidos y se han empleado muchos metales de transición diferentes, pero el hierro, el níquel y el cobalto siguen siendo el foco de la mayor parte de la investigación. Los nanotubos crecen en los sitios del catalizador metálico; el gas que contiene carbono se rompe en la superficie de la partícula del catalizador, y el carbono se transporta a los bordes de la partícula, donde forma el nanotubo. La longitud del tubo cultivado en sistemas VLS de catalizador soportado en superficie parece depender de la orientación del tubo de crecimiento con la superficie. Ajustando adecuadamente la concentración superficial y la agregación de las partículas de catalizador es posible sintetizar nanotubos de carbono alineados verticalmente, es decir, como una alfombra perpendicular al sustrato.
De los diversos medios para la síntesis de nanotubos, los procesos químicos muestran la mayor promesa para la deposición a escala industrial en términos de su relación precio/unidad. Existen ventajas adicionales para el crecimiento de VLS, que a diferencia de los otros métodos es capaz de cultivar nanotubos directamente sobre un sustrato deseado. Los sitios de crecimiento son controlables por deposición cuidadosa del catalizador. Adicionalmente, no se han desarrollado otros métodos de crecimiento para producir SWNT alineados verticalmente.
Funcionalización química de nanotubos de carbono
La limitación del uso de nanotubos de carbono en cualquier aplicación práctica ha sido su solubilidad; por ejemplo, los SWNT tienen poca o ninguna solubilidad en la mayoría de los disolventes debido a la agregación de los tubos. La agregación/cableado de nanotubos ocurre como resultado de la alta energía de unión de van der Waals de ca. 500 eV por mm de contacto del tubo. La fuerza de van der Waals entre los tubos es tan grande, que se necesita tremenda energía para separarlos, por lo que es muy para hacer combinación de nanotubos con otros materiales como en aplicaciones compuestas. La funcionalización de nanotubos, es decir, la unión de “grupos funcionales químicos” proporciona el camino para superar estas barreras. La funcionalización puede mejorar tanto la solubilidad como la procesabilidad, y se ha utilizado para alinear las propiedades de los nanotubos con las de otros materiales. El ejemplo más claro de esto es la capacidad de solubilizar nanotubos en una variedad de solventes, incluyendo agua. Es importante al discutir la funcionalización que se haga una distinción entre funcionalización covalente y no covalente.
Los métodos actuales para solubilizar nanotubos sin funcionalización covalente incluyen disolventes altamente aromáticos, superácidos, polímeros o tensioactivos. La “funcionalización” no covalente se basa generalmente en el concepto de interacciones supramoleculares entre el SWNT y alguna macromolécula como resultado de diversas fuerzas de adsorción, como las interacciones de van der Waals y π-apilamiento. La especiación química del nanotubo en sí no se ve alterada como resultado de la interacción. Por el contrario, la funcionalización covalente se basa en la reacción química en la pared lateral o al final del SWNT. Como se puede esperar, la alta relación de aspecto de los nanotubos significa que la funcionalización de la pared lateral es mucho más importante que la funcionalización de la tapa. La funcionalización covalente directa de la pared lateral se asocia con un cambio de hibridación de sp 2 a sp 2 y una pérdida simultánea de conjugación. Un enfoque alternativo a la funcionalización covalente implica la reacción de defectos presentes (o generados) en la estructura del nanotubo. Los sitios defectuosos pueden ser los extremos abiertos y agujeros en las paredes laterales, e irregularidades del pentágono y heptágono en el marco del grafeno del hexágono (a menudo asociadas con curvas en los tubos). Todas estas funcionalizaciones son derivatizaciones exoédricas. Teniendo en cuenta la estructura hueca de los nanotubos, es posible la funcionalización endoédrica de los SWNT, es decir, el llenado de los tubos con átomos o moléculas pequeñas. Es importante señalar que los métodos de funcionalización covalente tienen un problema en común: la funcionalización covalente extensa modifica las propiedades de SWNT al interrumpir el sistema p continuo de los SWNT.
Diversas aplicaciones de nanotubos requieren diferentes modificaciones específicas para lograr propiedades físicas y químicas deseables de los nanotubos. En este sentido, la funcionalización covalente proporciona un mayor grado de ajuste fino de la química y física de los SWNT que la funcionalización no covalente. Hasta ahora, se han utilizado diversos métodos para lograr la funcionalización de nanotubos (Figura\(\PageIndex{9}\)).

Tomando la química desarrollada para C 60, los SWNT pueden funcionalizarse usando adición 1,3 dipolar de iluros de azometina. Los SWNT funcionalizados son solubles en la mayoría de los solventes orgánicos comunes. También se utilizó el método de funcionalización de iluro de azometina para la purificación de SWNT. En condiciones electroquímicas, las sales de aril diazonio reaccionan con los SWNT para lograr SWNT funcionalizados, alternativamente los iones diazonio pueden generarse in situ a partir de la anilina correspondiente, mientras que una reacción libre de disolvente proporciona la mejor oportunidad para la funcionalización a gran escala de esta manera. En cada uno de estos métodos es posible controlar la cantidad de funcionalización en el tubo variando los tiempos de reacción y los reactivos utilizados; es posible la funcionalización tan alta como 1 grupo por cada 10 - 25 átomos de carbono.
La funcionalización orgánica mediante el uso de haluros de alquilo, una vía radical, en tubos tratados con litio en amoníaco líquido ofrece una ruta simple y flexible a una variedad de grupos funcionales. En esta reacción, la funcionalización ocurre en cada 17 carbonos. El mayor éxito se ha encontrado cuando los tubos están dodecilados. Estos tubos son solubles en cloroformo, DMF y THF.
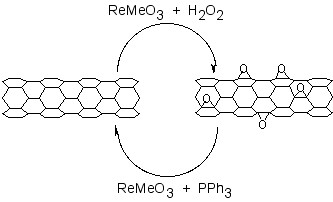
La adición de restos de oxígeno a las paredes laterales SWNT se puede lograr mediante el tratamiento con oxidación ácida o por aire húmedo, y ozonólisis. La epoxidación directa de los SWNTs se puede lograr mediante la reacción directa con un reactivo de peróxido, o catalíticamente. La desepoxidación catalítica (Figura\(\PageIndex{10}\)) permite el análisis cuantitativo del epóxido de pared lateral y condujo al sorprendente resultado de que los SWNT previamente asumidos “puros” en realidad contienen aproximadamente 1 oxígeno por 250 átomos de carbono.
Una de las vías de funcionalización más fáciles, y un sintón útil para las conversiones posteriores, es la fluoración de SWNTs, utilizando flúor elemental. Es importante destacar que se pueden lograr relaciones C: F de hasta 2:1 sin interrupción de la estructura tubular. Los SWNTs fluorados (F-SWNT) demostraron ser mucho más solubles que los SWNTs prístinos en alcoholes (1 mg/mL en iso-propanol), DMF y otros solventes orgánicos seleccionados. La microscopía de tunelización de barrido (STM) reveló que el flúor formó bandas de aproximadamente 20 nm, mientras que los cálculos con DFT revelaron que la adición de 1,2 es más energéticamente preferible que la adición de 1,4, lo que ha sido confirmado por RMN de 13 C en estado sólido. Los F-SWNT producen sintones altamente flexibles y su posterior elaboración se ha realizado con organolitio, reactivos de Grignard y aminas.
Los nanotubos funcionalizados se pueden caracterizar por una variedad de técnicas, tales como microscopía de fuerza atómica (AFM), microscopía electrónica de transmisión (TEM), espectroscopia UV-Vis y espectroscopia Raman. Los cambios en el espectro Raman de una muestra de nanotubos pueden indicar si se ha producido la funcionalización. Los tubos prístinos exhiben dos bandas distintas. Son el modo de respiración radial (230 cm -1) y el modo tangencial (1590 cm -1). Cuando se funcionaliza, una nueva banda, llamada banda de desorden, aparece en ca. 1350 cm -1. Esta banda se atribuye a los carbonos hibridados sp 3 en el tubo. Desafortunadamente, si bien la presencia de un modo D significativo es consistente con la funcionalización de la pared lateral y la intensidad relativa del modo D (trastorno) versus el modo G tangencial (1550 — 1600 cm -1) a menudo se usa como medida del nivel de sustitución. Sin embargo, se ha demostrado que Raman es un método poco confiable para la determinación del grado de funcionalización ya que la intensidad relativa de la banda D también es una función de la distribución de los sustituyentes así como de la concentración. Estudios recientes sugieren que la RMN de 13 C en estado sólido es posiblemente el único método definitivo para demostrar la unión covalente de grupos funcionales particulares.
Recubrimiento de nanotubos de carbono: creando nanoestructuras inorgánicas
Los fullerenos, nanotubos y nanofibras representan sustratos adecuados para la siembra de otros materiales como óxidos y otros minerales, así como semiconductores. En este sentido, el nanomaterial de carbono actúa como punto semilla para el crecimiento así como un método para definir relaciones de aspecto inusuales. Por ejemplo, las fibras de sílice se pueden preparar mediante una serie de métodos, pero es solo a través del recubrimiento SWNT que se pueden preparar nano-fibras de sílice con longitudes de micrones con decenas de nanómetros de diámetro.
Mientras que el C 60 por sí mismo no siembra fácilmente el crecimiento de materiales inorgánicos, la deposición en fase líquida de óxidos, como la sílice, en presencia de fullerenol, C 60 (OH) n, da como resultado la formación de esferas de óxido uniformes. Parece que el fullerenol actúa tanto como reactivo como punto físico para el posterior crecimiento del óxido, y es C 60, o un agregado de C 60, el que está presente dentro de la partícula esférica. La adición de fullerenol altera la morfología y la fase cristalina de los precipitados de CaCo 3 a partir de la solución acuosa, dando como resultado la formación de características esféricas, racimos en forma de flor de 5 puntas y cristales triangulares a diferencia de los cristales rómbos habituales. Además, se observa la fase metaestable de vaterita con la adición de C 60 (OH) n.
Como se señaló anteriormente, los SWNTs individuales se pueden obtener en solución cuando se encierran en una micela cilíndrica de un tensioactivo adecuado. Estos nanotubos individualizados se pueden recubrir con una variedad de materiales inorgánicos. La deposición en fase líquida (LPD) parece tener ventajas significativas sobre otros métodos, como la incorporación de SWNT en superficie en una matriz precerámica, el crecimiento in situ del SWNT en una matriz de óxido y los métodos sol-gel. La principal ventaja del crecimiento de LPD es que los SWNT individuales pueden estar recubiertos en lugar de haces o cuerdas. Por ejemplo, los SWNT se han recubierto con sílice mediante deposición en fase líquida (LPD) usando una solución de sílice/H 2 SiF 6 y una solución de SWNTs estabilizada con surfactante. El espesor del recubrimiento depende de la concentración de la mezcla de reacción y del tiempo de reacción. El núcleo SWNT se puede eliminar por termólisis bajo condiciones oxidantes para dejar una nano fibra de sílice. Es interesante señalar que el uso de un surfactante es contraproducente cuando se utilizan MWNT y VGFs, en este caso la activación superficial del nanotubo ofrece el adecuado inicio del crecimiento. La preoxidación del MWNT o VGF permite depositar recubrimientos uniformes. Los SWNTs, MWNTs y VGFs recubiertos pueden hacerse reaccionar posteriormente con reactivos superficiales adecuados para impartir miscibilidad en soluciones acuosas, geles de guar y matrices orgánicas. Además de los óxidos simples, se han preparado nanotubos recubiertos con minerales como carbonatos y semiconductores.
Bibliografía
- S. M. Bachilo, M. S. Strano, C. Kittrell, R. H. Hauge, R. E. Smalley, y R. B. Weisman, Science, 2002, 298, 2361.
- D. S. Bethune, C. H. Klang, M. S. DeVries, G. Gorman, R. Savoy, J. Vázquez, y R. Beyers, Nature, 1993, 363, 605.
- J, J. Brege, C. Gallaway, y A. R. Barron, J. Phys. Chem., C, 2007, 111, 17812.
- C. A. Dyke y J. M. Tour, J. Am. Chem. Soc. , 2003, 125, 1156.
- Z. Ge, J. C. Duchamp, T. Cai, H. W. Gibson, y H. C. Dorn, J. Am. Chem. Soc. , 2005, 127, 16292.
- L. A. Girifalco, M. Hodak, y R. S. Lee, Phys. Rev. B, 2000, 62, 13104.
- T. Guo, P. Nikolaev, A. G. Rinzler, D. Tománek, D. T. Colbert, y R. E. Smalley, J. Phys. Chem. , 1995, 99, 10694.
- J. H. Hafner, M. J. Bronikowski, B. R. Azamian, P. Nikolaev, A. G. Rinzler, D. T. Colbert, K. A. Smith, y R. E. Smalley, Chem. Phys. A lett. , 1998, 296, 195.
- A. Hirsch, Angew. Chem. Int. Ed. , 2002, 40, 4002.
- S. Iijima y T. Ichihashi, Nature, 1993, 363, 603.
- H. R. Jafry, E. A. Whitsitt, y A. R. Barron, J. Mater. Sci. , 2007, 42, 7381.
- H. W. Kroto, J. R. Heath, S. C. O'Brien, R. F. Curl, y R. E. Smalley, Nature, 1985, 318, 162.
- F. Liang, A. K. Sadana, A. Peera, J. Chattopadhyay, Z. Gu, R. H. Hauge, y W. E. Billups, Nano Lett. , 2004, 4, 1257.
- D. Ogrin y A. R. Barron, J. Mol. Cat. A: Chem. , 2006, 244, 267.
- D. Ogrin, J. Chattopadhyay, A. K. Sadana, E. Billups, y A. R. Barron, J. Am. Chem. Soc. , 2006, 128, 11322.
- R. E. Smalley, Acc. Chem. Res., 1992, 25, 98.
- M. J. Treacy, T. W. Ebbesen, y J. M. Gibson, Nature, 1996, 381, 678.
- E. A. Whitsitt y A. R. Barron, Nano Let. , 2003, 3, 775.
- J. Yang y A. R. Barron, Chem. Commun. , 2004, 2884.
- L. Zeng, L. B. Alemany, C. L. Edwards, y A. R. Barron, Nano Res., 2008, 1, 72.
Grafeno
Introducción
El grafeno es una lámina plana de un átomo de espesor de átomos de carbono unidos a sp 2 que están densamente empaquetados en una red cristalina de nido de abeja (Figura\(\PageIndex{11}\)). El nombre proviene de “grafito” y “alqueno”; el grafito en sí consiste en muchas láminas de grafeno apiladas juntas.

Las nanoláminas de grafeno de una sola capa se caracterizaron por primera vez en 2004, preparadas por exfoliación mecánica (el método “Scotch-tape”) de grafito a granel. Posteriormente se produjo grafeno mediante deposición química de vapor epitaxial sobre sustratos de carburo de silicio y níquel. Más recientemente, los nanobones de grafeno (GNR) se han preparado mediante el tratamiento oxidativo de nanotubos de carbono y por grabado plasmático de nanotubos incrustados en películas poliméricas.
Propiedades físicas del grafeno
Se ha reportado que el grafeno tiene un módulo de Young de 1 tPA y una fuerza intrínseca de 130 GP; similar a los nanotubos de carbono de pared simple (SWNT). Las propiedades electrónicas del grafeno también tienen cierta similitud con los nanotubos de carbono. El grafeno es un semiconductor de banda prohibida cero. La movilidad de los electrones en el grafeno es extraordinariamente alta (15,000 cm 2 /V.s a temperatura ambiente) y el transporte balístico de electrones se reportó en escalas de longitud comparables a las de los SWNT. Uno de los aspectos más prometedores del grafeno implica el uso de GNR. Cortar una capa individual de grafeno en una tira larga puede producir materiales semiconductores donde la banda prohibida se ajusta por el ancho de la cinta.
Si bien las nuevas propiedades electrónicas y físicas del grafeno garantizan que este material se estudiará en los próximos años, hay algunos obstáculos fundamentales aún por superar antes de que los materiales a base de grafeno puedan ser completamente utilizados. Los métodos de preparación de grafeno mencionados anteriormente son efectivos; sin embargo, no son prácticos para la fabricación a gran escala. La fuente más abundante y económica de grafeno es el grafito a granel. Los métodos químicos para la exfoliación del grafeno a partir del grafito proporcionan el enfoque más realista y escalable para los materiales de grafeno.
Las capas de grafeno se mantienen unidas en grafito por enormes fuerzas de van der Waals. Superar estas fuerzas es el principal obstáculo para la exfoliación con grafito. Hasta la fecha, los esfuerzos químicos en la exfoliación con grafito se han centrado principalmente en la intercalación, la derivatización química, la expansión térmica, la oxidación-reducción, el uso de surfactantes, o alguna combinación de estos.
Óxido de grafito
Probablemente la ruta más común al grafeno implica la producción de óxido de grafito (GO) mediante química de oxidación extremadamente dura. Los métodos de Staudenmeier o Hummers son los más utilizados para producir GO, un material altamente exfoliado que es dispersable en agua. La estructura del GO ha sido objeto de numerosos estudios; se sabe que contiene grupos funcionales epóxido a lo largo del plano basal de las láminas así como restos hidroxilo y carboxilo a lo largo de los bordes (Figura\(\PageIndex{12}\)). En contraste con otros métodos para la síntesis de GO, la oxidación del ácido m-peroxibenzoico (m-CPBA) del grafito sintético microcristalino a temperatura ambiente produce epóxido de grafito en alto rendimiento, sin defectos adicionales significativos.

Como el óxido de grafito es eléctricamente aislante, debe ser convertido por reducción química para restaurar las propiedades electrónicas del grafeno. El grafeno químicamente convertido (CCG) se reduce típicamente por hidrazina o borohidruro. Las propiedades de CCG nunca pueden coincidir completamente con las del grafeno por dos razones:
- La oxidación a GO introduce defectos.
- La reducción química no restaura completamente la estructura grafítica.
Como sería de esperar, CCG es propenso a la agregación a menos que se estabilice Los materiales de grafeno producidos a partir de grafito prístino evitan la oxidación severa al GO y la posterior reducción (incompleta); por lo tanto, los materiales producidos son potencialmente mucho más adecuados para aplicaciones electrónicas.
Se ha aplicado un enfoque catalítico para la eliminación de epóxidos de fullerenos y SWNT al epóxido de grafeno y GO. El tratamiento de grafenos oxidados con metiltrioxorhenio (MeReo 3, MTO) en presencia de PPh 3 da como resultado la transferencia de oxígeno, para formar O=PPh 3 y permitir la cuantificación de la relación C:O.
Dispersiones homogéneas de grafeno
Un enfoque alternativo para producir materiales de grafeno implica el uso de grafito prístino como material de partida. El valor fundamental de tal enfoque radica en su evitación de la oxidación a GO y posterior reducción (incompleta), preservando así las deseables propiedades electrónicas del grafeno. Hay precedentes para la exfoliación de grafito prístino en solventes orgánicos limpios sin oxidación ni surfactantes. Se ha reportado que son posibles dispersiones de grafeno de N, N-dimetilformamida (DMF), pero no se reportó caracterización detallada de las dispersiones. En contraste, Coleman y compañeros de trabajo reportaron dispersiones similares usando N-metilpirrolidona (NMP), resultando en láminas individuales de grafeno a una concentración de ≤0.01 mg/mL. NMP y DMF son solventes altamente polares, y no son ideales en los casos en que la química de reacción requiere un medio no polar. Además, son higroscópicos, lo que hace que su uso sea problemático cuando el agua debe ser excluida de las mezclas de reacción. Finalmente, la DMF es propensa a la descomposición térmica y química.
Recientemente, se han reportado dispersiones de grafeno en orto-diclorobenceno (ODCB) utilizando una amplia gama de fuentes de grafito. La elección de ODCB para exfoliación con grafito se basó en varios criterios:
- El ODCB es un disolvente de reacción común para los fullerenos y se sabe que forma dispersiones SWNT estables.
- ODCB es un aromático conveniente de alto punto de ebullición y es compatible con una variedad de químicas de reacción.
- ODCB, al ser aromático, es capaz de interactuar con el grafeno a través del apilamiento π-π.
- Se ha sugerido que los buenos solventes para la exfoliación con grafito deben tener valores de tensión superficial de 40 — 50 MJ/m 2. ODCB tiene una tensión superficial de 36.6 MJ/m 2, cercana al rango propuesto.
El grafito se exfolia fácilmente en ODCB con homogeneización y sonicación. Tres materiales de partida se dispersaron exitosamente: sintético microcristalino, expandido térmicamente y grafito pirolítico altamente ordenado (HOPG). Las dispersiones de grafito sintético microcristalino tienen una concentración de 0.03 mg/mL, determinada gravimétricamente. Las dispersiones de grafito expandido y HOPG son menos concentradas (0.02 mg/mL).
La microscopía electrónica de transmisión de alta resolución (HRTEM) muestra principalmente grafeno de pocas capas (n < 5) con capas simples y pequeñas escamas apiladas en la parte superior (Figura\(\PageIndex{13}\)). Los dominios grafíticos grandes son visibles; esto es apoyado además por difracción de electrones de área seleccionada (SAED) y transformada rápida de Fourier (FFT) en áreas seleccionadas. Las imágenes del microscopio de fuerza atómica (AFM) de dispersiones pulverizadas sobre sustratos de silicio muestran escamas extremadamente delgadas con casi todas por debajo de 10 nm. La altura promedio es de 7 - 10 nm. Las más delgadas son las monocapas de grafeno menores a 1 nm. Las dimensiones laterales de las nanoláminas oscilan entre 100 y 500 nm.

Las películas depositadas fundidas a partir de grafeno ODCB muestran mala conductividad eléctrica, sin embargo, después del recocido al vacío a 400 °C durante 12 horas las películas mejoran enormemente, teniendo resistencias de lámina del orden de 60 Ω/sq. En comparación, el grafeno cultivado epitaxialmente sobre Ni tiene una resistencia laminar reportada de 280 Ω/sq.
Funcionalización covalente de grafeno y óxido de grafito
La funcionalización covalente de los SWNT está bien establecida. Algunas rutas a los SWNTs funcionalizados covalentemente incluyen esterificación/amidación, alquilación reductiva (reacción de Billups) y tratamiento con iluros de azometina (reacción de Prato), sales de diazonio o nitrenos. Por el contrario, la derivatización química del grafeno y el GO aún está relativamente inexplorada.
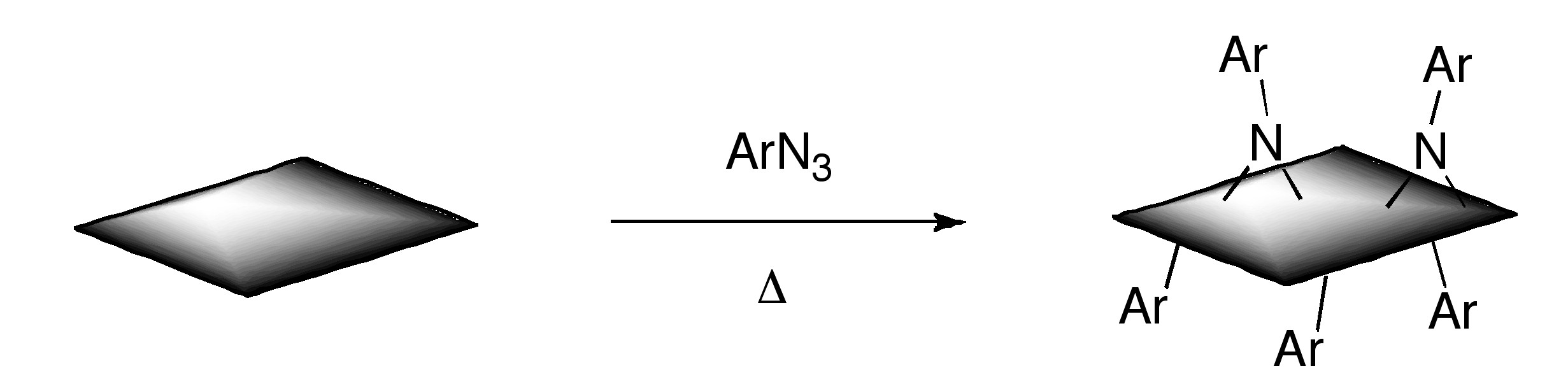
Algunos métodos previamente demostrados para SWNT se han adaptado a GO o grafeno. Los grupos de ácido carboxílico GO se han convertido en cloruros de acilo seguido de amidación con aminas de cadena larga. Adicionalmente, se ha reportado el acoplamiento de aminas primarias y aminoácidos a través del ataque nucleofílico de grupos epóxido GO. Todavía otra ruta acopló isocianatos a grupos ácido carboxílico de GO. También se ha demostrado la funcionalización de GO parcialmente reducido por sales de arildiazonio. La reacción de Billups se ha realizado sobre el compuesto de intercalación grafito potásico (C 8 K), así como fluoruro de grafito, y más recientemente GO. La alquilación de grafeno se ha logrado tratando fluoruro de grafito con reactivos de alquillitio.
Las dispersiones ODCB de grafeno se pueden convertir fácilmente para funcionalizar covalentemente el grafeno. La descomposición térmica del peróxido de benzoilo se utiliza para iniciar la adición radical de yoduros de alquilo al grafeno en dispersiones ODCB.

Adicionalmente, grafeno funcionalizado con nitrenos generados por descomposición térmica de aril azidas
Bibliografía
- P. Blake, P. D. Brimicombe, R. R. Nair, T. J. Booth, D. Jiang, F. Schedin, L. A. Ponomarenko, S. V. Morozov, H. F. Gleeson, E. W. Hill, A. K. Geim, y K. S. Novoselov, Nano Let., 2008, 8, 1704.
- J. Chattopadhyay, A. Mukherjee, C. E. Hamilton, J.-H. Kang, S. Chakraborty, W. Guo, K. F. Kelly, A. R. Barron, y W. E. Billups, J. Am. Chem. Soc., 2008, 130, 5414.
- G. Eda, G. Fanchini, y M. Chhowalla, Nat. Nanotechnol., 2008, 3, 270.
- M. Y. Han, B. Ozyilmaz, Y. Zhang, y P. Kim, Phys. Rev. Let., 2008, 98, 206805.
- Y. Hernández, V. Nicolosi, M. Lotya, F. M. Blighe, Z. Sol, S. De, I. T. McGovern, B. Holanda, M. Byrne, Y. K. Gun'Ko, J. J. Boland, P. Niraj, G. Duesberg, S. Krishnamurthy, R. Goodhue, J. Hutchinson, V. Scarraci, A. C. Ferrari, y J. N. Coleman, Nat. Nanotecnol. , 2008, 3, 563.
- W. S. Hummers y R. E. Offeman, J. Am. Chem. Soc., 1958, 80, 1339.
- L. Jiao, L. Zhang, X. Wang, G. Diankov, y H. Dai, Nature, 2009, 458, 877.
- D. V. Kosynkin, A. L. Higginbotham, A. Sinitskii, J. R. Lomeda, A. Dimiev, B. K. Price, y J. M. Tour, Nature, 2009, 458, 872.
- D. Li, M. B. Mueller, S. Gilje, R. B. Kaner, y G. G. Wallace, Nat. Nanotechnol., 2008, 3, 101.
- S. Niyogi, E. Bekyarova, M. E. Itkis, J. L. McWilliams, M. A. Hamon, y R. C. Haddon, J. Am. Chem. Soc., 2006, 128, 7720.
- Y. Si y E. T. Samulski, Nano Let., 2008, 8, 1679.
- L. Staudenmaier, Ber. Dtsch. Chem. Ges., 1898, 31, 1481.


