7.8: Halouros de Carbono
- Page ID
- 69519
Hay dos clases generales de haluros de carbono.
- Halouros homolépticos, e.g., CCl 4, CCl 2 F 2, C 6 Cl 6, etc.
- Halouros de carbonilo, por ejemplo, Cl 2 C=O.
En la Tabla se presenta un resumen de algunos haluros de carbono simples\(\PageIndex{1}\).
| Compuesto | Mp (°C) | Bp (°C) | Observaciones |
| CF 4 | -185 | -128 | Gas muy estable |
| CCl 4 | -23 | 76 | Líquido incoloro, estable |
| CbR 4 | 93 | 190 | Sólido amarillo pálido, se descompone al hervir |
| CI 4 | 171 | - | Sólido rojo brillante, se descompone antes de hervir, sublimado a baja presión |
| F 2 C=O | -114 | -83 | Descompuesto por H 2 O |
| Cl 2 C=O | -118 | 8 | El fosgeno, altamente tóxico |
| Br 2 C=O | - | 65 | Humos en el aire |
Tetrahaluros de carbono
Los tetrahaluros de carbono generalmente se preparan mediante la reacción directa (térmica) del carbono con el halógeno apropiado, (7.8.1); sin embargo, son posibles síntesis específicas para cada derivado.
\[ \text{C + 2 X}_2 \rightarrow \text{CX}_4\]
Además de la reacción directa del flúor con carbono, el CF 4 se puede preparar a partir de SiC, (7.8.2). El producto secundario SiF 4 se elimina haciendo pasar la mezcla de reacción a través de una solución de NaOH, en la que SiF 4 reacciona para formar silicato. La diferencia en la reactividad de SiF 4 y CF 4 es atribuible a la falta de un intermedio de cinco coordenadas energéticamente accesible requerido para el mecanismo asociativo.
\[ \text{SiC + F}_2 \rightarrow \text{SiF}_4\text{ + CF}_4 \]
El tetrabromuro de carbono se puede obtener por bromación de CH 4 con HBr o Br 2, o por reacción de CCl 4 con AlBr 3, (7.8.3). El tetraiodido de carbono (CI4) se puede preparar mediante la reacción de intercambio de halógeno catalizada por ácido de Lewis, (7.8.4).
\[ \text{3 CCl}_4\text{ + 4 ALBr}_3 \rightarrow \text{3 CBr}_4\text{ + 4 AlCl}_3\]
\[ \text{CCl}_4\text{ + 4 C}_2\text{H}_5\text{I} \rightarrow \text{CI}_4 \text{ + 4 C}_2\text{H}_5\text{Cl}\]
CF 4 es muy estable. De hecho, es tan estable que ni siquiera reacciona con el sodio fundido. A diferencia de CF 4, el tetracloruro de carbono (CCl 4) reacciona fácilmente con metales alcalinos (K y Na) u otros agentes reductores fuertes (por ejemplo, F 2, Al, Ba, Be y Zn). Si bien el CCl 4 es termodinámicamente inestable con respecto a la hidrólisis, es cinéticamente estable y, por lo tanto, encuentra un uso extensivo como disolvente. La fotólisis puede resultar en la transferencia de un radical cloruro a diversos sustratos. También se utiliza en la conversión de óxidos metálicos a los cloruros. El tetrabromuro de carbono (CbR 4) es insoluble en agua y otros solventes polares, pero soluble en benceno. El tetraiodido de carbono (CI 4) se descompone térmicamente, (7.8.5).
\[ \text{2 CI}_4 \rightarrow \text{2 I}_2 \text{ + I}_2\text{C=CI}_2 \]
La estabilidad decreciente de CX 4, de flúor a yodo, está directamente relacionada con la energía de enlace C-X.
| C-X | Energía de enlace (kJ/mol) |
| C-F | 485 |
| C-Cl | 327 |
| C-Br | 285 |
| C-I | 213 |
Peligros
A pesar de su uso como solvente CCl 4 tiene importantes efectos peligrosos. La inhalación de vapor de tetracloruro de carbono puede causar dolores de cabeza, confusión mental, depresión, fatiga, pérdida de apetito, náuseas, vómitos y coma. Los síntomas pueden tardar muchas horas en aparecer. El vapor y el líquido irritan los ojos, y la irritación interna, las náuseas y los vómitos se producen cuando se toman por vía oral. Los efectos crónicos de la inhalación prolongada incluyen bronquitis e ictericia, mientras que la exposición de la piel puede causar dermatitis.
El tetrabromuro de carbono es tóxico por inhalación, y el vapor es narcótico si se toma en altas concentraciones. Al igual que con CCl 4, CbR 4 puede reaccionar explosivamente con metales alcalinos.
Halouros homolépticos superiores
Los compuestos orgánicos que contienen solo carbono y un halógeno se denominan halocarbonos, y estos incluyen fluorocarbonos y clorocarbonos. La ruta más fácil a los fluorocarbonos implica la reacción de un hidrocarburo con un fluoruro de alta valencia (por ejemplo, CoF 3) o la reacción de un clorocarbono con SbF 3. En general, los clorocarbonos con átomos de carbono sp 3 son más estables que aquellos con centros de carbono sp 2. La excepción a esto son los compuestos aromáticos como C 6 Cl 6.
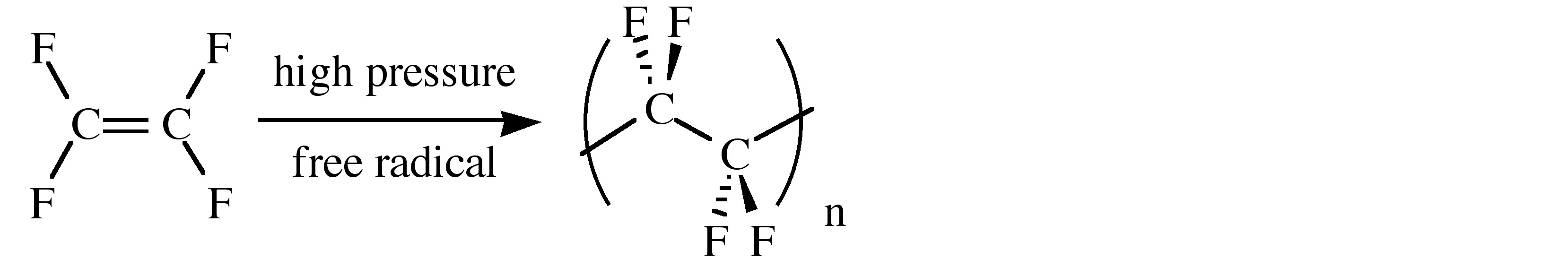
Las propiedades físicas de los fluorocarbonos varían de inertes a tóxicas. Así, el poli (tetrafluoroetileno), (C 2 F 4) n, conocido por sus siglas (PTFE) o su nombre comercial (Teflon), es químicamente inerte y tiene un bajo coeficiente de fricción (Tabla\(\PageIndex{3}\)). Como consecuencia, sus usos incluyen recubrimientos en balas perforadoras de blindaje (para detener el desgaste en el cañón de la pistola), contenedores de laboratorio y agitadores magnéticos, tubos para productos químicos corrosivos y cinta de sellado de rosca en aplicaciones de plomería (cinta para fontaneros). Un resumen de las propiedades físicas del PTFE se da en la Tabla\(\PageIndex{3}\). El PTFE se sintetiza mediante la polimerización en emulsión de monómero de tetrafluoroetileno bajo presión a través de un catalizador de radicales libres.
| Propiedad | Valor |
| Densidad | 2.2 g/cm 3 |
| Punto de fusión | 327 °C |
| Módulo de Young | 0.5 GPa |
| Fuerza de fluencia | 23 MPa |
| Coeficiente de fricción | 0.05 - 0.10 |
| Constante dieléctrica | 2.1 |
| Rigidez dieléctrica (1 MHz) | 60 mV/m |
En contraste con el PTFE, el octafluoroisobutileno, (CF 3) 2 C=CF 2, es altamente tóxico, mientras que el perfluorodecahidronaftaleno (C 10 F 8, Figura\(\PageIndex{1}\)) se utiliza como componente sustituto de la sangre.

Mezcla de haluros
Los haluros mixtos son una clase importante de compuestos halocarbonados. Se sintetizan por intercambio de haluro, (7.8.6). El alto costo de SbF 3 significa que la reacción generalmente se lleva a cabo con un exceso del cloruro.
\[\text{3 CCl}_4 \text{ + 2 SbF}_3 \rightarrow \text{2 CCl}_2\text{F}_2 \text{ + 2 SbCl}_2\]
El nombre ordinario para el haluro de carbono mixto es halón o freón, aunque el freón es en realidad una marca registrada Du Pont. En la Tabla se da una lista de compuestos seleccionados de Freón\(\PageIndex{4}\). Los halones no son tóxicos, no inflamables y no tienen olor. Sin embargo, es su propia falta de reactividad lo que ha causado un problema.
| Freón | Fórmula | Usos |
| 12 | CCl 2 F 2 | Refrigerante |
| 11 | CCl 3 F | Refrigerante |
| 114 | ClF 2 C-CCLF 2 | Refrigerante |
| 113 | Cl 3 C-CF 3 | Solvente |
| 13B1 | CBrF 3 | Extintor |
| 1211 | CBRCLF 2 | Extintor |
Impacto ambiental de los compuestos clorofluorcarbonados (CFC)
Los compuestos clorofluorcarbonados (CFC) son muy estables y no se degradan en el ambiente. Como consecuencia son transportados a la estratosfera donde se descomponen tras la fotólisis, (7.8.7). El radical cloruro resultante es un catalizador para la descomposición del ozono, (7.8.8), así como un catalizador para la reacción del ozono con oxígeno molecular, (7.8.9).
\[ \text{CCl}_2\text{F}_2\text{ + h}\nu \rightarrow \text{CClF}_2\text{ + Cl}\cdot \]
\[ \text{2 O}_3 \xrightarrow{\text{Cl}\cdot} \text{3 O}_2\]
\[ \text{O}_3 \text{ + O} \xrightarrow{\text{Cl}\cdot} \text{2 O}_2 \]
El uso generalizado de CFC como refrigerantes y propelentes significó que para 1986 había 2.5 mil millones de libras de CFC siendo liberados a la atmósfera. Esto equivalía a 1/2. lb por persona en el planeta. Dado que la capa de ozono proporciona la protección vital a la vida en la superficie de la Tierra de la radiación UV de alta energía, la liberación de CFC (junto con otros productos químicos) provocó un cambio dramático en la capa de ozono, incluido el aumento en el agujero polar en la capa de ozono. A raíz de que la UE pidió una prohibición completa de los CFC (que fue seguida por otros países). En su lugar se desarrollaron nuevos químicos con similares propiedades refrigerantes. Estos compuestos contenían enlaces C-H (por ejemplo, C 2 HCl 2 F 3 y C 2 H 3 Cl 2 F) que se rompen fácilmente en la atmósfera inferior, limitando así el transporte a la estratosfera.
Halouros de carbonilo
Todos los haluros de carbonilo (X 2 C=O, X = F, Cl, Br, I) son conocidos (Tabla\(\PageIndex{1}\)). El fosgeno (Cl 2 C=O) fue sintetizado por primera vez por John Davy (Figura\(\PageIndex{2}\)) en 1812 al exponer una mezcla de monóxido de carbono y cloro a la luz solar, (7.8.10). Lo nombró fosgeno del griego, phos (luz) y gen (nacido), en referencia al uso de la luz para promover la reacción. El fluoruro también se prepara mediante la reacción del monóxido de carbono con el halógeno, mientras que el bromuro se prepara por la hidrólisis parcial de CbR 4 con ácido sulfúrico.
\[ \text{CO + Cl}_2 \rightarrow \text{Cl}_2\text{C=O} \]

La síntesis de isocianatos a partir de alquil o aril aminas ilustra el carácter electrófilo del fosgeno y su capacidad para introducir el equivalente de “CO 2+ “, (7.8.11). Esta reacción se realiza en presencia de una base tal como piridina que absorbe el cloruro de hidrógeno. También se puede usar fosgeno para producir cloruros de acilo a partir de ácidos carboxílicos, (7.8.12). Sin embargo, el cloruro de tionilo se usa de manera más común y segura en esta reacción.
\[ \text{RNH}_2 \text{ + Cl}_2\text{C=O} \rightarrow \text{RN=C=O + 2 HCl} \]
\[ \text{RCO}_2\text{H + Cl}_2\text{C=O} \rightarrow \text{RC(O)Cl + HCl + CO}_2 \]
El fosgeno como arma de guerra
El fosgeno es un gas tóxico con olor a “heno recién segado” y fue utilizado en la guerra química durante la Primera Guerra Mundial (Figura\(\PageIndex{3}\)) donde era un arma más potente que el cloro. Si bien el cloro era potencialmente mortal provocó que la víctima tose violentamente y se ahogara (los cuerpos de defensa natural para limitar la inhalación), en contraste, el fosgeno provocó mucha menos tos con el resultado de que se inhaló más de él. El fosgeno a menudo tuvo un efecto retardado; aparentemente soldados sanos fueron derribados con envenenamiento por gas fosgeno hasta 48 horas después de la inhalación. Una dosis fatal de fosgeno finalmente condujo a la respiración superficial y a las cosquillas, pulso de hasta 120, una cara cenicienta y la descarga de cuatro pintas de líquido amarillo de los pulmones cada hora para los 48 de los espasmos ahogados.

Aunque el punto de ebullición del fosgeno (7.6 °C) significó que se trataba de un vapor, la denominada mezcla de fosgeno y cloro “estrella blanca” se usaba comúnmente en el Somme, debido a que el cloro suministraba el vapor necesario con el que transportar el fosgeno. En la Tabla se muestra un resumen de las bajas infligidas por agentes de guerra química durante la Gran Guerra\(\PageIndex{5}\).
| País | Total de bajas | Muertes |
| Rusia | 419,340 | 56,000 |
| Alemania | 200,000 | 9,000 |
| Francia | 190,000 | 8,000 |
| Imperio Británico | 188,706 | 8,109 |
| Austria-Hungría | 100,000 | 3,000 |
| USA | 72,807 | 1,462 |
| Italia | 60,000 | 4,627 |
| Otros | 10,000 | 1,000 |

