7.11: Oxidación de Silicio
- Page ID
- 69516
Nota
Este módulo fue desarrollado como parte del curso de la Universidad del Arroz CHEM-496: Química de los Materiales Electrónicos. Este módulo fue elaborado con la asistencia de Andrea Keys.
Introducción
En la fabricación de circuitos integrados (CI), la oxidación del silicio es esencial, y la producción de CI superiores requiere una comprensión del proceso de oxidación y la capacidad de formar óxidos de alta calidad. El dióxido de silicio tiene varios usos:
- Sirve como máscara contra implante o difusión de dopante en silicio.
- Proporciona pasivación superficial.
- Aísla un dispositivo de otro (aislamiento dieléctrico).
- Actúa como componente en estructuras MOS.
- Proporciona aislamiento eléctrico de sistemas de metalización multinivel.
Se han desarrollado métodos para formar capas de óxido sobre silicio, incluyendo oxidación térmica, anodización húmeda, deposición química de vapor (CVD) y anodización u oxidación por plasma. Generalmente, se usa CVD cuando se coloca la capa de óxido sobre una superficie metálica, y la oxidación térmica se usa cuando se requiere un nivel de densidad de carga bajo para la interfaz entre el óxido y la superficie de silicio.
Oxidación de silicio
La superficie del silicio tiene una alta afinidad por el oxígeno y, por lo tanto, una capa de óxido se forma rápidamente al exponerse a la atmósfera. Las reacciones químicas que describen esta formación son:
\[ \text{Si}_{\text{(s)}} \text{ + O}_{\text{2(g)}} \rightarrow \text{SiO}_{\text{2(s)}} \]
\[ \text{Si}_{\text{(s)}} \text{ + 2 H}_2\text{O}_{\text{(g)}} \rightarrow \text{SiO}_{\text{2(s)}} \text{ + 2 H}_{\text{2(g)}}\]
En la primera reacción se utiliza un proceso seco que involucra gas oxígeno como fuente de oxígeno y la segunda reacción describe un proceso húmedo que utiliza vapor. El proceso en seco proporciona un “buen” dióxido de silicio pero es lento y se usa principalmente al inicio del procesamiento. El procedimiento húmedo es problemático ya que la pureza del agua utilizada no puede garantizarse en un grado adecuado. Este problema se puede resolver fácilmente usando una técnica pirogénica que combina gases de hidrógeno y oxígeno para formar vapor de agua de muy alta pureza. Mantener reactivos de alta calidad es esencial para la fabricación de circuitos integrados, y es una preocupación que afecta cada paso de este proceso.
La formación de la capa de óxido involucra electrones de valencia compartidos entre silicio y oxígeno, lo que permite que la superficie del silicio se deshaga de enlaces “colgados”, como pares solitarios y orbitales vacíos. Estas vacantes crean estados de separación media entre las bandas de valencia y conducción, lo que evita el espacio de banda deseado del semiconductor. La fuerza del enlace Si-O es covalente (fuerte), y por lo tanto se puede usar para lograr la pérdida de estados de brecha media y pasivar la superficie del silicio.
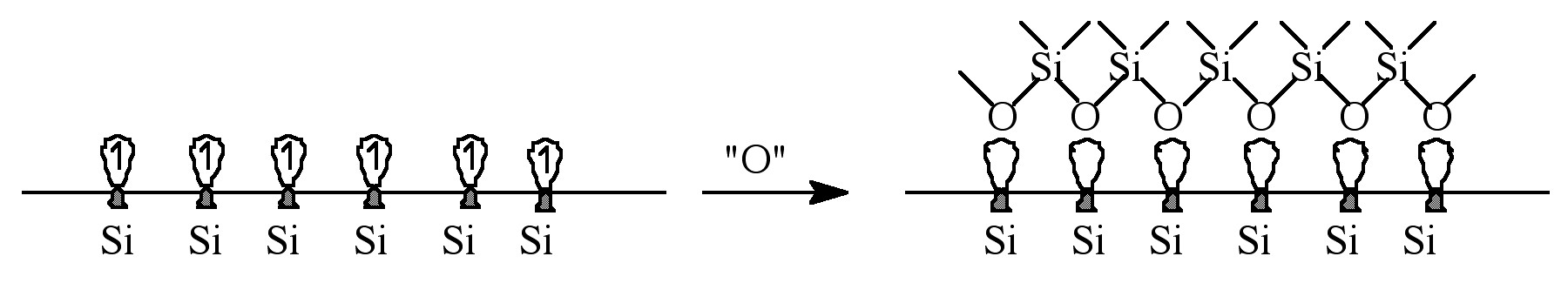
La oxidación del silicio se produce en la interfaz silicio-óxido y consta de cuatro etapas:
- Transporte difusivo de oxígeno a través de la capa de difusión en la fase de vapor adyacente a la interfaz óxido de silicio-vapor.
- Incorporación de oxígeno en la superficie exterior en la película de óxido de silicio.
- Transporte difusivo a través de la película de óxido de silicio hasta su interfaz con la red de silicio.
- Reacción del oxígeno con silicio en esta interfaz interna.
A medida que la interfaz Si-SiO 2 se mueve hacia el silicio, su volumen se expande, y en base a las densidades y pesos moleculares de Si y SiO 2, se utiliza 0.44 Å Si para obtener 1.0 Å SiO 2.
Limpieza previa a la oxidación
El primer paso para oxidar una superficie de silicio es la eliminación del óxido nativo que se forma debido a la exposición al aire libre. Esto puede parecer redundante para eliminar un óxido sólo para ponerse otro, pero esto es necesario ya que existe incertidumbre en cuanto a la pureza del óxido que está presente. La contaminación del óxido nativo por materiales tanto orgánicos como inorgánicos (derivada de etapas de procesamiento y manejo anteriores) debe eliminarse para evitar la degradación de las características eléctricas esenciales del dispositivo. Un procedimiento común utiliza una mezcla H 2 O-H 2 O 2 -NH 4 OH que elimina los orgánicos presentes, así como algunos metales del grupo I y II. La remoción de metales pesados se puede lograr usando una mezcla de H 2 O-H 2 O 2 -HCl, que se compleja con los iones que se forman. Después de la eliminación del óxido nativo, se puede cultivar el óxido deseado. Este crecimiento es útil porque proporciona: protección química, condiciones adecuadas para la litografía y pasivación. La protección evita que ocurran reacciones no deseadas y la pasivación llena vacantes de enlaces en la superficie no presentes dentro del interior del cristal. Así, la oxidación de la superficie del silicio cumple varias funciones en un solo paso.
Oxidación térmica
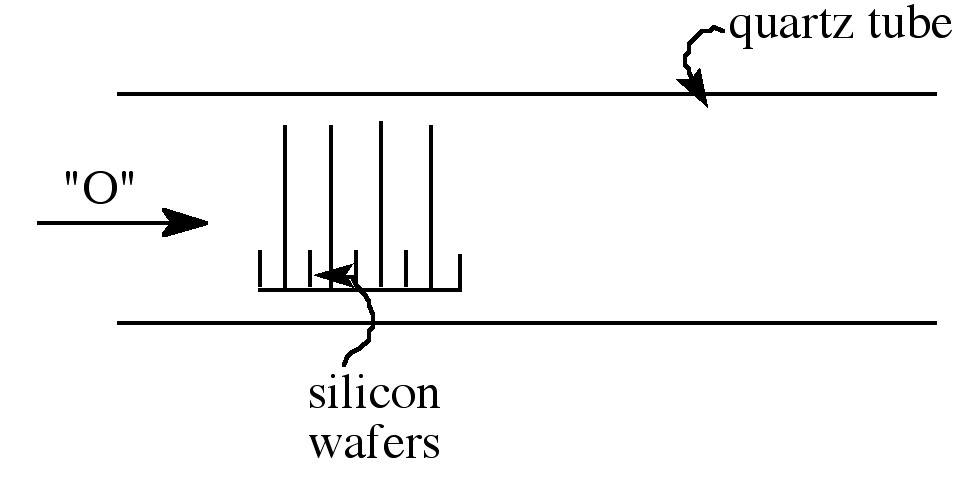
El crecimiento de óxidos sobre una superficie de silicio puede ser un proceso particularmente tedioso, ya que el crecimiento debe ser uniforme y puro. El espesor deseado suele caer en el rango de 50 - 500 Å, lo que puede llevar mucho tiempo y debe hacerse a gran escala. Esto se hace apilando las obleas de silicio en un tubo de cuarzo horizontal mientras la fuente de oxígeno fluye sobre las obleas, las cuales están situadas verticalmente en una paleta ranurada (bote). Este procedimiento se realiza a una presión de 1 atm, y la temperatura oscila entre 700 y 1200 °C, manteniéndose dentro de ±1 °C para asegurar la uniformidad. La elección de la técnica de oxidación depende del espesor y las propiedades de óxido requeridas. Los óxidos que son relativamente delgados y aquellos que requieren baja carga en la interfaz generalmente se cultivan en oxígeno seco. Cuando se requieren óxidos gruesos (> 0.5 mm), el vapor es la fuente de elección. El vapor se puede usar en un amplio rango de presiones (1 atm a 25 atm), y las presiones más altas permiten que se logre un crecimiento espeso de óxido a temperaturas moderadas en cantidades razonables de tiempo.
El espesor de las capas de SiO 2 sobre un sustrato de Si se determina fácilmente por el color de la película. La tabla\(\PageIndex{1}\) proporciona una línea de guía para óxidos cultivados térmicamente.
| Grosor de película (μm) | Color | Grosor de película (μm) | Color |
| 0.05 | bronceado | 0.63 | violeta-rojo |
| 0.07 | marrón | 0.68 | “azulado” |
| 0.10 | violeta oscuro a rojo-violeta | 0.72 | azul-verde a gree |
| 0.12 | azul real | 0.77 | “amarillento” |
| 0.15 | azul claro a azul metalizado | 0.80 | naranja |
| 0.17 | metálico a amarillo-verde claro | 0.82 | salmón |
| 0.20 | oro claro | 0.85 | rojo claro-violeta |
| 0.22 | oro | 0.86 | violeta |
| 0.25 | naranja a melón | 0.87 | azul violeta |
| 0.27 | rojo-violeta | 0.89 | azul |
| 0.30 | azul a azul violeta | 0.92 | azul-verde |
| 0.31 | azul | 0.95 | amarillo-verde |
| 0.32 | azul a azul-verde | 0.97 | amarillo |
| 0.34 | verde claro | 0.99 | naranja |
| 0.35 | verde a amarillo-verde | 1.00 | rosa clavel |
| 0.36 | amarillo-verde | 1.02 | rojo violeta |
| 0.37 | verde-amarillo | 1.05 | rojo-violeta |
| 0.39 | amarillo | 1.06 | violeta |
| 0.41 | naranja claro | 1.07 | azul-violeta |
| 0.42 | rosa clavel | 1.10 | verde |
| 0.44 | violeta-rojo | 1.11 | amarillo-verde |
| 0.46 | rojo-violeta | 1.12 | verde |
| 0.47 | violeta | 1.18 | violeta |
| 0.48 | azul-violeta | 1.19 | rojo-violeta |
| 0.49 | azul | 1.21 | violeta-rojo |
| 0.50 | azul verde | 1.24 | clavel rosado a salmón |
| 0.52 | verde | 1.25 | naranja |
| 0.54 | amarillo-verde | 1.28 | “amarillento” |
| 0.56 | verde-amarillo | 1.32 | azul cielo a verde-azul |
| 0.57 | “amarillento” | 1.40 | naranja |
| 0.58 | naranja claro a rosa | 1.46 | azul-violeta |
| 0.60 | rosa clavel | 1.50 | azul |
Oxidación a alta presión
La oxidación a alta presión es otro método de oxidación de la superficie de silicio que controla la velocidad de oxidación. Esto es posible porque la tasa es proporcional a la concentración del óxido, que a su vez es proporcional a la presión parcial de las especies oxidantes, según la ley de Henry, (7.11.3), donde C es la concentración de equilibrio del óxido, H es la constante de la ley de Henry, y p O es la presión parcial de las especies oxidantes.
\[\text{C = H}_{\text{(pO)}}\]
Este enfoque es rápido, con una tasa de oxidación que oscila entre 100 y 1000 mm/h, y también ocurre a una temperatura relativamente baja. Es un proceso útil, evitando que los dopantes se desplacen y además forma un bajo número de defectos, lo que es más útil al final del procesamiento.
Oxidación plasmática
La oxidación y anodización del silicio por plasma se logra fácilmente mediante el uso de oxígeno activado como especie oxidante. El oxígeno altamente reactivo se forma dentro de una descarga eléctrica o plasma. La oxidación se lleva a cabo en una cámara de baja presión (0.05 - 0.5 Torr), y el plasma es producido ya sea por una fuente de electrones DC o una descarga de alta frecuencia. En la simple oxidación por plasma la muestra (es decir, la oblea de silicio) se mantiene a potencial de tierra. Por el contrario, los sistemas de aniodización suelen tener una polarización de CC entre la muestra y un electrodo con la muestra sesgada positivamente con respecto al cátodo. Los electrodos de platino se utilizan comúnmente como cátodos.
Se han reportado al menos 34 reacciones diferentes que ocurren en un plasma de oxígeno, sin embargo, la gran mayoría de estas son intrascendentes con respecto a la formación de especies activas. Además, muchas de las especies potencialmente activas tienen una vida suficientemente corta que es poco probable que hagan una contribución significativa. Las especies activas primarias dentro del plasma de oxígeno son indudablemente O - y O 2+. Ambos se producen en cantidades casi iguales, aunque sólo la primera es relevante para la aniodización plasmática. Si bien estas especies pueden estar activas con respecto a la oxidación superficial, es más probable que se produzca una transferencia de electrones desde la superficie del semiconductor produzca especies de oxígeno activado, que son los reactivos reales en la oxidación del silicio.
El avance significativo de los procesos plasmáticos es que mientras la temperatura electrónica del gas oxígeno ionizado es superior a 10,000 K, las temperaturas térmicas requeridas son significativamente más bajas que las requeridas para el método de alta presión, es decir, < 600 °C. Las ventajas de las temperaturas de reacción más bajas incluyen : la minimización de la difusión del dopante y el impedimento de la generación de defectos. A pesar de estas ventajas, hay dos desventajas principales de cualquier proceso basado en plasma. Primero, los altos campos eléctricos presentes durante los procesos causan daños al óxido resultante, en particular, a menudo se produce una alta densidad de trampas de interfaz. Sin embargo, el recocido posterior puede mejorar la calidad de la película. En segundo lugar, las tasas de crecimiento de la oxidación plasmática son bajas, típicamente 1000 Å/h, esta tasa de crecimiento se incrementa en aproximadamente un factor de 10 para la aniodización plasmática, y se observan mejoras adicionales si se agrega 1 - 3% de cloro a la fuente de oxígeno.
Enmascaramiento
Una máscara selectiva contra la difusión de átomos dopantes a altas temperaturas se puede encontrar en una capa de dióxido de silicio, lo que puede resultar muy útil en el procesamiento de circuitos integrados. Una preposición de dopante por implantación de iones, difusión química o técnicas de giro típicamente da como resultado una fuente de dopante en o cerca de la superficie del óxido. Durante la etapa inicial de alta temperatura, la difusión en el óxido debe ser lo suficientemente lenta con respecto a la difusión en el silicio para que los dopantes no difundan a través del óxido en la región enmascarada y lleguen a la superficie del silicio. El espesor requerido puede determinarse midiendo experimentalmente, a una temperatura y tiempo particulares, el espesor de óxido necesario para evitar la inversión de un sustrato de silicio ligeramente dopado de conductividad opuesta. A esto se le suma entonces un factor de seguridad, con valores totales típicos que van de 0.5 a 0.7 mm. Las propiedades de enmascaramiento de impurezas resultan cuando el óxido se convierte parcialmente en una fase de “vidrio” de óxido de impurezas de sílice, y evita que las impurezas alcancen la interfaz SiO 2-Si.
Bibliografía
- M. M. Atalla, en Propiedades de Semiconductores Elementales y Compuestos, Ed. H. Gatos, Interciencia: Nueva York (1960).
- S. K. Ghandhi, VLSI Fabrication Principles, Silicio y arseniuro de galio, Wiley, Chichester, 2a Ed. (1994).
- S. M. Sze, Física de los Dispositivos Semiconductores, 2ª Edición, John Wiley & Sons, Nueva York (1981).
- D. L. Lile, Electron de Estado Sólido. , 1978, 21, 1199.
- W. E. Spicer, P. W. Chye, P. R. Skeath, y C. Y. Su, I. Lindau, J. Vac. Sci. Tecnol. , 1979, 16, 1422.
- V. Q. Ho y T. Sugano, IEEE Trans. Electron Devices, 1980, ED-27, 1436.
- J. R. Hollanhan y A. T. Bells, Técnicas y Aplicaciones de la Química del Plasma, Wiley, Nueva York (1974).
- R. P. H. Chang y A. K. Sinha, Appl. Phys. Lett., 1976, 29, 56.

