9.4: Peróxido de hidrógeno
- Page ID
- 69498
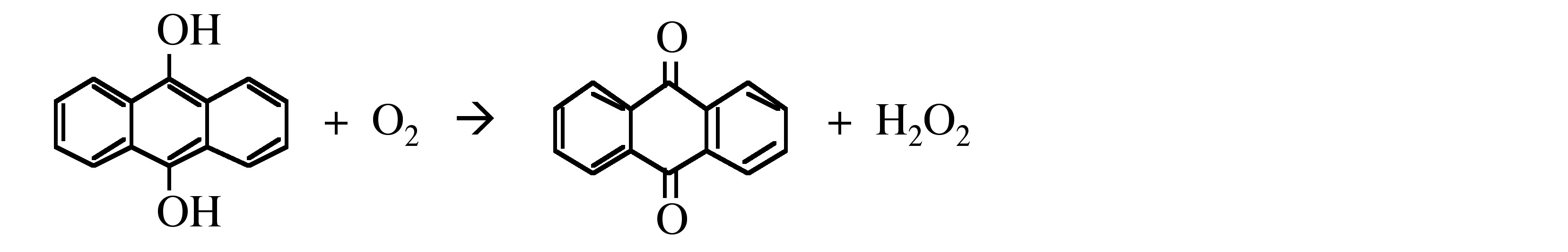
El peróxido de hidrógeno (H 2 O 2) es un líquido azul muy pálido pero aparece incoloro en solución diluida. Se prepara por la oxidación del antraquinol (se muestra a continuación). El peróxido de hidrógeno se extrae con agua de la solución de antraquinona y la solución al 20 - 40% se purifica por extracción con disolvente. Un proceso alternativo implica la oxidación del isopropanol en fase vapor o líquida a 100 °C y ca. 15 atm, (9.4.1). Los productos se separan por destilación fraccionada.
\[ \rm Me_2C(H)OH + O_2 \rightarrow Me_2C(OOH)OH \rightarrow Me_2\text{C=O} + H_2O_2\]
En la fase gaseosa H 2 O 2 adopta una conformación gauche (Figura\(\PageIndex{1}\)), pero solo hay una barrera baja a la rotación alrededor del enlace O-O.

El peróxido de hidrógeno es un líquido a temperatura y presión estándar (25 °C, 1 atm) debido a la presencia de fuertes enlaces de hidrógeno similares a los que se encuentran en el agua. De hecho, el rango de líquidos para H 2 O 2 (Mp = -0.43 °C, Bp = 150.2 °C) es en realidad más amplio que el agua, y es ligeramente más viscoso que el agua. El peróxido de hidrógeno tiene una densidad de 1.44 g/cm 3, y es 10 6 veces menos básico que el agua.
Al igual que con el agua, H 2 O 2 es un buen solvente debido a su naturaleza polar y amplio rango de temperatura del líquido, sin embargo, es peligroso en su estado puro debido a su fácil (ΔH = -99 kJ/mol) autodescomposición, (9.4.2), así como su fuerte naturaleza oxidante.
\[ \rm 2 H_2O_2 \rightarrow 2 H_2O + O_2\]
El peróxido de hidrógeno generalmente se vende como solución del 3 al 12% para uso doméstico; sin embargo, el laboratorio y ciertas aplicaciones industriales requieren soluciones del 30%.
Nota
El peróxido de hidrógeno debe almacenarse en un área fresca, seca, bien ventilada y lejos de cualquier sustancia inflamable o combustible. Debe almacenarse en un recipiente compuesto por materiales no reactivos como acero inoxidable o vidrio (otros materiales incluyendo algunos plásticos y aleaciones de aluminio también pueden ser adecuados). Debido a que se descompone rápidamente cuando se expone a la luz, debe almacenarse en un recipiente opaco, y las formulaciones farmacéuticas generalmente vienen en frascos marrones que filtran la luz.
La solución acuosa es débilmente ácida (K = 1.5 x 10 -12), (9.4.3). Sin embargo, no hay intercambio de átomos de oxígeno entre H 2 O 2 y H 2 O en la fase líquida.
\[ \rm H_2O_2 + H_2O \rightleftharpoons HO_2^- + H_3O^+\]
Como era de esperar, el peróxido de hidrógeno es un agente oxidante fuerte, (9.4.4), sin embargo, también puede actuar como agente reductor, (9.4.5).
\[ \rm H_2O_3 + 2 HI \rightarrow I_2 + 2 H_2O \]
\[ \rm 5 H_2O_2 + 2 MnO_4 + 6 H^+ \rightarrow 2 Mn^{2+} + 8 H_2O + 5 O_2 \uparrow \]


