10.2: Compuestos de Flúor
- Page ID
- 69429
El flúor elemental (F 2) es el elemento más reactivo. El flúor se combina directamente con todos los demás elementos, excepto el nitrógeno y los gases nobles más ligeros. También reacciona con muchos compuestos formando fluoruros, y muchos compuestos orgánicos se inflaman y queman en el gas. La naturaleza altamente reactiva se debe al débil enlace F-F (termodinámicamente inestable), que proporciona una baja energía de activación a las reacciones (cinéticamente inestables). El ΔG para reacciones suele ser grande debido a la fuerza de los enlaces X-F resultantes. El débil enlace F-F (158 kJ/mol) se debe al pequeño tamaño (0.5 Å) y la alta carga nuclear del flúor que resultan en un pequeño solapamiento de los orbitales de enlace y una repulsión entre los orbitales no enlazantes (pares solitarios) en los dos átomos de flúor.
Sales iónicas
La facilidad de formación del anión F se debe a la alta afinidad electrónica del flúor (-322 kJ/mol). Dado que el ion fluoruro es pequeño (1.33 Å) y el anión menos polarizable (es decir, duro) es estable en redes iónicas con cationes metálicos en un estado de oxidación alta (carga alta), por ejemplo, MnF 4 y CrF 5. En general los estados de oxidación más altos para cualquier metal se encuentran con las sales de fluoruro. Las grandes energías de ionización necesarias para producir los cationes son recuperadas por las altas energías de la red.
Compuestos covalentes
La alta electronegatividad del flúor significa que forma un enlace polar de un solo par de electrones con un alto carácter iónico. La naturaleza polar del enlace significa que hay un gran efecto inductivo dentro de una molécula. Por ejemplo, el perfluoroetanol (CF 3 CF 2 OH) tiene una acidez comparable a la del ácido acético.
La alta resistencia de los enlaces X-F (Tabla\(\PageIndex{1}\)) también se debe al alto carácter iónico (hasta 50%) que da como resultado una alta energía de activación para la ruptura del enlace. En contraste, la baja polarizabilidad del flúor significa que los enlaces intermoleculares de van der Waals son muy débiles. Así, incluso con pesos moleculares muy altos el punto de ebullición puede ser muy bajo, por ejemplo, WF 6, Bp = 17 °C, Mw = 297.84 g/mol.
| Bond | Energía de enlace (kJ/mol) |
|---|---|
| C-F | 486 |
| N-F | 272 |
| P-F | 490 |
Se puede preparar una amplia gama de complejos de fluoruro tanto a partir de metales (FeF 6 3-, RuF 6 -, PtF 6 2- y SnF 6 2-) como no metálicos (BF 4 -, SiF 6 2- y PF 6 -) fluoruros. Si bien muchos fluoruros son sales, cuando el metal está en sus estados de oxidación más altos (por ejemplo, OsF 6 y WF 6), la formación de una red iónica con el catión apropiado (es decir, Os 6+ y W 6+ respectivamente) es energéticamente desfavorable.
Fluoruro de hidrógeno
El fluoruro de hidrógeno (HF) se convierte en ácido fluorhídrico altamente corrosivo al entrar en contacto con la humedad. El fluoruro de hidrógeno puro debe manejarse en recipientes de metal o polietileno, mientras que las soluciones acuosas grabarán y disolverán fácilmente la cristalería estándar de laboratorio que requiere el uso de recipientes de polímero fluorado (por ejemplo, teflón).
El fluoruro de hidrógeno se sintetiza mediante la reacción de una sal de fluoruro con un ácido concentrado, (10.2.1). El vapor de HF puede condensarse y luego purificarse posteriormente por destilación.
\[ \rm CaF_2 + H_2SO_4 \rightarrow CaSO_4 + 2 HF \uparrow \]
El enlace H-F en fluoruro de hidrógeno implica un enlace de par de electrones con un alto grado de carácter iónico. Esto da como resultado un enlace H-F muy polar y un gran momento dipolar (1.86 D).
En fase vapor, el fluoruro de hidrógeno es monomérico por encima de 80 °C, pero a temperaturas más bajas se asocia en oligómeros y polímeros pequeños, por ejemplo, cíclico (HF) 6, como consecuencia de fuertes enlaces de hidrógeno intermoleculares. Como líquido puro (Mp = -83 °C, Bp = 19.5 °C), el fluoruro de hidrógeno se asocia extensamente por fuertes enlaces de hidrógeno para formar polímeros en zig-zag (Figura\(\PageIndex{1}\)).

El fluoruro de hidrógeno tiene una constante dieléctrica alta (84.2) y como tal es un buen disolvente para las moléculas polares. Sin embargo, no es un buen disolvente para sales (incluso fluoruros) porque no solvata demasiado bien los cationes. A pesar de esto, es útil como solvente porque es no oxidante y fácil de evaporar los productos.
De manera similar al agua, el fluoruro de hidrógeno se autoioniza, (10.2.2). Se conocen sales de H 2 F + y el anión F- es solvatado adicionalmente por el HF para formar una serie de sales, (10.2.3). El anión complejo HF 2 - también se forma en soluciones acuosas de fluoruro de hidrógeno (pK = 0.7).
\[ \rm 2 HF \rightleftharpoons H_2F^+ + F^-\]
\[ \rm F^- + \text{n HF} \rightleftharpoons HF_2^- + H_2F_3^- + H_3F_4^- \text{ etc.}\]
El fluoruro de hidrógeno es en realidad un ácido débil en solución acuosa con un pK bajo = 3.5. De hecho, HF es un ácido más débil que los otros análogos de halógeno:
\[ \rm HF<HCl<HBr<HI\]
Esta tendencia es a pesar de que el flúor es más electronegativo que los otros halógenos, pero es consistente con la fuerza del enlace H-F (568 kJ/mol).
El fluoruro de hidrógeno se utiliza como un ácido no oxidante para la hidrólisis de proteínas y la reacción de condensación catalizada por ácido. La estabilidad de su sal (HF 2 -) permite el estudio de ácidos muy fuertes, (10.2.5) y (10.2.6).
\[ \rm 2 HF + R_2\text{C=O} \rightarrow R_2\text{C=OH}^+ + HF^+_2\]
\[ \rm 2 HF + H_2O \rightarrow H_3O^+ + HF_2^-\]
La acidez del HF puede incrementarse suficientemente mediante la adición de un aceptor de fluoruro (por ejemplo, SbF 5) para facilitar la reacción con una base débil como el benceno, (10.2.7).
\[ \rm C_6H_6 + HF + SbF_5 \rightarrow C_6H_7^+ + SbF_6^-\]
Finalmente, el fluoruro de hidrógeno se puede utilizar en la síntesis de otros compuestos que contienen flúor:
\[ \rm 6 HF + KCl + PCl_5 \rightarrow K[PF_6] + 6 HCl \uparrow\]

Compuestos orgánicos de flúor
Los compuestos orgánicos en los que algunos o todos los átomos de hidrógeno son reemplazados por flúor tienen propiedades únicas (y a menudo importantes). La alta estabilidad de los compuestos fluorocarbonados es consecuencia de la energía de enlace C-F (486 kJ/mol) en comparación con la de C-H (415 kJ/mol); sin embargo, aunque cinéticamente estables, los fluorocarbonos no son necesariamente particularmente termodinámicamente estables.
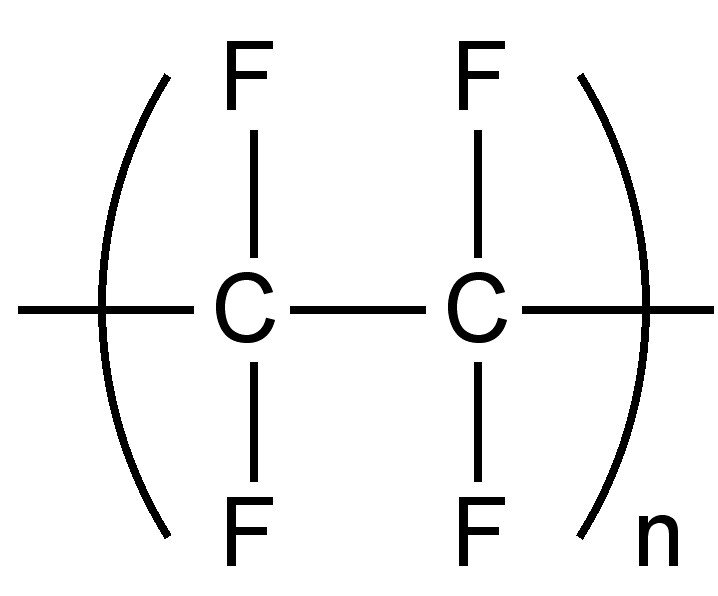
El reemplazo de hidrógeno por flúor da como resultado un aumento de la densidad; ya que el pequeño tamaño del flúor significa que la mínima distorsión o cambio estructural se produce como resultado de la sustitución. Al igual que con las sales metálicas, las débiles fuerzas intermoleculares significan que los compuestos orgánicos completamente fluorados tienen puntos de ebullición bajos. Un atributo de las bajas fuerzas intermoleculares es el bajo coeficiente de fricción para fluoropolímeros como el politetrafluoroetileno, comúnmente conocido como Teflon (Figura\(\PageIndex{2}\)).
Rutas sintéticas a compuestos fluorocarbonados
La ruta más simple a un compuesto de fluorocarbono implica la sustitución directa de otro halógeno por un fluoruro metálico, (10.2.9). La fuerza impulsora de esta reacción depende de la diferencia de energía libre de MF y McL, que está relacionada con la diferencia en las energías de la red. Así, cuanto mayor es el catión metálico, más favorecida es la reacción. En este sentido, AgF y CsF son el agente de fluoración más efectivo.
\[ \rm \text{R-Cl} + MF \rightleftharpoons \text{R-F} + MCl\]
El fluoruro de hidrógeno anhidro (HF) reacciona con compuestos de clorocarbono en presencia de un catalizador como SbCl 5 o CrF 4, (10.2.10). Sin embargo, se requieren temperaturas elevadas (50 — 150 °C) y altas presiones (50 — 500 psi).
\[ \rm 2 CCl_4 + 3 HF \rightarrow CCl_2F_2 + CCl_3F + 3 HCl \]
El reemplazo directo del hidrógeno por flúor es posible si la reacción se lleva a cabo en condiciones diluidas en presencia de un catalizador, (10.2.11).
\[ \rm C_6H_6 + 9 F_2 \xrightarrow{Cu} C_6F_{12} + 6 HF\]
El tetrafluoruro de azufre (SF 4) es un agente de fluoración particularmente selectivo. Se puede utilizar para convertir cetonas en compuestos difluoro, (10.2.12).
\[ \rm 2 R_2\text{C=O} + SF_4 \rightarrow R_2CF_2 + SO_2 \]


