14: Química Verde - Síntesis Orgánica Libre de Protección
- Page ID
- 74205
Durante los dos últimos siglos, la síntesis orgánica del arte ha visto enormes avances en varias disciplinas de la química orgánica. Poco después de los avances realizados por incondicionales como Kekule, Fischer y Robison a finales del siglo XIX y principios del XX, la química fue testigo de los albores de la química orgánica mecanicista. Pronto siguió la era de la espectroscopia y los reactivos para complementar y avanzar la química orgánica mecanicista y la síntesis a nuevas alturas. A mediados del siglo XX, los avances en la Ciencia de la Separación se hicieron cargo del arte clásico de la purificación. Las últimas tres décadas del siglo vieron el nacimiento de la Lógica en Síntesis. Todos estos desarrollos fueron buenos augurios para nuevos desarrollos en el descubrimiento de fármacos que condujeron a la síntesis a gran escala de varias moléculas orgánicas complejas. Sin embargo, este ritmo agitado de desarrollos en la química industrial se ha dado a costa del medio ambiente que es tan vital para la supervivencia de la vida en la tierra. En la industria química, esta realización se produjo solo después de que desastres como el presenciado en Bhopal, India sacudieron el mundo químico. La responsabilidad del desarrollo de nuevas moléculas recae en nosotros (químicos) y por lo tanto la responsabilidad del desarrollo responsable recae una vez más sobre nuestros hombros. Química Limpia (que significa Química Verde) depende de varios factores: materiales de partida limpios, reactivos limpios, solventes limpios, producto limpio, energía limpia y (no menos importante) procesos limpios. Si bien todos estos subtítulos se discuten bajo Química Verde, restringiríamos nuestras discusiones actuales a un aspecto del Proceso Verde a saber, síntesis libres de protección porque esto cae dentro de nuestras discusiones actuales 'Lógica de Sintesis'.
- Química Orgánica Avanzada: Principios Herramientas y Lógica de Síntesis, Vishal Publishing Co., Jalandhar, India (2012).
La Lógica de Síntesis abre una metodología sistemática para el desarrollo de Árboles Sintéticos. Cuando se concibe adecuadamente, un árbol sintético contiene todas las rutas plausibles para la síntesis del compuesto Target. La ruta elegida depende de la necesidad y limitaciones del científico desarrollador. De ahí que la elección de la química limpia comience aquí. Las rutas deben ser analizadas desde las ventanas para Química Verde. Una de esas ventanas verdes es la búsqueda de una ruta sintética Libre de Protección. ¿Por qué Ruta Libre de Protección? Una ruta industrialmente factible tiene que ser muy eficiente para ser económica. Al imponer tal condición -Libre de Protección- a la elección de rutas, debería ser posible llegar a dichas rutas. Cada secuencia de protección/desprotección agrega dos pasos al esquema. Así, más grupos protectores, menos es el rendimiento global. Además, cada paso de protección/desprotección se suma a la carga de subproducto liberada al ambiente. Así, la planeación basada en la protección tiene un arma de doble filo oculta en cada uno de esos pasos. Para minimizar la pérdida (del producto final precioso), la secuencia de protección/desprotección debe tratarse como una técnica evitable para ser utilizada solo con moderación. Recuerde siempre que la metodología de protección proporciona tal sensación de seguridad, uno tiende a abusar y sobreusar dicha instalación. Una vez que un químico se instala en tal zona de confort, uno tiende a dedicar menos tiempo/esfuerzo a buscar enfoques alternativos.
de rutas, debería ser posible llegar a dichas rutas. Cada secuencia de protección/desprotección agrega dos pasos al esquema. Así, más grupos protectores, menos es el rendimiento global. Además, cada paso de protección/desprotección se suma a la carga de subproducto liberada al ambiente. Así, la planeación basada en la protección tiene un arma de doble filo oculta en cada uno de esos pasos. Para minimizar la pérdida (del producto final precioso), la secuencia de protección/desprotección debe tratarse como una técnica evitable para ser utilizada solo con moderación. Recuerde siempre que la metodología de protección proporciona tal sensación de seguridad, uno tiende a abusar y sobreusar dicha instalación. Una vez que un químico se instala en tal zona de confort, uno tiende a dedicar menos tiempo/esfuerzo a buscar enfoques alternativos.
¿Es posible evitarlo? Debería ser posible seleccionar deliberadamente tales rutas del Árbol Sintético o dispositivo de dicho árbol en base a este criterio adicional. Se podrían seleccionar únicamente aquellas rutas que no requieran protección o que cuenten con un mínimo de tales técnicas.
- Se podrían agregar criterios de filtración mientras se diseñan árboles sintéticos para evitar este tipo de grupos conflictivos. Esto, de hecho, encogería enormemente el tamaño del árbol y, por lo tanto, limitaría el número de opciones.
- El esquema podría idearse con un mínimo de grupos conflictivos. Esto aumentaría el número de esquemas sintéticos y así proporcionaría más opciones al científico.
- Dondequiera que surjan tales conflictos, primero se deben buscar reactivos adecuados que sean quimioselectivos y/o regioselectivos, en lugar de recurrir a la comodidad de la protección. Los avances en reactivos/reacciones son tales que ahora tenemos varios reactivos selectivos y su número aumenta cada día que pasa.
Una vez que se toma una decisión consciente de que las síntesis libres de protección son 'elegantes' además de ser económicas, es más probable que se presenten esquemas adecuados. Dado que las síntesis a escala industrial se guían principalmente por factores de costo, no es sorprendente encontrar varios procesos industriales que son síntesis libres de protección. La protección/desprotección debe tratarse como un caso de mentalidad más que como limitaciones de la química. Dicho esto en términos tan contundentes, concedamos también que tal vez no sea factible evitar por completo las estrategias de protección/desprotección. En apoyo de estas declaraciones, pronto veríamos alguna síntesis exitosa libre de protección en este capítulo. En 2007, Phil S. Baran et.al. , reportó la síntesis total de algunos productos naturales marinos sin usar grupos protectores. Al discutir la síntesis, los autores sugieren que las siguientes pautas serían útiles a la hora de planificar el retroanálisis bajo esta filosofía.
- Se deben minimizar las reacciones redox que no conduzcan a la formación de enlaces C-C.
- Se debe maximizar el porcentaje de eventos de formación de enlaces C — C en las etapas sintéticas.
- Se deben hacer desconexiones para maximizar la convergencia.
- El nivel de oxidación global de los intermedios debe escalar linealmente durante el ensamblaje de la estructura molecular.
- Siempre que sea posible, deben diseñarse reacciones en cascada o tándem.
- La reactividad innata de los grupos funcionales debe ser aprovechada para evitar estrategias de protección.
- De ser necesario, se deben inventar nuevas metodologías para descubrir nuevos aspectos de las reactividades químicas.
- La química biomimectica podría proporcionar pautas útiles cuando se trata de productos naturales.
En un esfuerzo por demostrar su punto, han reportado una ruta eficiente para la síntesis de (+) -Ambiguina H. Esta síntesis se muestra a continuación (Fig 14.1). Las desconexiones estratégicas de los bonos previstos por estos trabajadores se orientaron en los lineamientos anteriores.
Dado que una ruta elegida es una elección deliberada del investigador, puede no ser justo comparar publicaciones de investigación basadas en diferentes motivos. Yo sería como comparar manzanas y naranjas. Nature 446, 404 (2007) y las referencias allí citadas.
A continuación se muestran las desconexiones estratégicas propuestas para H ambiguo (Fig 14.1).
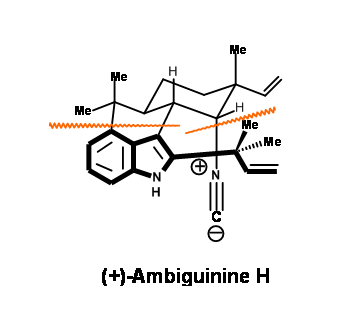
El primer objetivo fue (-) -Hapalindol U para el cual no se requiere la unidad t-prenilo. La unidad de anillo superior de seis miembros provino del conocido terpeno a través de cuatro pasos mostrados en (Fig 14.2)
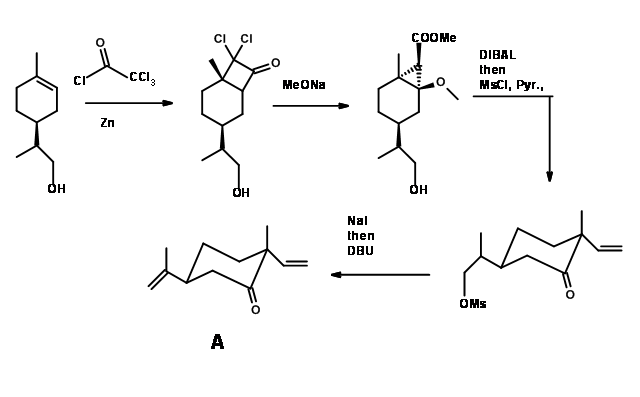
La posición α- a la cetona en A se vinculó el C3 del indol sin protección, utilizando una reacción desarrollada en su laboratorio (J. Am. Chem. Soc., 127, 7459 (2004)) (Fig 14.3). El segundo acoplamiento se intentó con varios catalizadores. El radical libre las condiciones del Heck fracasaron. Condujeron principalmente a la ciclación en C2 de la unidad de indol. Sondeando más, la reacción tuvo éxito utilizando la técnica de adición lenta del catalizador de Herrman. En ausencia del grupo NH en el indol, tales reacciones no lograron dar este acoplamiento. Ahora la conversión al producto natural (-) -Hapalindol U (A) necesitaba la transformación estereoselectiva de la unidad carbonilo a unidad de isonitrilo. Esto se logró mediante aminación reductora asistida por microondas estereocontrolada seguida de reacciones de formilación y deshidratación para dar (-) -Hapalindol U (A). Todas estas reacciones se pudieron escalar hasta el nivel de varios gramos. (-) -Hapalindol U se hizo en cantidades suficientes y se almacenó.
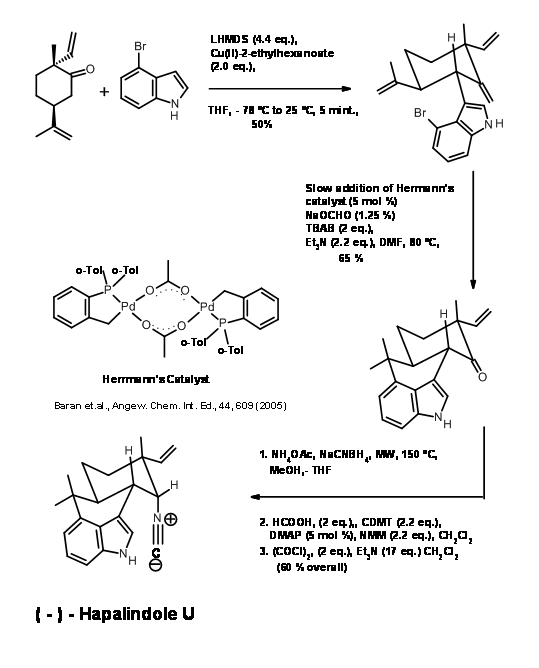
El siguiente objetivo (+) -Ambiguino H fue un compuesto muy inestable, el cual se realizó según y cuando fue necesario, utilizando las siguientes reacciones.
El (-) -Hapalindol U tenía varias unidades muy reactivas en proximidad. La introducción de una unidad prenilo en la región C2 abarrotada de la unidad de indol fue muy difícil (Fig 14.4). El tratamiento de t-BuOCl seguido de prenil-9-BBN condujo a una serie compleja de reacciones, dando como resultado un producto cristalino B. La formación de este producto se racionalizó mediante un mecanismo de reacción en cascada que se muestra en la figura. La fotólisis de B condujo a una escisión de tipo nórdico, seguida de un reordenamiento que deshizo de todos los grupos extra en el esqueleto para producir Ambiguina H. No se permitió que la reacción llegara a completarse debido a que el producto también era sensible a la fotólisis. El rendimiento reportado se basa en B.
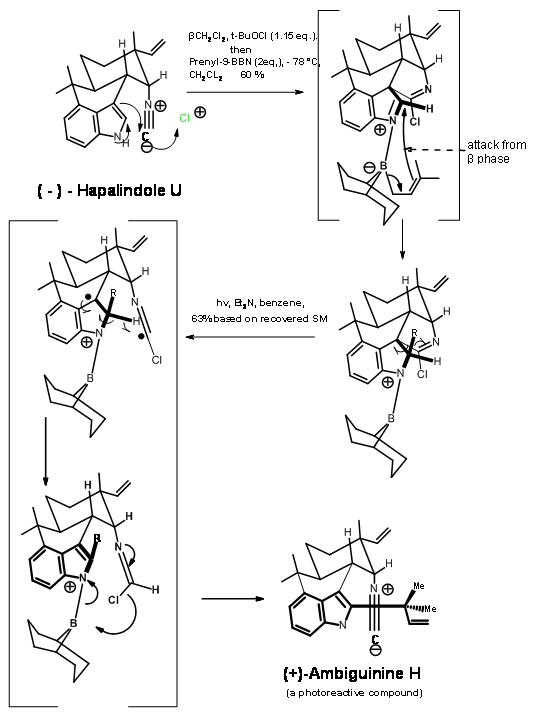
La insistencia de que no se permitieran protocolos de protección en el esquema no solo dio una ruta corta al compuesto objetivo, sino que también condujo al uso de Transformaciones de Reordenamiento, uso de Reacciones en Cascada y dio lugar a nuevos descubrimientos en reactividades químicas.
En la química antigua, se encontraría con varias dianas tan complejas (para ese momento), cuya síntesis se logró sin (o con muy pocas) secuencias de protección/desprotección. Hay otras síntesis reportadas en los últimos años que han seguido una barrera de 'no protección' en la planeación de las síntesis. Podríamos visitar dos síntesis más de este tipo en este capítulo.
Kessane, un constituyente de la raíz valaria japonesa es de interés debido a su efecto sedante y ansiolítico. En 2003, Booker-Milburn K. I. y sus compañeros de trabajo reportaron una síntesis industrial de este compuesto en 8 pasos siguiendo el tema 'sin protección/ desprotección'. El esquema de la síntesis se presenta en (Fig 14.5)
- Chem. Int. Ed. Engl., 34, 1370 (1995); Hoffman R. W, Síntesis, 21, 3531 (2006)
- Booker-Milburn K.I.; Jenkins H.; Charmant J. P. H.; Mohr Peter Org. Let., 5, 3309 (2003).

El uso de reactivos de metales de transición podría ayudar en la construcción de enlaces C — C sin necesidad de grupos protectores, como lo demostró el grupo de Baldwin en 2006 (Fig 14.6). Esta síntesis de Bureothin se logró en 7 pasos sin protocolo de protección.
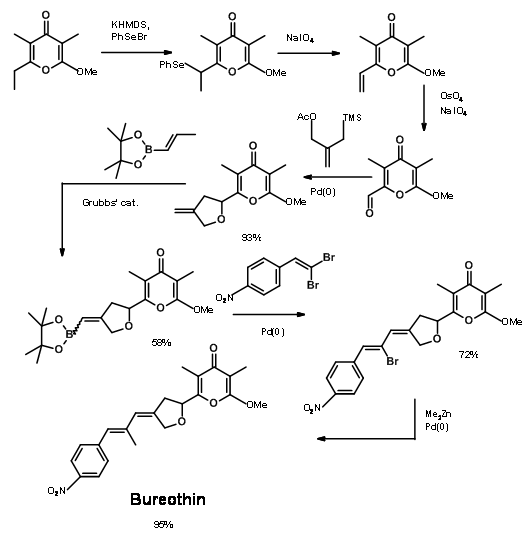
- Jacobson, M. F., Moses, J. E., Adlington, R. M. y Baldwin, J. E., Tetrahedron, 62, 1675 (2006).
Algunas maravillas raras de ingeniería molecular como la síntesis de PGF de R.B. Woodward (Fig 1.10.7) abren nuevos conceptos sobre 'Protección' en la síntesis molecular. Tenga en cuenta la forma en que incorporó un andamio de grupo protector en el mainframe molecular. A diferencia de la forma habitual de pensar la protección/desprotección como una operación aislada, estos trabajadores posteriormente incorporaron esta unidad protectora al marco molecular, logrando así la 'economía del carbono' muy adelantada a su tiempo. Estos conceptos de química verde llegaron décadas después. También vuelva a visitar algunas de las reacciones de ciclación de tipo biogenético discutidas anteriormente a la luz de la Química Verde.
Conclusión
Cualquier duda sobre la viabilidad de la síntesis libre de protección podría restarse. Sin embargo, en el estado actual de evolución de las metodologías sintéticas comunes, la metodología libre de protección también tiene sus limitaciones. En la actualidad, parece inconcebible producir un péptido o nucleótido de tamaño mediano con tales protocolos libres de protección. Esto también podría ser cierto para varias otras síntesis de moléculas complejas. La tesis principal de este ensayo es que es práctico concebir tales protocolos sintéticos libres de protección. Esto cae dentro de la convocatoria de Química Verde. Aunque esta ha sido la consigna en la síntesis industrial, el artículo de Baran de 2007 acuñó el modismo “Síntesis sin protección” y llamó la atención sobre tal posibilidad. Desde entonces han aparecido varios trabajos con este modismo. Se puede asegurar que un concepto verde tan básico no puede ser un desvanecimiento pasajero. Es más probable que marque una piedra angular en la lógica de la síntesis orgánica.
Lecturas adicionales
- Síntesis orgánica; Michael B. Smith, McGraw-Hill, Edición Internacional (1994).
- La lógica de la síntesis química, E.J. Corey & Xue-Min Cheng, John Wiley & Sons (1989).
- La Síntesis Total de Productos Naturales, Volumen 4; Editado por John ApSimon, John Wiley & Sons (1981).
- Química Orgánica Avanzada: Reacciones y Síntesis; Parte A y B; Francis A. Corey, Richard J. Sundberg, Springer (2007).
- Síntesis Total de Productos Naturales: Síntesis Total 1980-1994, Volumen 11, Parte 2; Michael C. Pirrung, Andrew T. Morehead & Bruce G. Young, John Wiley & Sons (2000).
- Química Orgánica Avanzada: Principios Herramientas y Lógica de la Síntesis Orgánica, R. Balaji Rao, Publicaciones Vishal. Jalandhar 144008 (PB), India (2012).

