INTERCAPÍTULO: Análisis retrosintético y predicción de vías metabólicas
- Page ID
- 72774
Imagina que eres un químico biológico que investiga sobre el metabolismo bacteriano. Usted y sus colegas aíslan una biomolécula interesante de un cultivo bacteriano, luego utilizan espectrometría de masas, RMN y otras técnicas analíticas para determinar su estructura. Usando su 'caja de herramientas' de tipos conocidos de reacciones orgánicas -sustitución nucleofílica, fosforilación, adiciones de aldol, etc.- ¿puede encontrar una vía químicamente razonable por la cual su compuesto podría sintetizarse enzimáticamente a partir de precursores metabólicos simples? En otras palabras, ¿se pueden rellenar los pasos bioquímicos faltantes (o al menos algunos de ellos) para llegar a una nueva vía metabólica potencial, que luego se puede utilizar como hipótesis para futuros trabajos experimentales para tratar de encontrar y estudiar las enzimas reales involucradas?
A continuación se muestra un ejemplo real que aproxima este escenario. Desde la década de 1960 se conoce una ruta biosintética completa para el difosfato de isopentenilo (IPP), la molécula básica para todos los compuestos isoprenoides, y esta vía, que comienza con acetil-CoA, demostró ser activa en levaduras, plantas y muchas otras especies, incluidos los humanos. Sin embargo, investigadores a finales de la década de 1980 descubrieron evidencia que indicaba que la vía conocida no está presente en las bacterias, aunque claramente usan IPP como molécula de bloque de construcción al igual que otras formas de vida.
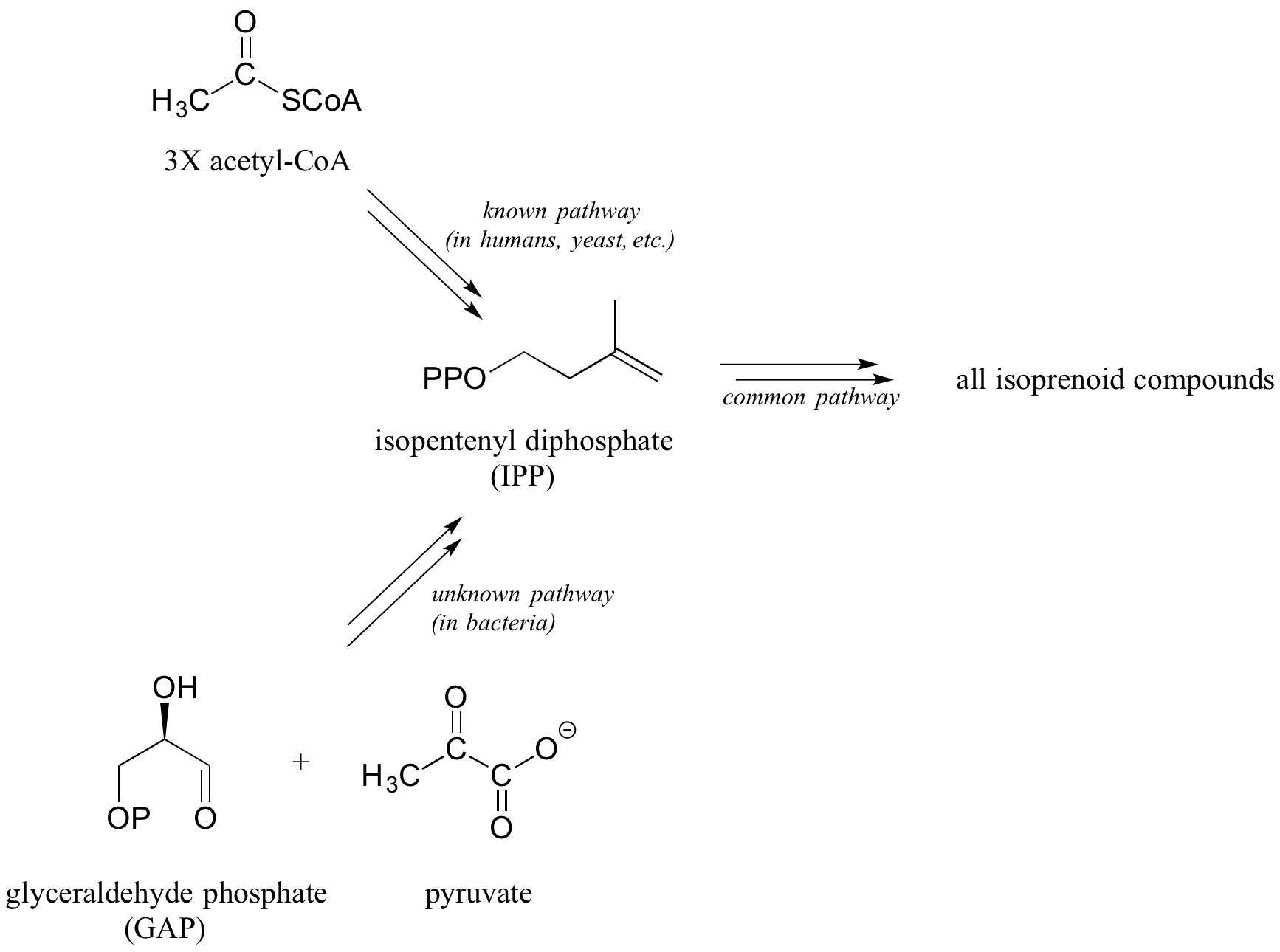
Durante los siguientes años, los investigadores realizaron una serie de experimentos en los que las bacterias se cultivaron en un medio que contenía glucosa 'marcada' con el isótopo 13 C. Con los resultados de estos experimentos, combinados con su conocimiento de los tipos de reacciones orgánicas biológicas comunes, los investigadores pudieron predecir correctamente que la vía bacteriana comienza con dos moléculas precursoras (piruvato y gliceraldehído fosfato en lugar de acetil CoA) y también predijo correctamente los dos primeros pasos enzimáticos de la ruta bacteriana recién descubierta. Este logro finalmente condujo a la elucidación de cada paso en la ruta, y el aislamiento de las enzimas que los catalizan. (Bioquímica J. 1993, 295, 517; J. Am. Chem. Soc. 1996, 118, 2564; Lípidos 2008, 43, 1095)
¿Por qué no pudieron predecir todo el camino? Resulta que varios de los pasos posteriores fueron algo inusuales, tipos de reacción desconocidos, pero el descubrimiento de estas reacciones dependía de la predicción correcta de los dos primeros pasos más familiares.
Los problemas de transformación de varios pasos de este tipo ofrecen una oportunidad inigualable de utilizar nuestro conocimiento de la química orgánica biológica combinada con el razonamiento creativo para resolver desafiantes y relevantes acertijos científicos. En este punto de tu carrera de química orgánica, aún no has acumulado suficientes herramientas en tu caja de herramientas de reacción para abordar la mayoría de los problemas de la vía bioquímica de la vida real como el abordado anteriormente, pero para cuando terminemos con la química de oxidación y reducción en el capítulo 15, podrás reconocer la mayoría de los tipos de reacciones que encontrará en el metabolismo real, y se le desafiará a predecir algunas vías reales en los problemas de fin de capítulo.
Usted sí, sin embargo, tiene en este momento suficiente repertorio bioorgánico para comenzar a aprender cómo se pueden abordar los problemas de vías de varios pasos, utilizando para la práctica algunos ejemplos generalizados, hipotéticos en los que los tipos de reacción involucrados se limitan a aquellos con los que ya está familiarizado.
Imagina que quieres averiguar cómo se arma un reloj mecánico anticuado. Una forma de hacerlo es comenzar con un reloj que funcione, y desmontarlo pieza por pieza. Alternativamente, uno podría comenzar con todas las piezas desmontadas, además de muchas otras piezas pequeñas de diferentes relojes, e intentar averiguar cómo armar el reloj específico que le interesa. ¿Qué enfoque es más fácil? La respuesta es intuitivamente obvia: generalmente es más fácil desarmar las cosas que volver a juntarlas.
Lo mismo es cierto para las moléculas. Si queremos averiguar la vía biosintética por la que se podría hacer una biomolécula grande y compleja en una célula, tiene sentido comenzar con el producto terminado y luego trabajar mentalmente hacia atrás, desarmándolo paso a paso usando reacciones conocidas y familiares, hasta llegar a moléculas precursoras más simples. Empezar con una gran colección de posibles moléculas precursoras y tratar de juntar las adecuadas para hacer el producto objetivo sería una tarea formidable.
El análisis retrosintético, el concepto de desmantelar mentalmente una molécula paso a paso, hasta convertirse en precursores más pequeños y simples mediante reacciones conocidas, es una herramienta intelectual poderosa y ampliamente utilizada desarrollada por químicos orgánicos sintéticos. El enfoque también ha sido adaptado para su uso por químicos biológicos en esfuerzos por predecir vías por las cuales biomoléculas conocidas podrían sintetizarse (o degradarse) en seres vivos.
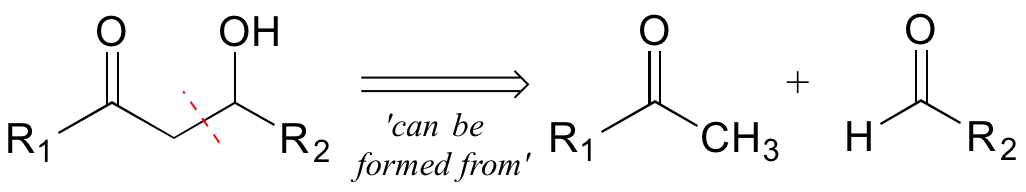
En la retrosíntesis, pensamos en una serie de reacciones a la inversa. Un paso químico hacia atrás (retro) está simbolizado por una flecha 'gruesa', comúnmente conocida como flecha retrosintética, y transmite visualmente la frase 'se puede formar a partir de'.

Considera un ejemplo sencillo, hipotético: partiendo de la molécula diana a continuación, ¿podemos llegar a una vía químicamente razonable a partir de los precursores indicados?
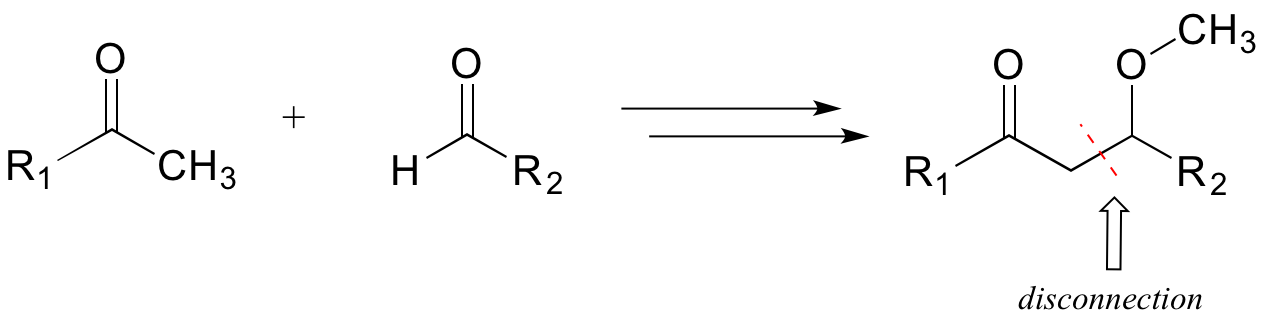
Un primer paso es identificar la desconexión relevante: un enlace clave (generalmente un enlace carbono-carbono) que debe formarse para hacer el producto objetivo a partir de precursores más pequeños. Buscamos en nuestra 'caja de herramientas' mental de tipos comunes de reacciones bioquímicas, y recordamos que es la única manera que conocemos (¡hasta ahora!) para hacer un nuevo enlace carbono-carbono es a través de una reacción de adición de aldol, que tiene lugar en un carbono alfa. Por lo tanto, podemos hacer una probable desconexión junto al carbono alfa en la molécula diana.
A continuación, debemos reconocer que la reacción de adición de aldol da como resultado una beta-hidroxicetona. ¡Pero nuestra molécula diana es beta- metoxicetona! Trabajando hacia atrás, nos damos cuenta de que el grupo beta-metoxi podría formarse a partir del grupo beta-hidroxi mediante una reacción de metilación SAM. Este es nuestro primer paso retrosintético (al revés).

El segundo paso retro (aldol) da cuenta de la desconexión que reconocimos anteriormente, y conduce a las dos moléculas precursoras.
Ahora, considere la transformación bioquímica más involucrada (pero aún hipotética) a continuación:
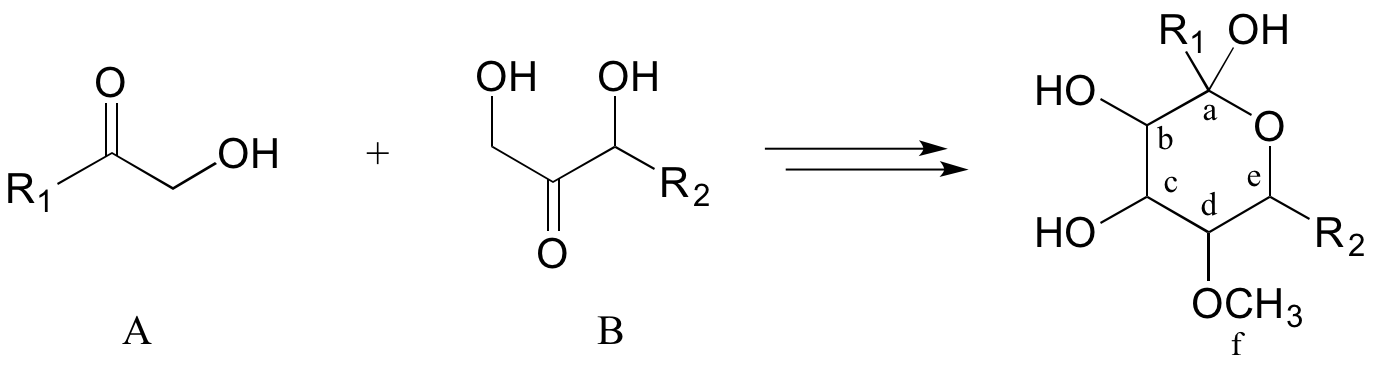
A menudo, lo mejor que se puede hacer primero en este tipo de problemas es contar los carbonos en los compuestos precursores y el producto, esto nos permite reconocer cuándo deben tenerse en cuenta en algún momento los carbonos adicionales de cada lado en nuestra solución. En este caso, se ha ganado un carbono (etiquetado 'f”) en forma de éter metílico en el producto. Esto es fácil de explicar: sabemos que la coenzima S-adenosil metionina (SAM) suele servir como donante del grupo metilo en reacciones enzimáticas de O - o N-metilación. Entonces, podemos proponer nuestro primer paso hacia atrás (retro): el producto como se muestra podría derivar de la metilación dependiente de SAM de un grupo alcohol en un intermedio propuesto I.
Paso retrosintético 1:
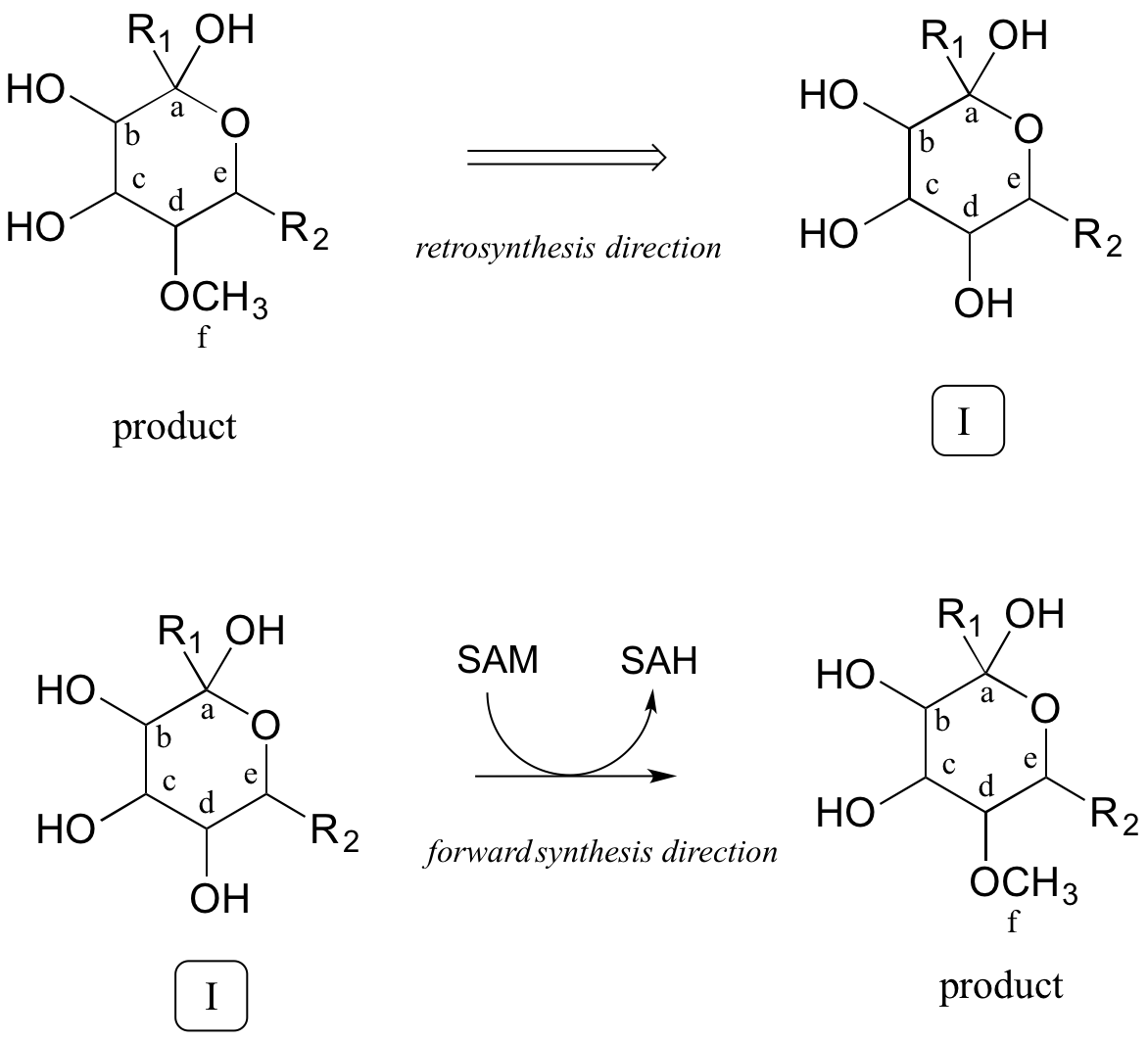
¿Cómo sabemos que el paso de metilación ocurre último? No, recuerden, estamos proponiendo una vía potencial, así que lo mejor que podemos hacer es proponer pasos que tengan sentido químico, y que ojalá puedan ser confirmados o invalidados posteriormente a través de la experimentación real. Por ahora, nos quedaremos con nuestra elección inicial para que el paso de metilación sea el último.
Ahora que hemos contabilizado el carbono extra, una cosa clave a reconocer respecto a la transformación en cuestión es que dos moléculas lineales se están combinando para formar un producto cíclico. Así, se necesitan hacer dos conexiones entre los reactivos A y B, una para unir los dos, la otra para cerrar el círculo. Nuestro trabajo principal en la dirección retro, entonces, es establecer en el producto los dos puntos de desconexión: en otras palabras, encontrar los dos vínculos en el producto que necesitan ser desmontados en nuestro análisis retrosintético. Mira de cerca el producto: ¿qué grupos funcionales ves? Con suerte, se pueden identificar dos grupos alcohol, un éter metílico y (críticamente) un hemicetal cíclico. Ya contabilizamos el éter metílico. Identificar el hemicetal cíclico es importante porque nos permite hacer nuestra próxima 'desconexión': sabemos cómo se forma un hemicetal a partir de una cetona y un alcohol, por lo que podemos trabajar mentalmente hacia atrás y predecir el intermedio II de cadena abierta que podría ciclarse para formar nuestro producto.

Ahora, comenzando con el grupo R1 y trabajando a lo largo de la cadena de carbono, podemos dar cuenta de los carbonos a-e en los dos precursores.
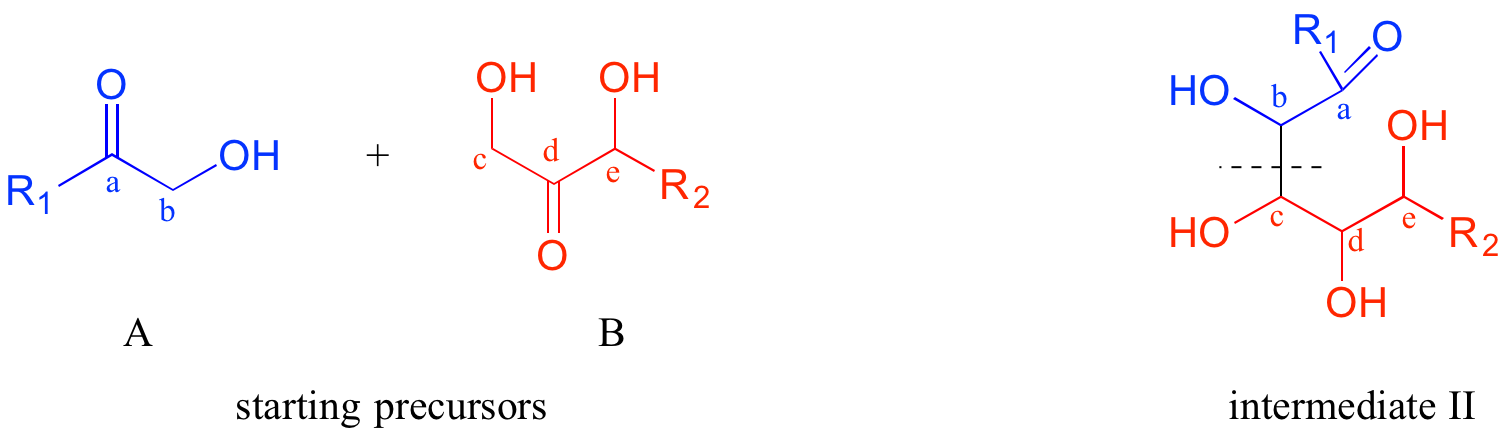
Así, la siguiente desconexión es entre los carbonos b y c. Aquí es donde realmente entra en juego nuestro dominio de la reactividad orgánica biológica: el OH en el carbono c del intermedio II está en la posición beta con respecto al carbono carbonílico a. Las reacciones de adición de aldol dan como resultado beta-hidroxi cetonas o aldehídos. Por lo tanto, podemos trabajar hacia atrás un paso más y predecir que nuestro intermedio II se formó a partir de una reacción de adición aldólica entre el intermedio III (como el nucleófilo) y la molécula precursora A (como el electrófilo).

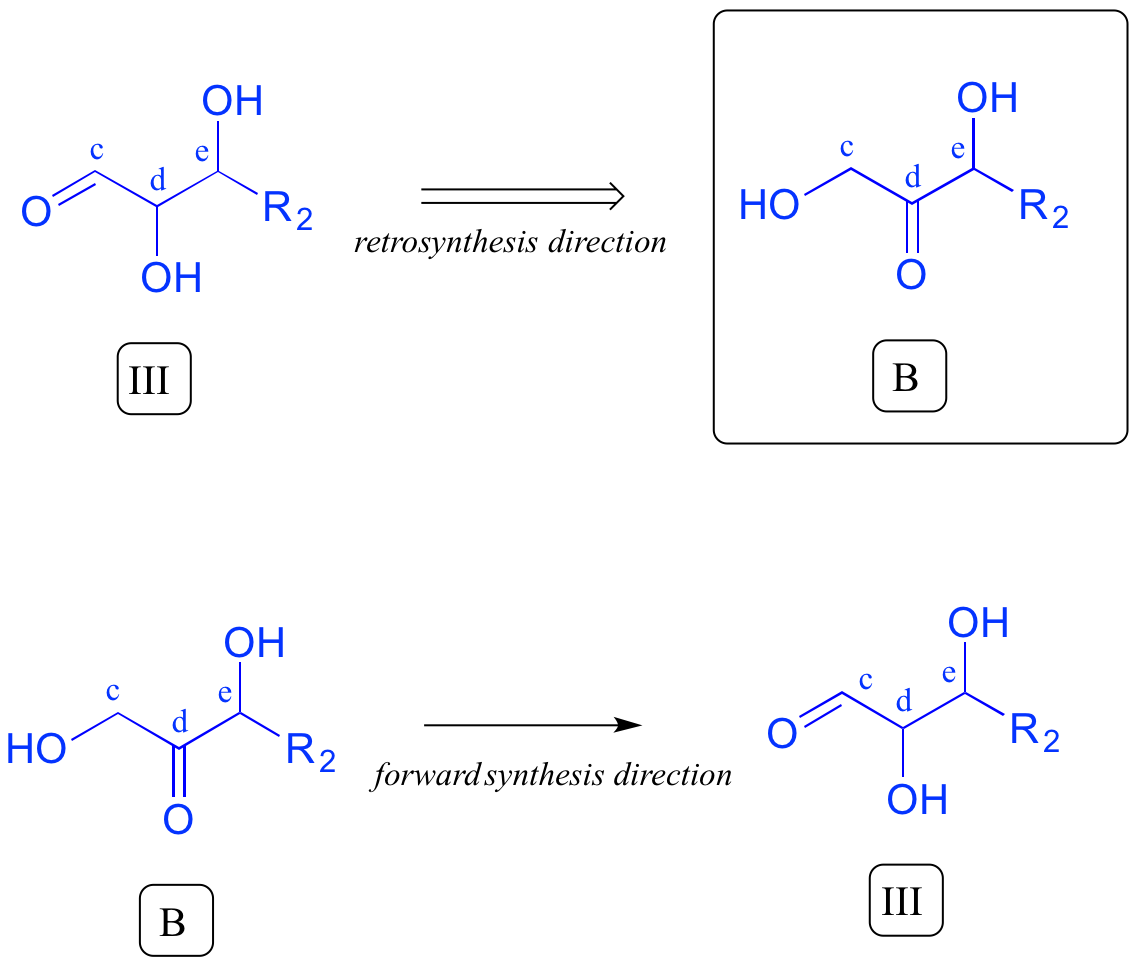
Estamos la mayor parte del camino a casa - hemos contabilizado con éxito dado precursor A. El intermedio III, sin embargo, no es precursor B. ¿Qué es diferente? Tanto III como B tienen un grupo carbonilo y dos grupos alcohol, pero el posicionamiento es diferente: III es un aldehído, mientras que B es una cetona. Piense de nuevo antes en este capítulo: el intermedio III podría formarse a partir de la isomerización del grupo carbonilo en el compuesto B. Ahora hemos dado cuenta de nuestro segundo precursor - ¡hemos terminado!
En la dirección hacia adelante, se puede escribir un diagrama de ruta completo de la siguiente manera:
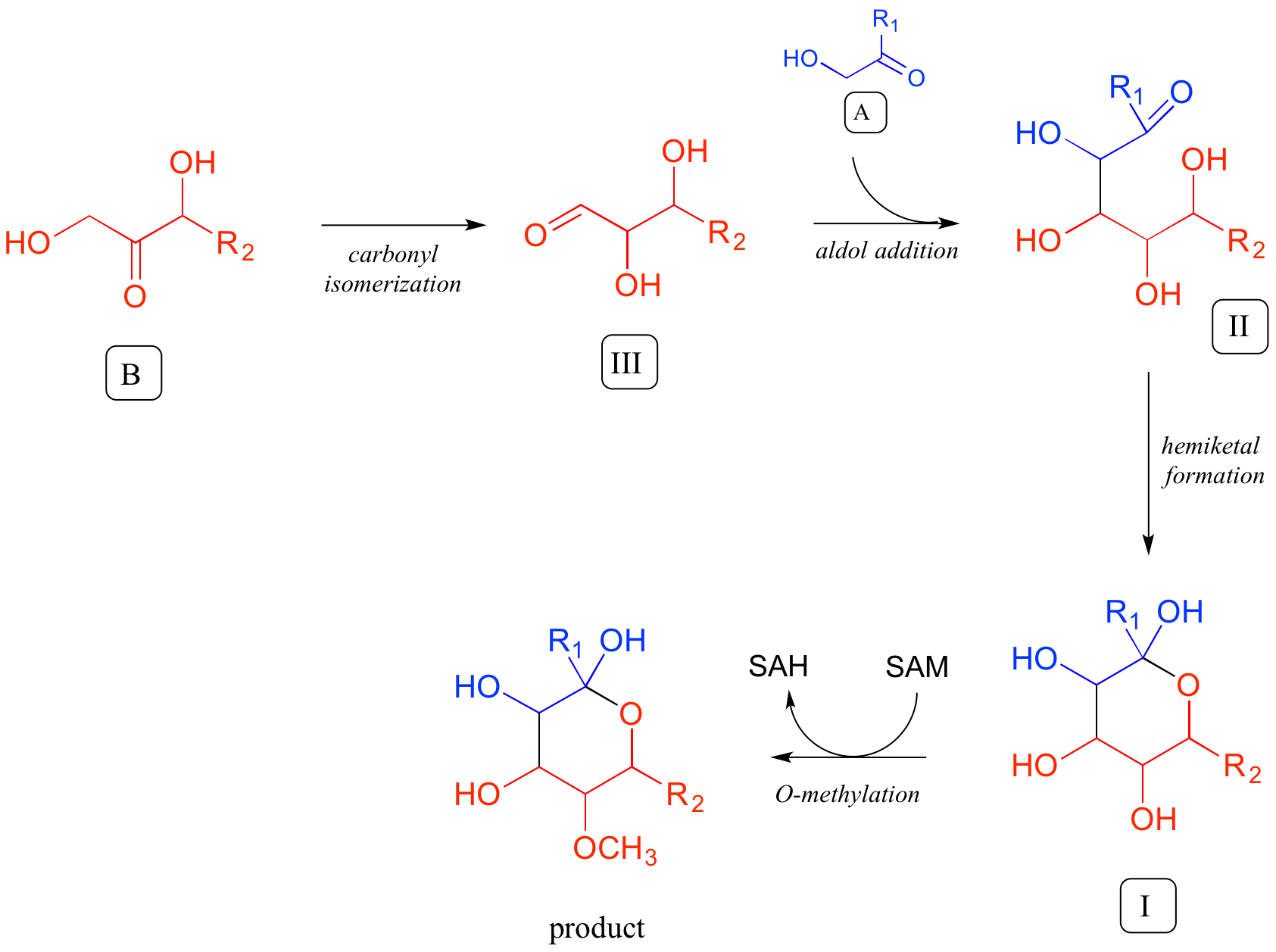
Un diagrama completo de 'retrosíntesis' para este problema se ve así:

Problemas de práctica para la retrosíntesis/predicción de vías


