1.6: Análisis de Combustión
- Page ID
- 152145
Objetivos de aprendizaje
Operar la Planta a 80% de capacidad quemando carbón para
- Realizar análisis de combustión para dos tipos de carbón,
- Comparar resultados.
Teoría
En el laboratorio de Eficiencia de Calderas, declaramos que la Eficiencia de Combustión se define como la relación entre la capacidad del quemador para quemar combustible completamente con el combustible no quemado y el exceso de aire en el escape. En este laboratorio, realizaremos un análisis de combustión.
Los combustibles fósiles pueden clasificarse en combustibles sólidos, líquidos y gaseosos. La gran mayoría de los combustibles se basan en carbono (C), hidrógeno (H 2) o alguna combinación de carbono e hidrógeno llamados hidrocarburos.
Durante la combustión, el oxígeno (O 2) se combina rápidamente con C, H 2, azufre (S2) y sus compuestos en combustibles sólidos, líquidos y gaseosos y da como resultado la liberación de energía. Excepto para aplicaciones especiales como la soldadura de oxiacetileno, en la que se requiere una llama de alta temperatura, el O 2 necesario para la combustión se obtiene del aire. El aire contiene O 2 y nitrógeno (N 2), más cantidades insignificantes de otros gases y para fines de ingeniería, puede considerarse que tiene la siguiente composición porcentual en masa:
O 2: 23%
N 2: 77%
Las proporciones en las que los elementos entran en la reacción de combustión en masa dependen de los pesos moleculares relativos como se muestra a continuación:
| Element | Símbolo | Peso molecular |
| Carbono | C | 12 |
| Azufre | S 2 | 32 |
| Hidrógeno | H 2 | 2 |
| Oxígeno | O 2 | 32 |
| Nitrógeno | N 2 | 28 |
Teoría de la combustión estequiométrica
La combustión completa de combustibles de hidrocarburos simples forma dióxido de carbono (C0 2) a partir del carbono y agua (H 2 0) del hidrógeno, por lo que para un combustible hidrocarbonado con la composición general C n H m, la ecuación de combustión en base molar es como flujos:
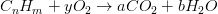
Donde el saldo debe satisfacerse siguiendo los moles para cualquier ecuación matemática:
Balance de carbono:
 kmol CO 2/kmol combustible
kmol CO 2/kmol combustible
Balance de hidrógeno:
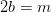
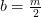 kmol H 2 O/ kmol combustible
kmol H 2 O/ kmol combustible
Balance de oxígeno:
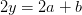
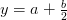 kmol O 2/kmol combustible
kmol O 2/kmol combustible
Considerando que la combustión ocurre en el aire más que en oxígeno puro, el nitrógeno en el aire puede reaccionar en el proceso de combustión para producir óxidos de nitrógeno. Además, algunos combustibles contienen elementos distintos al carbono, y estos elementos pueden reaccionar con el oxígeno durante la combustión. Además, la combustión no siempre es completa, y los gases de escape contienen productos no quemados y parcialmente quemados además de C0 2 y H 2 O.
El aire está compuesto por oxígeno, nitrógeno y pequeñas cantidades de dióxido de carbono, argón y otros componentes traza. Para efectos del cálculo posterior es perfectamente razonable considerar el aire como una mezcla de 21% (base molar) 02 y 79% (base molar) N 2. El nitrógeno será considerado como un gas “inerte” en los cálculos de combustión. La relación estequiométrica para la combustión completa de un combustible hidrocarbonado, C n H m, se convierte en
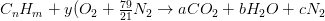
Las ecuaciones de balance son:
Balance de carbono:
 kmol CO 2/kmol combustible
kmol CO 2/kmol combustible
Balance de hidrógeno:
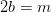
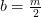 kmol H 2 O/ kmol combustible
kmol H 2 O/ kmol combustible
Balance de oxígeno:
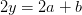
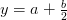 kmol O 2/kmol combustible
kmol O 2/kmol combustible
Balance de nitrógeno:
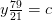 kmol N 2 /kmol combustible
kmol N 2 /kmol combustible
Las composiciones de gases de combustión se presentan en términos de fracciones molares como kmol de producto por kmol de combustible.
Ejemplo 1. Combustión de Octano en Aire
Determinar la relación estequiométrica aire/masa combustible y la composición del gas producto para la combustión de octano (C 8 H 18) en el aire.
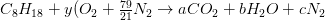
Balance de carbono:
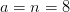 kmol CO 2/kmol combustible
kmol CO 2/kmol combustible
Balance de hidrógeno:
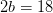
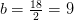 kmol H 2 O/ kmol combustible
kmol H 2 O/ kmol combustible
Balance de oxígeno:
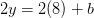
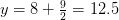 kmol O 2/kmol combustible
kmol O 2/kmol combustible
Balance de nitrógeno:
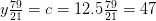 kmol N 2 /kmol combustible
kmol N 2 /kmol combustible
La ecuación de combustión se convierte en:
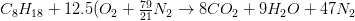
Relación aire/masa combustible considerando que 1 kmol de combustible es 114 kg de combustible (8*12 + 18 * (1) = 114):
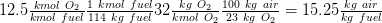
La composición de los gases de combustión en base molar es:
Número total de kmol de gases de combustión = kmol CO 2 + kmol H 2 O + kmol N 2 = 8 +9+ 47 = 64 kmol de gases de humo/ kmol combustible
CO 2 = 8/64 = 12.5%
H 2 O = 9/64 = 14%
N 2 = 47/64 = 73.5%
Otros componentes e impurezas en el combustible hacen que el proceso de cálculo sea más complicado. Por ejemplo, si el azufre existe en el combustible suele ser quemado en dióxido de azufre (SO 2). La ceniza, las impurezas inorgánicas (minerales) no combustibles en el combustible, sufre una serie de transformaciones a las temperaturas de combustión, serán descuidadas en el cálculo posterior (se supondrá que la ceniza es inerte).
Para la mayoría de los combustibles sólidos y líquidos, la composición química es en base a masa, como se determina en el análisis final.
Química de combustión basada en masa
Las reacciones de combustión se escriben siguiendo las reglas estequiométricas definidas anteriormente. La cantidad de materia que entra en una reacción es igual a la cantidad de materia en los productos de la reacción.
La reacción para la combustión completa de C puede escribirse de la siguiente manera:
C+O 2 =CO 2
o, si se utilizan pesos moleculares,
12+32=44
1 kg C + 2⅔ kg O 2 = 3⅔ kg CO 2
La combustión completa de H 2 ocurre de la siguiente manera:
2H 2 +O 2 =2H 2 O
4+32=36
1 kg H 2 + 8 kg O 2 = 9 kg H 2 O
El azufre se quema de la siguiente manera:
S +O 2 =SO 2
32+32=64
1 kg S + 1 kg O 2 = 2 kg SO 2
Además, 1 kg de O 2 (masa estequiométrica de O 2) está contenido en 1/0.232=4.3 kg de aire que es la masa estequiométrica de aire. Este aire contendrá 4.3-1=3.3 kg N 2. Por lo tanto podemos escribir:
1 kg S + 4.3 kg aire = 2 kg SO 2 +3.3 kg N 2
Procedimiento
Si el análisis del combustible viene dado por masa, siga los siguientes pasos:
- Total O 2 requerido: Determinar la masa de O 2 requerida para cada constituyente y encontrar la masa total de O 2 (Restar cualquier O 2 que pueda estar en el combustible)
- Aire estequiométrico: Masa estequiométrica de aire = O 2 requerido/0.232
- Masa total de productos de combustión: Determinar el% de masa de cada producto de combustión. Por ejemplo, dado el contenido de C de 84.9%, CO 2 =84.9/100*2= 3.11% y encontrar la masa total de productos de combustión.
- Análisis de los productos de combustión por masa: Supongamos que la masa total de los productos de combustión en la etapa 3 se ha encontrado como 12.09 kg/kg de combustible, luego CO 2 =3.11/12.09*100=25.74. Esto significa que 25.74% del gas de combustión es CO 2. Repita este cálculo para cada constituyente.
Instrucciones de laboratorio
Ejecutar la condición inicial I14 80% Carbón y configurar tendencias para las siguientes variables:
X00820 X00821 X00822 X00823 X00824 E23356
G02196 G02197 X32419 X02419 G00831 H00830
- Quema de carbón por defecto: Después de 10 minutos de ejecutar el simulador, congelar el simulador e imprimir las dos tendencias. Este es el punto de referencia para el siguiente paso.
- Quema de carbón de mala calidad: Cambie al modo de ejecución y acceda a la página de Lista Variable 0111 en MD180. Establezca los nuevos valores como se muestra a continuación. Después de 10 minutos, congele el simulador e imprima las dos tendencias.
- X00820:70.40
- X00821:5.10
- X00822:1.10
- X00823:12.50
- X00824:1.60
- X00825:9.30
- Cálculo: Calcule los siguientes valores para ambos tipos de combustibles:
- Total O 2 requerido
- Aire estequiométrico
- Masa total de productos de combustión
- Análisis de productos de combustión en masa [%]: CO 2, H 2 O, SO 2, N 2
- Comparación: Compare sus hallazgos con base en los siguientes datos:
- Salida del horno SO x flujo
- Salida del horno NO x flujo
- Contenido de CO en los gases de combustión
- Contenido de oxígeno en los gases de combustión
- Aire de combustión teórica
- Valor calorífico del carbón
Sugerencias y consejos
En este laboratorio, se están realizando dos análisis de combustión. Para la recolección de datos, configura tus tendencias, a continuación se muestra una gráfica de tendencias de muestra (asegúrate de que tus impresiones de tendencias estén etiquetadas correctamente de lo contrario, el análisis de datos será muy confuso):
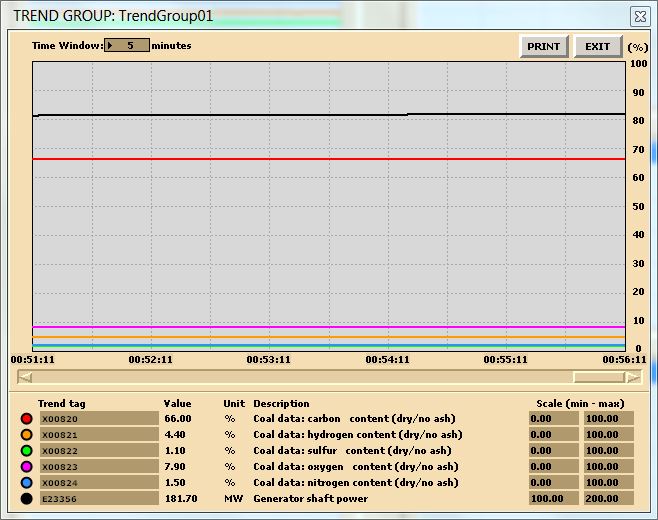
Datos de muestra para carbón
Para cambiar la composición del combustible usa la Lista de Variables Página#: 0111 en MD180:

Composición química del carbón
Entregables
Su informe de laboratorio debe incluir lo siguiente:
- Parcelas de tendencia: Abastecer todas las parcelas tomadas para cada uno de los 2 combustibles,
- Cálculo: Según las instrucciones de laboratorio anteriores, realice análisis de combustión utilizando MATLAB o MS Excel.
- Conclusión: Escriba un resumen (máx. 500 palabras, en un cuadro de texto si usa Excel) comparando sus resultados y sugerencias para un estudio posterior.
Lectura adicional:
- Ingeniería Básica Termodinámica en Unidades SI por R. Joel: Combustión.
- Ingeniería Térmica por H.L. Solberg, O.C. Cromer y A.R. Spalding: Los combustibles fósiles y su combustión.


