2.3: Valencia y Estructura Cristalina
- Page ID
- 153705
Por ejemplo, los elementos del grupo I: Li, Na, K, Cu, Ag y Au tienen un solo electrón de valencia. (Figura abajo) Todos estos elementos tienen propiedades químicas similares. Estos átomos delatan fácilmente un electrón para reaccionar con otros elementos. La capacidad de regalar fácilmente un electrón hace que estos elementos sean excelentes conductores.
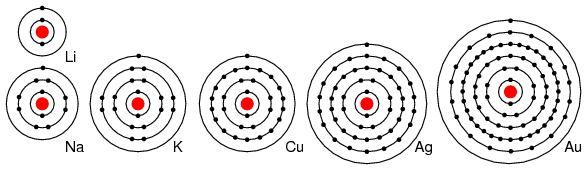
Elementos del grupo IA de la tabla periódica: Li, Na y K, y los elementos del grupo IB: Cu, Ag y Au tienen un electrón en el caparazón exterior, o valencia, que se dona fácilmente. Electrones de cáscara interna: Para n= 1, 2, 3, 4; 2n 2 = 2, 8, 18, 32.
Elementos del grupo VIIA: Fl, Cl, Br y yo tenemos 7 electrones en la capa externa. Estos elementos aceptan fácilmente un electrón para llenar la capa exterior con 8 electrones completos. (Figura abajo) Si estos elementos aceptan un electrón, se forma un ion negativo a partir del átomo neutro. Estos elementos que no renuncian a los electrones son aisladores.
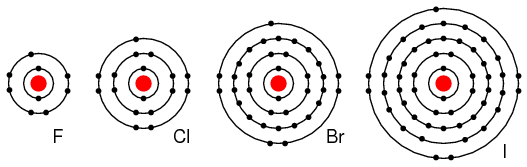
Elementos del grupo VIIA de la tabla periódica: F, Cl, Br e I con 7 electrones de valencia aceptan fácilmente un electrón en reacciones con otros elementos.
Por ejemplo, un átomo de Cl acepta un electrón de un átomo de Na para convertirse en un ion Cl - como se muestra en la Figura a continuación. Un ion es una partícula cargada formada a partir de un átomo donando o aceptando un electrón. A medida que el átomo de Na dona un electrón, se convierte en un ion Na +. Es así como los átomos de Na y Cl se combinan para formar NaCl, sal de mesa, que en realidad es Na + Cl -, un par de iones. El Na + y el Cl - que llevan cargas opuestas, se atraen entre sí.
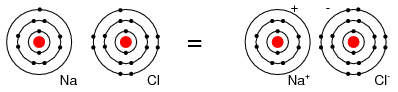
El átomo de sodio neutro dona un electrón al átomo de cloro neutro formando iones Na + y Cl -.
El cloruro de sodio cristaliza en la estructura cúbica que se muestra en la Figura a continuación. Este modelo no está a escala para mostrar la estructura tridimensional. Los iones Na + Cl - en realidad están empaquetados de manera similar a capas de canicas apiladas. La estructura cristalina cúbica fácilmente dibujada ilustra que un cristal sólido puede contener partículas cargadas.
Elementos del grupo VIIIA: He, Ne, Ar, Kr, Xe tienen todos 8 electrones en la concha de valencia. (Figura abajo) Es decir, el caparazón de valencia es completo, lo que significa que estos elementos no donan ni aceptan electrones. Tampoco participan fácilmente en reacciones químicas ya que los elementos del grupo VIIIA no se combinan fácilmente con otros elementos. En los últimos años los químicos han obligado a Xe y Kr a formar algunos compuestos, sin embargo para los fines de nuestra discusión esto no es aplicable. Estos elementos son buenos aislantes eléctricos y son gases a temperatura ambiente.
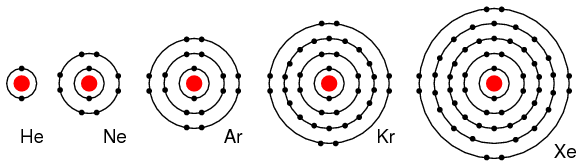
Elementos del grupo VIIIA: He, Ne, Ar, Kr, Xe son en gran parte no reactivos ya que el caparazón de valencia está completo.
Elementos del grupo IVA: C, Si, Ge, que tienen 4 electrones en la cubierta de valencia como se muestra en la Figura a continuación forman compuestos al compartir electrones con otros elementos sin formar iones. Este enlace electrónico compartido se conoce como enlace covalente. Tenga en cuenta que el átomo central (y los otros por extensión) han completado su caparazón de valencia al compartir electrones. Tenga en cuenta que la figura es una representación 2-d de unión, que en realidad es 3-d. Es este grupo, IVA, el que nos interesa por sus propiedades semiconductoras.
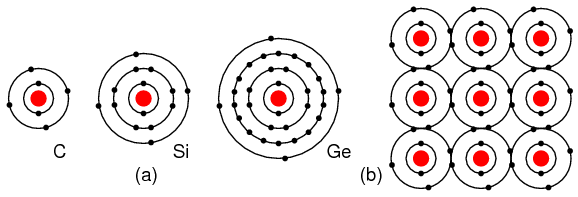
(a) Elementos del grupo IVA: C, Si, Ge que tienen 4 electrones en la capa de valencia, (b) completan la capa de valencia compartiendo electrones con otros elementos.
Estructura cristalina: La mayoría de las sustancias inorgánicas forman sus átomos (o iones) en una matriz ordenada conocida como cristal. Las nubes externas de electrones de los átomos interactúan de manera ordenada. Incluso los metales están compuestos por cristales a nivel microscópico. Si a una muestra de metal se le da un pulimento óptico, luego se graba con ácido, la estructura microcristalina microscópica se muestra como en la Figura a continuación. También es posible adquirir, a un costo considerable, especímenes metálicos monocristalinos de proveedores especializados. El pulido y grabado de tal espécimen no revela ninguna estructura microcristalina. Prácticamente todos los metales industriales son policristalinos. La mayoría de los semiconductores modernos, por otro lado, son dispositivos de cristal único. Nos interesan principalmente las estructuras monocristalinas.
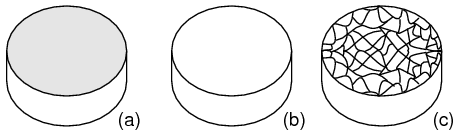
(a) Muestra de metal, (b) pulida, (c) grabada con ácido para mostrar estructura microcristalina.
Muchos metales son blandos y se deforman fácilmente por las diversas técnicas de trabajo del metal. Los microcristales se deforman en el trabajo del metal. Además, los electrones de valencia son libres de moverse alrededor de la red cristalina, y de cristal a cristal. Los electrones de valencia no pertenecen a ningún átomo en particular, sino a todos los átomos.
La estructura cristalina rígida en la Figura siguiente está compuesta por un patrón repetitivo regular de iones Na positivos e iones Cl negativos. Los átomos de Na y Cl forman iones Na + y Cl - mediante la transferencia de un electrón de Na a Cl, sin electrones libres. Los electrones no son libres de moverse por la red cristalina, una diferencia en comparación con un metal. Tampoco los iones están libres. Los iones se fijan en su lugar dentro de la estructura cristalina. Sin embargo, los iones son libres de moverse si el cristal de NaCl se disuelve en agua. Sin embargo, el cristal ya no existe. La estructura regular y repetitiva se ha ido. La evaporación del agua deposita los iones Na + y Cl - en forma de nuevos cristales a medida que los iones cargados opuestos se atraen entre sí. Los materiales iónicos forman estructuras cristalinas debido a la fuerte atracción electrostática de los iones con carga opuesta.
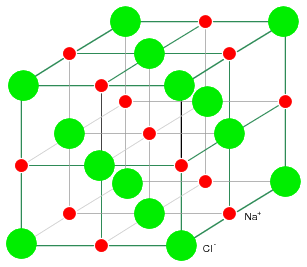
Cristal de NaCl que tiene una estructura cúbica.
Los semiconductores del Grupo 14 (anteriormente parte del Grupo IV) forman un patrón de enlace tetraédrico utilizando los electrones orbitales s y p alrededor del átomo, compartiendo enlaces de pares de electrones con cuatro átomos adyacentes. (Figura a continuación (a)). Los elementos del grupo 14 tienen cuatro electrones externos: dos en un s-orbital esférico y dos en orbitales p. Uno de los orbitales p está desocupado. Los tres orbitales p se hibridan con el orbital s para formar cuatro orbitales moleculares sp 3. Estas cuatro nubes de electrones se repelen entre sí a un espaciamiento tetraédrico equidistante alrededor del átomo de Si, atraídas por el núcleo positivo como se muestra en la Figura a continuación.
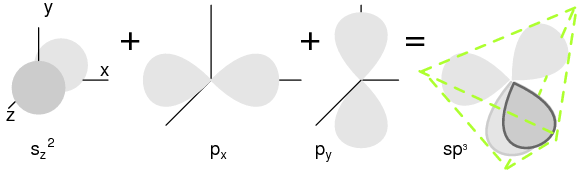
Se hibridan uno s-orbital y tres electrones p-orbitales, formando cuatro orbitales moleculares sp 3.
Cada átomo semiconductor, Si, Ge o C (diamante) está unido químicamente a otros cuatro átomos por enlaces covalentes, enlaces electrónicos compartidos. Dos electrones pueden compartir un orbital si cada uno tiene números cuánticos de espín opuestos. Así, un electrón desapareado puede compartir un orbital con un electrón de otro átomo. Esto corresponde a la superposición de la Figura a continuación (a) de las nubes de electrones, o unión. La figura a continuación (b) es una cuarta parte del volumen de la celda unitaria de estructura cristalina de diamante que se muestra en la figura a continuación en el origen. Los enlaces son particularmente fuertes en el diamante, disminuyendo en fuerza bajando el grupo IV a silicio y germanio. El silicio y el germanio forman cristales con una estructura de diamante.
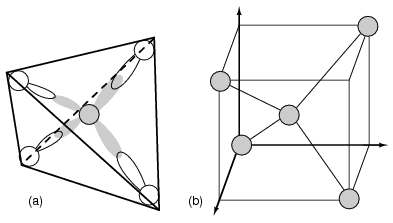
(a) Enlace tetraédrico del átomo de Si. (b) conduce a 1/4 de la celda de unidad cúbica
La celda unitaria de diamante es el bloque básico de construcción de cristal. La siguiente figura muestra cuatro átomos (oscuros) unidos a otros cuatro dentro del volumen de la celda. Esto equivale a colocar uno de la Figura arriba (b) en el origen de la Figura a continuación, colocar tres más en caras adyacentes para llenar el cubo completo. Seis átomos caen en la mitad de cada una de las seis caras cúbicas, mostrando dos enlaces. Los otros dos enlaces a cubos adyacentes se omitieron para mayor claridad. De ocho esquinas cúbicas, cuatro átomos se unen a un átomo dentro del cubo. ¿Dónde están unidos los otros cuatro átomos? Los otros cuatro se unen a cubos adyacentes del cristal. Tenga en cuenta que a pesar de que cuatro átomos de esquina no muestran enlaces en el cubo, todos los átomos dentro del cristal están unidos en una molécula gigante. Un cristal semiconductor se construye a partir de copias de esta celda unitaria.
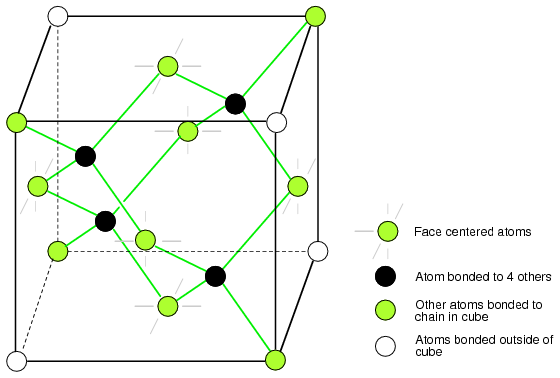
Si, Ge y C (diamante) forman un cubo centrado en la cara intercalado.
El cristal es efectivamente una molécula. Un átomo se une covalentemente a otros cuatro, que a su vez se unen a otros cuatro, y así sucesivamente. La red cristalina es relativamente rígida resistiendo la deformación. Pocos electrones se liberan para la conducción alrededor del cristal. Una propiedad de los semiconductores es que una vez que se libera un electrón, se desarrolla un espacio vacío cargado positivamente que también contribuye a la conducción.
REVISIÓN
- Los átomos intentan formar una capa externa completa, de valencia, de 8 electrones (2 electrones para la capa más interna). Los átomos pueden donar algunos electrones para exponer un caparazón subyacente de 8, aceptar algunos electrones para completar un caparazón o compartir electrones para completar un caparazón.
- Los átomos a menudo forman matrices ordenadas de iones o átomos en una estructura rígida conocida como cristal.
- Un átomo neutro puede formar un ion positivo donando un electrón.
- Un átomo neutro puede formar un ion negativo aceptando un electrón
- Los semiconductores del grupo IVA: C, Si, Ge cristalizan en una estructura diamantada. Cada átomo en el cristal es parte de una molécula gigante, uniéndose a otros cuatro átomos.
- La mayoría de los dispositivos semiconductores están fabricados a partir de monocristales


