5: Flujos y Ciclos de Nutrientes
( \newcommand{\kernel}{\mathrm{null}\,}\)
Objetivos de aprendizaje
Después de completar este capítulo, podrás
- Explica qué son los nutrientes y da ejemplos.
- Discutir el concepto de ciclo de nutrientes y describir compartimientos y flujos importantes.
- Describir los factores que afectan el desarrollo de los principales tipos de suelo.
- Describir los ciclos de carbono, nitrógeno, fósforo y azufre.
Nutrientes
Los nutrientes son cualquier producto químico que se necesite para el correcto funcionamiento de los organismos. Podemos distinguir dos tipos básicos de nutrientes: (1) químicos inorgánicos que los organismos autótrofos requieren para la fotosíntesis y el metabolismo, y (2) compuestos orgánicos ingeridos como alimento por organismos heterótrofos. Este capítulo trata sobre los nutrientes inorgánicos.
Las plantas absorben una amplia gama de nutrientes inorgánicos de su entorno, típicamente como compuestos simples. Por ejemplo, la mayoría de las plantas obtienen su carbono como dióxido de carbono gaseoso (CO 2) de la atmósfera, su nitrógeno como los iones (moléculas cargadas) nitrato (NO 3 —) o amonio (NH 4 +), su fósforo como fosfato (PO 4 3—), y su calcio y magnesio como iones simples (Ca 2+ y Mg 2+). Los iones se obtienen en forma disuelta en el agua del suelo absorbida por las raíces de las plantas. Las plantas utilizan estos diversos nutrientes en la fotosíntesis y otros procesos metabólicos para fabricar todos los bioquímicos que necesitan para su crecimiento y reproducción.
Algunos nutrientes inorgánicos, denominados macronutrientes, son necesarios por las plantas en cantidades relativamente grandes. Estos son carbono, oxígeno, hidrógeno, nitrógeno, fósforo, potasio, calcio, magnesio y azufre. El carbono y el oxígeno se requieren en las mayores cantidades porque el carbono típicamente comprende aproximadamente el 50% del peso seco de la biomasa vegetal y el oxígeno algo menos. El hidrógeno representa aproximadamente 6% de la biomasa vegetal seca, mientras que el nitrógeno y el potasio ocurren en concentraciones de 1-2% y las de calcio, fósforo, magnesio y azufre son 0.1-0.5%. Los micronutrientes son necesarios en cantidades mucho menores, e incluyen boro, cloro, cobre, hierro, manganeso, molibdeno y zinc. Cada uno de estos representa menos de 0.01% de la biomasa vegetal y tan poco como unas pocas partes por millón (ppm, o 10—6; 1 ppm equivale a 0.0001%; ver Apéndice A).

Los heterótrofos obtienen los nutrientes que requieren de los alimentos que consumen, los cuales pueden ser biomasa vegetal (en el caso de un herbívoro), otros heterótrofos (carnívoros), o ambos (omnívoros). La biomasa ingerida contiene nutrientes en diversas formas unidas orgánicamente. Los animales digieren las formas orgánicas de los nutrientes en su intestino y las asimilan como simples compuestos orgánicos o inorgánicos, que utilizan para sintetizar sus propios bioquímicos necesarios a través de diversos procesos metabólicos.
Flujos y ciclos de nutrientes
Aunque la Tierra gana pequeñas cantidades de material a través de impactos de meteoritos, estas entradas extraterrestres son insignificantes en comparación con la masa del planeta. Esencialmente, a nivel global, la Tierra es un sistema aislado en términos de materia. Como consecuencia de este hecho, los nutrientes y otros materiales “ciclan” dentro y entre ecosistemas. En contraste, la energía siempre “fluye a través” de los ecosistemas y la biosfera (Capítulo 4). El ciclo de nutrientes se refiere a las transferencias, transformaciones químicas y reciclaje de nutrientes en los ecosistemas. Un presupuesto de nutrimentos es una estimación cuantitativa (numérica) de las tasas de entrada y salida de nutrientes hacia y desde un ecosistema, así como las cantidades presentes y transferidas dentro del sistema.
Los principales elementos de un ciclo nutritivo se muestran en la Figura 5.1. El límite exterior del diagrama define los límites de un ecosistema. (Incluso podría representar toda la biosfera, en cuyo caso no habría entradas ni salidas del sistema). En estudios ecológicos, el sistema a menudo se define como un paisaje particular, lago o cuenca hidrográfica (una cuenca terrestre de la que el agua drena en un arroyo o lago). Cada uno de estos sistemas cuenta con entradas y salidas de nutrientes, cuyas tasas se pueden medir.
Las cajas dentro del límite representan compartimentos, cada uno de los cuales almacena una cantidad de material. Los tamaños de los compartimentos se expresan típicamente en unidades de masa por unidad de área superficial. Ejemplos de tales unidades son kilogramos por hectárea (kg/ha) o toneladas por hectárea (t/ha). En estudios acuáticos, los tamaños de los compartimentos pueden expresarse por unidad de volumen de agua (como g/m 3). Las flechas en el diagrama representan flujos, o transferencias de material entre compartimentos. Los fundentes son funciones de velocidad y se miden en términos de masa por área por tiempo (por ejemplo, kg/ha-año).
El sistema se puede dividir en cuatro compartimentos principales:
- La atmósfera consiste en gases y pequeñas concentraciones de partículas suspendidas y vapor de agua.
- Las rocas y el suelo consisten en minerales insolubles que no están directamente disponibles para su absorción por los organismos.
- Los nutrientes disponibles están presentes en formas químicas que son solubles en agua hasta cierto punto, por lo que pueden ser absorbidos por los organismos de su entorno y contribuir a su nutrición mineral.
- El compartimento orgánico consiste en nutrientes presentes dentro de la materia orgánica viva y muerta. Este compartimento se puede dividir en tres grupos funcionales: (a) biomasa viva de autótrofos como plantas, algas y bacterias autótrofas, (b) heterótrofos vivos incluyendo herbívoros, carnívoros, omnívoros y detrívoros, y (c) y todas las formas de materia orgánica muerta.
Las principales transferencias de material entre compartimentos, o fundentes, también se muestran en la Figura 5.1. Estas son vías de transferencia importantes dentro de los ciclos de nutrientes. Por ejemplo, las formas insolubles de nutrientes en las rocas y el suelo están disponibles para su absorción por los organismos a través de diversas transformaciones químicas, como la meteorización, que hacen que los nutrientes sean solubles en agua. Esto se invierte por reacciones que producen compuestos insolubles a partir de los solubles. Estas últimas reacciones forman minerales secundarios como carbonatos (por ejemplo, piedra caliza, CaCo 3 y dolomita, MgCO 3), óxidos de hierro y aluminio (Fe 2 O 3 y Al (OH) 3), sulfuros (por ejemplo, sulfuro de hierro, FeS 2) y otros compuestos que son no disponible directamente para la absorción biológica.
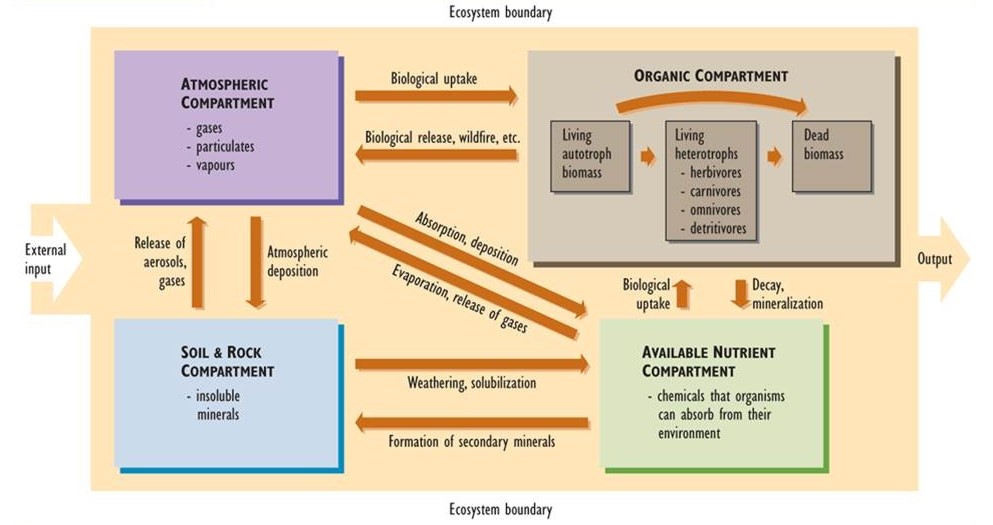
Otros flujos en los ciclos de nutrientes incluyen la absorción biológica de nutrientes de la atmósfera o de la piscina disponible en el suelo. Por ejemplo, el follaje de las plantas asimila dióxido de carbono (CO 2) del aire, y las raíces absorben iones nitrato (NO 3 —) y amonio (NH 4 +) disueltos en el agua del suelo. Luego, las plantas fijan metabólicamente estos nutrientes en su biomasa en crecimiento. Los nutrientes orgánicos pueden entonces ingresar a la red alimentaria y eventualmente se depositan como biomasa muerta. Los nutrientes orgánicos en la biomasa muerta se reciclan a través de la descomposición y mineralización, los cuales regeneran el suministro de nutrientes disponibles.
Estos conceptos se examinan con más detalle en los siguientes apartados. Inicialmente, examinamos el ecosistema del suelo, que es donde la mayoría de los ciclos de nutrientes ocurren dentro de los hábitats terrestres. Luego examinaremos aspectos clave del ciclo de carbono, nitrógeno, fósforo y azufre.
El ecosistema del suelo
El suelo es una mezcla compleja y variable de roca fragmentada, materia orgánica, humedad, gases y organismos vivos que cubre casi todos los paisajes terrestres. El suelo proporciona soporte mecánico para el cultivo, incluso para árboles de hasta 100 m. El suelo también almacena agua y nutrientes para su uso por las plantas y proporciona hábitat para los muchos organismos que están activos en la descomposición de la biomasa muerta y el reciclaje de su contenido de nutrientes. El suelo es un componente de todos los ecosistemas terrestres, pero también es en sí mismo un ecosistema dinámico.
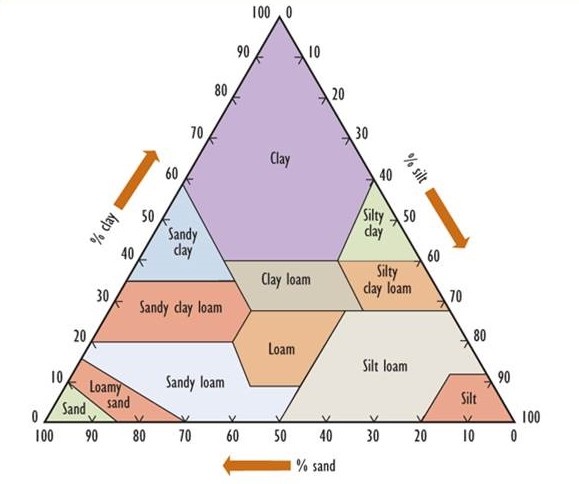
El suelo se desarrolla durante largos periodos de tiempo hacia una condición madura. Fundamentalmente, el suelo se deriva de un llamado material padre, que consiste en rocas y minerales que se encuentran a un metro más o menos de la superficie. Los materiales parentales en la mayor parte de Canadá se depositaron a través de procesos glaciales., a menudo como una mezcla compleja conocida como till, que contiene fragmentos de roca de varios tamaños y mineralogía. En algunas zonas, sin embargo, los materiales parentales se depositaron bajo inmensos lagos interiores, generalmente en tiempos posglaciales. Tales lugares son típicamente planos y tienen suelos uniformes de grano fino que varían en textura desde arcilla hasta arena. (Las partículas de arcilla tienen un diámetro menor a 0.002 mm, mientras que el limo varía de 0.002 a 0.05 mm, arena de 0.05 a 2 mm, grava de 2 a 20 mm, y grava gruesa y escombros son mayores de 20 mm.) La Figura 5.2 presenta una clasificación textural del suelo basada en el porcentaje de partículas del tamaño de arcilla, limo y arena.
Figura 5.2. Una Clasificación Textural de Suelos. La composición porcentual de partículas del tamaño de arcilla, limo y arena se utiliza para clasificar los suelos en los 12 tipos principales que se muestran. Fuente: Modificado de Foth (1990).
En otras regiones, los materiales progenitores conocidos como loess se derivan del limo que fue transportado por el viento desde otros lugares. Debido a su tamaño de partícula muy pequeño, el suelo rico en arcilla tiene una enorme superficie, lo que le confiere importantes propiedades químicas como la capacidad de unir muchos iones nutritivos.
Las características del material parental tienen una influencia importante en el tipo de suelo que eventualmente se desarrolla. Sin embargo, el desarrollo del suelo también se ve profundamente afectado por procesos biológicos y factores climáticos como la precipitación y la temperatura.
Por ejemplo, el agua de la precipitación disuelve ciertos minerales y lleva los iones resultantes hacia abajo. Este proceso, conocido como lixiviación, modifica la química y mineralogía tanto de la superficie como de las partes más profundas del suelo. Además, los insumos de hojarasca (biomasa muerta) de las plantas incrementan el contenido de materia orgánica en el suelo. La hojarasca fresca es un sustrato alimenticio para muchas especies que se descomponen de animales que habitan en el suelo, hongos y bacterias. Estos organismos eventualmente oxidan los desechos orgánicos en dióxido de carbono, agua y nutrientes inorgánicos como el amonio, aunque algunos materiales permanecen como materia orgánica compleja, conocida como humus. A medida que los suelos se desarrollan, asumen una estratificación vertical conocida como perfil de suelo, que tiene capas reconocibles conocidas como horizontes. Desde la superficie hacia abajo, los principales horizontes de un perfil de suelo bien desarrollado son los siguientes:
El suelo que ha sido modificado por influencias humanas puede estratificarse de manera diferente. En tierras cultivadas, por ejemplo, se desarrolla en la superficie una capa de arado homogénea (A p) de 15-20 cm. La capa de arado es de estructura uniforme porque se ha mezclado repetidamente durante muchos años. Además, el suelo de las tierras agrícolas suele ser deficiente en materia orgánica, compactado por el paso repetido de maquinaria pesada, y degradado en estructura, concentración de nutrientes y otras cualidades importantes para su capacidad de sustentar la productividad de los cultivos. Estos temas se examinan con más detalle en los Capítulos 14 y 24.

En términos generales, el suelo dentro de un tipo particular de ecosistema, como la tundra, el bosque de coníferas, el bosque de frondosas o la pradera, tiende a desarrollarse de una manera distintiva. Los suelos se clasifican por las condiciones ecológicas bajo las cuales se desarrollaron. El nivel más alto de clasificación organiza los suelos en grupos llamados órdenes, que a su vez pueden dividirse en conjuntos más detallados. Los órdenes de suelo más importantes en Canadá son:

La importancia del suelo
El ecosistema del suelo es extremadamente importante. Las plantas terrestres obtienen su agua y gran parte de los nutrientes que necesitan del suelo, absorbiéndolas a través de sus raíces. El suelo también proporciona hábitat para una gran diversidad de animales y microorganismos que juegan un papel crucial en la descomposición de la hojarasca y el ciclo de nutrientes.
El suelo es económicamente importante porque influye críticamente en los tipos de cultivos agrícolas que se pueden cultivar (este tema se examina en el Capítulo 14). Algunos de los suelos agrícolas más productivos son los depósitos aluviales que se encuentran a lo largo de los ríos y sus deltas, donde las inundaciones periódicas y la deposición de limo aportan abundantes suministros de nutrientes. Mientras no sean demasiado pedregosos, el chernozem y el brunisol también son fértiles y útiles para la agricultura. Gran parte de la agricultura de pradera se desarrolla en suelos chernozem, mientras que gran parte de la fértil tierra agrícola del sur de Quebec y Ontario tiene tipos de brunisol.
El ciclo del carbono
El carbono es uno de los componentes básicos de la vida y el elemento más abundante en los organismos, representando aproximadamente la mitad de la biomasa seca típica. Los aspectos clave del ciclo global del carbono se presentan en la Figura 5.3 (véanse también el Capítulo 17 y la Figura 17.1). El dióxido de carbono gaseoso (CO 2) es la forma de carbono más abundante en la atmósfera, donde se presenta en una concentración de aproximadamente 400 ppm (0.04%), aunque el metano (CH 4, 1.8 ppm) también es significativo.
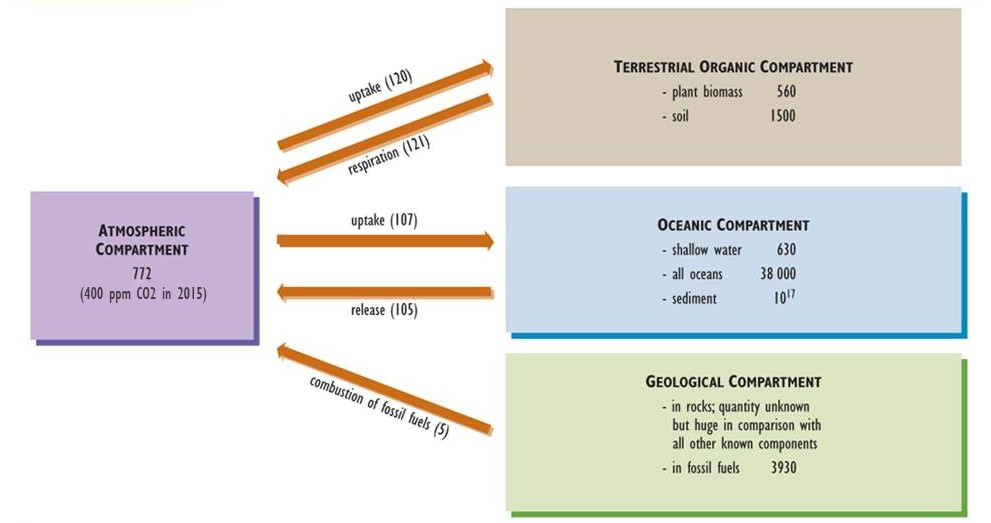
El CO 2 atmosférico es un nutriente crítico para organismos fotosintéticos, como plantas y algas. Las plantas absorben este gas a través de pequeños poros (llamados estomas) en su follaje, lo fijan en azúcares simples, y luego usan la energía fija para apoyar su respiración y lograr crecimiento y reproducción. La biomasa de autótrofos está disponible para ser consumida por heterótrofos y pasada a través de redes alimenticias. Todos los organismos liberan CO 2 a la atmósfera como producto de desecho de su metabolismo respiratorio.
El CO 2 es también la emisión más común asociada a la descomposición de la materia orgánica muerta. Sin embargo, si este proceso ocurre en condiciones anaeróbicas (en las que el oxígeno, O 2, no está presente), entonces se emiten tanto CO 2 como CH 4. Debido a que la descomposición anaeróbica es relativamente ineficiente, la materia orgánica muerta a menudo se acumula en humedales como pantanos y pantanos, formando eventualmente turba. Bajo condiciones geológicas adecuadas de entierro profundo, alta presión y temperatura, y falta de oxígeno, turba y otros materiales orgánicos pueden transformarse lentamente en combustibles fósiles ricos en carbono como carbón, petróleo y gas natural (ver Capítulo 13).
El CO 2 atmosférico también se disuelve en agua oceánica, formando el ion bicarbonato (HCO 3 —), que puede ser absorbido y fijado por algas y bacterias fotosintéticas, que son la base de la red alimentaria marina. Diversos organismos marinos también utilizan CO 2 y HCO 3 oceánicos —para fabricar sus cáscaras de carbonato de calcio (CaCo 3), un mineral insoluble que se acumula lentamente en los sedimentos y eventualmente puede litiarse en piedra caliza (también CaCO 3).
A lo largo de casi todo el tiempo geológico, la cantidad de CO 2 absorbida por la biota global de la atmósfera fue similar a la liberada a través de la respiración y la descomposición. En consecuencia, el ciclo de este nutriente puede ser visto como un sistema de estado estacionario. En los tiempos modernos, sin embargo, las emisiones antropogénicas han cambiado el balance de carbono atmosférico. Las emisiones globales de CO 2 y CH 4 son ahora mayores que la absorción de estos gases, un desequilibrio que ha dado lugar a concentraciones crecientes en la atmósfera. Este fenómeno parece estar intensificando el efecto invernadero de la Tierra y dando como resultado el calentamiento global (ver Capítulo 17).
El Ciclo del Nitrógeno
El nitrógeno es otro nutriente importante para los organismos, siendo un componente integral de muchos bioquímicos, incluyendo aminoácidos, proteínas y ácidos nucleicos. Al igual que el ciclo del carbono, el del nitrógeno tiene una fase atmosférica importante. Sin embargo, a diferencia del carbono, el nitrógeno no es un constituyente significativo de rocas y minerales. En consecuencia, el reservorio atmosférico juega un papel primordial en el ciclo del nitrógeno (Figura 5.4).
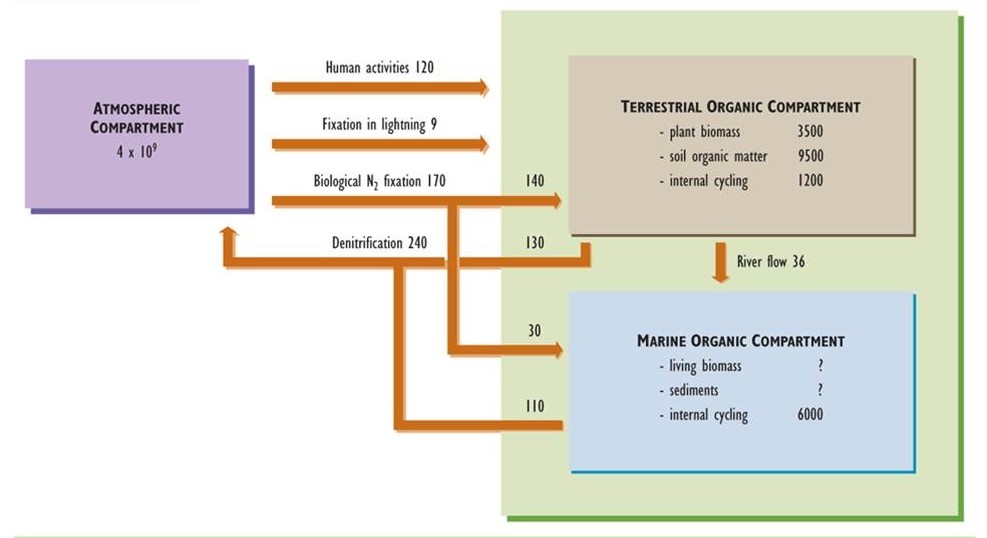
Prácticamente todo el nitrógeno en la atmósfera se presenta en forma de gas nitrógeno (N 2, a veces denominado dinitrógeno), el cual está presente en una concentración de 78%. Otras formas gaseosas de nitrógeno son el amoníaco (NH 3), el óxido nítrico (NO), el dióxido de nitrógeno (NO 2) y el óxido nitroso (N 2 O). Estos gases traza suelen ocurrir en concentraciones atmosféricas mucho menos de 1 ppm, aunque puede haber cantidades mayores cercanas a las fuentes de emisiones antropogénicas (ver Capítulo 16). El nitrógeno también se encuentra en partículas traza que contienen nitrato (NO 3 —) y amonio (NH 4 +), como nitrato de amonio (NH 4 NO 3) y sulfato de amonio ((NH 4) 2 SO 4), ambos de los cuales pueden ser contaminantes significativos relacionados con lluvia ácida y neblina (ver Capítulos 16 y 19).
El nitrógeno se presenta en muchas formas adicionales en ambientes terrestres y acuáticos. “Nitrógeno orgánico” se refiere a la gran variedad de moléculas que contienen nitrógeno en la biomasa viva y muerta. Estos químicos van en carácter desde aminoácidos simples, pasando por proteínas y ácidos nucleicos, hasta moléculas grandes y complejas que son componentes de la materia orgánica humidificada. El nitrógeno en los ecosistemas también se presenta en un pequeño número de compuestos inorgánicos, los más importantes de los cuales son los gases N 2 y NH 3 y los iones nitrato, nitrito (NO 2 —) y amonio. El ciclo del nitrógeno implica la transformación y el ciclo de las diversas formas orgánicas e inorgánicas del nitrógeno dentro de los ecosistemas.
Fijación de nitrógeno
Debido a que los dos átomos de nitrógeno en el gas dinitrógeno se mantienen unidos por un triple enlace fuerte, N 2 es un compuesto altamente no reactivo. Por esta razón, el N 2 puede ser utilizado directamente por sólo unos pocos organismos especializados, a pesar de que es extremadamente abundante en el medio ambiente. Estas especies fijadoras de nitrógeno, todas las cuales son microorganismos, tienen la capacidad de metabolizar N 2 en gas NH 3, que luego puede ser utilizado para su nutrición. Más importante aún, el NH 3 también se vuelve indirectamente disponible para la gran mayoría de plantas autótroficas y microorganismos que no pueden fijar el N 2 por sí mismos.
La fijación biológica de nitrógeno es un proceso crítico, la mayoría de los ecosistemas dependen de él para proporcionar el nitrógeno que sustenta su productividad primaria. De hecho, debido a que el nitrógeno no es un constituyente importante de rocas y minerales del suelo, la fijación del N 2 es responsable en última instancia de casi todo el nitrógeno orgánico en la biomasa de organismos y ecosistemas a lo largo de la biosfera. Las únicas otras fuentes significativas de nitrógeno fijo para los ecosistemas son la deposición atmosférica de nitrato y amonio en la precipitación y precipitación de polvo, y la absorción de gases NO y NO 2 por las plantas. Sin embargo, estas son generalmente fuentes menores en comparación con la fijación biológica de N 2.
Los más conocidos de los microorganismos fijadores de N 2 son las bacterias llamadas Rhizobium, que viven en nódulos especializados en las raíces de plantas leguminosas, como los guisantes y los frijoles. Algunos no leguminosos, como los alisos, también viven en una simbiosis beneficiosa (un mutualismo; ver Capítulo 9) con microorganismos fijadores de N 2. Así lo hacen la mayoría de los líquenes, que son un mutualismo entre un hongo y una alga. Muchos otros microbios fijadores de N 2 son libres de vida en el suelo o el agua, como las cianobacterias (bacterias azul-verdosas).
La fijación no biológica de nitrógeno también ocurre, por ejemplo, durante un evento relámpago cuando N 2 atmosférico se combina con O 2 en condiciones de gran calor y presión. Los humanos también pueden hacer que el N 2 sea fijo. Por ejemplo, el fertilizante nitrogenado se fabrica combinando N 2 con gas hidrógeno (H 2, que se fabrica a partir de CH 4, un combustible fósil) en presencia de catalizadores de hierro para producir NH 3. Además, se forma NO gas en los motores de combustión interna de los vehículos, donde N 2 se combina con O 2 en condiciones de alta presión y temperatura. Se emiten grandes cantidades de NO a la atmósfera en los gases de escape de los vehículos, contribuyendo a la contaminación del aire (Capítulo 16). La fijación antropogénica de N 2 asciende ahora a alrededor de 120 millones de toneladas anuales, alrededor del 83% de las cuales es la fabricación de fertilizantes. Este es un componente globalmente importante del ciclo moderno del nitrógeno y es comparable en magnitud con la fijación de N 2 no humana (alrededor de 170 millones de toneladas por año).

Amonificación y Nitrificación
Después de que un organismo muere, su nitrógeno unido orgánicamente debe convertirse en formas inorgánicas; de lo contrario, el reciclaje de su nitrógeno fijo no sería posible (Figura 5.5). La etapa inicial de este proceso es la amonificación, en la que el nitrógeno orgánico de la biomasa muerta se transforma en amoníaco, el cual adquiere un ion hidrógeno (H +) para formar amonio (NH 4 +). Como tal, la amonificación es un componente del complejo proceso de descomposición, pero uno que es específico del ciclo del nitrógeno. La amonificación se lleva a cabo por una variedad de microorganismos. El amonio resultante es una fuente de nutrición adecuada para muchas especies de plantas, particularmente aquellas que viven en ambientes con suelo ácido. La mayoría de las plantas, sin embargo, no pueden utilizar NH 4 + de manera efectiva, y requieren nitrato (NO 3 —) como su principal fuente de nutrición nitrogenada.
La nitrificación es el proceso mediante el cual el nitrato se sintetiza a partir del amonio. El paso inicial es la conversión de NH 4 + a nitrito (NO 2 —), una función realizada por bacterias conocidas como Nitrosomonas. Una vez que se forma el nitrito, es rápidamente oxidado a nitrato por la bacteria Nitrobacter. Debido a que las Nitrosomonas y Nitrobacter son sensibles a la acidez, la nitrificación no ocurre en suelos ácidos ni en agua. Es por ello que las plantas que crecen en hábitats ácidos deben poder utilizar el amonio como fuente de nitrógeno.
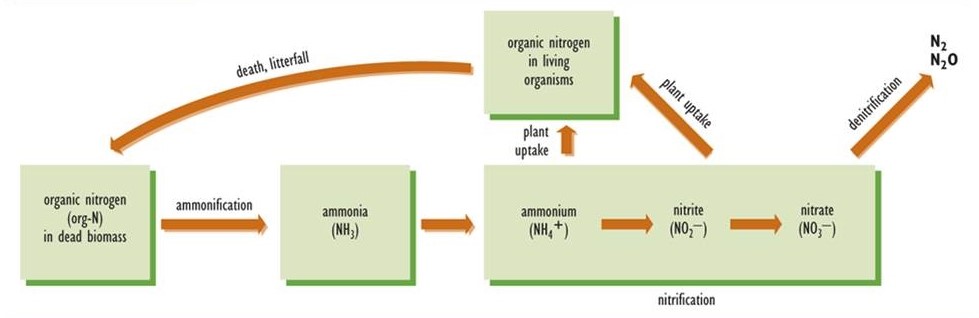
Desnitrificación
En la desnitrificación, también realizada por una amplia variedad de especies microbianas, el nitrato se convierte en cualquiera de los gases N 2 O o N 2, los cuales son liberados a la atmósfera. La desnitrificación ocurre en condiciones anaeróbicas, y su tasa es mayor cuando hay una gran concentración de nitrato, por ejemplo en tierras agrícolas fertilizadas que se inunda temporalmente. En algunos aspectos, la desnitrificación puede considerarse un proceso de contrapeso a la fijación de nitrógeno. De hecho, las tasas globales de fijación y desnitrificación de nitrógeno están en un balance aproximado, por lo que la cantidad total de nitrógeno fijo en la biosfera no está cambiando mucho con el tiempo.
El ciclo del fósforo
El fósforo es un constituyente clave de muchos bioquímicos, incluyendo grasas y lípidos, ácidos nucleicos como los materiales genéticos ADN y ARN, y moléculas portadoras de energía como ATP. Sin embargo, el fósforo es requerido por los organismos en cantidades mucho menores que el nitrógeno o el carbono. Sin embargo, el fósforo suele escasear, por lo que es un nutriente crítico en muchos ecosistemas, particularmente en agua dulce y agricultura.
A diferencia de los ciclos de carbono y nitrógeno, el del fósforo no tiene una fase atmosférica significativa. Aunque los compuestos de fósforo sí ocurren en la atmósfera, como cantidades traza en partículas, los insumos resultantes a los ecosistemas son pequeños comparados con las cantidades disponibles de los minerales del suelo o de la adición de fertilizantes a tierras agrícolas. El fósforo tiende a moverse del paisaje terrestre a las aguas superficiales y luego eventualmente a los océanos, donde se deposita para sedimentar que actúa como sumidero a largo plazo. Aunque algunos minerales de fósforo en los sedimentos oceánicos eventualmente se reciclan a la tierra por elevación geológica asociada con la construcción de montañas, este es un proceso extremadamente lento y no tiene sentido en escalas de tiempo ecológicas. Por lo tanto, aspectos del ciclo global del fósforo representan un sistema de flujo continuo.
Sin embargo, ciertos procesos devuelven algo de fósforo marino a porciones del paisaje continental. Por ejemplo, algunos tipos de peces pasan la mayor parte de su vida en el mar pero migran por ríos para reproducirse. Cuando son abundantes, peces como el salmón importan cantidades sustanciales de fósforo orgánico a los tramos más altos de los ríos, donde se descompone en fosfato después de que los peces desovan y mueren. Las aves marinas que comen peces también son localmente importantes para devolver el fósforo oceánico a la tierra a través de sus excrementos.
El suelo es la principal fuente de captación de fósforo para la vegetación terrestre. El ion fosfato (PO 4 3—) es la forma más importante de fósforo disponible en las plantas. Aunque los iones fosfato suelen ocurrir en pequeñas concentraciones en el suelo, se producen constantemente a partir de minerales que se disuelven lentamente como los fosfatos de calcio, magnesio y hierro (Ca 3 (PO 4) 2, Mg 3 (PO 4) 2 y FePO 4). El fosfato también se produce por la oxidación microbiana del fósforo orgánico, un componente del proceso más general de descomposición. El fosfato soluble en agua es rápidamente absorbido por los microorganismos y por las raíces de las plantas y se utiliza en la síntesis de una amplia gama de bioquímicos.
Los autótrofos acuáticos también utilizan el fosfato como su principal fuente de nutrición de fósforo. De hecho, el fosfato es comúnmente el factor limitante más importante para la productividad de los ecosistemas de agua dulce. Esto significa que la productividad primaria aumentará si el sistema es fertilizado con fosfato, pero no si se trata con fuentes de nitrógeno o carbono (a menos que primero tengan suficiente PO 4 3— agregado; ver Capítulo 20). Los lagos y otros ecosistemas acuáticos reciben la mayor parte de su suministro de fosfato a través de la escorrentía de partes terrestres de su cuenca, y por el reciclaje de fósforo de sedimentos y fósforo orgánico suspendidos en la columna de agua.
Los humanos están afectando enormemente el ciclo global del fósforo al extraerlo para fabricar fertilizantes y aplicar ese material a tierras agrícolas para aumentar su productividad. Desde hace algún tiempo, la principal fuente de fertilizantes de fósforo fue el guano, el excremento seco de las aves marinas. El guano se extrae en islas, como las de la costa de Chile y Perú, donde abundan las colonias reproductoras de aves marinas y el clima es seco, permitiendo que el guano se acumule. Durante el siglo XX, sin embargo, se descubrieron depósitos de minerales fosfatados sedimentarios en varios lugares, como el sur de Florida. El fósforo se había concentrado geológicamente en depósitos sedimentarios en estos lugares a través de la deposición de organismos marinos a lo largo de millones de años. Estos yacimientos se están minando ahora para abastecer fósforo mineral utilizado para fabricar fertilizantes agrícolas. Sin embargo, cuando estos depósitos minerales fácilmente explotables se agotan, el fósforo puede llegar a ser un factor limitante para la producción agrícola en un futuro no muy lejano.
Cada año se fabrican alrededor de 50 millones de toneladas de fertilizante de fósforo. Este es un insumo muy significativo para el ciclo global del fósforo, en vista de la estimación de que alrededor de 200 millones de toneladas de fósforo al año son absorbidas naturalmente del suelo por la vegetación.
Imagen 5.4. Donde abundan las aves marinas coloniales, sus excrementos (guano) pueden extraerse como fuente de fertilizante rico en fósforo. Esta es una vista de una gran colonia de cormoranes guanay (Phalacrocorax bougancillii) devoradores de peces cerca de Paracas frente a la costa del Perú. El guano seco se raspa periódicamente de las rocas y se utiliza con fines agrícolas. Fuente: B. Freedman.

Cuestiones Ambientales 5.1. Demasiado de algo bueno — Contaminación por nutrientes Los
nutrientes son esenciales para el metabolismo saludable de los organismos y para el correcto funcionamiento de los ecosistemas. A menudo, un aumento en el suministro de ciertos nutrientes potenciará la productividad de las plantas silvestres y cultivadas, este es el principio detrás del uso de fertilizantes en la agricultura. Sin embargo, también hay casos en los que un suministro excesivo de nutrientes ha ocasionado importantes problemas ambientales.
Debido a que el suministro de las formas disponibles de nitrógeno (particularmente NO 3 — y NH 4 +) suele ser un factor limitante para la productividad agrícola, estos son generalmente los nutrientes más abundantes en fertilizantes. Sin embargo, el uso de fertilizantes agrícolas puede resultar en concentraciones de NO 3 —en agua potable que son lo suficientemente altas como para ser tóxicas para los humanos, especialmente para los infantes (ver Capítulo 24). También sabemos que las plantas pueden absorber NO gaseoso y N 2 O de la atmósfera y utilizarlos como nutrientes, junto con NO 3 — y NH 4 + de la precipitación y el agua del suelo. Sin embargo, el NO gaseoso y el N 2 O son contaminantes del aire si ocurren en altas concentraciones, especialmente en ambientes soleados donde están involucrados en la producción fotoquímica de ozono tóxico (ver Capítulo 16). Además, grandes cantidades de NO 3 — y NH 4 + en lluvia y nieve pueden contribuir a la lluvia ácida (ver Capítulo 19).
Existen otros ejemplos de problemas ambientales causados por el exceso de nutrientes. Por ejemplo, el CO 2 es uno de los nutrientes vegetales más importantes porque el carbono comprende aproximadamente la mitad de la biomasa vegetal. Pero este nutriente crítico ocurre en una concentración atmosférica relativamente pequeña —solo alrededor de 0.04%. Sin embargo, la concentración de CO 2 en la atmósfera ha aumentado alrededor de 45% durante los últimos dos siglos y continúa amplificándose. Este cambio bien documentado está contribuyendo al calentamiento global, un problema ambiental importante (ver Capítulo 17).
La eutrofización, o una productividad excesiva de las masas de agua, es otro problema ambiental relacionado con un suministro excesivo de nutrientes. La mayoría de las veces es causada por un exceso de PO 4 3—, generalmente debido al vertimiento de aguas residuales o escorrentía de tierras agrícolas fertilizadas (ver Capítulo 20). Los lagos altamente eutróficos se degradan ecológicamente y pueden dejar de ser útiles como fuente de agua potable o para la recreación.
Claramente, estos ejemplos muestran que existe un equilibrio fino entre los químicos que sirven como nutrientes beneficiosos, o como contaminantes dañinos.
El Ciclo del Azufre
El azufre es un constituyente clave de ciertos aminoácidos, proteínas y otros bioquímicos. El azufre es abundante en algunos minerales y rocas y tiene una presencia significativa en el suelo, el agua y la atmósfera.
El azufre atmosférico se encuentra en diversos compuestos, algunos de los cuales son contaminantes atmosféricos importantes (ver Capítulo 16). El dióxido de azufre (SO 2), un gas, es emitido por erupciones volcánicas y también es liberado por centrales eléctricas de carbón y fundiciones de metales. El SO 2 es tóxico para muchas plantas en concentraciones inferiores a 1 ppm. En algunos lugares, como el área de Sudbury, este gas ha causado importantes daños ecológicos (Capítulo 16).
En la atmósfera, SO 2 se oxida al anión (ion cargado negativamente) sulfato (SO 4 2—), que se produce como partículas diminutas o se disuelve en gotitas suspendidas de humedad. En esta forma, la carga negativa del sulfato debe ser equilibrada por la carga positiva de cationes como el amonio (NH 4 +), el calcio (Ca 2 +), o el ion hidrógeno (H +, elemento clave de la “lluvia ácida”; ver Capítulo 19).
El sulfuro de hidrógeno (H 2 S), que tiene olor a huevos podridos, se emite naturalmente desde los volcanes y respiraderos de aguas profundas. También se libera de hábitats donde los compuestos orgánicos de azufre se están descomponiendo en condiciones anaeróbicas, y de sistemas acuáticos pobres en oxígeno donde SO 4 2— se está reduciendo a H 2 S. El sulfuro de dimetilo es otro gas de azufre reducido que se produce en los océanos y emitidos a la atmósfera. En ambientes ricos en oxígeno, como la atmósfera, H 2 S se oxida a sulfato, al igual que el sulfuro de dimetilo, pero más lentamente.
La mayoría de las emisiones de SO 2 a la atmósfera están asociadas con actividades humanas, pero casi todas las emisiones de H 2 S son naturales. Una excepción importante es la emisión de H 2 S de pozos de gas agrio e instalaciones de procesamiento, por ejemplo, en Alberta. En general, la emisión global de todos los gases que contienen azufre equivale a alrededor de 251 millones de toneladas de azufre al año. Alrededor del 41% de esta emisión es antropogénica y el resto es natural (ver Capítulo 16).
El azufre se presenta en rocas y suelos en una variedad de formas minerales, las más importantes de las cuales son los sulfuros, los cuales se presentan como compuestos con metales. Los sulfuros de hierro (como FeS 2, llamado pirita cuando se presenta como cristales cúbicos) son los minerales sulfurados más comunes, pero todos los metales pesados (como el cobre, el plomo y el níquel) pueden existir en esta forma mineral. Dondequiera que los sulfuros metálicos se expongan a un ambiente rico en oxígeno, la bacteria Thiobacillus thiooxidans oxida el mineral, generando sulfato como producto. Esta bacteria autótrofa utiliza la energía de esta transformación química para sostener su crecimiento y reproducción. Este tipo de productividad primaria se llama quimiosíntesis (en paralelo con la fotosíntesis de las plantas). En los lugares donde se oxidan grandes cantidades de sulfuro, altos niveles de acidez se asocian con el producto sulfato, fenómeno denominado drenaje ácido-mina (ver Capítulo 19).
El azufre también se presenta en una variedad de formas unidas orgánicamente en el suelo y el agua. Estos compuestos incluyen proteínas y otras sustancias que contienen azufre en la materia orgánica muerta. Los microorganismos del suelo oxidan el azufre orgánico a sulfato, un ion que las plantas pueden usar en su nutrición.
Las plantas satisfacen sus requerimientos nutricionales de azufre al asimilar sus compuestos minerales simples del ambiente, principalmente absorbiendo sulfato disuelto en el agua del suelo, que es absorbida por las raíces. En ambientes donde la atmósfera está contaminada por SO 2, las plantas también pueden absorber este gas a través de su follaje. Sin embargo, demasiada absorción puede ser tóxica para las plantas — hay una delgada línea entre el SO 2 como nutriente vegetal y como veneno.
Las actividades humanas han influido mucho en ciertos flujos del ciclo del azufre. El daño ambiental importante ha sido causado por la toxicidad del SO 2, la lluvia ácida, el drenaje ácido-mina y otros problemas relacionados con el azufre. Sin embargo, el azufre también es un importante producto mineral, con muchos usos industriales en la manufactura y como fertilizante agrícola. La mayor parte del azufre comercial se obtiene limpiando el gas natural “agrio” (metano, CH 4) de su contenido de H 2 S y eliminando SO 2 de los gases residuales en las fundiciones de metales.
Conclusiones
Los nutrientes son sustancias químicas que son esenciales para el metabolismo de organismos y ecosistemas. Si son insuficientes en cantidad, entonces la productividad ecológica es menor de lo que potencialmente podría ser. Los nutrientes también pueden estar presentes en exceso, en cuyo caso el daño ambiental puede ser causado por toxicidad y otros problemas. Los nutrientes circulan rutinariamente entre formas inorgánicas y orgánicas dentro de los ecosistemas. Los aspectos clave de los ciclos de nutrientes son ilustrados por los ciclos de carbono, nitrógeno, fósforo y azufre.
Preguntas para revisión
- ¿Cuáles son los aspectos básicos de un ciclo nutritivo? En su respuesta, describa los papeles de los compartimentos y flujos.
- ¿Cómo se forma el suelo a partir de un material padre? Incluya las influencias de los procesos físicos y biológicos en su respuesta.
- ¿Cuáles son los principales tipos de suelo? ¿En qué se diferencian?
- ¿Cuáles son las transformaciones químicas clave en el ciclo del nitrógeno y cuáles se ven afectadas por las influencias humanas?
Preguntas para Discusión
- Comparar y contrastar aspectos clave del ciclo de carbono, nitrógeno, fósforo y azufre.
- El uso de fertilizantes nitrogenados y de fósforo es crucial para la agricultura moderna, sin embargo, estos materiales se fabrican a partir de recursos no renovables y pueden no estar tan fácilmente disponibles en el futuro. ¿Cuáles serían las consecuencias para la producción agrícola si estos fertilizantes fueran más caros y menos disponibles?
- ¿Cómo afectan tus actividades diarias a aspectos del ciclo del carbono?
- Si el suelo se vuelve ácido, es posible que el proceso de nitrificación ya no ocurra. ¿Cuáles son las consecuencias de este cambio para la nutrición de las plantas?
Explorando problemas
- Una planta de tratamiento de aguas residuales ha solicitado permiso para desechar sus lodos ricos en nutrientes en tierras agrícolas cercanas. Se le ha pedido diseñar un estudio que examine los efectos de los lodos en el ciclo de nitrógeno y fósforo en el agroecosistema. ¿Qué variables clave de respuesta deben medirse durante el estudio? ¿Qué experimentos recomendaría para examinar los posibles efectos del lodo en el ciclo de nutrientes y la productividad de los cultivos?
Referencias citadas y lecturas adicionales
Atlas, R.M. y R. Bartha. 1998. Ecología Microbiana: Fundamentos y Aplicaciones. 4ª ed. Benjamin/Cummings, Menlo Park, CA.
Blasing, T.J. y K. Smith. 2007. Concentraciones recientes de gases de efecto invernadero Centro de Análisis de Información sobre Dióxido de Carbono, Laboratorio Nacional Oak Ridge, Departamento de Energía de Estados Unidos, Oak Ridge, TN. cdiac.ornl.gov/pns/current_ ghg.html
Botkin, D.B. y E.A. Keller. 2014. Ciencias Ambientales: La Tierra como Planeta Viviente. 9a ed. Wiley & Hijos, Nueva York, NUEVO.
Brady, N.C. y R.R. Weil. 2007. La naturaleza y las propiedades de los suelos. 14a ed. Prentice Hall, Nueva York, NY.
Freedman, B., J. Hutchings, D. Gwynne, J. Smol, R. Sufffling, R. Turkington, R. Walker, y D. Bazeley. 2014. Ecología: Un contexto canadiense. 2a ed. Nelson Canadá, Toronto, ON.
Hutzinger, O. (ed.) 1982. El Manual de Química Ambiental. Springer-Verlag, Nueva York. Likens, G.E., y F.H. Bormann. 1999. Biogeoquímica de un Ecosistema Forestal. 2a ed. Springer-Verlag, Nueva York.
Margulis, L., C. Matthews, y A. Haselton. 2000. Evolución Ambiental. 2ª ed. MIT Press, Cambridge, MA.
Yeso, E.J. 2002. Ciencia y Gestión del Suelo. 3a ed. Delmar Thomson Learning, Florencia, KY.
Post, W.M., T. Peng, W.R. Emanual, A.W. King, V.H. Dale, y D.L. DeAngelis. 1990. El Ciclo Global del Carbono. Científico Americano, 78:310-26.
Schlesinger, W.H. 1997. Biogeoquímica: un análisis del cambio global. 2a ed. Prensa Académica, San Diego, CA.


