5.2: Organizadores-Otros Organizadores
- Page ID
- 53029
Organizadores
Una de las cosas más interesantes de la construcción de cuerpos de animales es la diversidad que vemos a través y dentro de los cuerpos. Por ejemplo, aunque el patrón del gen Hox en moscas de la fruta y ratones es muy similar, los resultados finales (un ratón adulto o una mosca adulta) son extremadamente diferentes. También vemos una diversidad intrigante dentro de los cuerpos. Por ejemplo, un segmento torácico en una mosca de la fruta podría expresar un solo gen Hox a través de un segmento, sin embargo, partes de este segmento adoptan muchas formas diferentes. Gran parte de esta diferenciación está regida por organizadores locales y genes de control maestro. Estos son genes expresados localmente que a menudo se expresan en muchos segmentos en puntos similares. Dependiendo del gen Hox expresado en ese segmento, activarán diferentes partes del cuerpo. Por ejemplo, veremos más adelante los genes de control maestro de ala -estos genes construyen alas en segmentos torácicos y diferentes estructuras, como trampas de ginebra, en otros segmentos. El tipo de ala - élitros, haltere, ala voladora, etc. también depende de la posición del segmento en el cuerpo y de la especie en la que se expresa. Por ejemplo, las libélulas tienen dos alas voladoras, mientras que la primera ala en un escarabajo es un elitrón protector, y la segunda ala en una mosca es un órgano propioceptivo.
Este tipo de programación se conoce como homología serial. Volveremos a este concepto más adelante, pero es una idea conceptualmente importante en Evo-Devo. Los homólogos seriales son un tipo especial de homólogo en el que el mismo tipo de tejido que expresa un conjunto central de reguladores genéticos (un organizador) se encuentra en múltiples puntos a lo largo de un eje corporal. Un ejemplo fácil de entender de homólogos seriales son los brazos y las piernas. Desde el punto de vista del desarrollo, son casi idénticos para la primera parte de su crecimiento, solo crecen diferencias sustanciales después. Expresan los mismos genes centrales de las extremidades (como pronto consideraremos) y tienen los mismos huesos, aunque en formas ligeramente diferentes. Los homólogos seriales son increíblemente importantes en nuestra comprensión de la evolución porque son genéticamente “baratos”, ya que utilizan la misma red reguladora génica central, pero pueden proporcionar funciones novedosas como el uso de herramientas más la locomoción. El destino de un homólogo en serie a menudo depende de los genes Hox que se expresan en la región del organizador homólogo serial.
Las salidas del organizador no solo se ven afectadas por el código Hox, también pueden configurar ellos mismos el código Hox (como en el caso de Nanos y Bicoid) o pueden configurar un eje diferente (como el eje dorsoventral de una rana o el eje anteroposterior de una extremidad). Ahora que tiene un firme conocimiento de las redes reguladoras de genes, podemos echar un vistazo más de cerca a un famoso organizador que ya hemos considerado: el organizador Spann-Mangold de la rana gastrula.
La genética del organizador Spemann-Mangold y la notocorda
Si necesitas un repaso rápido en el organizador Spemann-Mangold, echa un vistazo a Escote y Gastrulación. Brevemente, el organizador Spemann-Mangold es mesodermo que se encuentra en la posición de la media luna gris, el polo dorsal del embrión de rana (o tritón). Este organizador, a medida que se desarrolla en la notocorda, induce la formación de estructuras dorsales como el sistema nervioso central y la columna vertebral. Los anfibios con un organizador adicional Spemann-Mangold cultivan un segundo eje A/P (renacuajos gemelos unidos) y los anfibios que carecen de un organizador Spemann-Mangold se convierten en una “pieza de vientre”.
Usando la genética, podemos explicar dos enormes preguntas: 1) ¿Qué causa que se desarrolle el organizador? y 2) ¿Cómo induce la formación de estructuras dorsales? El primer paso en la formación del organizador es la rotación cortical misma, como se muestra en la Figura 1 de Rotación Cortical. En rotación cortical, los microtúbulos rotan la corteza externa del óvulo fertilizado con relación a la masa interna. El polo vegetal tiene varias proteínas localizadas y ARNm anclados a su citoesqueleto. En la masa interna esto incluye VegT y Vg1 7,8. La corteza externa tiene proteína Dishevelada (Dsh) localizada vegetalmente, un componente de la vía Wnt, que se transporta hacia el polo animal durante la rotación cortical 9. El desplazamiento de Dsh crea una nueva zona - una parte del embrión con Dsh, pero no Vg1 o VegT (Figura 8) 10. Dsh ayuda a localizar y estabilizar la b-catenina, el factor de transcripción de la vía canónica Wnt. Ahora tenemos Vg1 y VegT en el polo vegetal y Dsh y b-catenina en el futuro extremo dorsal.
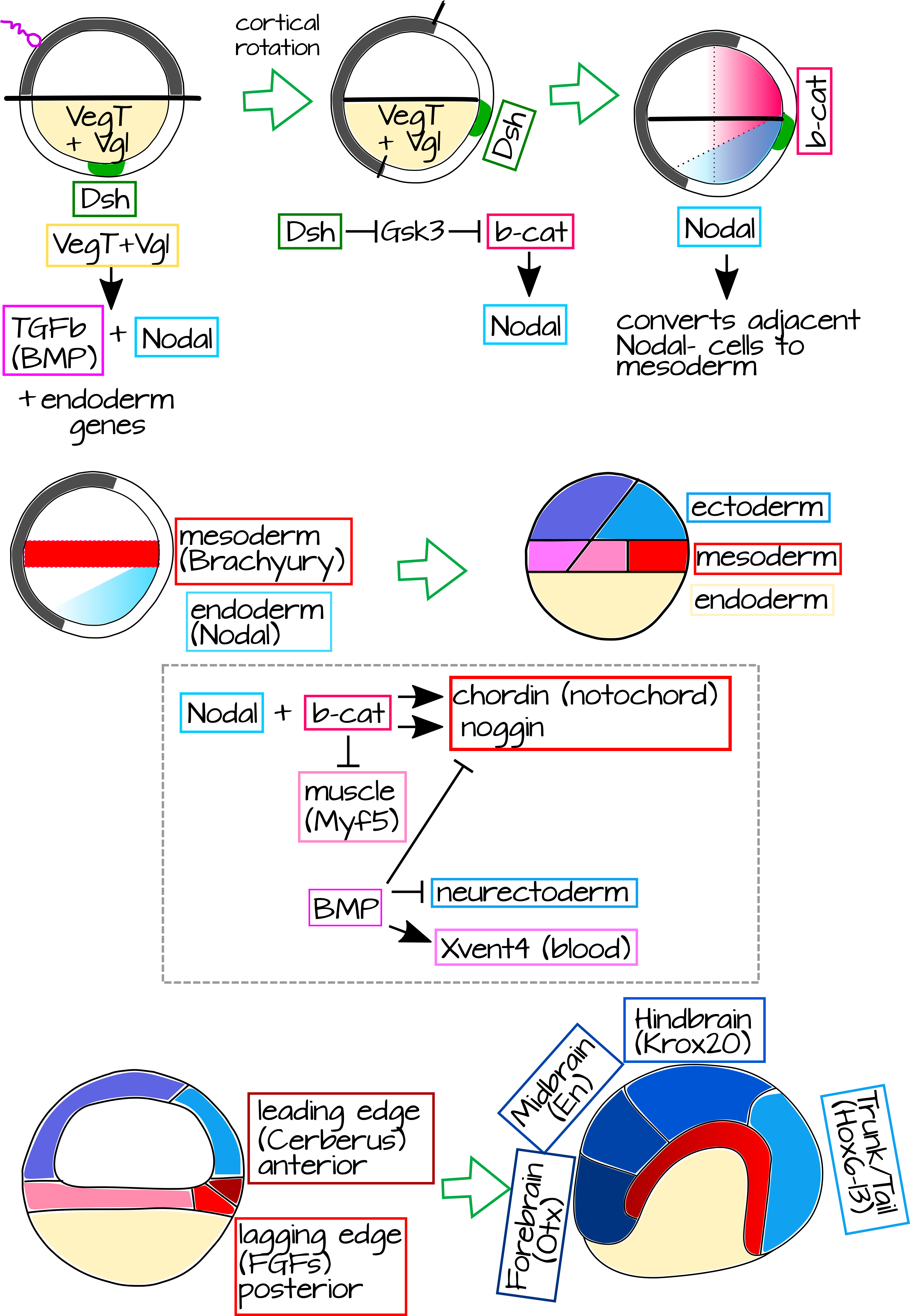 |
Figura 8: Genética del organizador Spenmann-Mangold. Las proteínas de origen materno configuran un eje Animal/Vegetal en el óvulo no fertilizado, incluyendo VegT y Vg1 en la corteza interna del polo Vegetal (naranja). Después de la fertilización, la rotación cortical pone en contacto la proteína de la corteza externa del polo Vegetal Dishevelada (Dsh, verde) con la corteza interna del animal, impulsando la acumulación de b-catenina en las células dorsales. Las proteínas polares vegetales activan la expresión de TGFb (BMP) y Nodal. Nodal convierte las células nodales adyacentes en mesodermo (rojo), dando como resultado una franja de mesodermo justo por encima del polo vegetal. Mientras tanto, la b-catenina mejora la expresión Nodal en la mayor parte dorsal del embrión, lo que resulta en una alta expresión Nodal en la corteza interna vegetal dorsal. Esto, más b-catenina, impulsa la expresión de genes organizadores como Chordin y Noggin, mientras que reprime destinos del mesodermo ventral como músculo. Chordin y Noggin especifican la notocorda, que alargará e inducirá el ectodermo dorsal (todo ectodermo es azul) que se encuentra sobre él para convertirse en neurectodermo. BMP reprime la actividad organizadora en el lado ventral del embrión, en particular el ectodermo ventral formará piel, no neurectodermo. La notocorda en sí tiene un borde delantero (anterior) y rezagado (posterior) que expresan diferentes genes e inducen diferentes partes del sistema nervioso central. Un archivo svg editable de esta figura está disponible en https://scholarlycommons.pacific.edu/open-images/27/ |
A medida que avanza la escisión, VEGT y Vg1 inducen la expresión de Nodal (específicamente la proteína relacionada ganglionar de Xenopus o Xnr) en las células más vegetales. Estas células se convertirán en el endodermo. Nodal, un homólogo de TGFb, señala a células cercanas que carecen de Nodal (células nodales), estas células se convertirán en el mesodermo. La expresión ganglionar también es inducida por b-catenina. Esto hace un gradiente de Nodal que es mayor en el lado dorsal, donde es inducido por VEGT y Vg1 así como b-catenina. Mientras que la b-catenina se estabiliza en una amplia franja de tejido dorsal, la expresión nodal se restringe al lado vegetal del embrión donde se expresa por todas partes, pero más alta donde está presente b-catenina (Figura 8). Donde la señalización ganglionar se encuentra con células mesodérmicas con b-catenina alta, vemos la expresión de un nuevo conjunto de genes: los genes organizadores Chordin, Noggin, Frizzled y más (Figura 8) 11.
Estos genes organizadores son factores de transcripción y miembros de vías de transducción de señales. Algunos de ellos especificarán el mesodermo organizador como “dorsal” (notocordio y somitas) y algunos de ellos señalarán al ectodermo suprayacente durante la gastrulación y lo especificarán como “neural” en lugar de epidérmico. La mecánica física de este proceso es fascinante, y podemos estudiarlas más adelante si te interesa, pero por ahora me enfocaré solo en la genética y resumiré brevemente los movimientos de los tejidos. Como viste antes, las células organizadoras mesodérmicas experimentan involución en el labio dorsal del blastoporo y se arrastran a lo largo de las células ectodérmicas suprayacentes para formar una capa gruesa debajo de ellas. La mayor parte del mesodermo en el embrión gastrulante expresa BMP4, una proteína secretada por la familia TGFb. Este BMP4 señala al ectodermo suprayacente para que se convierta en epidermis. Sin embargo, el organizador expresa antagonistas de BMP4, como Chordin y Noggin 12. Esto hace que el ectodermo por encima del mesodermo organizador asuma los objetivos neuronales.
El organizador en sí no es una estructura homogénea, está conformado por varias poblaciones celulares que expresan diferentes genes de señalización y factores de transcripción. Por ejemplo, el borde de ataque del organizador (la parte que invaginará primero y se convertirá en la notocorda más anterior) expresa un antagonista de Wnt y BMP4 llamado Cerberus 13. Cerberus y otros genes de vanguardia especifican las porciones anteriores de la notocorda a través de redes reguladoras génicas que finalmente conducirán a la expresión del gen del prosencéfalo Otx2 14 en el ectodermo suprayacente. Las células organizadoras que siguen este borde de ataque expresan la molécula de señalización secretada FGF, que impulsa la expresión del gen del mesencéfalo Krox20 en el ectodermo sobre él. Tanto Otx2 como Krox20 ayudan a crear el patrón de expresión del gen Hox, junto con otros genes organizadores expresados en un patrón anteroposterior en la notocorda 14. De esta manera, la notocorda es capaz de dirigir el patrón anteroposterior del tubo neural (Figura 8).
Otros Organizadores
Hay una multitud de otros organizadores en biología del desarrollo y sus propiedades fundamentales nos dan ideas sobre la genética de la evolución. Se especifican por factores externos, por ejemplo, por la intersección de células adyacentes a Nodal-y que expresan b-catenina en el organizador Spemann-Mangold. Actúan sobre otros tejidos a través de moléculas de señalización secretadas, por ejemplo, la cordina inhibiendo BMP4 para especificar el neurectodermo. Y su actividad sobre otros tejidos puede variar con el tiempo y/o el espacio, por ejemplo la capacidad de la notocorda para inducir estructuras del sistema nervioso tanto anterior como posterior.
El notocordio tiene una tercera actividad organizativa sobre el ectodermo (sin mencionar que es actividad organizadora en el mesodermo), esto es modelar el eje D/V del tubo neural. Durante la gastrulación, el ectodermo que se encuentra sobre la notocorda responde a las señales de ésta para doblarse en un tubo y se hunde bajo la epidermis. Este tubo se polariza en el lado dorsal (cerca de la epidermis suprayacente) y el lado ventral (cerca de la notocorda). Una señal Shh de la notocorda impulsa la secreción de Shh desde el lado ventral. Este gradiente de Shh se opone a un gradiente de BMP dorsal (familia TGFb) iniciado por señalización epidérmica (Figura 9).
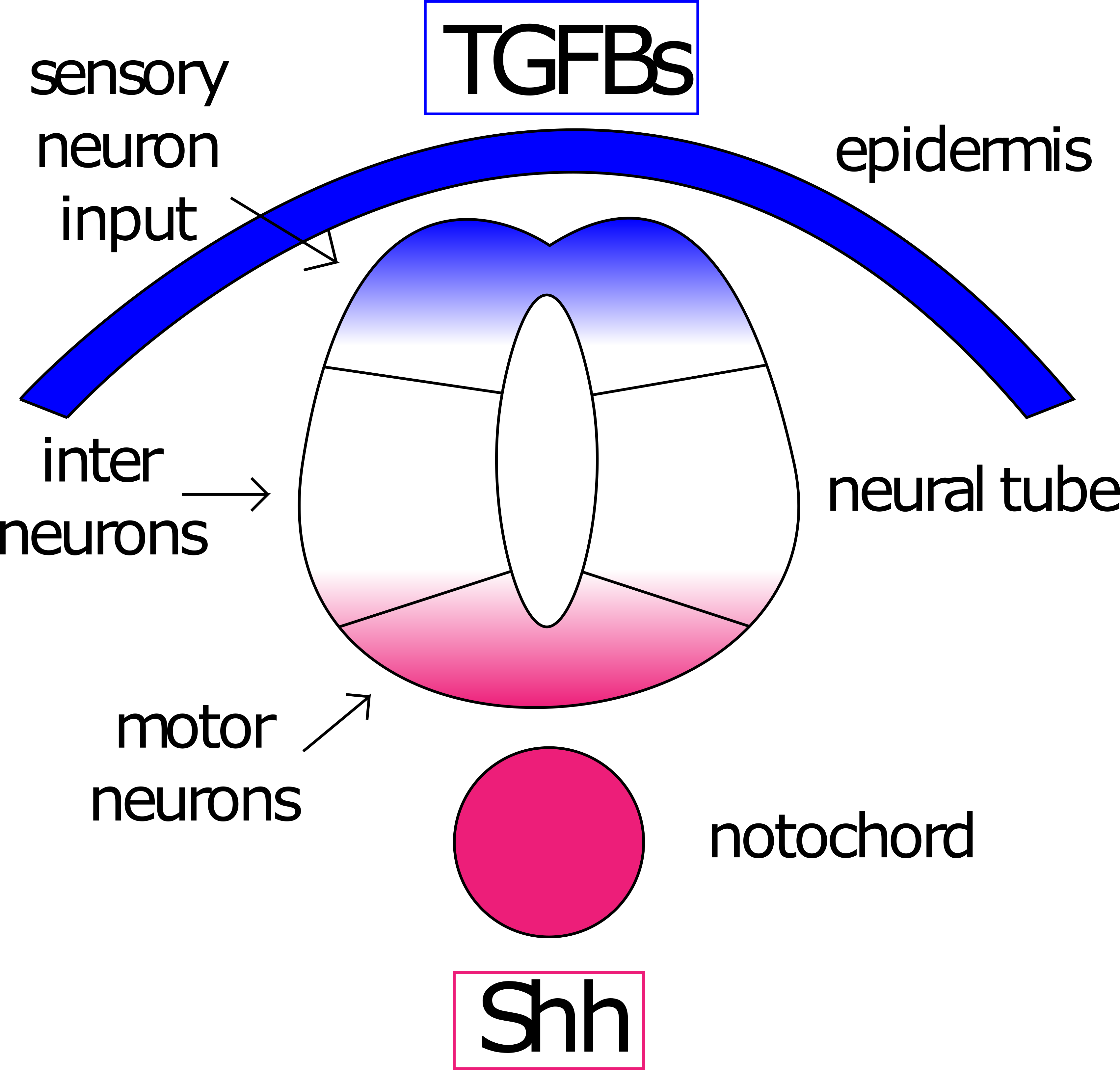 Figura 8: Gradientes opuestos modelan el tubo neural. Los TGF (azul) de la epidermis y Sonic Hedgehog (Shh, rojo) de la notocorda modelan el eje dorsal/ventral del tubo neural. Las neuronas expuestas a una alta concentración de TGFb se convertirán en neuronas sensoriales, las expuestas a altos niveles de Shh se convertirán en neuronas motoras. Las neuronas expuestas a niveles bajos de ambas se convertirán en interneuronas. Figura de Amanda Lo y Ajna Rivera
Figura 8: Gradientes opuestos modelan el tubo neural. Los TGF (azul) de la epidermis y Sonic Hedgehog (Shh, rojo) de la notocorda modelan el eje dorsal/ventral del tubo neural. Las neuronas expuestas a una alta concentración de TGFb se convertirán en neuronas sensoriales, las expuestas a altos niveles de Shh se convertirán en neuronas motoras. Las neuronas expuestas a niveles bajos de ambas se convertirán en interneuronas. Figura de Amanda Lo y Ajna Rivera
Un archivo svg editable de esta figura está disponible en https://scholarlycommons.pacific.edu/open-images/28/
Estos dos gradientes opuestos conducen a gradientes de factores de transcripción activos que responden a estas vías de transducción de señales y a la expresión de genes con elementos reguladores cis que responden a estos factores de transcripción (Figura 9) 15. Le Dreu y Marti nombran 11 dominios distintos identificados por la expresión del factor de transcripción único y el subtipo neuronal 15.
Otro organizador famoso es uno que encontraste en Intro Bio: el organizador de extremidades tetrápodos. Este es un organizador de dos partes, con una franja larga y delgada de células en el punto más distal de la extremidad que expresa y secreta FGF promotores del crecimiento, y el punto más posterior de la extremidad que expresa Sonic Hedgehog (Shh, Figura 10). La porción FGF de la extremidad se llama cresta ectodérmica apical. Es el centro de señalización que mantiene la extremidad agregando más elementos distales en el extremo. De esta manera, los elementos más proximales, como el húmero y el codo, se desarrollan primero. Los elementos más distales, como el antebrazo, la muñeca y las manos, se acuestan más tarde. Curiosamente, este sistema parece estar en un temporizador, en lugar de estar estrictamente modelado espacialmente. Si la división celular se inhibe a mitad del desarrollo del brazo, el radio, el cúbito y el húmero pueden ser pequeños o ausentes, con una cintura de mano y hombro normalmente proporcionada. Esto parece algo similar al mutante gap en Drosophila, aunque el mecanismo de desarrollo es completamente diferente.
Figura 10: El organizador del miembro tetrápodo. La cresta ectodérmica apical (AER, rojo) secreta FGF que mantienen proliferando las células subyacentes y mantienen la señalización de Shh desde la Zona de Actividad Polarizante (ZPA, azul). La proteína Shh secretada por las células ZPA forma un gradiente a lo largo del eje A/P (pulgar/meñique) de la extremidad. Bajo/no Shh especifica los objetivos del dedo pulgar e índice, el Shh alto especifica los parados del dedo meñique y del dedo anular. ¿Qué pasa si agregamos Shh al otro lado de la extremidad en desarrollo? Imagen del usuario de wikimedia commons Peteruetz bajo licencia CC BY-SA 3.0
El centro de señalización Shh es un verdadero organizador. No solo secreta una molécula de señalización como la AER, sino que esta molécula de señalización actúa de manera graduada. Los niveles altos de Shh dan como resultado el desarrollo de elementos posteriores de la extremidad, como el radio o el meñique, mientras que los niveles bajos dan como resultado el desarrollo de elementos medios, como los dedos medios, y la ausencia de Shh conduce a elementos anteriores, como el pulgar.
En general, las cascadas de factores de transducción de señales y transcripción son responsables de gran parte del patrón del embrión en desarrollo. Esto nos da una gran pista sobre cómo la evolución puede actuar sobre el desarrollo para cambiar la morfología adulta. Pequeños cambios en la cantidad o ubicación de un morfógeno pueden tener grandes efectos en el adulto. El mismo “kit de herramientas” de genes se conserva en la evolución, pero también se reutiliza en muchos contextos diferentes. Por ejemplo, el papel de Shh en modelar tu Sistema Nervioso Central así como tus manos. Esta reutilización de elementos de caja de herramientas en nuevos contextos les da nuevas funciones -dependiendo del activador y represores locales que se encuentren allí, los genes de la vía de transducción de señales disponibles, así como las modificaciones cromosómicas epigenéticas ya presentes. Hasta ahora nos hemos centrado principalmente en gradientes y organizadores en patrones, pero en Patrones veremos un par de otras formas de modelar un embrión.


