5.1: Glicólisis
- Page ID
- 52979
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Casi todas las reacciones metabólicas son catalizadas por enzimas para mantenerse al día con las demandas de energía y materiales de la célula. De hecho, la discusión de algunos de los procesos metabólicos en este capítulo casi parecerá ser listas lavadoras de enzimas. Comenzaremos con una de esas listas para describir el catabolismo del azúcar simple, la glucosa, a través del proceso de glucólisis.
Glicólisis
Ya sea que la célula sea procariota o eucariota, uno de sus métodos básicos para generar energía utilizable es la glucólisis. Este proceso utiliza glucosa, que es la fuente de energía más común para la mayoría de las células. Sin embargo, la glucosa no se puede descomponer directamente para proporcionar energía a la célula: la glucólisis es un proceso que la descompone en una serie de reacciones para crear trifosfato de adenosina (ATP), que es la “moneda” energética más común de la célula. Es decir, el ATP puede liberar energía utilizable en una sola reacción.
La glucosa, al ser un azúcar de 6 carbonos, tiene una gran cantidad de energía potencial almacenada en sus enlaces. Sin embargo, dado que es termodinámicamente estable, se necesitaría la inversión de mucha energía externa para liberar la energía de la glucosa en un solo paso (por ejemplo encenderla para descomponerla en CO 2 y H 2 O), y no solo es imposible que las células generen ese tipo de energía en una vez, la célula no tiene ningún mecanismo para utilizar toda la energía liberada en un instante en el tiempo. La mayor parte se desperdiciaría como exceso de calor. En cambio, la célula utiliza enzimas para desestabilizar y descomponer el azúcar a través de una serie de conversiones en compuestos intermedios. El proceso básico y las enzimas involucradas son los siguientes.
1. La glucosa es fosforilada por la hexoquinasa para producir Glucosa-6-Fosfato. La enzima se llama así porque es una quinasa (pone un grupo fosfato) que actúa sobre una hexosa (azúcar de seis carbonos). En este caso, coloca el fosfato sobre el carbono 6 de la glucosa. Sin embargo, la hexoquinasa también puede fosforilar otras hexosas como la fructosa y la manosa (todas en la conformación D). Hay dos razones principales por las que esto es bueno para la célula. Dado que la concentración de glucosa es mayor dentro de la célula que en el exterior, hay presión para que vuelva a salir de la célula. Al convertirlo a G6P, ya no forma parte del gradiente de concentración de glucosa, y tiene un grupo fosfato cargado, lo que hace que sea casi imposible escapar de la membrana. La adición del fosfato también aumenta la energía en la molécula, haciéndola menos estable termodinámicamente, para que pueda ser descompuesta. Esta reacción requiere el uso de ATP como donante de fosfato y la energía necesaria para unirlo. Es decir, la energía se utiliza en este paso, no se produce. Considéralo una inversión de energía, ya que al final de la glucólisis, se produce más ATP que usado.
La hexoquinasa requiere ATP en forma de complejo (a los grupos fosfato 2 y 3) con un catión divalente, típicamente Mg 2+ in vivo. El ATP solo es en realidad un inhibidor competitivo de la hexoquinasa. El producto, G6P, también funciona como inhibidor, proporcionando así cierta medida de regulación de retroalimentación. De hecho, las células musculares que utilizan reservas de glucógeno convierten el glucógeno directamente a G6P, por lo que la actividad de la hexoquinasa es muy baja en esas células.
2. La glucosa-6-fosfato se convierte en fructosa-6-fosfato por la fosfoglucosa isomerasa. Como su nombre lo indica, la isomerasa simplemente reorganiza los átomos existentes dentro del G6P para hacer el F6P sin eliminación o adición de ningún átomo.
3. La fructosa-6-fosfato es fosforilada por fosfofructoquinasa (PFK) a Fructosa- 1,6-bisfosfato. De nuevo hay una inversión de un ATP para proporcionar el grupo fosfato y la energía para unirlo.
PFK es un importante regulador de la glucólisis. Es una proteína tetramérica, y cada subunidad tiene dos sitios de unión para ATP: uno es el sitio sustrato normal, el otro es un sitio inhibidor tal que la unión de ATP disminuye la afinidad de la enzima por F6P. El ATP no es el único regulador de la actividad de PFK: el AMP también es un regulador positivo de PFK, y puede aumentarlo hasta 5 veces.
4. El fructosa-1,6-bisfosfato es cortado a la mitad por la aldolasa, produciendo una molécula de fosfato de dihidroxiacetona y una molécula de gliceraldehído-3-fosfato.
Existen dos clases de aldolasas: la clase I se encuentra en animales y plantas, mientras que la clase II se encuentra en hongos y bacterias. La clase I no requiere cofactores, pero la clase II requiere un catión divalente (fisiológicamente generalmente Fe 2+ o Zn 2+).
5. El G3P puede participar en la siguiente reacción, pero el fosfato de dihidroxiacetona, a pesar de su similitud, no puede. Entonces, necesita ser reorganizado por triosa fosfato isomerasa, que la convierte en otra molécula de gliceraldehído-3-fosfato.
La triosa fosfato isomerasa es una “enzima perfecta” que cataliza la formación del producto tan rápido como la enzima y el sustrato pueden hacer contacto en solución (es decir, la velocidad es puramente limitada por difusión).
6. Cada una de las dos moléculas de G3P generadas a partir de la molécula de glucosa ahora sufre oxidación catalizada por gliceraldehído-3-fosfato deshidrogenasa (GAPDH) en presencia de NAD + y fosfato inorgánico (P i). Cada una de estas reacciones produce 1,3-bisfosfosglicerato, que tiene un grupo fosfato de alta energía, y NADH. El NADH es un portador de electrones de alta energía (el electrón proviene de G3P). En eucariotas con un ambiente
aeróbico, este NADH probablemente se utilizará para ayudar a generar ATP a través del ciclo del ácido tricarboxílico (también conocido como ciclo de Krebs o ciclo del ácido cítrico). En situaciones anaeróbicas, el NADH participará en la fermentación por razones discutidas en la siguiente sección.
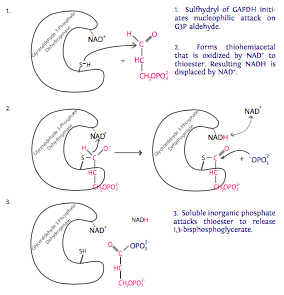
7. El grupo fosfato en el 1-carbono de 1,3-bisfosfosglicerato es transferido a ADP por fosfoglicerato quinasa para hacer 3-fosfoglicerato y ATP (¡finalmente!). De las dos moléculas de G3P que entran en el paso 6, obtenemos dos moléculas de ATP para proporcionar energía a la célula en este paso. Recordando la inversión anterior de ATP (en los pasos 1 y 3), la reacción sólo se ha “paralizado” en este punto. 2 adentro, 2 out.
El nombre de la enzima sugiere que se agrega un fosfato al fosfoglicerato. Esto no es un error: recuerde que las enzimas pueden catalizar reacciones en cualquier dirección, dependiendo de las condiciones de reacción. Bajo condiciones de alto fosfoglicerato y ATP, se produciría la fosforilación del fosfoglicerato. Sin embargo, las condiciones fisiológicas son una concentración relativamente alta del 1,3-bisfosfosglicerato en comparación con niveles relativamente bajos de fosfoglicerato, impulsando así la reacción “hacia atrás” con respecto a la denominación de la enzima.
8. El 3-fosfoglicerato se reordena entonces por la fosfoglicerato mutasa para hacer 2-fosfoglicerato. Esta molécula tiene una mayor energía libre de hidrólisis que cuando el grupo fosfato está en el carbono 3.
La acción de la fosfoglicerato mutasa no es solo la transferencia intramolecular del grupo fosfato que parece ser a primera vista. La enzima debe activarse primero por fosforilación, y es el fosfato de la enzima el que se agrega al 2-carbono de 3PG. El intermedio doblemente fosforilado luego transfiere su 3-fosfato a la enzima, y se libera 2PG.
9. Esa energía se utiliza para crear ATP, ya que el 2-fosfoglicerato sufre deshidratación por enolasa para producir fosfoenolpiruvato (PEP).
La PEP se hace porque la hidrólisis del fosfato de 2PG no libera suficiente energía para impulsar la fosforilación de ADP a ATP. La hidrólisis PEP, por otro lado, libera significativamente más de lo necesario.
10. La piruvato quinasa luego transfiere un grupo fosfato de alta energía de PEP a ADP, produciendo un ATP para su uso por la célula, y piruvato.
La piruvato quinasa requiere no solo Mg 2+ divalente como con la mayoría de las otras quinasas, sino también K +. La enzima funciona en dos etapas: el ADP ataca al fósforo PEP para producir ATP y enolpiruvato. Luego, el enolpiruvato se convierte en su cetotautomérico.
Teniendo en cuenta la duplicación de las reacciones de los pasos 6-10 (la división de fructosa-1,6- bisfosfato genera dos G3P), la producción total de energía utilizable a partir de la glucólisis de una sola molécula de glucosa es 4 ATP y 2 NADH. Sin embargo, la producción neta de ATP es de solo 2 ATP si recordamos la inversión inicial de dos ATP en los primeros pasos. Realmente no hay nada de qué escribir a casa. Además, aunque el NADH y el piruvato pueden participar en el ciclo del ácido tricarboxílico en situaciones eucariotas aeróbicas para generar una cantidad significativa de ATP, en situaciones anaeróbicas, no producen energía utilizable.
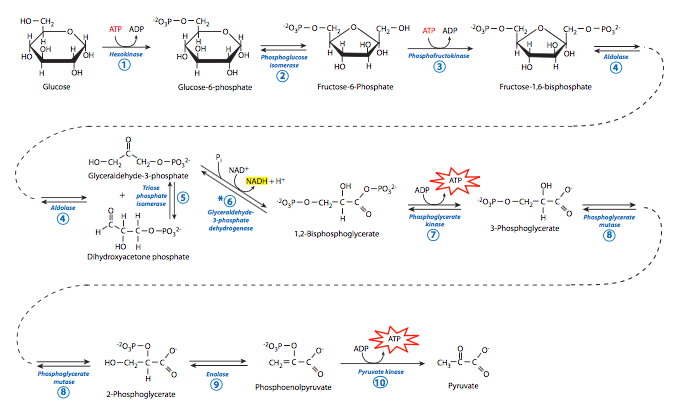
Las flechas bidireccionales indican enzimas utilizadas tanto para la glucólisis como para la gluconeogénesis. Las flechas unidireccionales indican enzimas que solo funcionan en la glucólisis. *Tenga en cuenta que las reacciones 6-10 están ocurriendo por duplicado (dos G3P de una glucosa).
Por lo tanto, la producción anaeróbica de ATP, es decir, la glucólisis, es mucho menos eficiente para extraer energía de una molécula de glucosa que la producción aeróbica de ATP, que puede generar aproximadamente 38 ATP por glucosa. Por otro lado, cuando se debe generar rápidamente mucho ATP, la glucólisis es el mecanismo de elección, en células como las fibras de contracción rápida del músculo esquelético. Estas células en realidad tienen muy pocas mitocondrias porque la glucólisis puede producir ATP a una tasa mucho mayor (hasta 100 veces) que la fosforilación oxidativa. ¿Qué pasa con el piruvato y el NADH? En las células metabolizadoras aeróbicas, van a las mitocondrias para el ciclo de TCA y fosforilación oxidativa. En los anaerobios, se someten a fermentación.
Nótese que el NADH producido por la glucólisis en el citoplasma no participa directamente en la fosforilación oxidativa en las mitocondrias ya que la membrana mitocondrial interna es impermeable a la misma, sino que envía un “equivalente virtual” a las mitocondrias a través de una de dos vías: el aspartato- malato shuttle combina antipuertos malato-α-cetoglutarato, antipuertos de aspartato-glutamato e interconversión de metabolitos por transaminasa con malato deshidrogenasa para oxidar NADH citoplásmicamente y utilizar la energía generada para reducir NAD + en la matriz mitocondrial; la otra vía es un DHAP sistema lanzadera, en el que se usa NADH para reducir el fosfato de dihidroxiacetona a glicerol-3-P usando una glicerol-3-fosfato deshidrogenasa citoplásmica, y el ciclo del DHAP a glicerol-3-P a través de una flavoproteína deshidrogenasa incrustada en la membrana mitocondrial interna. Esta flavoproteína deshidrogenasa toma los electrones de glicerol-3-P para hacer FADH 2, que puede participar en la cadena de transporte de electrones.
La lanzadera DHAP o glicerofosfato es menos eficiente que la lanzadera de malato-aspartato, generando aproximadamente 2 ATP vs 2.7 ATP por NADH. Sin embargo, puede operar incluso cuando la concentración de NADH citoplásmica es baja, como ocurre en tejidos/células con una tasa metabólica muy alta (incluyendo músculo esquelético y cerebro), mientras que la lanzadera de malato-aspartato (prevalente en hígado y corazón) es sensible a la concentración relativa de NADH y NAD + .


