13.1: Envejecimiento
- Page ID
- 57310
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)¿Qué es Envejecer?
El envejecimiento es la pérdida progresiva de funciones fisiológicas que aumenta la probabilidad de muerte. Esta tabla da algunos datos.
| Peso del cerebro | 56% |
| Suministro de sangre al cerebro | 80 |
| Salida del corazón en reposo | 70 |
| Número de glomérulos en el riñón | 56 |
| Tasa de filtración glomerular | 69 |
| Velocidad de retorno al pH normal de la sangre después del desplazamiento | 17 |
| Número de papilas gustativas | 36 |
| Capacidad vital | 56 |
| Fuerza del agarre de la mano | 55 |
| Captación máxima de O 2 durante el ejercicio | 40 |
| Número de axones en el nervio espinal | 63 |
| Velocidad del impulso nervioso | 90 |
| Peso corporal | 88 |
La disminución de la función ciertamente ocurre dentro de las células. Esto es especialmente cierto en el caso de las células que ya no están en el ciclo celular:
- neuronas en el cerebro;
- músculo esquelético y cardíaco;
- células renales.
Tejidos y órganos hechos de células que se repone por mitosis a lo largo de la vida. La sangre y el epitelio intestinal muestran muchos menos signos de envejecimiento.
En el mundo natural, muy pocos animales viven el tiempo suficiente para mostrar signos de envejecimiento. La mortalidad aleatoria por inanición, depredación, enfermedades infecciosas y un ambiente hostil (por ejemplo, frío) mata a la mayoría de los animales mucho antes de que comiencen a mostrar signos de envejecimiento. Incluso para los humanos, el envejecimiento sólo se ha vuelto común en las últimas décadas.
A principios del siglo XX, las enfermedades infecciosas como la neumonía y la influenza causaron más muertes en Estados Unidos que enfermedades “orgánicas” como el cáncer. Ahora la situación se invierte. La disponibilidad de armas eficaces contra enfermedades infecciosas (por ejemplo, saneamiento, antibióticos e inmunización) ha aumentado considerablemente la esperanza de vida promedio (pero no la vida máxima) y ha dado como resultado que enfermedades “orgánicas” como las enfermedades cardiovasculares y el cáncer se conviertan en la causa más común de muerte.
En 1900, un recién nacido en Estados Unidos podría esperar una esperanza de vida promedio de solo 47 años. Las enfermedades infecciosas fueron las principales causas de muerte, matando a la mayoría de las personas antes de que alcanzaran una edad en la que el envejecimiento se Tres cuartos de siglo después, la esperanza de vida había aumentado a 73 años y las enfermedades “orgánicas”, incluidas todas las enfermedades del envejecimiento, habían reemplazado a las enfermedades infecciosas como principal causa de muerte. Hoy en día, la esperanza de vida ha aumentado a 80 para las mujeres (74 para los hombres), y hacer frente al envejecimiento de la población se ha convertido en un importante desafío económico y social en Estados Unidos.

La gráfica anterior muestra cuatro curvas representativas de supervivencia. El eje vertical representa la fracción de supervivientes a cada edad (en el eje horizontal).
- La curva A es característica de organismos que tienen baja mortalidad hasta finales de la vida. Entonces la mortalidad se convierte cada vez más en el punto final del proceso de envejecimiento.
- La curva B es típica de poblaciones en las que factores ambientales como el hambre y la enfermedad oscurecen los efectos del envejecimiento (y la mortalidad infantil en alta).
- La curva C es una curva teórica para organismos para los que la probabilidad de muerte es igual en todas las edades. Este podría ser el caso de organismos que muestran pocos, si los hay, signos de envejecimiento (algunos peces) o aquellos (por ejemplo, pájaros cantores en la naturaleza) que sufren una mortalidad aleatoria severa por causas ambientales a lo largo de la vida.
- La curva D es típica de organismos, ostras por ejemplo, que producen un gran número de crías acompañadas de altas tasas de mortalidad infantil.
Los organismos con curvas de supervivencia entre C y D no tienen oportunidad de mostrar signos de envejecimiento.
Envejecimiento en Invertebrados
Los animales invertebrados han proporcionado algunas pistas importantes sobre el proceso de envejecimiento.
- Los invertebrados coloniales como esponjas y corales no muestran signos de envejecimiento. Incluso los cnidarios individuales, como la anémona de mar que vivió 78 años, muestran poco o ningún signo de envejecimiento. En todos estos casos, esto probablemente se deba a que hay un reemplazo constante de las celdas viejas por nuevas a medida que pasan los años.
- Las langostas también pueden vivir hasta una edad muy avanzada sin signos evidentes de una disminución de la fecundidad o cualquier otro proceso fisiológico. Pero las langostas nunca dejan de crecer, por lo que una vez más puede ser la formación continua de nuevas células lo que mantiene al animal en marcha.
- En los recipientes de cultivo, Drosophila tiene una vida útil limitada y muestra signos de envejecimiento antes de morir. Se han encontrado dos factores que influyen en el proceso de envejecimiento y por lo tanto en la vida útil:
- Restricción calórica, es decir, una dieta de semi-inanición. De hecho, se ha demostrado que restringir la ingesta de alimentos aumenta la esperanza de vida (y ralentiza el envejecimiento) en todos los animales —incluidos los mamíferos— que han sido probados.
- Se han identificado genes individuales que prolongan la vida útil en Drosophila (y también en el invertebrado Caenorhabditis elegans).
Envejecimiento en Vertebrados
Algunos vertebrados de sangre fría peces, anfibios, reptiles tienen una larga vida útil si pueden sobrevivir a los peligros ambientales (se sabe que las tortugas gigantes han alcanzado los 177 años de edad). Estos animales son de sangre fría y crecen tan lentamente que probablemente sucumben a los peligros ambientales antes de que dejen de crecer y comiencen a mostrar signos de envejecimiento. La situación es diferente para las aves y los mamíferos. Son de sangre caliente, crecen rápidamente hasta el tamaño adulto y, si se protegen de los peligros ambientales, mostrarán signos de envejecimiento.
¿Por qué envejecemos?
Programado en nuestros genes
Los pros
- Se han encontrado genes individuales que aumentan la vida útil en Drosophila, C. elegans y ratones. Los genes que suprimen la señalización por insulina y el factor de crecimiento similar a la insulina 1 (Igf-1) aumentan la esperanza de vida en estos animales. Ejemplos:
- Los ratones con uno de sus genes receptores de Igf-1 “noqueados” viven 25% más que los ratones normales.
- Klotho. Las células en el riñón y el cerebro liberan la porción extracelular de una proteína transmembrana de la superficie celular en la sangre. Esta “hormona”, llamada Klotho, se une a receptores en muchas células diana reduciendo su capacidad para responder a la insulina y la señalización de Igf-1.
- Los ratones homocigotos para un gen klotho mutante muestran muchos signos de envejecimiento prematuro, mientras que
- los ratones que expresan niveles extra altos de la proteína Klotho viven 20— 30% más de lo normal.
- La larga vida se extiende claramente en familias humanas.
- El envejecimiento suele aparecer antes en animales que sufren altas tasas de mortalidad por causas externas (por ejemplo, depredación) temprano en la vida.
¿Por qué debería ser esto? Tres posibilidades (interrelacionadas):
- La acumulación de mutaciones dañinas (en la línea germinal). Pocos individuos sobreviven el tiempo suficiente para que estos sean seleccionados contra ellos.
- Pleiotropía antagónica. Se seleccionarán para los genes que promuevan la supervivencia temprana en la vida a expensas de mantener el cuerpo.
Algunos ejemplos:- p53. Al obligar a las células con ADN dañado a dejar de dividirse y volverse senescentes o incluso a morir por apoptosis, protege al organismo de la amenaza de que esas células se vuelvan cancerosas pero a costa de reducir la renovación celular (por ejemplo, al disminuir el tamaño de las reservas de células madre). Los ratones que se ven obligados a producir niveles más altos de lo normal de la proteína p53 muestran muchos signos de envejecimiento prematuro, mientras que las hembras deficientes en p53 tienen fecundidad reducida (los blastocistos no logran implantarse). Entonces aquí hay una compensación por un gen que promueve el éxito evolutivo a una edad temprana pero a expensas del envejecimiento acelerado.
- Tanto en Drosophila como en C. elegans, algunas mutaciones que aumentan la esperanza de vida lo hacen a costa de la disminución de la fecundidad y viceversa.
- Soma desechable. La muerte temprana por causas externas seleccionará genes que aumenten las posibilidades de transmitir germoplasma (es decir, reproducción) a expensas de genes que podrían retrasar el envejecimiento.
- No hay manera de que la selección natural pueda seleccionar para genes cuyo único efecto beneficioso aparece una vez terminada la edad de reproducción. Pero
- cualquier gen que extienda el período reproductivo o
- cualquier gen que promueva la aptitud en la juventud así como la longevidad
Los contras
La alta mortalidad temprana por causas externas (por ejemplo, depredadores) se ha relacionado con el envejecimiento temprano (en los sobrevivientes) en algunos animales, pero lo contrario se ha encontrado en otros. Estos resultados contradictorios no niegan el papel de los genes en el envejecimiento, sino que indican que otros factores ambientales (por ejemplo, quedan más alimentos para los sobrevivientes) pueden sesgar el resultado.
La inevitable consecuencia de una vida activa
Los pros
- Muchos vertebrados de sangre fría (por ejemplo, muchos peces y reptiles) no muestran signos de envejecimiento.
- Los ratones transgénicos cuyo “termostato” en el hipotálamo se ha restablecido para dar una temperatura corporal más baja (reducida en 0.3 — 0.5°C) viven 12% (machos) a 20% (hembras) más que sus compañeros de camada no transgénicos. Esto se traduce en agregar unos 3 meses a la vida promedio de 27 meses para estos ratones. (Ver Conti, B., et al. , Ciencia, 3 de noviembre de 2006).)
- Los efectos de la Restricción Calórica (RC). La vida útil de las levaduras, C. elegans, Drosophila, aves y mamíferos (ratones, ratas y probablemente monos) puede prolongarse, y los signos de envejecimiento se retrasan, si se mantienen con una dieta de semi-inanición. Restricción calórica en ratones causa
- una caída en
- el nivel de insulina circulante y factor de crecimiento similar a la insulina 1 (IGF-1);
- el nivel de glucosa y triglicéridos en la sangre;
- el nivel de NADH (producido por la respiración celular) dentro de las células;
- un incremento en la producción de sirtuinas — desacetilasas que eliminan los grupos acetilo de las proteínas.
- apoptosis de las células que se van a inhibir;
- formación de tejido adiposo a suprimir;
- aumento de la producción de óxido nítrico (NO) que es esencial para que los beneficios de la CR surtan efecto.
- aumentó en gran medida la actividad física y
- menor peso corporal.
Los efectos que prolongan la vida y otros efectos de la RC en ratas y ratones pueden no ser tan significativos como parecen. Todos los estudios se han realizado en ratas y ratones de laboratorio. Los animales de control normalmente se alimentan ad libitum, lo que significa que tienen comida disponible todo el tiempo. Pero este no sería probablemente el caso en la naturaleza por lo que puede ser que la fisiología y la esperanza de vida de estos animales ya estén comprometidas y que los efectos de la RC estén restaurando principalmente las condiciones normales para estas especies.
El problema de los controles adecuados también puede explicar los resultados divergentes en estudios de RC en monos rhesus.
- En la edición del 10 de julio de 2009 de Science, investigadores del Centro Nacional de Investigación de Primates de Wisconsin reportaron el estado de los monos rhesus que habían estado en RC durante 20 años en comparación con un grupo control permitido alimentar ad libitum con la misma dieta durante ese tiempo. Los resultados: los animales CR mostraron marcadamente menos signos de envejecimiento (ninguno mostró signos de diabetes), y los pocos que murieron por causas relacionadas con la edad lo hicieron a solo un tercio de la tasa de los controles.
- Sin embargo, un estudio de 25 años de RC en monos rhesus realizado en el Instituto Nacional del Envejecimiento (NIA) (y reportado en Nature en agosto de 2012) no mostró aumento de longevidad en los monos CR.
La diferencia puede haber surgido porque los monos testigo en Wisconsin fueron alimentados ad libitum mientras que los controles en el NIA fueron alimentados con una cantidad fija. Además, la dieta utilizada en el estudio de Wisconsin fue mucho mayor en azúcar que la dieta en el NIA, y las dietas NIA también incluyeron ácidos grasos omega-3 y otros componentes saludables ausentes de la dieta de Wisconsin. Entonces, tal vez el efecto positivo visto en el estudio de Wisconsin resultó de que los animales CR simplemente recibían menos dieta poco saludable que los controles.
- una caída en
Resveratrol
El resveratrol, es una pequeña molécula que se encuentra en el vino tinto que parece activar las sirtuinas imitando los efectos de la restricción calórica. Los ratones que reciben dosis diarias de resveratrol mientras se entregan a una dieta alta en grasas engordan pero evitan los cambios degenerativos y la vida acortada que normalmente acompañan a una dieta alta en grasas. Pero antes de salir corriendo a comprar vino tinto, darse cuenta de que las dosis de resveratrol administradas a los ratones eran mucho mayores de lo que se podría suministrar al beberlo. Los estudios sobre el efecto del resveratrol en la prolongación de la vida útil en levaduras, Drosophila y C. elegans han producido resultados mixtos.
Nadie sabe con certeza por qué la restricción calórica retrasa el envejecimiento, pero algunos mecanismos podrían deberse a que disminuye el nivel de glucosa en la sangre y con ello la velocidad con la que los lípidos y las proteínas sufren de glicación. Los productos de licación enriquecida (AGE) son moléculas que tienen una función reducida debido a la adición fortuita de azúcares a los mismos. Para proteínas como colágenos y elastina, este resultado es aumentar la rigidez de la matriz extracelular (MEC) de los vasos sanguíneos, articulaciones, corazón, riñón, etc. La reducción de la ingesta de calorías reduce la fecundidad femenina (al menos en C. elegans, Drosophila, ratas y ratones). La energía que se habría dedicado a producir descendencia puede dedicarse en cambio a la reparación y mantenimiento de tejidos. La restricción calórica eleva el nivel de sirtuinas:
- La proteína SIRT1 CR en ratones knockout que carecen de SIRT1 no aumenta la esperanza de vida.
- juega un papel clave en la reparación del daño del ADN y, por lo tanto, ayuda a proteger la integridad del genoma que parece ser esencial para la longevidad.
- También inhibe el sensor de nutrientes TOR (“diana de la rapamicina”) que acelera el envejecimiento en ratones.
- SIRT1 también inhibe la activación de p53 protegiendo así contra el daño mitocondrial.
- La proteína SIRT3 se encuentra en las mitocondrias donde inhibe la producción de radicales libres.
La teoría de los radicales libres del envejecimiento
Un aspecto importante del metabolismo es la oxidación de los alimentos por las mitocondrias. El transporte de electrones en las mitocondrias genera especies reactivas de oxígeno (” ROS “) como el anión superóxido (O 2 −), que genera peróxido de hidrógeno (H 2 O 2). Aunque las células contienen enzimas para desintoxicar estas sustancias reactivas (por ejemplo, catalasa que descompone H 2 O 2), eventualmente e inevitablemente dañan macromoléculas en la célula: proteínas; lípidos; y probablemente lo más importante de todo, el ADN.
Las proteínas y lípidos dañados se acumulan en la célula, especialmente las células que no se dividen como las neuronas y los músculos, produciendo agregados de proteínas desnaturalizadas y un “pigmento envejecido” llamado lipofuscina (un componente principal de la cera del oído). La acumulación de agregados proteicos en los músculos estriados reduce la fuerza muscular. Los agregados proteicos se acumulan más lentamente en las células de los animales con una dieta restringida en calorías, tal vez como resultado de una autofagia más eficiente. Sin embargo, puede ser el daño al ADN el factor crucial en la disminución de la función celular con la edad.
El ADN de las mitocondrias (ADNmt) puede estar en especial riesgo. Las ROS se producen como un subproducto inevitable del transporte de electrones en las mitocondrias y por lo tanto se generan cerca del ADNmt. Pero los productos de estos genes son esenciales para el transporte de electrones. Entonces tal vez se genere un bucle de retroalimentación positiva: ROS -> mutaciones en genes de transporte de electrones reduciendo su eficiencia -> más producción de ROS.
Evidencia de apoyo:
- El ADNmt acumula mutaciones más rápido que el ADN nuclear, y estos muestran las características químicas del daño por ROS.
- Los ratones transgénicos que contienen el gen humano para la catalasa (pero con la señal de focalización que normalmente enviaría la proteína a peroxisomas reemplazados por el de las mitocondrias) viven 20% más de lo normal para su cepa. [Ver Schriner, S. E. et al., Science, 24 de junio de 2005.]
- Los ratones transgénicos cuya ADN polimerasa para copiar genes de ADNmt (ADN polimerasa gamma) es defectuosa e introduce un elevado número de mutaciones en el ADNmt, muestran muchos signos de envejecimiento prematuro —tanto celular como en diversos sistemas de órganos— y mueren temprano.
Los contras
- Ni los ratones genéticamente modificados para sobreproducir radicales libres, ni los diseñados para producir menores cantidades de radicales libres, tienen ningún cambio en su vida útil.
- Los murciélagos y ratones son similares en tamaño y tasa metabólica, pero los murciélagos pueden vivir diez veces más tiempo.
- Aunque las levaduras carentes de glucosa viven más tiempo, tienen una tasa de respiración celular incrementada —no disminuida—.
- La tasa metabólica de los ratones con dieta CR no es menor que la de los ratones con dieta normal.
- Los efectos beneficiosos de la RC se afianzan en cualquier momento, al menos en Drosophila. Incluso después de tres semanas con una dieta rica (en la segunda mitad de la vida normal de las moscas adultas), cambiar a una dieta CR reduce la mortalidad al mismo grado que las moscas mantenidas en RC a lo largo de su vida adulta. Lo contrario también es cierto: cambiar de una dieta CR a una dieta rica rápidamente deshace el buen trabajo de la primera. Estos resultados sugieren que si una dieta rica produce daños irreversibles y acumulativos, sus efectos nocivos sobre la vida pueden ser embotados en cualquier momento.
La acumulación de células senescentes
Senescencia cronológica
Una vez formadas, algunas células de un ratón o humano nunca son reemplazadas. Una neurona formada durante el desarrollo embrionario puede seguir funcionando al final de la vida. Sin embargo, durante su vida útil, el daño a sus orgánulos y ADN puede acumularse dando como resultado una pérdida de función. A esto se le llama senescencia cronológica. En otros tejidos, por ejemplo, la sangre y los epitelios, las células nuevas reemplazan a las viejas durante toda la vida. Pero a pesar de ser nuevos, pueden tener una función reducida debido a la senescencia replicativa.
Senescencia replicativa
Se podría esperar que las células extraídas de un ratón o ser humano y colocadas en cultivo de tejidos puedan cultivarse indefinidamente, pero ese no es el caso. Cuando los fibroblastos humanos, por ejemplo, se colocan en cultivo, proliferan al principio, pero eventualmente llega un momento en que su tasa de mitosis se ralentiza y finalmente se detiene. Las células continúan viviendo por un tiempo, pero no pueden pasar de G 1 a la fase S del ciclo celular. Este fenómeno se llama senescencia replicativa. Los fibroblastos tomados de un humano joven pasan por alrededor de 60—80 duplicaciones antes de alcanzar la senescencia replicativa.
¿Por qué debería ser esto? Las células —a menos que retengan la enzima telomerasa— pierden ADN de las puntas de sus cromosomas (telómeros) con cada división celular. En general, los telómeros en las células de animales viejos son mucho más cortos que los de los animales jóvenes. Un estudio reciente de aves de corta vida versus de larga vida mostró que el acortamiento de los telómeros fue más rápido en las especies de corta vida. Y una especie, un petrel que vive cuatro veces más tiempo que otras aves de su tamaño, en realidad tiene telómeros que crecieron más con la edad. La mayoría de las células somáticas del cuerpo dejan de expresar telomerasa. Sin embargo, las células genéticamente manipuladas para expresar telomerasa mucho después de que debieron haberse detenido, evitan la senescencia replicativa. Las células germinales, por ejemplo, espermatogonia, y algunas células madre continúan expresando la enzima. Alrededor del 95% de las células cancerosas expresan telomerasa. Si los telómeros se vuelven demasiado cortos (menos de 13 repeticiones en las células humanas), se producen anomalías cromosómicas —un sello distintivo del cáncer—. El cáncer se puede evitar si la célula detecta esta peligrosa condición y deja de dividirse. Por lo que el acortamiento de los telómeros puede proteger contra el cáncer al precio de la senescencia celular.
Dos proteínas codificadas por los genes supresores de tumores p53 y p16 INK4a desempeñan un papel fundamental en la detención del ciclo celular. El resultado: senescencia replicativa. Entonces la senescencia replicativa puede ser el precio que pagamos por eliminar las células del ciclo celular antes de que puedan acumular las mutaciones que las convertirían en células cancerosas.
El papel de las proteínas supresoras tumorales en la senescencia replicativa se refleja en el animal intacto, al menos en ratones.
- Los ratones diseñados para expresar niveles anormalmente altos de actividad de p53 muestran muchos signos de envejecimiento prematuro, incluida la reducción prematura en la longitud de sus telómeros.
- Ratones
- que expresan niveles anormalmente altos de p16 Ink4a tienen una capacidad reducida para regenerar tejido mientras
- los ratones cuya actividad de p16 INK4a se suprime continúan reparando el tejido dañado tan eficientemente como lo hacen los animales jóvenes.
- En ratones, eliminar las células senescentes (son altas en p16 INK4a) previene (en ratones jóvenes) y revierte parcialmente (en ratones mayores) algunos de los signos del envejecimiento como las cataratas, y la pérdida de tejido adiposo y masa muscular esquelética.
- Ratones genéticamente diseñados para expresar altos niveles de
- telomerasa y
- genes supresores de tumores (por ejemplo, p53 y p16 INK4a)
El papel de la deficiencia de telomerasa en el envejecimiento de los mamíferos
Los ratones cuyos genes para la telomerasa han sido “noqueados” (ya sea Tert −/− o Terc −/−) muestran muchos de los cambios degenerativos asociados con el envejecimiento.
- El número de mitocondrias en sus células disminuye al igual que la función de las que permanecen.
- Disminuye el consumo de oxígeno y la producción de ATP.
- La eficiencia de la cadena de transporte de electrones disminuye.
- Esto conduce a una mayor generación de especies reactivas de oxígeno (ROS).
- El nivel de actividad de p53 aumenta.
- disminución de la mitosis
- la apoptosis de las células aumenta
- aumenta la senescencia replicativa
- La anatomía y función de órganos como el hígado y el corazón muestran los cambios degenerativos de la edad.
En el número 6 de enero de 2011 de Nature, Mariela Jaskelioff y sus colegas (muchos del mismo equipo que encontraron los resultados descritos en el apartado anterior) informan que la reactivación de la telomerasa en ratones envejecidos revierte muchos signos de envejecimiento.
Sus animales experimentales eran otra cepa de ratones deficientes en telomerasa; es decir, ratones que no podían producir telomerasa ni siquiera en esas células —células madre “adultas” y células de la línea germinal— que normalmente retienen la actividad telomerasa. Los ratones se fabricaron mediante “knocking-in” de un gen que impide cualquier expresión de transcriptasa inversa de telómeros (TERT) a menos que se le administre un fármaco activador al animal. Sin el medicamento, estos ratones viven la mitad de lo normal, y a medida que envejecen, muestran muchos signos de envejecimiento:
- sus telómeros se acortan, lo que lleva a aberraciones cromosómicas;
- sus células experimentan senescencia replicativa temprana;
- casi todos sus órganos —testículos, bazo, intestino, cerebro— muestran cambios degenerativos típicos del envejecimiento.
PERO, si se le administra el fármaco activador durante un periodo de cuatro semanas en un momento en que los cambios degenerativos ya eran aparentes (25-30 semanas), su deterioro se detuvo e incluso se invirtió parcialmente.
- la longitud de sus telómeros aumentó;
- la senescencia replicativa se retrasó;
- su vida útil se incrementó sustancialmente;
- su cerebro, testículos, hígado, bazo e intestino escaparon de los cambios degenerativos observados en ratones deficientes en telomerasa no tratados;
- produjeron camadas más grandes que los ratones no tratados;
- se redujo la activación de p53, lo que indica
- redujo el daño a su genoma y
- reducción de la apoptosis en sus tejidos
¿Cómo conduciría la senescencia replicativa de las células al deterioro de la estructura y función de los tejidos envejecidos (por ejemplo, la piel) en los que residen? En los tejidos, por ejemplo, la piel y otros epitelios, donde la mitosis debe continuar durante toda la vida para reemplazar las células que se pierden, la acumulación de células senescentes —incapaces de continuar la mitosis— podría conducir a los cambios característicos del envejecimiento en ese tejido.
- Un mecanismo podría ser simplemente la incapacidad de las células senescentes para reparar el tejido por mitosis.
- Sin embargo, las células senescentes permanecen activas aunque los genes que expresan cambian. Quizás las proteínas que secretan (e.g., enzimas que digieren colágeno) provocan los cambios de envejecimiento en el tejido donde residen.
- Quizás sea la senescencia de las células madre adultas la que mayor efecto tiene sobre el envejecimiento de los tejidos. En ratones knockout que no pueden producir la proteína Klotho, las células madre y las células progenitoras en diversos tejidos experimentan senescencia y disminución en el número.
¿Una compensación inevitable?
Algunos de los datos hasta ahora sugieren que los esfuerzos para evitar los cambios degenerativos que vienen con la edad (por ejemplo, aumentando la renovación celular por medio de una mayor actividad de la telomerasa) con la esperanza de aumentar la longevidad pueden acelerar la muerte por cáncer mientras que los esfuerzos para prevenir el cáncer (por ejemplo, aumentando la actividad de genes supresores de tumores) pueden apresurar el envejecimiento. Sin embargo, otra evidencia pinta un cuadro menos sombrío. Los ratones heterocigotos para el gen supresor de tumores p53 (p53 +/−) desarrollan muchos cánceres cuando se exponen a radiación ionizante. Con una sola copia de este supresor tumoral, una sola célula corre un gran riesgo de perder la copia restante (“pérdida de heterocigosidad”) e iniciar el crecimiento de un clon maligno. Sin embargo, si antes de ser irradiados a los ratones se les administra resveratrol —para estimular la producción de la proteína SIRT1 anti-envejecimiento— se reduce la incidencia de algunos cánceres y los ratones viven más tiempo antes de sucumbir a sus tumores.
La acumulación de errores genéticos
Los pros
- Los ratones que recibieron radiación ionizante que daña el ADN muestran un envejecimiento temprano.
- Ratones transgénicos con defecto en la función “correctora” de la ADN polimerasa responsable de copiar el ADN mitocondrial
- acumulan muchas mutaciones en sus genes mitocondriales;
- muestran signos marcados de envejecimiento prematuro.
- Las células tomadas de ratones viejos (y humanos viejos) muestran niveles ligeramente elevados de mutaciones somáticas y anomalías cromosómicas como translocaciones y aneuploidía. Muchos de estos cambios también causan cáncer por lo que no es casualidad que la incidencia de cáncer aumente con el avance de la edad (gráfica).
- Las células madre hematopoyéticas de ratones “knockout” deficientes en cualquiera de estas enzimas necesarias para el mantenimiento del genoma
- XPD para reparación por escisión de nucleótidos (NER)
- Ku80 para unión de extremos no homólogos (NHEJ)
- TR (ARN de telomerasa) necesario para el mantenimiento de los telómeros
- La mayoría de las células madre hematopoyéticas en ratones envejecidos muestran evidencia de roturas bicatenarias (DSB) en su cromatina.
- A medida que se forman las DSB, las proteínas SIRT1 se mueven desde sus ubicaciones originales (en los promotores génicos) a las ubicaciones de las DSB (donde reclutan proteínas reparadoras del ADN). Esto desplaza el patrón de expresión génica a uno típico de las células envejecidas.
- Las células tomadas de personas mayores (y personas con síndromes de envejecimiento prematuro) muestran marcadas reducciones en la transcripción de algunos genes, aumentos en otros.
Pistas del Transcriptoma de Cerebros Envejecidos
Un grupo de investigadores de Harvard informó (en la edición del 26 de junio de 2004 de Nature) los resultados de su estudio de la expresión génica en el cerebro humano. Extrajeron el ARN del tejido cerebral autopsiado de 30 personas que habían muerto a edades que iban de 26 a 106. Analizaron el ARN con chips de ADN buscando el nivel de actividad de unos 11 mil genes diferentes (el transcriptoma). Surgió un patrón claro.
El nivel de actividad de unos 400 genes cambió con el tiempo.
- La expresión génica disminuyó en la vejez para muchos genes. Algunos ejemplos:
- genes que codifican proteínas involucradas en la actividad sináptica en el cerebro (por ejemplo, aprendizaje, memoria)
- Receptores NMDA, AMPA, GABA A
- quinasa II dependiente de calmodulina de calcio (CaMKII)
- genes involucrados en las funciones mitocondriales, tales como
- producción de ATP (necesaria para la reparación del ADN)
- producción de especies reactivas dañinas de oxígeno (ROS)
- genes que codifican proteínas involucradas en la actividad sináptica en el cerebro (por ejemplo, aprendizaje, memoria)
- La expresión génica aumentó en la vejez para otros genes. Algunos ejemplos:
- genes involucrados en la inflamación y otras defensas inmunitarias;
- genes que codifican proteínas involucradas en la defensa contra especies reactivas de oxígeno (ROS);
- genes que codifican proteínas involucradas en la reparación del ADN.
La transición del transcriptoma juvenil al transcriptoma del cerebro envejecido se produjo en diferentes momentos desde tan jóvenes como 42 a tan viejos a los 73.
Un estudio de células individuales del músculo cardíaco en ratones jóvenes y viejos (Bahar, R. et al., Nature, 22 de junio de 2006) demostró que el transcriptoma de células jóvenes era bastante uniforme de célula a célula pero el de células envejecidas era altamente variable de una célula a otra. La expresión génica variable de una célula a otra en un solo tejido bien podría conducir a defectos en el funcionamiento de ese tejido.
Pistas de síndromes de envejecimiento prematuro
Los humanos padecen una serie de enfermedades genéticas raras que, entre otras cosas, producen signos de envejecimiento prematuro, por ejemplo, canas, piel arrugada y vida útil acortada. En varios casos, los genes mutados son aquellos que tienen papeles que desempeñar en el mantenimiento de la integridad del genoma, es decir, en la reparación del ADN.
- Síndrome de Werner. El cabello de los pacientes se vuelve gris a los 20 años y la mayoría muere a finales de los 40 con signos de edad como osteoporosis, cataratas y aterosclerosis. Incluso cuando son jóvenes, sus células experimentan senescencia replicativa después de solo ~20 duplicaciones en lugar de las 70 normales o más. Causado por mutaciones en WRN, que codifica una helicasa necesaria para la reparación del ADN y el mantenimiento de los telómeros.
- Síndrome de Cockayne (CS). Causado por mutaciones en genes necesarios para la reparación del ADN, especialmente la reparación del ADN acoplado a la transcripción. Si bien estas personas muestran solo algunos de los signos del envejecimiento, sí tienen una esperanza de vida muy reducida.
- Ataxia telangiectasia (AT). Estos pacientes muestran signos de envejecimiento prematuro. Carecen de un producto de gen funcional (ATM) necesario para detectar daños en el ADN e iniciar una respuesta de reparación.
- Síndrome de progeria de Hutchinson-Gilford. Los niños con este raro trastorno muestran muchos signos de envejecimiento severo al cumplir segundo año y mueren en la adolescencia temprana. Causada por mutaciones en el gen (LMNA) para lamin la proteína de filamento intermedio que estabiliza la membrana interna de la envoltura nuclear. La maquinaria para la replicación, transcripción y reparación del ADN se encuentra en la superficie interna de la envoltura nuclear, y las células de estos pacientes tienen un mayor daño en el ADN y otros defectos en la expresión génica.
Por lo que estos síndromes sugieren que el envejecimiento puede ser consecuencia no tanto de mutaciones en general, sino de mutaciones en aquellos genes cuyos productos son esenciales para la replicación, reparación y transcripción libres de errores de todos los genes.
¿Por qué un ratón es tan viejo a los 2 años como un humano a los 70
Si el envejecimiento representa la consecuencia inevitable de una falla en la reparación del ADN, ¿por qué ocurre tanto antes en algunos mamíferos (por ejemplo, ratones) que en otros (por ejemplo, elefantes y humanos)?
La respuesta probablemente radica en el riesgo de muerte por factores externos (por ejemplo, depredación, inanición, frío) en esa especie.
Como se señaló anteriormente, pocos mamíferos pequeños alguna vez envejecen porque mueren temprano por causas externas. Estos animales son r-estrategas, poniendo su energía en rápidamente
- alcanzar la madurez sexual
- produciendo un gran número de crías que pronto pueden vivir de forma independiente
No hay una ventaja selectiva para que inviertan en la maquinaria de reparación eficiente del ADN porque van a morir antes de que las mutaciones se conviertan en un problema.
Los humanos, en contraste, son K-estrategas. Tardan mucho tiempo en llegar a la madurez sexual. También producen pequeñas cantidades de jóvenes que deben ser atendidos durante un largo periodo. No es de extrañar, entonces, que la evolución en humanos (y otros mamíferos de larga vida) haya seleccionado genes que promueven la reparación eficiente del ADN.
La tabla muestra que la eficiencia de la reparación del ADN se correlaciona directamente con la vida útil en una variedad de mamíferos.
| Correlación entre la vida útil y la efectividad relativa de la reparación del ADN en células de ciertos mamíferos. En cada caso, las células que crecían en cultivo de tejidos se irradiaron con luz ultravioleta y luego se determinó la eficiencia con la que repararon su ADN. (De la obra de R. W. Hart y R. B. Setlow, 1974.) | ||
|---|---|---|
| Especies | Vida útil promedio, año | Efectividad relativa de la reparación del ADN |
| Humano | 70 | 50 |
| Elefante | 60 | 47 |
| Vaca | 30 | 43 |
| Hámster | 4 | 26 |
| Rata | 3 | 13 |
| Ratón | 2 | 9 |
| musaraña | 1 | 8 |
Interrelaciones
Examinar los diversos factores que han estado implicados en el proceso de envejecimiento sugiere que la mayoría —quizás todos— están interrelacionados.
- Disfunción de las mitocondrias con la producción de
- especies reactivas de oxígeno (ROS) con su efecto perjudicial sobre
- ADN y otros constituyentes celulares acoplados con
- inicio de senescencia replicativa para que las células dañadas ya no puedan ser reemplazadas
todos pueden desempeñar papeles importantes. Por lo que los factores descritos anteriormente no son de ninguna manera mutuamente excluyentes.
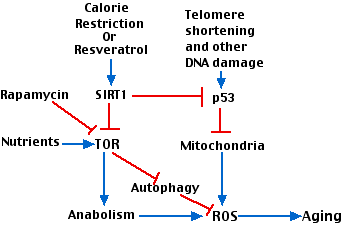
La figura anterior intenta mostrar cómo interactúan diversos factores involucrados en el envejecimiento. Los jugadores clave son
- El acortamiento gradual de telómeros con divisiones celulares repetidas.
- p53.
- la enzima designada TOR (” t arget o f r apamicina”). TOR es una quinasa que participa en muchas vías metabólicas en la célula. (Es inhibida por el antibiótico rapamicina que se utiliza como inmunosupresor).
Las interacciones estimuladoras se muestran con flechas azules; las interacciones inhibitorias se muestran en rojo.
Interacciones:
- El acortamiento de los telómeros activa p53 lo que conduce a mitocondrias dañadas.
- La ineficiente cadena de transporte de electrones en las mitocondrias dañadas produce ROS.
- Los abundantes nutrientes (ej. aminoácidos) así como otros estimulantes del crecimiento activan TOR que promueve el anabolismo (síntesis de proteínas y lípidos) con la producción concomitante de especies reactivas de oxígeno (ROS) y el envejecimiento.
- La restricción calórica, trabajando a través de SIRT1 inhibe TOR y sus efectos aguas abajo.
- La inhibición de TOR alivia su inhibición de la autofagia permitiendo que las células eliminen, por ejemplo, mitocondrias dañadas.
- SIRT1 inhibe la activación de p53 protegiendo así contra el daño mitocondrial.
Debido a la asociación entre el acortamiento de los telómeros y el envejecimiento, dos empresas han comenzado (en 2011) a ofrecer pruebas de longitud de telómeros. Queda por ver cómo tales pruebas podrían ser útiles para las personas que las piden.
Las señas de identidad del envejecimiento
En la edición del 6 de junio de 2013 de Cell, un grupo internacional de científicos desarrolló una lista de 9 características que caracterizan el envejecimiento en animales. (Este esfuerzo por poner orden a un tema tan complejo recuerda a artículos anteriores de la misma revista, The Hallmarks of Cancer.)
Esperaban que cada sello cumpliera por lo menos con dos de tres criterios.
- Debe ser característico del envejecimiento normal.
- El aumento de la expresión del sello debería resultar en un envejecimiento más rápido.
- Los esfuerzos para reducir la expresión del sello deben prolongar una vida saludable (“healthspan”).
Las 9 señas de identidad.
1. Inestabilidad genómica
Cumpliendo con los criterios:
- Las células envejecidas contienen más daño al ADN que las jóvenes.
- Los agentes que aumentan el daño no reparado al ADN, incluido el daño cromosómico (por ejemplo, aneuploidía), aceleran el envejecimiento.
- Evidencia limitada de que los tratamientos que reducen, por ejemplo, la segregación errónea cromosómica, prolongan la salud.
2. Atrición de Telómeros
Cumpliendo con los criterios:
- Los cromosomas de las células envejecidas tienen telómeros más cortos que los de las células jóvenes.
- Los ratones deficientes en telomerasa muestran envejecimiento prematuro.
- Los tratamientos que reactivan la telomerasa en ratones normales retrasan el envejecimiento.
3. Alteraciones Epigenéticas
Cumpliendo con los criterios:
- Los patrones de metilación del ADN y modificaciones de histonas cambian a medida que un mamífero envejece.
- Los ratones deficientes en la sirtuina SIRT6, enzima que desacetila las histonas, envejecen más rápidamente de lo normal.
- Los tratamientos que incrementan la actividad de las sirtuinas incrementan la salud en ratones.
A medida que los humanos envejecemos, el ADN en nuestras células acumula un número cada vez mayor de cambios epigenéticos medidos por la metilación de los CPG. Esto es cierto para una amplia variedad de tipos celulares incluso los que se han formado recientemente; es decir, el número de cambios epigenéticos refleja la edad del donante no la edad de la célula. La correlación es tan buena que el análisis de estos cambios en una célula puede predecir la edad del donante a veces en cuestión de meses.
4. Pérdida de Proteostasis La
proteostasis es la homeostasis del proteoma, el equilibrio adecuado de la síntesis y degradación de las proteínas en la célula.
Cumpliendo con los criterios:
- El aclaramiento de proteínas desnaturalizadas (desplegadas) por autofagia y proteasomas, así como la capacidad de replegarlas con chaperonas, todas disminuyen con la edad. El resultado: agregados proteicos tóxicos que se acumulan en células envejecidas.
- Los ratones mutantes con actividad chaperona defectuosa envejecen más rápidamente.
- Drosophila transgénica y C. elegans que sobreexpresan chaperonas han aumentado la vida útil.
5. Detección de Nutrimentos Derigulados
Cumpliendo con los criterios:
- El sensor de nutrientes TOR (“diana de la rapamicina”), que promueve el anabolismo, aumenta durante el envejecimiento normal (y produce obesidad, al menos en ratones).
- El aumento de la actividad de TOR acelera el envejecimiento en ratones.
- Ejemplos:
- La supresión genética de la señalización TOR extiende la vida útil en Drosophila y C. elegans.
- La Restricción Calórica (RC), que inhibe la TOR, aumenta la salud en todos los animales en los que se ha probado.
- La rapamicina, que inhibe la TOR, prolonga la vida útil en Drosophila, C. elegans y ratones.
6. Disfunción mitocondrial
Cumpliendo con los criterios:
- La producción y eficiencia de las mitocondrias disminuye en el envejecimiento, por lo demás normal, de los ratones.
- Las mutaciones deletéreas en el ADN mitocondrial y otros defectos en la función mitocondrial aceleran el envejecimiento en ratones.
- Aún no hay evidencia convincente de que los tratamientos para mejorar la función mitocondrial aumenten la vida útil.
7. Senescencia Celular
Cumpliendo con los criterios:
- La senescencia replicativa (células que ya no pueden ingresar al ciclo celular) se establece mucho antes en las células de animales envejecidos que en animales jóvenes.
- Los ratones diseñados para expresar niveles anormalmente altos de p53, una proteína que bloquea la entrada al ciclo celular, muestran muchos signos de envejecimiento prematuro.
- En ratones, la eliminación de las células senescentes previene (en ratones jóvenes) y revierte parcialmente (en ratones mayores) algunos de los signos del envejecimiento como las cataratas, y la pérdida de tejido adiposo y masa muscular esquelética.
8. Agotamiento de Células Madre
Cumpliendo con los criterios:
- La capacidad proliferativa de las células madre adultas disminuye con la edad en los tejidos examinados.
- Agotar deliberadamente el charco de células madre en el intestino de Drosophila conduce al envejecimiento prematuro.
- El trasplante de células madre de ratones jóvenes a ratones envejecidos mejora los cambios degenerativos del envejecimiento y prolonga su vida.
9. Comunicación intercelular alterada
Todas las células responden a señales químicas en su entorno. Estas incluyen citocinas secretadas por células cercanas (estimulación paracrina).
Cumpliendo con los criterios:
- La inflamación en diversos tejidos —mediada por la secreción de una variedad de citocinas— aumenta en los ancianos.
- Los ratones modificados genéticamente que son incapaces de regular a la baja los ARNm que sintetizan citocinas proinflamatorias muestran un envejecimiento acelerado.
- La inhibición de la citocina proinflamatoria NF-κB retrasa el envejecimiento en ratones. Incluso un agente antiinflamatorio tan simple como la aspirina parece prolongar la vida en ratones.
Relaciones de las señas de identidad
- Las primeras 4 señas de identidad parecen representar los eventos iniciadores que conducen al envejecimiento.
- Los sellos 5, 6 y 7 parecen representar el daño producido cuando la celda intenta responder al daño causado por los primeros 4 sellos distintivos.
- Tomados en conjunto, los sellos 1 a 7 producen el fenotipo de envejecimiento visto en los sellos 8 y 9, los cuales son en última instancia responsables de la disminución con la edad en la función de las células y del organismo del que forman parte.
¿Un Elixir de la Juventud?
A pesar de años de investigación, solo se han descubierto tres intervenciones que ralentizan el proceso de envejecimiento y/o prolongan la vida.
- Restricción Calórica (CR). Funciona en todos los animales probados.
- Rapamicina. Extiende la vida útil en ratones, Drosophila y C. elegans pero no parece revertir ni detener los cambios degenerativos del envejecimiento.
- Parabiosis. Cuando el sistema circulatorio de un ratón joven se une al de un ratón viejo (la técnica se llama parabiosis), varios tejidos del ratón viejo, por ejemplo, su músculo esquelético, músculo cardíaco, hígado y sistema nervioso central, se rejuvenecen. Un candidato prometedor para mediar este efecto es una proteína llamada GDF11 (“Factor de Diferenciación de Crecimiento 11"). (GDF11 también se conoce como BMP-11). Las inyecciones de GDF11 recombinante son casi tan efectivas como la parabiosis. GDF11 probablemente actúa estimulando la actividad de las células madre. Sin embargo, aún no hay evidencia de que aumente la vida útil de los ratones.
Envejecimiento en organismos unicelulares
Solía pensarse que muchos organismos unicelulares, como la levadura y las bacterias, eran inmortales; es decir, ellos
- nunca envejecido sino que simplemente siguió dividiéndose para producir nuevos individuos;
- no tenían la distinción entre línea germinal (inmortal) y soma (mortal) que tienen los organismos multicelulares.
Si es true, cada vez que una celda se divide, las dos celdas hijas serían idénticas en todos los aspectos a la padre (división simétrica).
Pero al menos para la levadura y E. coli, este no es el caso.
Las células de levadura envejecen y, como se discutió anteriormente, han demostrado ser útiles para estudiar el proceso de envejecimiento. Colocando una sola célula de levadura en medio sólido y retirando a su hija (la yema) cada vez que se produce una, resulta que el número de veces que la célula madre puede formar un nuevo brote por mitosis es limitado. Después de producir un brote unas 20 a 30 veces, la célula madre muestra una serie de cambios celulares dañinos (por ejemplo, mitocondrias defectuosas) y muere.
Pero, al menos temprano en su vida, los cogollos nacen con el potencial de una vida plena. Por lo que la división mitótica debe ser asimétrica con las propiedades del cogollo diferentes a las de su progenitor. Ahora se han demostrado varios mecanismos por los cuales esto ocurre.
- Se forma una barrera de difusión en el cuello entre la célula madre y su brote. Esta barrera impide el paso de la madre al brote de componentes nucleares dañados, por ejemplo, fragmentos de ADN similares a plásmidos producidos durante la vida de la madre. En contraste con la situación en la mayoría de los eucariotas, en las levaduras no hay ruptura de la envoltura nuclear durante la mitosis. Durante la anafase, la envoltura nuclear crece y la porción que encierra los cromosomas hijos ingresa al brote. Sin embargo, la barrera en el cuello mantiene todos los complejos de poros nucleares (NPC) preexistentes dentro de la célula madre y estos retienen los fragmentos de ADN y quizás otros componentes nucleares dañados.
- La mayoría de los componentes citoplásmicos dañados, como las proteínas desnaturalizadas por especies reactivas de oxígeno (ROS) que resultan en la formación de agregados no funcionales, se unen a las mitocondrias envejecidas y al retículo endoplásmico, ambos retenidos en la célula madre. Cualquier agregado proteico que pase es disuelto por las chaperonas en la yema o, si eso falla, los filamentos de actina en la yema mueven los agregados de nuevo a la célula madre. Este último mecanismo requiere la presencia de una serie de proteínas, entre ellas una sirtuina que se encuentra en la levadura llamada Sir2 (“Silent information regulator 2").
Las células madre son células que se dividen asimétricamente para producir una célula hija que va a diferenciarse y una célula hija que sigue siendo una célula madre. Se han encontrado varios ejemplos, en Drosophila y en mamíferos, donde las células madre envejecidas depositan preferentemente sus componentes celulares dañados, por ejemplo, proteínas agregadas, en la hija que se diferenciarán mientras mantienen componentes intactos en la hija que seguirán siendo un tallo celular. Entonces, al igual que la levadura, estas células madre tienen un mecanismo que protege preferentemente a la célula “inmortal” de los inevitables efectos del envejecimiento.
Envejecimiento en E. coli

Un fenómeno similar de envejecimiento se ha encontrado en E. coli. Cuando E. coli se divide, se forma un tabique en el medio de la célula en división y luego se pellizcan las dos células hijas. A medida que la pared celular sella la rotura, las dos celdas hijas terminan con un extremo “viejo” y un extremo recién formado. Cuando las dos hijas pasan a dividirse, se repite el proceso. Los viejos extremos originales se transmiten de generación en generación (más bien como hebras inmortales de ADN).
El diagrama muestra cómo durante la división celular, se forman dos nuevos polos, uno en cada una de las células de la progenie (nuevos polos se muestran en verde para la primera generación; magenta para la segunda). Los otros extremos de esas células se formaron durante una división previa.
Se ha mostrado (Stewart EJ, Madden R, Paul G, Taddei F (2005) Envejecimiento y muerte en un organismo que se reproduce por división morfológicamente simétrica. PLoS Biol 3 (2): e45 doi:10.1371/journal.pbio.0030045) que las células que heredan un polo cada vez más viejo presentan una tasa de crecimiento disminuida, disminución de la producción de crías y una mayor incidencia de muerte.
Entonces parece que el fenómeno —característico de todos los organismos multicelulares— de un soma envejecido y mortal productor de germoplasma (espermatozoides y óvulos) que inicia una nueva generación juvenil puede tener su contraparte en organismos unicelulares. Quizás ninguna célula pueda escapar de los estragos del tiempo sobre la integridad de sus orgánulos y las moléculas.
Envejecimiento en Plantas
Anuales y Bienales
Anuales, como muchos pastos y “malezas”
- crecer vigorosamente por un período;
- luego forman flores seguidas de frutos.
- A la fructificación le sigue una ralentización del crecimiento acompañada de cambios fisiológicos y morfológicos como
- un incremento en la tasa de respiración (catabolismo)
- pérdida de clorofila
- Estos cambios constituyen el envejecimiento y terminan en la muerte de la planta. Las bienales siguen el mismo patrón, pero tardan dos años en hacerlo.
Este patrón está claramente programado en los genes. Incluso con abundante humedad, minerales del suelo, luz solar y temperaturas cálidas, las plantas envejecen y mueren.
Perennes
La situación es bastante diferente en las plantas perennes. A lo largo de sus vidas, las plantas perennes leñosas (árboles) producen nuevos tejidos vasculares, hojas y flores cada año. No presentan signos marcados de envejecimiento, aunque su tasa de crecimiento puede disminuir a lo largo de los años. Finalmente, la enfermedad o incapacidad para soportar su tamaño cada vez mayor contra la carga de viento o nieve conducen a su muerte.

Esta imagen (cortesía de Walter Gierasch) es de pinos eristlecone (Pinus longaeva) que crecen en las Montañas Blancas del este de California. El análisis de anillos de árboles muestra que algunos de estos árboles tienen casi 5000 años de edad. Pero tenga en cuenta que ninguna célula viva en el árbol tiene más de unos pocos años.
Aun así, ¿cómo han evitado plantas de larga vida como estas la acumulación —a lo largo de años de replicación del ADN a medida que sus células se dividieron— de mutaciones perjudiciales que reducirían la condición física y la vida útil? Quizás sea porque las células en los meristemas vegetales, donde comienza todo el crecimiento son células madre que se dividen lentamente y como todas las células madre, asimétricamente; es decir, produciendo una hija que seguirá siendo una célula madre y otra que iniciará una fase de mitosis rápida y eventualmente se diferencian en los tejidos maduros de la planta. Si (y esto es hasta ahora solo una especulación) la división de una célula madre meristemática es asimétrica con respecto a la segregación de cadenas de ADN; es decir, la célula madre retiene las cadenas inmortales de ADN mientras que la célula destinada a producir más tejidos recibe las cadenas recién replicadas, esto proporcionaría una mecanismo adicional para proteger el genoma a medida que pasan los años.


