13.2: Telómeros
- Page ID
- 57311
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Cada cromosoma eucariota consiste en una sola molécula de ADN asociada a una variedad de proteínas. Las moléculas de ADN en los cromosomas eucariotas son lineales; es decir, tienen dos extremos. (Esto contrasta con cromosomas bacterianos como el de E. coli que es un círculo cerrado, es decir, no tiene extremos).
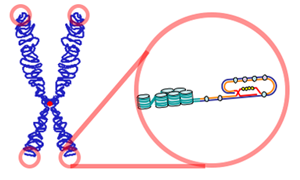
La molécula de ADN de un cromosoma típico contiene una matriz lineal de genes (que codifican proteínas y ARN) intercalados con mucho ADN no codificante. En el ADN no codificante se incluyen tramos largos que conforman el centrómero y tramos largos en los extremos del cromosoma, los telómeros. Los telómeros son cruciales para la vida de la célula. Evitan que los extremos de los diversos cromosomas en la célula se adhieran accidentalmente entre sí. Los telómeros de humanos consisten en hasta 2000 repeticiones de la secuencia 5' GGTTAG 3'
5'... GGTTAG GGTTAG GGTTAG GGTTAG GGTTAG GGTTAG..
3' 3'... CCAATC CCAATC CCAATC CCAATC CCAATC CCAATC CCAATC.. 5'
La replicación de cromosomas lineales presenta un problema especial
La ADN polimerasa solo puede sintetizar una nueva cadena de ADN a medida que se mueve a lo largo de la cadena molde en la dirección 3' —> 5'. Esto funciona bien para la cadena 3' —> 5' de un cromosoma ya que la ADN polimerasa puede moverse ininterrumpidamente desde un origen de replicación hasta que se encuentra con otra burbuja de replicación o el final del cromosoma. Sin embargo, la síntesis usando la cadena 5' —> 3' como molde tiene que ser discontinua. Cuando la horquilla de replicación se abre suficientemente, la ADN polimerasa puede comenzar a sintetizar una sección de cadena complementaria —llamada fragmento de Okazaki — trabajando en la dirección opuesta. Posteriormente, una ADN ligasa (“ADN ligasa I”) une los fragmentos de Okazaki juntos.

En la Figura\(\PageIndex{3}\), las flechas negras horizontales muestran la dirección en la que se mueven las horquillas de replicación. Dondequiera que la horquilla de replicación de una cadena se mueva hacia el extremo 3', el ADN recién sintetizado (rojo) comienza como fragmentos de Okazaki (guiones rojos). Esto continúa hasta cerca del final del cromosoma. Entonces, a medida que la horquilla de replicación se acerca al final del ADN, ya no hay suficiente plantilla para continuar formando fragmentos de Okazaki. Por lo que no se puede completar el extremo 5' de cada hebra recién sintetizada. Así cada uno de los cromosomas hijos tendrá un telómero acortado.
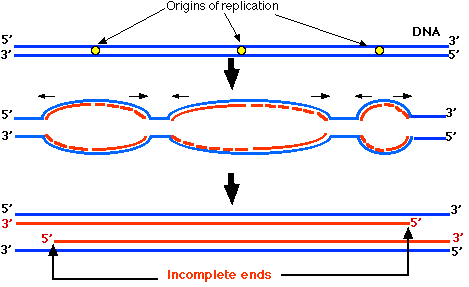
Se estima que los telómeros humanos pierden alrededor de 100 pares de bases de su ADN telomérico en cada mitosis. Esto representa alrededor de 16 repeticiones de GGTTAG. A este ritmo, después de 125 divisiones mitóticas, los telómeros se habrían ido por completo. ¿Es por esto que las células somáticas normales están limitadas en el número de divisiones mitóticas antes de que se extinguen?
Telómeros y Envejecimiento Celular
Los telómeros son importantes, por lo que su contracción constante con cada mitosis podría imponer una vida finita en las células. Este, de hecho, es el caso. Las células normales (no cancerosas) no crecen indefinidamente cuando se colocan en cultivo. Las células extraídas de un recién nacido y colocadas en cultivo se dividirán casi 100 veces. Mucho antes del final, sin embargo, su tasa de mitosis disminuye (a menos de una vez cada dos semanas). Si mis células fueran cultivadas (tengo 81 años), solo manejarían un par de docenas de mitosis antes de que dejaran de dividirse y se extinguieran. Este fenómeno se llama senescencia replicativa. ¿Podría la contracción de los telómeros ser un reloj que determine la longevidad de un linaje celular y así sea responsable de la senescencia replicativa?
Evidencia
Algunas células no experimentan senescencia replicativa:
- las células de la línea germinal (el germoplasma)
- eucariotas unicelulares como Tetrahymena thermophila
- células madre, incluidas las células madre “adultas” y las células madre cancerosas.
Resulta que estas células son capaces de mantener la longitud de sus telómeros. Lo hacen con la ayuda de una enzima telomerasa.
Telomerasa
La telomerasa es una enzima que agrega secuencias de repetición de telómeros al extremo 3' de las cadenas de ADN. Al alargar esta hebra, la ADN polimerasa es capaz de completar la síntesis de los “extremos incompletos” de la cadena opuesta. La telomerasa es una ribonucleoproteína. Su única molécula de SNORNa, llamada TERC (“TE lomere R NA C omponent”), proporciona una plantilla CCAAUC (en mamíferos) para guiar la inserción de GGTTAG. Su componente proteico —llamado TERT (” TE lomere R everse T ranscriptasa”) — proporciona la acción catalítica. Así, la telomerasa es una transcriptasa inversa; sintetiza ADN a partir de un molde de ARN.
La telomerasa generalmente se encuentra solo en las células de la línea germinal, incluidas las células madre embrionarias (ES); eucariotas unicelulares como Tetrahymena thermophila; y algunas, quizás todas, células madre “adultas” (incluidas las células madre cancerosas) y células “progenitoras” que les permiten proliferar. Cuando las células somáticas normales se transforman en el laboratorio con ADN que expresa altos niveles de telomerasa, continúan dividiéndose por mitosis mucho después de que la senescencia replicativa debería haberse establecido. Y lo hacen sin acortar más sus telómeros. Esta notable demostración (reportada por Bodnar et. al. en la edición del 16 de enero de 1998 de Science) proporciona la evidencia más convincente hasta ahora de que la telomerasa y el mantenimiento de la longitud de los telómeros son la clave para la inmortalidad celular.
Síndromes de deficiencia de telómeros
Varias enfermedades humanas raras son causadas por mutaciones en TERT o TERC o varios otros genes involucrados en el mantenimiento de los telómeros. La gravedad de la enfermedad, los órganos que afecta y la edad de inicio varían ampliamente. Pero todos se caracterizan por telómeros anormalmente cortos. Los pacientes con deficiencia de telómeros también tienen un mayor riesgo de desarrollar cáncer.
Telomerasa y Cáncer
La característica crucial que distingue a un cáncer del tejido normal es su capacidad para crecer indefinidamente. La mayoría de los cánceres (85— 90%) expresan telomerasa, al menos en la población de células madre cancerosas que se dividen incontrolablemente causando que el tumor crezca. Quizás los agentes que impiden la expresión del gen para la telomerasa —o impiden la acción de la enzima— proporcionarán una nueva clase de armas en la lucha contra el cáncer. Pero si la actividad de la telomerasa —por breve que sea— es esencial para todas las células, es mejor que tengamos cuidado, y si la falta de telomerasa acelera la senescencia replicativa, también puede acelerar el envejecimiento de los tejidos que dependen de las células recién formadas para continuar la salud, una compensación que tal vez no valga la pena hacer.
Telomerasa y Células Trasplantadas
Una aproximación a la terapia génica es extraer las células del paciente, transformarlas con el gen para el producto que el paciente no ha podido sintetizar, devolverlas al paciente. Un problema con este enfoque es que las células —como todas las células somáticas normales— son mortales. Después de una serie de divisiones mitóticas, mueren. Esa es la razón por la que los niños descritos en el enlace anterior requirieron infusiones frescas periódicas de sus células T transformadas.
¿Y si sus células pudieran transformarse no solo con el gen terapéutico, sino también con un gen activo de la telomerasa? Esto debería darles una vida útil ilimitada. Pero si las células cancerosas recuperan la capacidad de producir telomerasa, ¿no sería cierto lo contrario; que las células transformadas con un gen activo de la telomerasa podrían volverse cancerosas? Quizás no. Las células descritas por Bodnar et. al. en la edición del 16 de enero de 1998 de Science han seguido creciendo en cultivo y han sido sometidas a una serie de pruebas para ver si han adquirido alguna propiedad de las células cancerosas en cultivo.
Los resultados son alentadores. Si bien estas células continúan dividiéndose indefinidamente como lo hacen las células cancerosas,
- Todavía muestran inhibición de contacto como lo hacen las células normales cuando se cultivan en cultivo.
- No crecen en tumores cuando se inyectan en ratones inmunodeficientes (como lo hacen las células cancerosas).
- Todavía son quisquillosos con su dieta, incapaces de crecer en los simples medios que apoyan a las células cancerosas en cultivo.
- Todavía conservan un cariotipo normal; algo que las células cancerosas rara vez hacen.
Sin embargo, estudios con animales enteros —ratones transgénicos que expresan niveles anormalmente altos de TERT— revelan que sí sufren una elevada incidencia de cáncer.
La ahora famosa oveja Dolly fue clonada utilizando un núcleo tomado de una célula de oveja adulta que había estado creciendo en cultivo. El donante celular tenía 6 años de edad y sus células habían estado creciendo en cultivo durante varias semanas. ¿Y los telómeros de Dolly? El análisis de la longitud de los telómeros en las células de Dolly revela que solo fueron 80% del tiempo que en una oveja normal de un año de edad. No es de extrañar, ya que el núcleo que creó a Dolly había estado privado de telomerasa durante muchas generaciones. Otras dos ovejas —clonadas a partir de células embrionarias, no adultas— también tenían telómeros acortados aunque no tan cortos como los de Dolly. Quizás el tiempo que las células pasaron en cultivo antes de ser utilizadas explica esto.

Dolly. (Cc BY-SA 2.0 Toni Barros).
¿Significa esto que Dolly está condenada a una vida acortada? Parecía sana al principio e incluso tenía bebés propios. Pero los problemas médicos —probablemente no relacionados con sus telómeros— terminaron con su eutanasia a una edad relativamente temprana. Pero sus telómeros cortos sí agregan otra pregunta al debate sobre la clonación de mamíferos a partir de células adultas.


