2.9: Proteínas
- Page ID
- 56394
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Las proteínas son polímeros de aminoácidos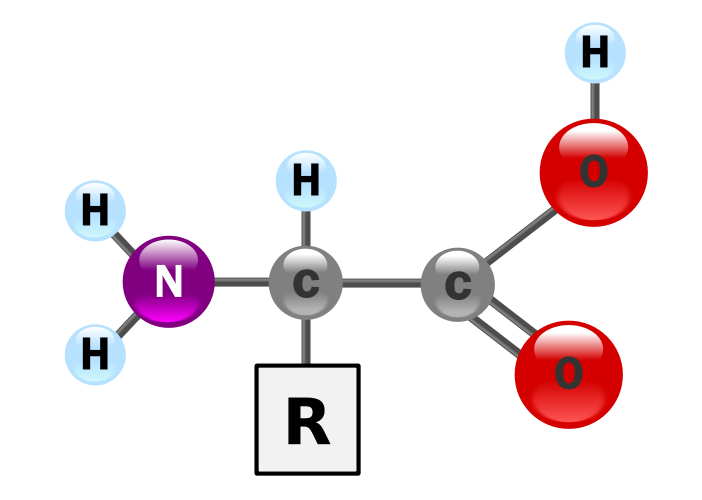
Las proteínas proporcionan gran parte de la capacidad estructural y funcional de las células. Las proteínas están compuestas por monómeros llamados aminoácidos. Los aminoácidos son hidrocarburos que tienen un grupo amino (-NH 2) y un grupo carboxilo ácido (-COOH). El grupo R representa una cadena hidrocarbonada con una modificación que altera las propiedades del aminoácido. Se utilizan 20 aminoácidos universales para construir proteínas. La variación en los grupos funcionales a lo largo de la cadena de aminoácidos da lugar a la diversidad funcional de las proteínas.

20 aminoácidos y sus propiedades. Un aminoácido 21 en esta tabla representa la selenocisteína no universalmente encontrada.
Los monómeros se unen a través de una reacción de síntesis de deshidratación entre grupos amino y carboxilo adyacentes para producir un enlace peptídico.
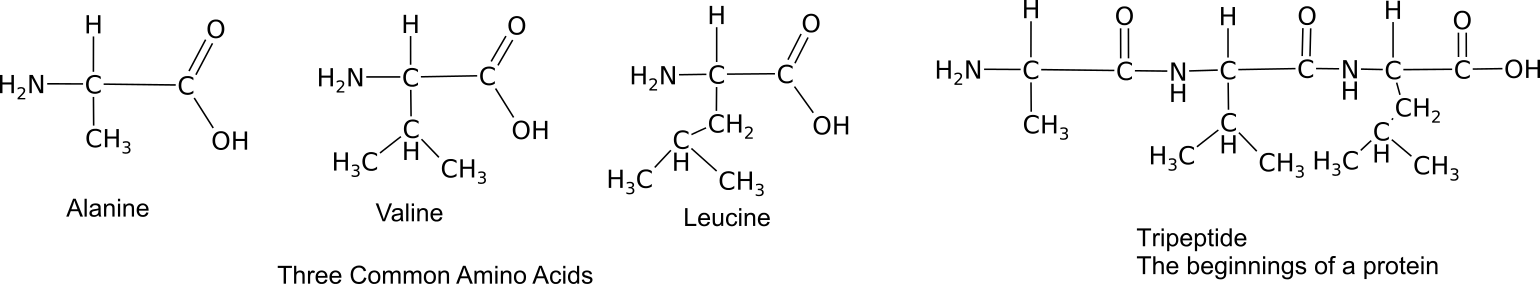
Tres aminoácidos se unen en un tripéptido.
Cómo los aminoácidos interactúan entre sí y con el medio ambiente
Utilice la siguiente simulación para probar cómo una cadena polipeptídica con pliegue basado en el tipo de solución en la que se encuentra y la composición de los aminoácidos.
- Simulación de plegamiento de proteínas (CC BY 4.0 Consorcio Concord)
Niveles de Estructura

- Estructura Primaria (1°): La secuencia de aminoácidos leída desde el extremo Amino o N-terminal de la molécula hasta el extremo Carboxil o C-terminal
- Tyr-Cys-Arg-Phe-Leu-Val-...
- Estructura secundaria (2°): estructuras tridimensionales locales que se forman a partir de interacciones de aminoácidos, como enlaces de hidrógeno
- Hélice alfa: espirales que ocurren a partir de los enlaces H entre los grupos N-H y C=O a lo largo de la cadena principal de la proteína

Vista lateral de la hélice α que ilustra los enlaces H en magenta entre el oxígeno carboxilo (rojo) y el nitrógeno amínico (azul)

Vista de arriba hacia abajo de una hélice α

Vista lateral del diagrama de cinta de hélices α-atravesando una membrana.
- Hojas Beta: hebras o láminas de aminoácidos conectadas lateralmente que se producen a partir de los enlaces H entre los grupos N-H y C=O a lo largo de la cadena principal de la proteína
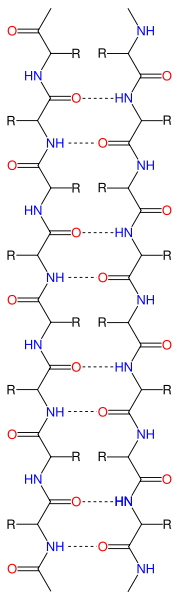


Diagrama de cinta de β-hojas
- Estructura terciaria (3°): estructura tridimensional global de la cadena peptídica
- Estructura cuaternaria (4°): estructura de proteína multimérica a partir del ensamblaje de múltiples subunidades peptídicas
Diversidad de Proteínas
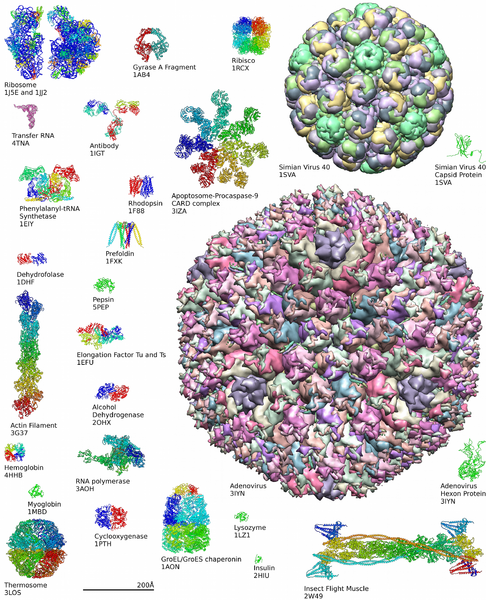
Conoce más sobre la complejidad de las estructuras proteicas en el Banco de Datos de Proteínas.
Detección de Proteínas (Actividad)
Teoría de detección de proteínas:
Las proteínas se pueden detectar mediante el uso de la prueba de Biuret. Específicamente, los enlaces peptídicos (enlaces C-N) en proteínas se complejan con Cu 2+ en reactivo Biuret y producen un color violeta. Un Cu 2+ debe complejarse con cuatro a seis enlaces peptídicos para producir un color; por lo tanto, los aminoácidos libres no reaccionan positivamente. Los polipéptidos largos (proteínas) tienen muchos enlaces peptídicos y producen una reacción positiva al reactivo. El reactivo Biuret es una solución alcalina de 1% de CuSO 4, sulfato de cobre. El color violeta es una prueba positiva para la presencia de proteína, y la intensidad del color es proporcional al número de enlaces peptídicos en la solución.


Prueba de Biuret
- Examine la siguiente tabla. Indicar si la muestra es un testigo negativo, un testigo positivo o un experimental.
- Predecir el cambio de color de la solución.
- Formular una hipótesis sobre los componentes de los experimentos.
- Obtener 6 tubos de ensayo y numerarlos 1-6.
- Añadir los materiales enumerados en la tabla.
- Añadir 3 gotas de reactivo Biuret (1.0% CuSO 4 con NaOH) a cada tubo y mezclar.
- Registre el color del contenido de los tubos en la Tabla.
Conclusiones sobre las Muestras de Orina
Con base en los resultados de la prueba de Benedict y la prueba de Biuret, ¿podemos sacar alguna conclusión?


