8.1: Introducción
- Page ID
- 56278
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Electroforesis en gel de agarosa

La agarosa es un polímero de carbohidrato lineal purificado de las paredes celulares de ciertas especies de algas. El agar es una combinación del extracto crudo que contiene agarosa y el polisacárido más pequeño agaropectina. Cuando se disuelven y funden en líquido, las hebras de agarosa se enredan para formar una red que retiene el fluido en un gel. La reducción del fluido crea un mayor porcentaje del gel que es más firme y contiene poros más pequeños dentro de la red.

Colocar un peine dentro de la agarosa fundida crea espacios que permiten la inserción de muestras cuando el gel se solidifica. Las moléculas pueden atravesar los poros a medida que son atraídas por las corrientes eléctricas. Los compuestos cargados migrarán hacia el electrodo de carga opuesta pero la velocidad de migración estará influenciada por el tamaño de las moléculas. Los compuestos más pequeños pueden atravesar fácilmente la cinta, mientras que los artículos más grandes se retrasan por el tamaño de poro. Sigue esta simulación para tener una mejor idea de cómo utilizamos la Electroforesis en Gel de Agarosa en biología molecular para estudiar fragmentos de ADN.
Las moléculas de ADN no son fácilmente visibles cuando se resuelven (se separan) en un gel de agarosa. Para visualizar las moléculas, se debe administrar un colorante de ADN al gel. En los laboratorios de investigación, se agrega un agente intercalante de ADN llamado Bromuro de etidio al gel fundido y se unirá al ADN de las muestras cuando se corran. Luego, el bromuro de etidio se puede visualizar en una caja UV que emitirá fluorescencia al compuesto y revelará bandas donde se acumula el ADN. Dado que el bromuro de etidio es conocido como carcinógeno, los laboratorios de enseñanza utilizarán un agente intercalante de ADN más seguro conocido como Sybr Green. Esto se puede visualizar de manera similar pero en su lugar emitirá fluorescencia a un color verde.
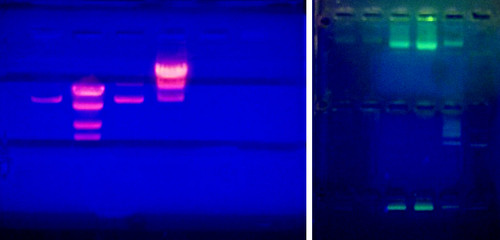
Geles de agarosa visualizados en un transiluminador UV. A la izquierda se muestra un gel con bromuro de etidio. A la derecha se muestra un gel con Sybr Green.
Los geles de agarosa están hechos y bañados en una solución tamponada, generalmente de Tris-borato-EDTA (TBE) o Tris-acetato-EDTA (TAE). Independientemente de la solución tamponada, el tampón proporciona los electrolitos necesarios para que la corriente pase y mantenga el pH de la solución.
Las muestras de ADN se preparan en un tampón similar a la solución en la que se procesará para asegurar que la cadena principal de fosfato del ADN permanezca desprotonada y se mueva hacia el electrodo positivo. Adicionalmente, se agrega glicerol u otro compuesto a este tampón para que la solución se hunda en los pozos sin esparcirse. A menudo se incluye un colorante en este tampón de carga para visualizar la carga en los pocillos y rastrear la progresión relativa del gel.
Configuración de gel de agarosa

Haga clic aquí para ver el video “Ensamblar la plataforma y cargar/ejecutar el gel”:
Recursos Externos
Electroforesis de Colorantes (Actividad)
- Preparar un gel de agarosa al 1% añadiendo 60 ml de tampón Tris-borato-EDTA (TBE) a 0,6 g de agarosa en un matraz Erlenmeyer
- Colocar el matraz en un microondas o en el calor hasta que se derrita la agarosa.
- Deténgase periódicamente y arremoline la solución y no permita que hierva.
- Montar la bandeja de fundición bloqueando los extremos con cinta adhesiva o juntas de plástico.
- Coloca el peine en el centro de la bandeja de colada.
- Puede colocar las bandejas de fundición dentro de un refrigerador y verter la solución en la bandeja.
- Espere hasta que el gel se solidifique.
- Separe cuidadosamente las juntas de la bandeja.
- Retire el peine y coloque la bandeja de colada en una cámara de electroforesis.
- Cubra el gel con tampón TBE.
- Usando una micropipeta, cargue muestras de colorante de 40-50μl secuencialmente en los pozos.
- Cubra la cámara de electroforesis con la tapa y asegure un buen contacto entre los electrodos.
- Es convencional que el lado POSITIVO del tanque esté más cerca de ti.
- Con el lado POSITIVO más cercano a usted, cargue las muestras de izquierda a derecha.
- Ajuste la fuente de alimentación a 100-120V y presione el botón Ejecutar (debería ver burbujas en cada electrodo) y dejar funcionar durante al menos 40 minutos.
- Después de 40 minutos, detenga la corriente y retire el gel en la bandeja de colada.
- Coloca la bandeja sobre un fondo blanco y documenta tu gel.
Seguimiento de la actividad
1. ¿Qué colores eran los tintes originalmente antes de cargarlos en los pozos?
2. ¿Cuántas bandas separadas de tinte hay en cada pozo después de la corrida?
3. ¿Qué significa que hay múltiples bandas en un carril? ¿Qué significa que solo hay una banda en un carril?
4. ¿Qué nos ilustra la duración de la migración sobre las propiedades de las moléculas de tinte?
5. ¿En qué dirección migraron las moléculas de colorante? ¿Qué indica la dirección de migración sobre los analitos?
6. ¿Hay carriles donde hay múltiples bandas del MISMO color?


