14.1: Introducción
- Page ID
- 56342
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Manipulación Genética (Selección)
La modificación genética de los organismos ha venido ocurriendo a través de la manipulación humana desde el inicio de la agricultura. Los humanos criaron selectivamente cultivos y ganado para propagar rasgos deseables en un proceso denominado selección artificial. El pasto original que dio origen al maíz domesticado llamado teosinte apenas se parece a lo que pensamos al imaginar el maíz moderno.

Teosinte, el progenitor del maíz. El maíz se produjo debido a la cría selectiva. Crédito: John Doebley (CC-BY)
Variación: Domesticación de cultivos
La cría selectiva puede producir una variedad de características incluso dentro de la misma especie. A continuación se muestra una selección de hortalizas de la especie Brassica oleracea que se han desarrollado en diferentes variedades a lo largo de la historia agrícola.

Col: Brassica oleracea var. capitata Crédito: Forest & Kim Starr (CC-BY 3.0)

Brócoli: Brassica oleracea var. italica Crédito: Coyau (CC-BY-SA 3.0)

Colinabo: Brassica oleracea var. gongilodos Coyau (CC-BY-SA 3.0)

Romanesco: Brassica oleracea var. botrytis Crédito: Richard Bartz (CC-BY-SA 2.5)
Variación: Domesticación Animal

Crédito: Mary Bloom, American Kennel Club (CC-BY-SA 4.0)

Los animales de compañía como los perros se sometieron a miles de años de domesticación y selección por rasgos que eran deseables para diferentes circunstancias. Existe un alto grado de diversidad morfológica entre las razas de perros y su progenitor ancestral de lobo gris.
Manipulación Genética (Ingeniería)
La selección artificial toma varias generaciones a lo largo de un largo período de tiempo. Con el advenimiento del ADN recombinante y la biotecnología, los científicos ahora pueden modificar genéticamente los organismos mediante la introducción de genes extraños para proporcionar características deseables dentro de una generación. Este proceso no requiere rasgos para que surjan naturalmente en una especie.


GloFish son peces cebra transgénicos (Danio rerio) que expresan variantes de GFP. La parte inferior presenta un pez de tipo silvestre. Crédito: Azul (CC-BY)
GloFish® son mascotas novedosas que tienen la inserción de varios genes de proteínas fluorescentes cnidarias en el genoma. Estos peces fueron liberados en Estados Unidos en 2003 y posteriormente se han desarrollado en variedades rojas, naranjas y azules. Los tetras negros y las púas de tigre también están disponibles ahora.

Tetra negra (Gymnocorymbus ternetzi) GloFish Crédito: https://www.flickr.com/photos/fergy08/ (CC-BY 2.0)
Crédito Tetra Negro de Tipo Salvaje: Fernandograu (CC-BY-SA 3.0)
Ingeniería Genética en Plantas
Con el advenimiento de la agroindustria, la agricultura se ha convertido en una empresa con fines de lucro independiente de la producción alimentaria. En este caso, la alta producción es primordial. Mientras que la agricultura tradicional o la selección artificial fue lenta y metódica, la modificación genética en el contexto de la agroindustria es instantánea a través de la ingeniería genética. El objetivo de la ingeniería genética es transferir el ADN que codifica un gen útil o favorable de un organismo que porta ese gen a uno que no lo hace. El simple hecho de insertar ADN en un organismo no da como resultado la expresión. Un promotor apropiado para el organismo transgénico debe estar aguas arriba del gen de interés para impulsar la transcripción. En mamíferos, un promotor fuerte que dará como resultado la expresión en cada célula es el promotor CMV que se deriva del citomegalovirus. De igual manera en las plantas, un promotor fuerte que funciona en cada célula se deriva de promotores virales como el promotor CaMV del virus del mosaico de la coliflor del gen 35S (un ARN ribosómico). (Secuencia CaMV 35S en NCBI)
Ejemplos de rasgos útiles incluyen:
- Degradar herbicidas
- Matar plagas agrícolas
- Sintetizar nutrientes críticos
- Para mejorar el color y el sabor
- Resiste daños durante el tránsito o almacenamiento prolongado.
- Incremento de tamaño
- Reducir el tiempo de comercialización (crecimiento o maduración más rápidos)
Los alimentos genéticamente modificados se han convertido en un tema candente de discusión en los últimos tiempos. Estos cultivos se generan a través de la infección de células vegetales por una bacteria llamada Agrobacterium tumefaciens. Agrobacterium es una alfaproteobacteria gramnegativa de la familia Rhizobiaceae que incluye fijadores simbióticos de nitrógeno que se encuentran en las leguminosas. A diferencia de esos simbiontes, Agrobacterium es una bacteria patógena del suelo conocida como agente causante de las agallas de la corona (tumores).

Agalla de corona en un Kalanchoë infectado con Agrobacterium tumefaciens Crédito: Bhai (CC-BY-SA 3.0)
Los tumores son causados por la infección de células vegetales por la bacteria y la posterior inserción del ADN-T (“ADN de transferencia”) que tiene una capacidad inductora de tumores (Ti). Mediante la ingeniería del ADN-T en un plásmido, los genes seleccionados pueden ser entregados a las células vegetales a través de la infección de bacterias transformadas.
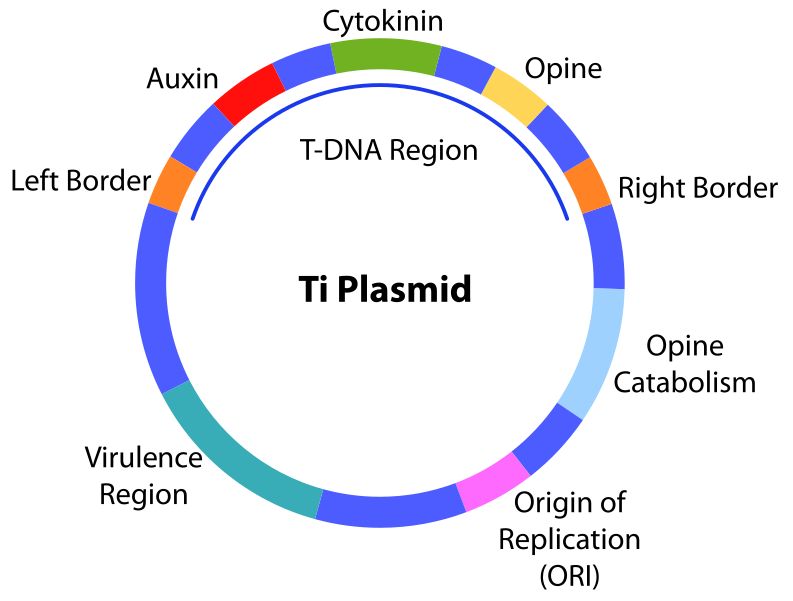
El plásmido Ti tiene la región T-ADN reemplazada por el transgén. El Ti se transforma en Agrobacterium que transduce el ADN en células vegetales.
Se diseñó un plásmido Ti modificado llamado pGreen para proporcionar un MCS y un marcador de selección para la inserción de genes extraños de interés. Para que estos genes se expresen, son impulsados por promotores de plantas fuertes como los del gen CaMV 35S.

La planta que se va a diseñar se cultiva e infecta con las Agrobacterias transformadas que luego inducirán quistes que eventualmente enraizan. El promotor fuerte del CaMV 35S expresará constitutivamente el gen en todas las células de la planta.
Transformación de papa silvestre en cultivo usando agrobacterium Crédito: Seb951 (CC-BY-SA 3.0)
Crecimiento de cultivos transgénicos
Superficie de terreno utilizada en millones de hectáreas.
Resistencia al Daño
El primer cultivo genéticamente modificado aprobado por la FDA para la venta fue conocido como el tomate Flavr Savr. Los tomates son propensos a sufrir daños durante el envío y por lo tanto se recogen antes de madurar. Sin embargo, los tomates madurados en la viña tienen un sabor más rico. Calgene desarrolló el Flavr Savr y lo vendió al mercado entre 1994-1997 en Estados Unidos. Flavr Savr se modificó insertando antisentido en el genoma que inactivó la expresión de poligalacturonasa. La poligalacturonasa degrada la pectina en las paredes celulares del fruto, lo que resulta en ablandamiento, proclividad al daño y eventual pudrición.
Resistencia a Herbicidas

Roundup es el nombre comercial del herbicida glifosato utilizado en la agricultura para controlar las poblaciones de malezas desarrollado y patentado por Monsanto. El glifosato se absorbe a través del follaje de las plantas e interfiere con las enzimas que ayudan en la producción de tirosina, fenilalanina y triptófano. Las plantas y los organismos inferiores generan aminoácidos aromáticos a través de una enzima 5-enolpiruvilshikimato-3-fosfato (EPSP) sintasa que es el objetivo de este compuesto. Se diseñaron una serie de cultivos Roundup Ready mediante la inserción del gen EPSP de Agrobacterium impulsado por el promotor CaMV 35S. Esta versión del gen es inherentemente resistente a la intoxicación por glifosato.
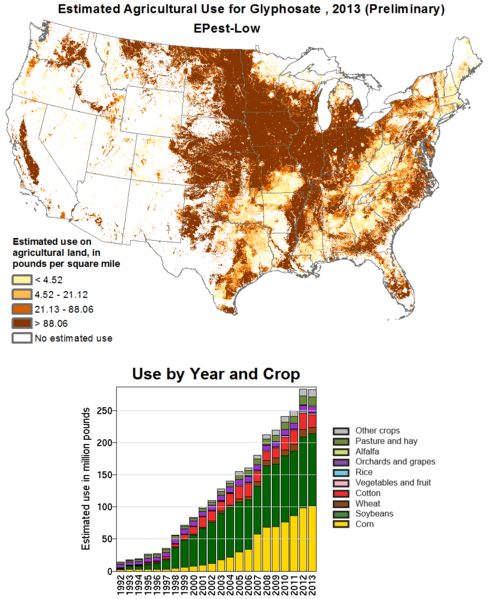
La emergencia de las supermalas hierbas

El amaranto palmero (Amaranthus palmeri), comúnmente conocido como pigweed, es una especie de plaga en los campos de algodón y soya que se ha vuelto resistente al glifosato.
Crédito: Pompilid (CC-BY-SA 3.0)
Resistencia a Plagas

Crédito: Cyndy Sims Parr (CC-BY-SA)
Los cristales de Bacillus thuringiensis (Bt), llamada proteína Cry, son tóxicos para diversos insectos: polillas y mariposas, escarabajos, hormigas, avispas, moscas y mosquitos, abejas, nematodos. La inserción de este gen en plantas como el maíz (Bt-Corn) fue diseñada para ser resistente a plagas.

Resistencia a Enfermedades
Las papayas en Estados Unidos provienen principalmente de Hawái. Un virus conocido como Enfermedad de la Mancha Ringspot de la Papaya amenazó el cultivo de papaya en Hawai. Para combatir esto, las papayas fueron modificadas genéticamente para bloquear la entrada viral en las células de la papaya. Las papayas compradas en los mercados latinos probablemente no están modificadas y generalmente provienen de México donde la enfermedad de la mancha anular aún no es un problema.

El virus de la viruela es una amenaza para el género Prunus. Se ha desarrollado una planta de ciruela genéticamente modificada llamada C5. Las células de estas plantas silencian la expresión de la proteína de la cubierta de la viruela del ciruelo si se infectan para bloquear la propagación

Un albaricoque infectado con viruela del ciruelo.

Ciruelas resistentes C5
Ingeniería Nutricional
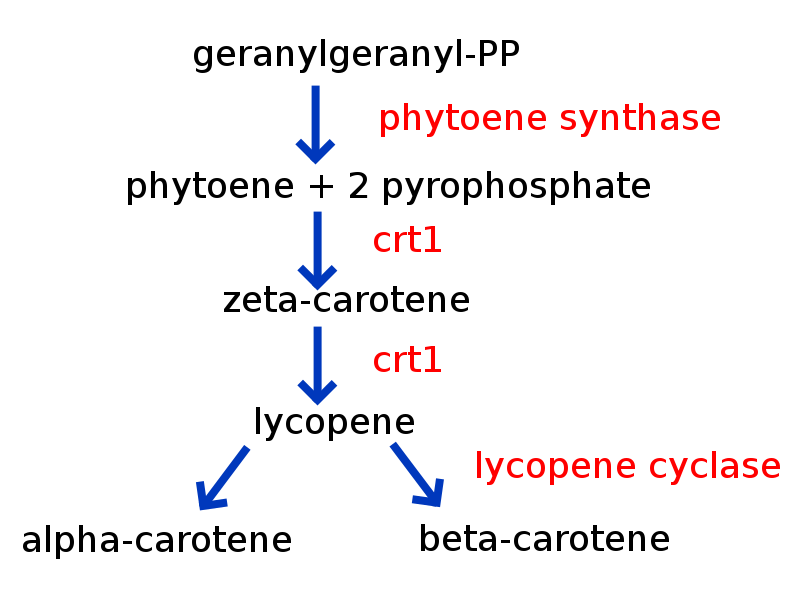
Crédito: es:usuario: Petaholmes, (CC-BY-SA 3.0)
El arroz dorado es un arroz genéticamente diseñado que está destinado a abordar la deficiencia de vitamina A. Introduce genes enzimáticos de otras especies involucradas en las vías biosintéticas para la producción de β-caroteno, un precursor de la vitamina A. Se estima que millones de muertes y ceguera irreversible ocurren en el tercer mundo cada año debido a la deficiencia de Vitamina A y la creación de este arroz se pretendía atender el problema.
El arroz es un alimento básico en muchas culturas, por lo tanto es un buen sistema de entrega. Existen muchas controversias en torno al Arroz Dorado debido al sentimiento anti-OGM (de los sistemas de patentamiento), sensibilidades culturales (arroz blanco venerado en ciertas culturas) y dudas de contenido/conversión de vitamina A.

Explora el Debate
- Los estudios de caso revelan las complejas verdades detrás de los mitos sobre cultivos transgénicos
- Estudios de caso: Una mirada a los cultivos transgénicos. Gilbert N. Naturaleza. 2013 2 de mayo; 497 (7447) :24-6. doi: 10.1038/497024a
Expresión heteróloga en cultivo de tejidos

Células de Riñón Embrionario Humano (HEK293T) que expresan la proteína fluorescente verde.
Mayor aumento de HEK293T que expresa la proteína fluorescente verde.
Estructura plasmídico
Vector de expresión pTarget en mamíferos. El MCS se encuentra dentro del gen lacZ lo que permite el cribado azul/blanco de la bacteria después de la clonación. LacZ se ejecuta en la orientación opuesta como el promotor CMV que impulsará la transcripción del gen cuando está dentro de una célula de mamífero. Los servidores de origen SV40 como origen de replicación plasmídica si la línea celular también expresa antígeno T grande SV40, como las células HEK293T.
Los vectores de expresión en mamíferos contienen las mismas características distintivas que los plásmidos bacterianos: replicación bacteriana de origen y gen de resistencia bacteriana a antibióticos (β-lactamasa o Amp R). Las características generales del plásmido bacteriano permiten el transporte y la propagación del plásmido en una célula bacteriana. Los vectores de expresión en mamíferos incluyen adicionalmente un promotor de mamífero fuerte (como CMV del promotor temprano inmediato de citomegalovirus) aguas arriba de un sitio de clonación múltiple (MCS). Los plásmidos transfectados en células son de naturaleza transitoria a menos que se seleccione el ADN para. La inclusión de un gen de resistencia a antibióticos de mamífero, como la neomicina fosfotransferasa (Neo R), permite la integración del plásmido en el genoma de la célula mediante el uso de altas concentraciones de Neomicina o el análogo G418.
Lipofección
Los lípidos catiónicos pueden encapsular ADN plasmídico en liposomas. Las porciones catiónicas interactúan con la membrana plasmática cargada negativamente para suministrar el ADN a las células.
Transfección de fosfato cálcico
La solución de cloruro de calcio se puede utilizar para incubar con ADN plasmídico. Cuando esta solución se mezcla con una solución salina tamponada con HEPES (HEBs) que contiene iones fosfato, la solución precipita sobre la superficie de las células de mamífero donde son captadas con el ADN.
Knock-Out y Transgénesis
En el laboratorio se modifican los organismos modelo para comprender los mecanismos básicos de los genes. La transformación del ADN recombinante en bacterias es un ejemplo de una modificación genética. Otros organismos modelo, como los ratones, se utilizan para estudiar genes. A través del ADN recombinante, los científicos pueden extirpar selectivamente un gen, o crear un knock-out (KO).
Las células madre embrionarias (ES) son células pluripotentes con la capacidad de diferenciarse en otros tipos de células. Las células ES cultivadas pueden transfectarse con ADN plasmídico con el fin de alterarlas genéticamente. Los vectores linealizados que contienen un gen alterado pueden recombinarse homólogamente con el gen nativo para reemplazarlo. La selección de células con el gen alterado por un antibiótico (como G418) permite el aislamiento y propagación de células ES modificadas por ingeniería genética.
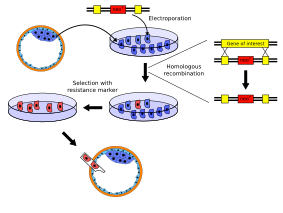
Crédito: Kjaergaard (CC-BY- 3.0)

Crédito: Kjaergaard (CC-BY- 3.0)
Las células ES pueden inyectarse en blastocistos de ratón y contribuir parcialmente al ratón posterior tras la implantación en un ratón. Estos primeros ratones son referidos como quimeras porque surgen de mezclas de células de 2 fuentes genéticas. Se desea la transmisión de la línea germinal de las células modificadas y la reproducción de la quimera revela descendencia heterocigótica del fondo manipulado. Se pueden generar ratones knock-out completos en la generación posterior de reproducción.


Crédito: Smartse (CC-BY-SA 3.0)
Los científicos también pueden sobreexpresar o expresar heterólogamente genes extraños en lo que se denomina organismos transgénicos. Como suena el nombre, transgén se refiere a un gen de un lugar traído a otro.
Los modelos transgénicos y KO permiten a los científicos estudiar los roles de los genes dentro del organismo y comprender el funcionamiento básico.
A través de la mutagénesis, se han producido derivados de la proteína verde fluorescente (GFP) para proporcionar una paleta de colores. Adicionalmente, el posterior descubrimiento de genes similares de otras especies cnidarias ha ayudado a la biotecnología al proporcionar moléculas trazadoras dentro de organismos en desarrollo o dentro de las células.

Bacterias que expresan diversos derivados de GFP en agar del laboratorio del Premio Nobel Roger Tsien.
Si bien los organismos comerciales como GloFish son una novedad, la inserción dirigida de GFP y las variantes en el genoma bajo diferentes sistemas promotores permiten a los científicos comprender el funcionamiento específico de la célula o contribución al organismo. Un ejemplo de esto se puede encontrar en la neurobiología del desarrollo donde se pueden rastrear axones individuales.

Un “arco cerebral” es un sistema en el que se coloca un casete de genes variantes de GFP aguas abajo de un promotor neuronal para permitir el rastreo de neuronas individuales y sus axones en ratones. Crédito: Jeff W. Lichtman y Joshua R. Sanes (CC-BY 3.0)
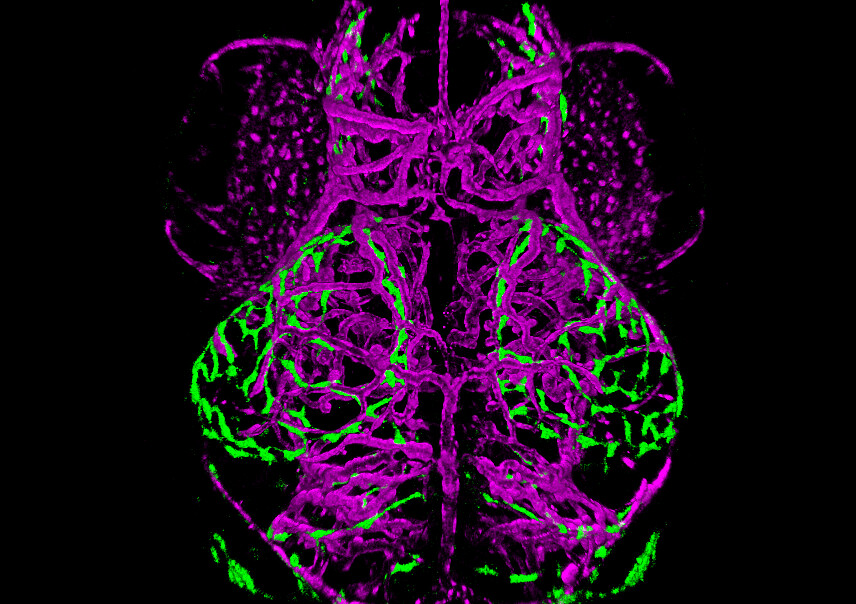
Cerebro de un pez cebra doble transgénico de 10 días de edad. Los vasos sanguíneos se muestran en magenta (KDRL:mCherry) y una nueva población de células endoteliales perivasculares se muestran en verde (MRC1a:EGFP).




