12: Energética y Reacciones Redox
- Page ID
- 55994
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Metabolismo se refiere a la suma de reacciones químicas que ocurren dentro de una célula. El catabolismo es la descomposición de moléculas orgánicas e inorgánicas, utilizadas para liberar energía y derivar moléculas que podrían ser utilizadas para otras reacciones. El anabolismo es la síntesis de moléculas más complejas a partir de moléculas orgánicas e inorgánicas más simples, lo que requiere energía.
Energética
Si bien se pierde algo de energía como calor en las reacciones químicas, la medida de interés para las células es la cantidad de energía libre (G), o la energía disponible para hacer el trabajo. Las células realizan tres tipos diferentes de trabajo: el trabajo químico (como el anabolismo), el trabajo de transporte (como la captación de nutrientes) y el trabajo mecánico (como la rotación de un flagelo).
El cambio en la energía libre se denota típicamente como ΔG°', lo que indica el cambio en la energía libre en condiciones estándar de pH 7, 25oC, presión de 1 atmósfera (también conocido como el cambio de energía libre estándar). Una reacción que genera un ΔG°' positivo indica que la reacción requiere energía y es de naturaleza endergónica. Una reacción que genera un ΔG°' negativo indica que la reacción libera energía y es de naturaleza exergónica. Las reacciones que son exergónicas liberan energía que puede ser conservada por la célula para hacer el trabajo.
Trifosfato de adenosina (ATP)
El trifosfato de adenosina o ATP es una molécula de alta energía utilizada por todas las células como moneda de energía, en parte porque dona fácilmente un grupo fosforilo a otras moléculas. Una reacción exergónica liberará energía, impulsando la síntesis de ATP a partir de la adición de una molécula de fosfato (ortofosfato o P i) a adenosina difosfato o ADP. Una reacción endergónica, que requiere energía, se acoplará con la hidrólisis de ATP a ADP + P i, utilizando la energía liberada para impulsar la reacción.
Enzimas
Para que se produzca una reacción química, se deben romper los enlaces químicos. La energía requerida para romper los enlaces se llama energía de activación. La cantidad de energía de activación requerida por una celda se puede disminuir con la ayuda de un catalizador, sustancias que ayudan a que la reacción continúe sin ser cambiadas por la reacción. Las células utilizan catalizadores proteicos conocidos como enzimas.
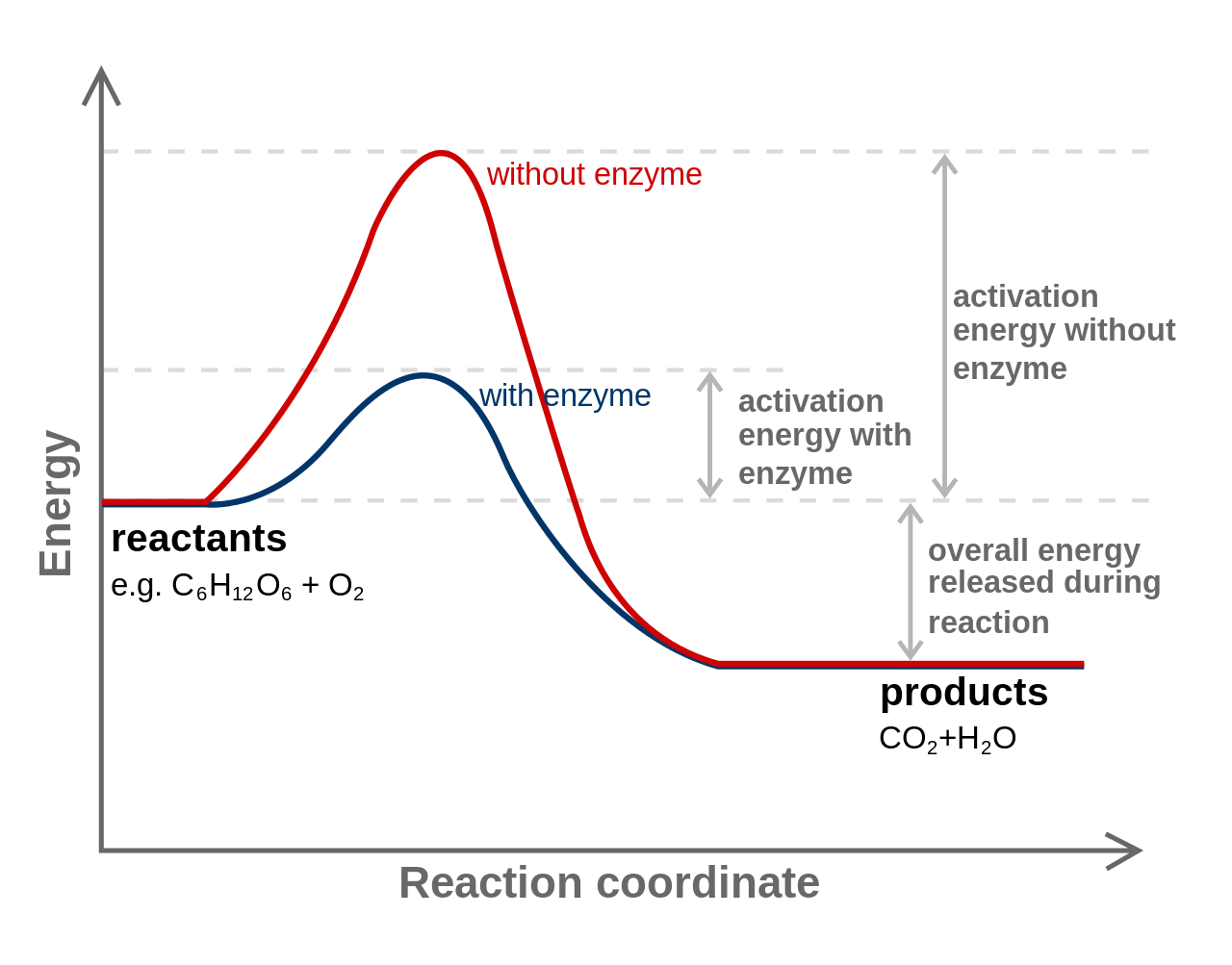
Energía de activación. Por Originalmente subido por Jerry Crimson Mann, vectorizado por Tutmosis, corregido por Fvasconcellos (es:Image:Activation2.png) [GFDL o CC-BY-SA-3.0], vía Wikimedia Commons
Reacciones Redox
Las células conservan energía en forma de ATP acoplando su síntesis a la liberación de energía a través de reacciones de oxidación-reducción (redox), donde los electrones pasan de un donante de electrones a un aceptor de electrones. La oxidación de una molécula se refiere a la pérdida de sus electrones, mientras que la reducción de una molécula se refiere a su ganancia de electrones. Los químicos orgánicos suelen referirse al proceso por el mnemotécnico OIL RIG: La Oxidación Es Pérdida, La Reducción Es Ganancia. Una molécula que se oxida está actuando como donante de electrones, mientras que la molécula que se está reduciendo actúa como aceptor de electrones. Dado que los electrones representan energía, una sustancia con muchos electrones para donar puede pensarse como rica en energía.
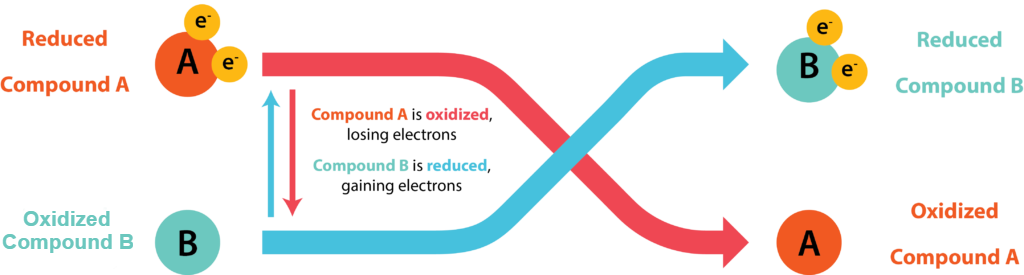
Par Redox Conjugado
Los electrones no existen libremente en solución, deben estar acoplados con átomos o moléculas. Cada reacción redox consiste en dos medias reacciones, donde una sustancia dona electrones y así se convierte en un producto oxidado mientras que otra sustancia acepta los electrones y así se convierte en un producto reducido. El par redox conjugado se refiere al aceptor y donante de una media reacción.
Una sustancia puede ser un donador de electrones o un aceptor de electrones, dependiendo de las otras sustancias en la reacción. Un par redox representa ambas formas de una sustancia en media reacción, con la forma oxidada (el aceptor de electrones) siempre colocada a la izquierda y la forma reducida (el donador de electrones) a la derecha. Un ejemplo sería ½ O2/H2O, donde H2O podría servir como donador de electrones y O2 podría servir como aceptor de electrones. A cada media reacción se le da un potencial de reducción estándar (E'0) en voltios o milivoltios, que es una medida de la tendencia del donante en la reacción a renunciar a los electrones. Una sustancia con mayor tendencia a donar electrones en la forma reducida tiene un E'0 más negativo, mientras que una sustancia con tendencia débil a donar electrones en la forma reducida tiene un E'0 menos negativo o incluso positivo. Una sustancia con un E'0 negativo hace un donador de electrones muy bueno, en la forma reducida.
Torre Redox
La información relativa a los potenciales de reducción estándar para varias parejas redox se muestra en forma de torre redox, la cual enumera las parejas en forma vertical en función de su E'0. Las parejas redox con el E'0 más negativo en el listado en la parte superior mientras que las que tienen la E'0 más positiva se listan en la parte inferior. La sustancia reducida con mayor tendencia a donar electrones se encontraría en la parte superior de la torre a la derecha, mientras que la sustancia oxidada con mayor tendencia a aceptar electrones se encontraría en la parte inferior de la torre de la izquierda. Las parejas redox en el medio pueden servir como donadores de electrones o aceptores, dependiendo de la sustancia con la que se asocien para una reacción. La diferencia entre los potenciales de reducción de un donante y un aceptor (ΔE'0) se mide como aceptor E'0 menos donante E'0. Cuanto mayor sea el valor para ΔE'0, mayor será la energía potencial para una célula. Los valores mayores se derivan cuando existe la mayor distancia entre el donante y el aceptor (o una caída más grande por la torre).
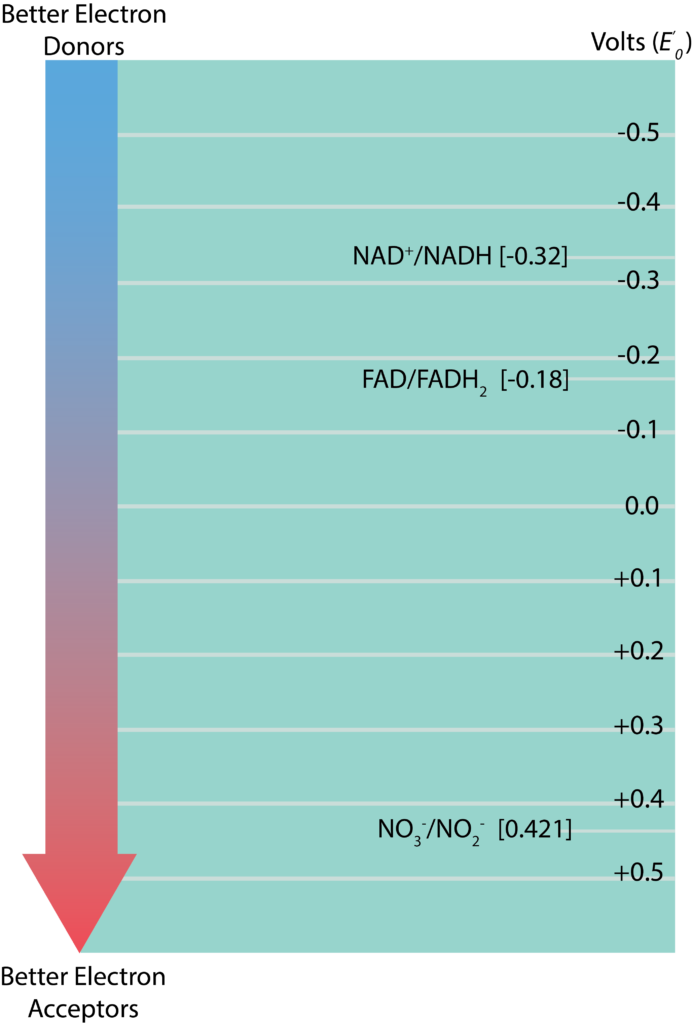
Torre de Electrones.
Si bien ΔE'0 es proporcional a ΔG°', también es importante el número de electrones que una sustancia tiene que donar. La fórmula real es:
\[\Delta \mathrm{G}^{\circ\prime} = -nF \cdot \Delta {\mathrm{E}^{\prime}}_{0}\]
donde n es el número de electrones que se transfieren y F es la constante de Faraday (23,062 cal/molo-voltio, 96, 480 J/mole-voltios).
Portadores de electrones
La transferencia de electrones del donante al aceptor no ocurre directamente, ya que los donantes y aceptores de electrones químicamente diferentes podrían nunca interactuar entre sí. En cambio, muchos intermedios celulares participan en el proceso, con la posibilidad de que se produzca la captura de energía a lo largo del camino. Estos intermedios se denominan portadores de electrones y van y vienen entre una forma reducida (cuando portan un electrón) y una forma oxidada (después de haber pasado el electrón), sin ser consumidos en la reacción ellos mismos.
Para que la reacción sea energéticamente favorable para la célula, los portadores deben disponerse en orden de su potencial de reducción estándar (es decir, bajando por la torre redox), pasando un electrón de un portador con el E'0 más negativo a un portador con un E'0 menos negativo. Es importante señalar que algunos portadores aceptan tanto electrones como protones, mientras que otros portadores aceptan electrones únicamente. Este hecho será de crucial importancia más adelante, en la discusión de cómo se genera la energía.
Si bien hay muchos portadores de electrones diferentes, algunos exclusivos de organismos específicos o grupos de organismos, cubramos algunos de los más comunes:
- Dinucleótido de nicotinamida adenina (NAD+/NADH) — una coenzima que transporta tanto electrones (e-) como protones (H+), dos de cada uno. Una molécula estrechamente relacionada es nicotinamida adenina dinucleótido fosfato (NADP+/ NADPH), que acepta 2 electrones y 1 protón.
- El dinucleótido de flavina adenina (FAD/FADH) y el mononucleótido de flavina (FMN/FMNH) llevan 2 electrones y 2 protones cada uno. Las proteínas con estas moléculas se llaman flavoproteínas.
- Coenzima Q (CoQ) /ubiquinona — lleva 2 electrones y 2 protones.
- Citocromos: usan átomos de hierro como parte de un grupo hemo para transportar 1 electrón a la vez.
- Las proteínas de hierro-azufre (Fe-S), como la ferredoxina, utilizan átomos de hierro que no forman parte del grupo hemo para portar 1 electrón a la vez.
Cadena de transporte de electrones
El proceso comienza con un donante de electrones inicial, una sustancia del exterior de la célula, y termina con un aceptor de electrones final, otra sustancia del exterior de la célula. En el medio los electrones pasan de portador a portador, a medida que los electrones se abren paso por la torre de electrones. Para que el proceso sea más eficiente, la mayoría de los portadores de electrones están incrustados dentro de una membrana de la célula, en el orden en que están dispuestos en una torre redox. Estas cadenas de transporte de electrones se encuentran dentro de la membrana celular de bacterias y arqueas, y dentro de la membrana mitocondrial de eucariotas.
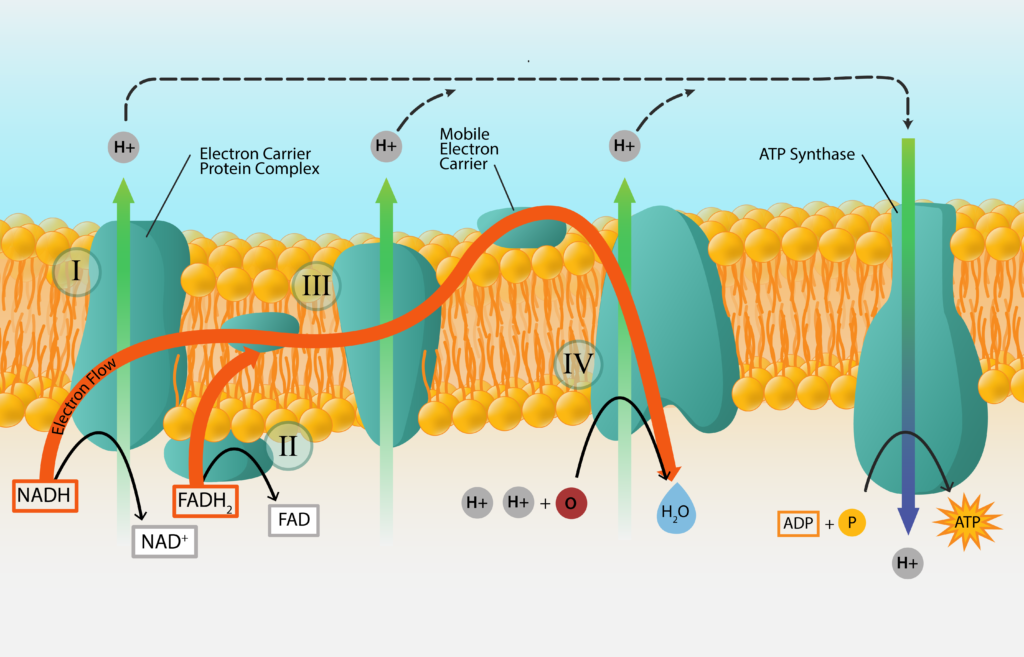
Cadena de Transporte de Electrones.
Palabras clave
metabolismo, catabolismo, anabolismo, energía libre (G), trabajo químico, trabajo de transporte, trabajo mecánico, ΔG°', cambio de energía libre estándar, exergónico, endergónico, trifosfato de adenosina (ATP), ortofosfato (P i), energía de activación, catalizador, enzima, reacción oxidación-reducción (redox), donante de electrones, aceptor de electrones, OIL RIG, par redox conjugado, par redox, potencial de reducción estándar (E'0), torre redox, ΔE'0, portadores de electrones, dinucleótido nicotinamida adenina (NAD+/NADH), nicotinamida adenina dinucleótido fosfato (NADP+/ NADPH), flavina adenina dinucleótido (FAD/FADH), flavina mononucleótido (FMN/ FMNH), coenzima Q (CoQ) /ubiquinona, citocromo, proteínas hierro-azufre (Fe-S), ferredoxina, cadena de transporte de electrones (ETC).
Preguntas de Estudio
- ¿Cómo se definen el metabolismo, el catabolismo y el anabolismo?
- ¿Cuáles son los 3 tipos principales de trabajo que realizan las células? ¿Cuál es un ejemplo de cada tipo?
- ¿Qué es la energía libre? ¿Qué es la energía libre estándar?
- ¿Cuáles son las características de una reacción endergónica y una exergónica? ¿Cómo pueden las células conservar la energía que desprenden las reacciones?
- ¿Cuál es el papel del ATP en la célula y por qué es un buen compuesto para este papel?
- ¿Qué son las enzimas? ¿Qué papel juegan las enzimas en la conservación de energía?
- ¿Qué es la oxidación y reducción? ¿Qué representa el potencial de reducción estándar, como 2H+/H2 = -0.42V? Indicar lo que representa cada término en esta ecuación. En pares redox con un potencial O-R más negativo la forma reducida es más probable que sea un electrón ____________________ y tenga __________________________ energía potencial. ¿Qué es un par redox conjugado?
- ¿Qué es una torre de electrones y cómo ayuda este concepto a explicar el intercambio de energía en una célula?
- ¿Qué es ΔG0'? ¿Qué representa y cómo se calcula?
- ¿Qué es un portador de electrones, qué papel juegan, cuáles son los portadores de electrones más comunes en la célula y por qué deben reciclarse constantemente?
- ¿Qué es una cadena de transporte de electrones y cómo funciona para conservar energía para la célula?

