12.4: Ingeniería Genética - Riesgos, Beneficios y Percepciones
( \newcommand{\kernel}{\mathrm{null}\,}\)
Objetivos de aprendizaje
- Resumir los mecanismos, riesgos y beneficios potenciales de la terapia génica
- Identificar cuestiones éticas que involucran la terapia génica y las agencias reguladoras que brindan supervisión para los ensayos clínicos
- Comparar terapia génica de células somáticas y de línea germinal
Muchos tipos de ingeniería genética han arrojado claros beneficios con pocos riesgos aparentes. Pocos cuestionarían, por ejemplo, el valor de nuestro ahora abundante suministro de insulina humana producida por bacterias genéticamente modificadas. Sin embargo, muchas aplicaciones emergentes de la ingeniería genética son mucho más polémicas, a menudo porque sus beneficios potenciales se enfrentan a riesgos significativos, reales o percibidos. Este es ciertamente el caso de la terapia génica, una aplicación clínica de la ingeniería genética que algún día puede proporcionar una cura para muchas enfermedades pero que sigue siendo en gran parte un enfoque experimental para el tratamiento.
Mecanismos y Riesgos de la Terapia Génica
Las enfermedades humanas que resultan de mutaciones genéticas suelen ser difíciles de tratar con medicamentos u otras formas tradicionales de terapia porque los signos y síntomas de la enfermedad son el resultado de anomalías en el genoma de un paciente. Por ejemplo, un paciente puede tener una mutación genética que impida la expresión de una proteína específica requerida para la función normal de un tipo celular particular. Este es el caso en pacientes con Inmunodeficiencia Combinada Severa (SCID), una enfermedad genética que perjudica la función de ciertos glóbulos blancos esenciales para el sistema inmunológico.
La terapia génica intenta corregir anomalías genéticas mediante la introducción de un gen funcional no mutado en el genoma del paciente. El gen no mutado codifica una proteína funcional que el paciente de otro modo no podría producir. A veces se utilizan vectores virales como adenovirus para introducir el gen funcional; parte del genoma viral se elimina y se reemplaza con el gen deseado (Figura12.4.1). Las formas más avanzadas de terapia génica intentan corregir la mutación en el sitio original del genoma, como es el caso del tratamiento de la SCID.
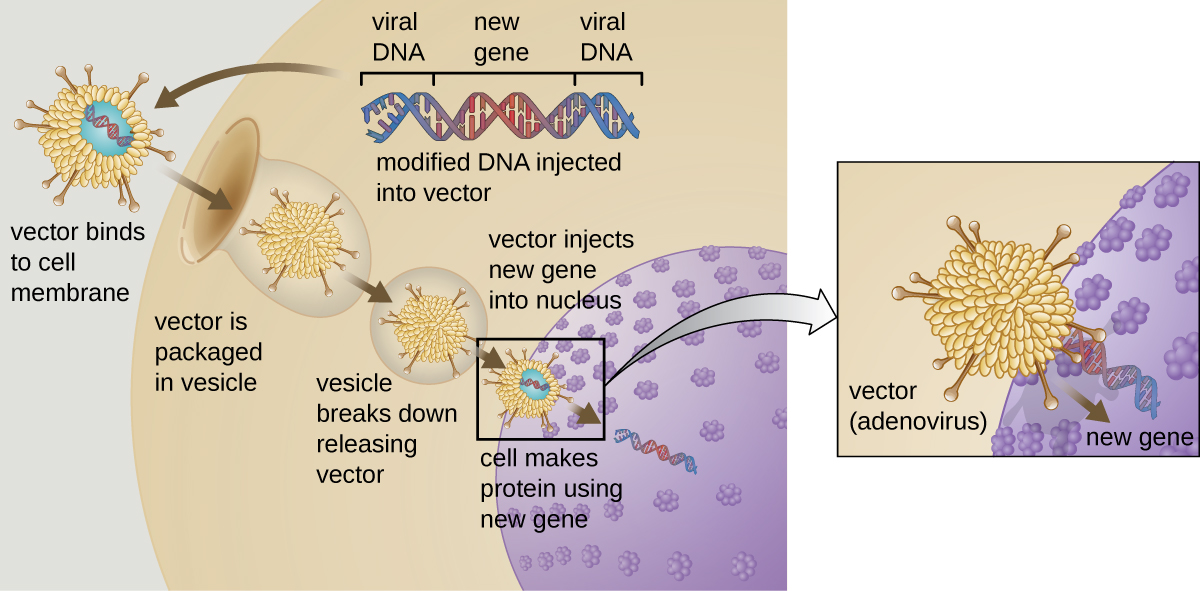
Hasta el momento, las terapias génicas han demostrado ser relativamente ineficaces, con las posibles excepciones de los tratamientos para la fibrosis quística y la deficiencia de adenosina desaminasa, un tipo de IDCID. Otros ensayos han demostrado los claros peligros de intentar la manipulación genética en organismos multicelulares complejos como los humanos. En algunos pacientes, el uso de un vector de adenovirus puede desencadenar una respuesta inflamatoria imprevista del sistema inmune, lo que puede conducir a insuficiencia orgánica. Además, debido a que los virus a menudo pueden dirigirse a múltiples tipos de células, el vector del virus puede infectar células no diana para la terapia, dañando estas otras células y posiblemente conduciendo a enfermedades como el cáncer. Otro riesgo potencial es que el virus modificado pueda volver a ser infeccioso y causar enfermedad en el paciente. Por último, existe el riesgo de que el gen insertado pueda inactivar involuntariamente otro gen importante en el genoma del paciente, alterando el ciclo celular normal y posiblemente dando lugar a la formación de tumores y cáncer. Debido a que la terapia génica implica tantos riesgos, los candidatos a la terapia génica deben estar completamente informados de estos riesgos antes de dar su consentimiento informado para someterse a la terapia.
Los riesgos de la terapia génica se concretaron en el caso de 1999 de Jesse Gelsinger, paciente de 18 años que recibió terapia génica como parte de un ensayo clínico en la Universidad de Pensilvania. Jesse recibió terapia génica para una afección llamada deficiencia de ornitina transcarbamilasa (OTC), que conduce a la acumulación de amoníaco en la sangre debido al procesamiento deficiente del amoníaco. Cuatro días después del tratamiento, Jesse murió después de una respuesta inmune masiva al vector adenovirus. 1
Hasta ese momento, los investigadores no habían considerado realmente una respuesta inmune al vector como un riesgo legítimo, pero en la investigación, parece que los investigadores tenían alguna evidencia que sugiriera que este era un posible resultado. Antes del tratamiento de Jesse, varios otros pacientes humanos habían sufrido efectos secundarios del tratamiento, y tres monos utilizados en un ensayo habían muerto como resultado de la inflamación y trastornos de la coagulación. A pesar de esta información, parece que ni Jesse ni su familia se dieron cuenta de estos resultados cuando consintieron la terapia. La muerte de Jesse fue la primera muerte de paciente debido a un tratamiento de terapia génica y resultó en la detención inmediata del ensayo clínico en el que estuvo involucrado, la posterior detención de todos los demás ensayos de terapia génica en la Universidad de Pensilvania, y la investigación de todos los demás ensayos de terapia génica en el Estados Unidos. Como resultado, se reexaminó la regulación y supervisión de la terapia génica en general, dando como resultado nuevos protocolos regulatorios que aún están vigentes en la actualidad.
Ejercicio12.4.1
- Explicar cómo funciona la terapia génica en teoría.
- Identificar algunos riesgos de la terapia génica.
Supervisión de Terapia Génica
Actualmente, existe una importante supervisión de los ensayos clínicos de terapia génica. A nivel federal, tres organismos regulan paralelamente la terapia génica: la Administración de Alimentos y Medicamentos (FDA), la Oficina de Protección a la Investigación Humana (OHRP) y el Comité Asesor de ADN Recombinante (RAC) en los Institutos Nacionales de Salud (NIH). Junto con varias agencias locales, estas agencias federales interactúan con la junta de revisión institucional para garantizar que se implementen protocolos para proteger la seguridad del paciente durante los ensayos clínicos. El cumplimiento de estos protocolos se hace cumplir principalmente a nivel local en cooperación con las dependencias federales. Las terapias génicas se encuentran actualmente bajo la revisión federal y local más extensa en comparación con otros tipos de terapias, las cuales son más típicamente solo bajo la revisión de la FDA. Algunos investigadores creen que estas amplias regulaciones en realidad inhiben el progreso en la investigación en terapia génica. En 2013, el Instituto de Medicina (ahora Academia Nacional de Medicina) llamó a los NIH a relajar su revisión de los ensayos de terapia génica en la mayoría de los casos. 2 Sin embargo, garantizar la seguridad del paciente sigue siendo de suma preocupación.
Preocupaciones éticas
Más allá de los riesgos para la salud de la terapia génica, la capacidad de modificar genéticamente a los humanos plantea una serie de cuestiones éticas relacionadas con los límites de dicha “terapia”. Si bien la investigación actual se centra en la terapia génica para enfermedades genéticas, los científicos podrían algún día aplicar estos métodos para manipular otros rasgos genéticos que no se perciben como deseables. Esto plantea interrogantes como:
Ejercicio12.4.2
- ¿Qué rasgos genéticos son dignos de ser “corregidos”?
- ¿Se debe utilizar la terapia génica por razones estéticas o para potenciar las habilidades humanas?
- ¿Se debe utilizar la manipulación genética para impartir rasgos deseables al nonato?
- ¿Todos tienen derecho a la terapia génica, o el costo de la terapia génica podría crear nuevas formas de desigualdad social?
- ¿Quién debe ser responsable de regular y vigilar el uso inadecuado de las terapias génicas?
La capacidad de alterar las células reproductivas mediante terapia génica también podría generar nuevos dilemas éticos. Hasta la fecha, los diversos tipos de terapias génicas han sido dirigidas a las células somáticas, las células no reproductivas dentro del cuerpo. Debido a que los rasgos de las células somáticas no se heredan, ningún cambio genético logrado por la terapia génica de células somáticas no se transmitiría a la descendencia. Sin embargo, si los científicos introducen con éxito nuevos genes en las células germinales (óvulos o espermatozoides), los rasgos resultantes podrían transmitirse a la descendencia. Este enfoque, llamado terapia génica de línea germinal, podría usarse potencialmente para combatir enfermedades hereditarias, pero también podría llevar a consecuencias no deseadas para las generaciones futuras. Además, existe la cuestión del consentimiento informado, porque los afectados por la terapia génica de línea germinal son nonatos y por lo tanto no pueden elegir si reciben la terapia. Por estas razones, el gobierno de Estados Unidos actualmente no financia proyectos de investigación que investiguen terapias génicas de línea germinal en humanos.
Terapias genéticas de riesgo
Si bien actualmente no hay terapias génicas en el mercado en Estados Unidos, muchas están en proceso y es probable que algunas eventualmente sean aprobadas. Con los recientes avances en terapias génicas dirigidas a p53, un gen cuyas mutaciones de células somáticas se han visto implicadas en más del 50% de los cánceres humanos, 3 tratamientos contra el cáncer a través de terapias génicas podrían generalizarse mucho más una vez que lleguen al mercado comercial.
Llevar cualquier terapia nueva al mercado plantea cuestiones éticas que enfrentan los beneficios esperados frente a los riesgos. ¿Qué tan rápido deberían traerse nuevas terapias al mercado? ¿Cómo podemos garantizar que las nuevas terapias hayan sido suficientemente probadas para su seguridad y efectividad antes de que se comercialicen al público? El proceso por el cual se desarrollan y aprueban nuevas terapias complica tales preguntas, ya que los involucrados en el proceso de aprobación suelen estar bajo una presión significativa para obtener una nueva terapia aprobada incluso ante riesgos significativos.
Para recibir la aprobación de la FDA para una nueva terapia, los investigadores deben recopilar datos significativos de laboratorio de ensayos con animales y enviar una solicitud de nuevo medicamento en investigación (IND) al Centro de Evaluación e Investigación de Medicamentos (CDER) de la FDA. Después de un período de espera de 30 días durante el cual la FDA revisa el IND, pueden comenzar los ensayos clínicos con sujetos humanos. Si la FDA percibe un problema antes o durante el ensayo clínico, la FDA puede ordenar una “retención clínica” hasta que se aborde cualquier problema. Durante los ensayos clínicos, los investigadores recopilan y analizan datos sobre la efectividad y seguridad de la terapia, incluidos los efectos secundarios observados. Una vez que la terapia cumpla con los estándares de efectividad y seguridad de la FDA, los desarrolladores pueden enviar una Solicitud de Nuevo Medicamento (NDA) que detalla cómo se fabricará, empacará, monitoreará y administrará la terapia.
Debido a que las nuevas terapias génicas son frecuentemente el resultado de muchos años (incluso décadas) de investigación clínica y de laboratorio, requieren una inversión financiera significativa. Para cuando una terapia ha llegado a la etapa de ensayos clínicos, las apuestas financieras son altas para las compañías farmacéuticas y sus accionistas. Esto crea posibles conflictos de intereses que a veces pueden afectar el juicio objetivo de los investigadores, sus financiadores e incluso los participantes del ensayo. El caso Jesse Gelsinger (ver Case in Point: Gene Therapy Gone Wrong) es un ejemplo clásico. Ante una enfermedad potencialmente mortal y sin tratamientos razonables disponibles, es fácil ver por qué un paciente podría estar ansioso por participar en un ensayo clínico sin importar los riesgos. También es fácil ver cómo un investigador podría ver los riesgos a corto plazo para un pequeño grupo de participantes del estudio como un pequeño precio a pagar por los beneficios potenciales de un nuevo tratamiento que cambia el juego.
La muerte de Gelsinger condujo a un mayor escrutinio de la terapia génica, y los posteriores resultados negativos de la terapia génica han resultado en la detención temporal de los ensayos clínicos pendientes de investigación adicional. Por ejemplo, cuando los niños en Francia tratados con terapia génica para SCID comenzaron a desarrollar leucemia varios años después del tratamiento, la FDA detuvo temporalmente los ensayos clínicos de tipos similares de terapia génica que ocurren en Estados Unidos. 4 Casos como estos resaltan la necesidad de que investigadores y profesionales de la salud no solo valoren el bienestar humano y los derechos de los pacientes sobre la rentabilidad, sino que también mantengan la objetividad científica a la hora de evaluar los riesgos y beneficios de las nuevas terapias.
Ejercicio12.4.3
- ¿Por qué la investigación en terapia génica está tan estrechamente regulada?
- ¿Cuál es la principal preocupación ética asociada a la terapia génica de línea germinal?
Conceptos clave y resumen
- Si bien la terapia génica muestra una gran promesa para el tratamiento de enfermedades genéticas, también hay riesgos significativos involucrados.
- Existe una considerable regulación federal y local del desarrollo de terapias génicas por parte de las compañías farmacéuticas para su uso en humanos.
- Antes de que el uso de la terapia génica pueda aumentar drásticamente, hay muchos temas éticos que deben ser abordados por las comunidades médicas y de investigación, los políticos y la sociedad en general.
Notas al pie
- 1 Bárbara Sibbald. “Muerte pero una consecuencia no intencionada del ensayo de terapia génica”. Revista de la Asociación Médica Canadiense 164 núm. 11 (2001): 1612—1612.
- 2 Kerry Grens. “Reporte: Facilidad Revisiones de Terapia Génica”. El científico, 9 de diciembre de 2013. http://www.the-scientist.com/?articl...erapy-Reviews/. Accedido el 27 de mayo de 2016.
- 3 Zhen Wang y Yi Sun. “Dirigiéndose a p53 para la terapia novedosa contra el cáncer”. Oncología Traslacional 3, núm. 1 (2010): 1—12.
- 4 Cheque Erika. “La terapia génica: un trágico revés”. Naturaleza 420 núm. 6912 (2002): 116—118.


