13.4: Probando la Eficacia de Antisépticos y Desinfectantes
( \newcommand{\kernel}{\mathrm{null}\,}\)
Objetivos de aprendizaje
- Describir por qué se utiliza el coeficiente de fenol
- Comparar y contrastar los métodos de difusión de disco, dilución de uso y uso para probar la efectividad de antisépticos, desinfectantes y esterilizantes
La efectividad de diversos desinfectantes químicos se refleja en los términos utilizados para describirlos. Los desinfectantes químicos se agrupan por el poder de su actividad, reflejando cada categoría los tipos de microbios y virus contra los que son efectivos los desinfectantes componentes. Los germicidas de alto nivel tienen la capacidad de matar células vegetativas, hongos, virus y endosporas, lo que lleva a la esterilización, con un uso prolongado. Los germicidas de nivel intermedio, como su nombre indica, son menos efectivos contra endosporas y ciertos virus, y los germicidas de bajo nivel matan solo las células vegetativas y ciertos virus envueltos, y son ineficaces contra las endosporas.
Sin embargo, varias condiciones ambientales influyen en la potencia de un agente antimicrobiano y su efectividad. Por ejemplo, la duración de la exposición es particularmente importante, ya que la exposición más larga aumenta la eficacia. De igual manera, la concentración del agente químico también es importante, siendo mayores concentraciones más efectivas que las menores. La temperatura, el pH y otros factores también pueden afectar la potencia de un agente desinfectante.
Un método para determinar la efectividad de un agente químico incluye limpiar superficies antes y después de su uso para confirmar si se mantuvo un campo estéril durante el uso. Pruebas adicionales se describen en las secciones que siguen. Estas pruebas permiten el mantenimiento de protocolos de desinfección adecuados en entornos clínicos, controlando el crecimiento microbiano para proteger a los pacientes, trabajadores de la salud y la comunidad.
Coeficiente de fenol
La efectividad de un desinfectante o antiséptico se puede determinar de varias maneras. Históricamente, la efectividad de un agente químico a menudo se comparó con la del fenol, el primer agente químico utilizado por Joseph Lister. En 1903, los químicos británicos Samuel Rideal (1863—1929) y J. T. Ainslie Walker (1868—1930) establecieron un protocolo para comparar la efectividad de una variedad de sustancias químicas con la del fenol, utilizando como sus organismos de prueba Staphylococcus aureus (una bacteria grampositiva) y Salmonella enterica serovar Typhi (una bacteria gramnegativa). Expusieron las bacterias de prueba a las soluciones químicas antimicrobianas diluidas en agua durante 7.5 minutos. Luego calcularon un coeficiente de fenol para cada sustancia química para cada una de las dos bacterias analizadas. Un coeficiente de fenol de 1.0 significa que el agente químico tiene aproximadamente el mismo nivel de efectividad que el fenol. Un agente químico con un coeficiente de fenol inferior a 1.0 es menos efectivo que el fenol. Un ejemplo es la formalina, con coeficientes de fenol de 0.3 (S. aureus) y 0.7 (S. enterica serovar Typhi). Un agente químico con un coeficiente de fenol mayor a 1.0 es más efectivo que el fenol, como la cloramina, con coeficientes de fenol de 133 y 100, respectivamente. Aunque el coeficiente de fenol alguna vez fue una medida útil de efectividad, ya no se usa comúnmente debido a que las condiciones y organismos utilizados fueron elegidos arbitrariamente.
Ejercicio13.4.1
¿Cuáles son las diferencias entre los tres niveles de efectividad desinfectante?
Método de Difusión de Discos
El método de difusión de discos implica aplicar diferentes productos químicos a discos de papel de filtro estériles separados (Figura13.4.1). Los discos se colocan luego en una placa de agar que ha sido inoculada con la bacteria diana y los químicos se difunden fuera de los discos hacia el agar donde se han inoculado las bacterias. A medida que crece el “césped” de las bacterias, las zonas de inhibición del crecimiento microbiano se observan como áreas claras alrededor de los discos. Aunque existen otros factores que contribuyen a los tamaños de las zonas de inhibición (por ejemplo, si el agente es soluble en agua y capaz de difundirse en el agar), las zonas más grandes típicamente se correlacionan con una mayor eficacia de inhibición del agente químico. El diámetro a través de cada zona se mide en milímetros.
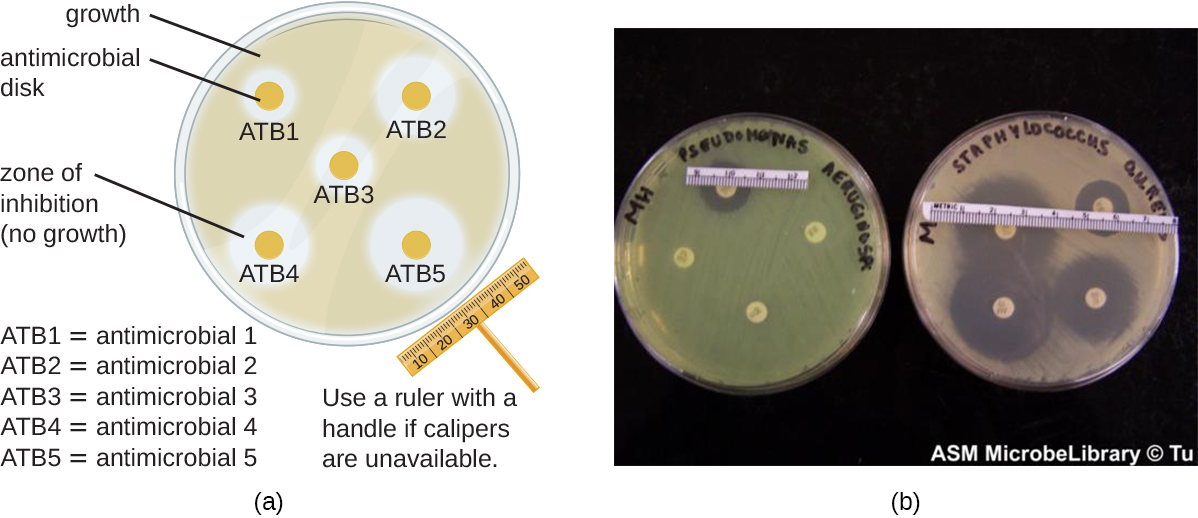
Ejercicio13.4.2
Al comparar las actividades de dos desinfectantes contra un mismo microbio, utilizando el ensayo de difusión de disco, y asumiendo que ambos son solubles en agua y pueden difunderse fácilmente en el agar, ¿un desinfectante más efectivo tendría una zona de inhibición más grande o una más pequeña?
Prueba de dilución de uso
También se utilizan otros métodos para medir la efectividad de un agente químico en entornos clínicos. La prueba de dilución de uso se usa comúnmente para determinar la efectividad de desinfección de un químico en una superficie inanimada. Para esta prueba, se sumerge un cilindro de acero inoxidable en un cultivo del microorganismo objetivo y luego se seca. Luego, el cilindro se sumerge en soluciones de desinfectante a diversas concentraciones durante un período de tiempo especificado. Finalmente, el cilindro se transfiere a un nuevo tubo de ensayo que contiene medio estéril fresco que no contiene desinfectante, y este tubo de ensayo se incuba. La supervivencia bacteriana se demuestra por la presencia de turbidez en el medio, mientras que la muerte del organismo diana en el cilindro por el desinfectante no producirá turbidez.
La Asociación de Químicos Agrícolas Oficiales Internacional (AOAC), un grupo sin fines de lucro que establece muchos estándares de protocolo, ha determinado que un mínimo de 59 de 60 réplicas no deben mostrar crecimiento en dicha prueba para lograr un resultado aprobado, y los resultados deben ser repetibles a partir de diferentes lotes de desinfectante y cuando se realiza en diferentes días. Los fabricantes de desinfectantes realizan pruebas de dilución de uso para validar las afirmaciones de eficacia de sus productos, según lo designado por la EPA.
Ejercicio13.4.3
¿La prueba de uso y dilución se realiza en un entorno clínico? ¿Por qué?
Prueba en uso
Una prueba en uso puede determinar si una solución de desinfectante utilizada activamente en un entorno clínico está contaminada microbialmente (Figura13.4.2). Una muestra de 1 mL del desinfectante usado se diluye en 9 mL de medio de caldo estéril que también contiene un compuesto para inactivar el desinfectante. Diez gotas, que suman aproximadamente 0.2 mL de esta mezcla, se inoculan en cada una de las dos placas de agar. Una placa se incuba a 37 °C durante 3 días y la otra se incuba a temperatura ambiente durante 7 días. Las placas son monitoreadas para el crecimiento de colonias microbianas. El crecimiento de cinco o más colonias en cualquiera de las placas sugiere que existían células microbianas viables en la solución desinfectante y que está contaminada. Dichas pruebas en uso monitorean la efectividad de los desinfectantes en el entorno clínico.
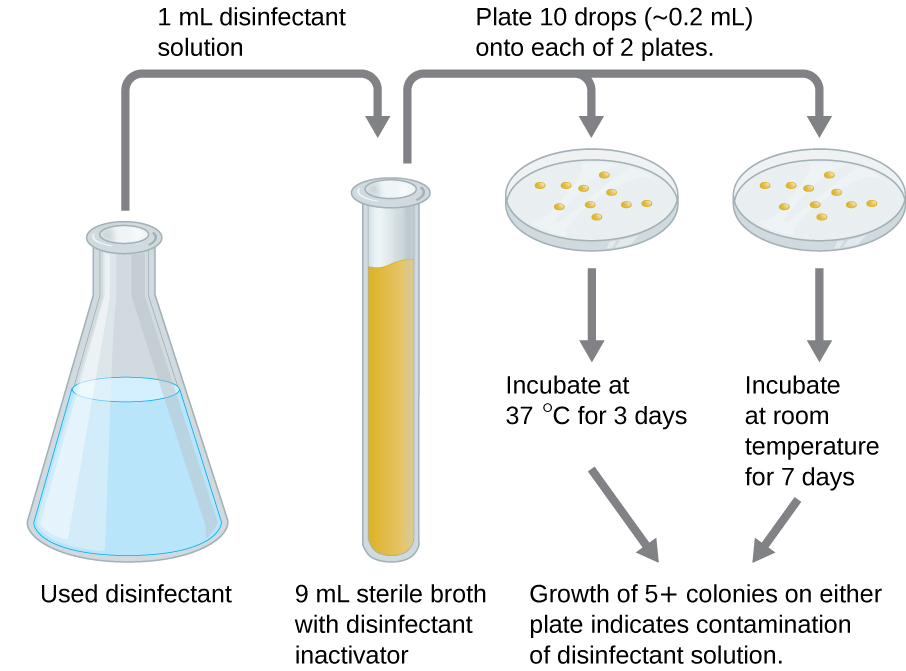
Ejercicio13.4.4
¿Qué indica una prueba positiva en uso?
Foco Clínico: Resolución
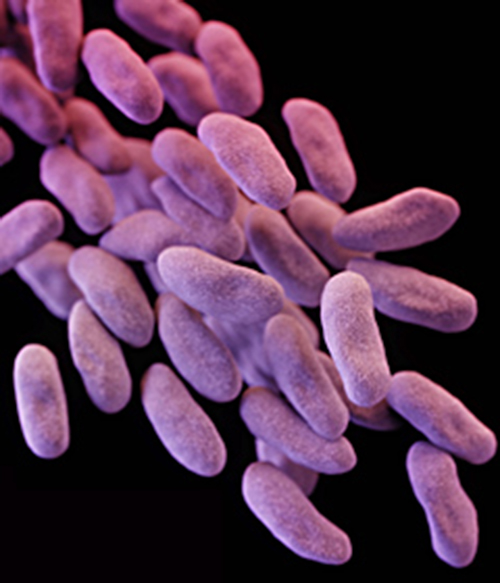
A pesar del tratamiento antibiótico, los síntomas de Roberta empeoraron. Desarrolló pielonefritis, una infección renal grave, y fue rehospitalizada en la unidad de cuidados intensivos (UCI). Su condición continuó deteriorándose y desarrolló síntomas de shock séptico. En este punto, su médico ordenó un cultivo de su orina para determinar la causa exacta de su infección, así como una prueba de sensibilidad a los medicamentos para determinar qué antibióticos serían efectivos contra la bacteria causante. Los resultados de esta prueba indicaron resistencia a una amplia gama de antibióticos, incluyendo los carbapenémicos, una clase de antibióticos que se utilizan como último recurso para muchos tipos de infecciones bacterianas. Este fue un desenlace alarmante, sugiriendo que la infección de Roberta fue causada por una llamada superbacteria: una cepa bacteriana que ha desarrollado resistencia a la mayoría de los antibióticos de uso común. En este caso, el agente causal pertenecía a las Enterobacteriaceae resistentes a carbapenémicos (CRE), una familia de bacterias farmacorresistente que normalmente se encuentra en el sistema digestivo (Figura13.4.3). Cuando se introduce CRE en otros sistemas corporales, como puede ocurrir a través de instrumentos quirúrgicos, catéteres o endoscopios mal limpiados, pueden ocurrir infecciones agresivas.
Las infecciones por CRE son notoriamente difíciles de tratar, con una tasa de mortalidad del 40% al 50%. Para tratar su infección renal y shock séptico, Roberta fue tratada con diálisis, líquidos intravenosos y medicamentos para mantener la presión arterial y prevenir la coagulación de la sangre. También se inició en un tratamiento agresivo con la administración intravenosa de un nuevo medicamento llamado tigeciclina, que ha tenido éxito en el tratamiento de infecciones causadas por bacterias resistentes a los medicamentos.
Después de varias semanas en la UCI, Roberta se recuperó de su infección por CRE. No obstante, los funcionarios de salud pública pronto notaron que el caso de Roberta no estaba aislado. Varios pacientes que se sometieron a procedimientos similares en el mismo hospital también desarrollaron infecciones por CRE, algunos muriendo como resultado. En última instancia, la fuente de la infección se rastreó hasta los duodenoscopios utilizados en los procedimientos. A pesar de que el personal del hospital siguió meticulosamente los protocolos de desinfección del fabricante, las bacterias, incluida la CRE, permanecieron dentro de los instrumentos y fueron introducidas a los pacientes durante los procedimientos
¿Quién es el Responsable?
Las infecciones por Enterobacteriaceae resistentes a carbapenémicos por endoscopios contaminados se han convertido en un problema de alto perfil en los últimos años. Se han rastreado varios brotes de CRE hasta endoscopios, incluido un caso en el Centro Médico Ronald Reagan UCLA a principios de 2015 en el que 179 pacientes pudieron haber estado expuestos a un endoscopio contaminado. Siete de los pacientes desarrollaron infecciones y dos más tarde fallecieron. Se han presentado diversas demandas contra Olympus, el fabricante de los endoscopios. Algunos afirman que Olympus no obtuvo la aprobación de la FDA para cambios de diseño que pudieran haber provocado contaminación, y otros afirman que el fabricante ocultó a sabiendas información de los hospitales sobre defectos en los endoscopios.
Demandas como estas plantean preguntas difíciles de responder sobre responsabilidad. Los procedimientos invasivos son intrínsecamente riesgosos, pero los resultados negativos pueden minimizarse mediante el estricto cumplimiento de los protocolos establecidos. ¿Quién es el responsable, sin embargo, cuando ocurren resultados negativos debido a protocolos defectuosos o equipos defectuosos? ¿Se puede responsabilizar a los hospitales o trabajadores de la salud si han seguido estrictamente un procedimiento defectuoso? ¿Deberían los fabricantes ser responsables, y tal vez ser expulsados del negocio, si sus equipos que salvan vidas fallan o se encuentran defectuosos? ¿Cuál es el papel del gobierno para garantizar que el uso y mantenimiento de equipos médicos y protocolos sean a prueba de fallas?
Los protocolos para limpiar o esterilizar equipos médicos a menudo son desarrollados por agencias gubernamentales como la FDA, y otros grupos, como la AOAC, una organización científica sin fines de lucro que establece muchos protocolos de uso estándar a nivel mundial. Estos procedimientos y protocolos son adoptados luego por los fabricantes de dispositivos y equipos médicos. En última instancia, los usuarios finales (hospitales y su personal) son responsables de seguir estos procedimientos y pueden ser considerados responsables si ocurre una infracción y los pacientes se enferman por equipos mal limpiados.
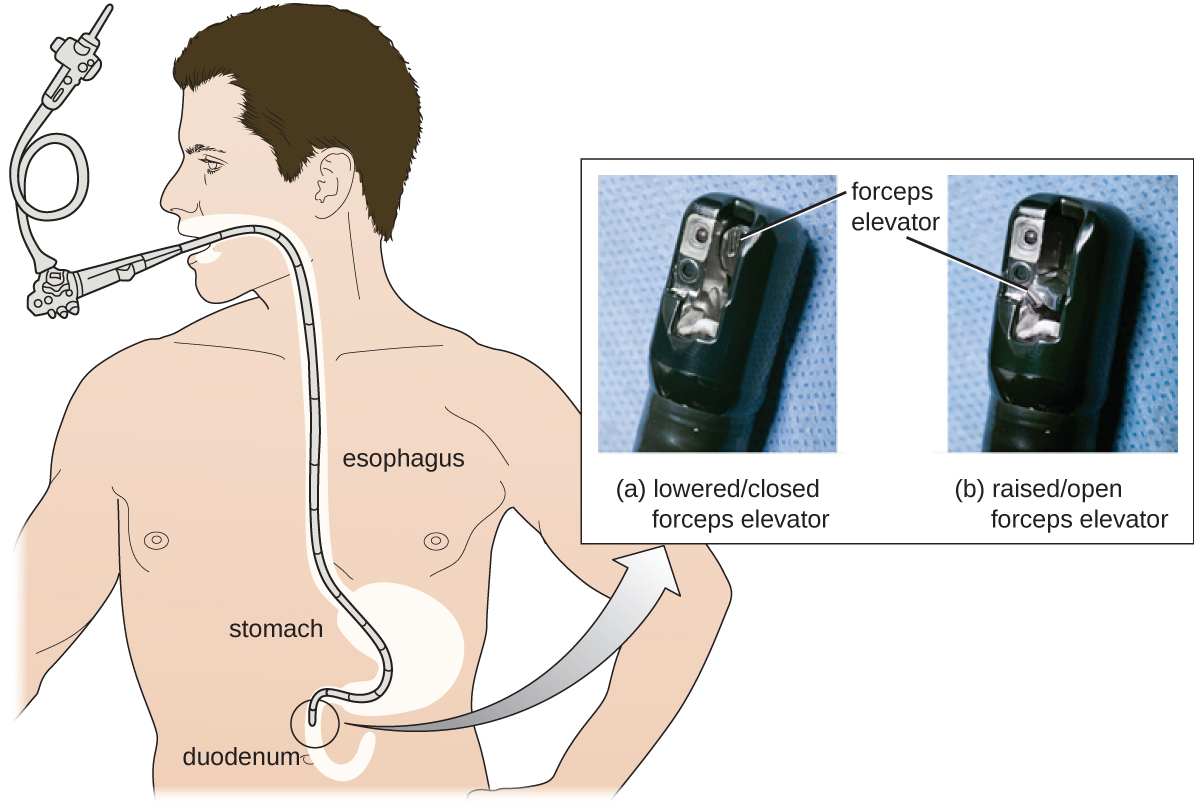
Desafortunadamente, los protocolos no son infalibles, y a veces se necesitan resultados negativos para revelar sus fallas. En 2008, la FDA había aprobado un protocolo de desinfección para endoscopios, utilizando glutaraldehído (a menor concentración cuando se mezcla con fenol), o-ftalaldehído, peróxido de hidrógeno, ácido peracético y una mezcla de peróxido de hidrógeno con ácido peracético. Sin embargo, los brotes posteriores de CRE por el uso de endoscopios mostraron que este protocolo por sí solo era inadecuado.
Como resultado de los brotes de CRE, hospitales, fabricantes y la FDA están investigando soluciones. Muchos hospitales están instituyendo procedimientos de limpieza más rigurosos que los que exige la FDA. Los fabricantes están buscando formas de rediseñar los duodenoscopios para minimizar las grietas difíciles de alcanzar donde las bacterias pueden escapar de los desinfectantes, y la FDA está actualizando sus protocolos. En febrero de 2015, la FDA agregó nuevas recomendaciones para la limpieza cuidadosa de las manos del mecanismo elevador del duodenoscopio (la ubicación donde los microbios tienen más probabilidades de escapar a la desinfección), y emitió documentación más cuidadosa sobre el control de calidad de los protocolos de desinfección (Figura13.4.4).
No hay garantía de que nuevos procedimientos, protocolos o equipos eliminen por completo el riesgo de infección asociada a los endoscopios. Sin embargo, estos dispositivos se utilizan con éxito en 500,000—650,000 procedimientos anuales en los Estados Unidos, muchos de ellos salvavidas. ¿En qué momento los riesgos superan los beneficios de estos dispositivos y a quién se debe responsabilizar cuando se producen resultados negativos?
Conceptos clave y resumen
- Los desinfectantes químicos se agrupan por los tipos de microbios y agentes infecciosos contra los que son efectivos. Los germicidas de alto nivel matan células vegetativas, hongos, virus y endosporas, y en última instancia, pueden conducir a la esterilización. Los germicidas de nivel intermedio no pueden matar a todos los virus y son menos efectivos contra las endosporas. Los germicidas de bajo nivel matan las células vegetativas y algunos virus envueltos, pero son ineficaces contra las endosporas.
- La efectividad de un desinfectante está influenciada por varios factores, incluyendo la duración de la exposición, la concentración del desinfectante, la temperatura y el pH.
- Históricamente, se comparó la efectividad de un desinfectante químico con la del fenol al matar a Staphylococcus aureus y Salmonella enterica serovar Typhi, y se calculó un coeficiente de fenol.
- El método de difusión de disco se utiliza para probar la efectividad de un desinfectante químico contra un microbio en particular.
- La prueba de dilución de uso determina la efectividad de un desinfectante en una superficie. Las pruebas en uso pueden determinar si las soluciones desinfectantes se están utilizando correctamente en entornos clínicos.


