16.3: Cómo se propagan las enfermedades
- Page ID
- 54889
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Describir los diferentes tipos de reservorios de enfermedades
- Comparar modos de transmisión de contacto, vector y vehículo
- Identificar vectores importantes de enfermedades
- Explicar la prevalencia de infecciones nosocomiales
Comprender cómo se propagan los patógenos infecciosos es fundamental para prevenir enfermedades infecciosas. Muchos patógenos requieren un huésped vivo para sobrevivir, mientras que otros pueden persistir en un estado latente fuera de un huésped vivo. Pero al haber infectado a un huésped, todos los patógenos también deben tener un mecanismo de transferencia de un huésped a otro o morirán cuando su hospedador muera. Los patógenos a menudo tienen elaboradas adaptaciones para explotar la biología, el comportamiento y la ecología del huésped para vivir y moverse entre los hospederos. Los huéspedes han desarrollado defensas contra patógenos, pero debido a que sus tasas de evolución suelen ser más lentas que sus patógenos (debido a que sus tiempos de generación son más largos), los huéspedes suelen estar en desventaja evolutiva. Esta sección explorará dónde sobreviven los patógenos, tanto dentro como fuera de los huéspedes, y algunas de las muchas formas en que se mueven de un huésped a otro.
Embalses y Transportadores
Para que los patógenos persistan durante largos periodos de tiempo requieren reservorios donde residen normalmente. Los reservorios pueden ser organismos vivos o sitios no vivos. Los reservorios no vivos pueden incluir suelo y agua en el ambiente. Estos pueden albergar naturalmente al organismo porque puede crecer en ese ambiente. Estos ambientes también pueden contaminarse con patógenos en heces humanas, patógenos desprendidos por hospedadores intermedios o patógenos contenidos en los restos de hospedadores intermedios.
Los patógenos pueden tener mecanismos de latencia o resiliencia que les permitan sobrevivir (pero normalmente no reproducirse) durante diferentes períodos de tiempo en ambientes no vivos. Por ejemplo, Clostridium tetani sobrevive en el suelo y en presencia de oxígeno como endospora resistente. Aunque muchos virus pronto se destruyen una vez en contacto con el aire, el agua u otras condiciones no fisiológicas, ciertos tipos son capaces de persistir fuera de una célula viva durante diferentes cantidades de tiempo. Por ejemplo, un estudio que analizó la capacidad de los virus de la influenza para infectar un cultivo celular después de cantidades variables de tiempo en un billete mostró tiempos de supervivencia de 48 horas a 17 días, dependiendo de cómo se depositaron en el billete. 1 Por otro lado, los rinovirus causantes de frío son algo frágiles, por lo general sobreviven menos de un día fuera de los fluidos fisiológicos.
Un ser humano que actúa como reservorio de un patógeno puede o no ser capaz de transmitir el patógeno, dependiendo de la etapa de infección y del patógeno. Para ayudar a prevenir la propagación de enfermedades entre los escolares, los CDC han desarrollado pautas basadas en el riesgo de transmisión durante el curso de la enfermedad. Por ejemplo, los niños con varicela son considerados contagiosos durante cinco días desde el inicio de la erupción, mientras que los niños con la mayoría de las enfermedades gastrointestinales deben permanecer en casa durante 24 horas después de que desaparezcan los síntomas.
Un individuo capaz de transmitir un patógeno sin presentar síntomas es referido como portador. Un portador pasivo está contaminado con el patógeno y puede transmitirlo mecánicamente a otro huésped; sin embargo, un portador pasivo no está infectado. Por ejemplo, un profesional de la salud que no logra lavarse las manos después de ver a un paciente que alberga un agente infeccioso podría convertirse en un portador pasivo, transmitiendo el patógeno a otro paciente que se infecta.
Por el contrario, un portador activo es un individuo infectado que puede transmitir la enfermedad a otros. Un portador activo puede presentar o no signos o síntomas de infección. Por ejemplo, los portadores activos pueden transmitir la enfermedad durante el período de incubación (antes de que muestren signos y síntomas) o el período de convalecencia (después de que los síntomas hayan disminuido). Los portadores activos que no presentan signos o síntomas de enfermedad a pesar de la infección se denominan portadores asintomáticos. Patógenos como el virus de la hepatitis B, el virus del herpes simple y el VIH son frecuentemente transmitidos por portadores asintomáticos. Mary Mallon, mejor conocida como María tifoidea, es un famoso ejemplo histórico de portadora asintomática. Inmigrante irlandés, Mallon trabajó como cocinero para hogares en la ciudad de Nueva York y sus alrededores entre 1900 y 1915. En cada hogar, los residentes desarrollaron fiebre tifoidea (causada por Salmonella typhi) pocas semanas después de que Mallon comenzara a trabajar. Investigaciones posteriores determinaron que Mallon fue responsable de al menos 122 casos de fiebre tifoidea, cinco de los cuales fueron mortales. 2 Consulte Eye on Ethics: Typhoid Mary para más información sobre el caso Mallon.
Un patógeno puede tener más de un reservorio vivo. En las enfermedades zoonóticas, los animales actúan como reservorios de enfermedades humanas y transmiten el agente infeccioso a los humanos a través del contacto directo o indirecto. En algunos casos, la enfermedad también afecta al animal, pero en otros casos el animal es asintomático.
En las infecciones parasitarias, el hospedador preferido del parásito se llama hospedador definitivo. En parásitos con ciclos de vida complejos, el hospedador definitivo es el huésped en el que el parásito alcanza la madurez sexual. Algunos parásitos también pueden infectar a uno o más huéspedes intermedios en los que el parásito atraviesa varias etapas inmaduras del ciclo de vida o se reproduce asexualmente.
George Soper, el ingeniero sanitario que rastreó el brote tifoidea hasta Mary Mallon, da cuenta de su investigación, ejemplo de epidemiología descriptiva, en “La curiosa carrera de María tifoidea”.
Ejercicio\(\PageIndex{1}\)
- Enumere algunos reservorios no vivos para patógenos.
- Explicar la diferencia entre una portadora pasiva y una portadora activa.
Transmisión
Independientemente del reservorio, la transmisión debe ocurrir para que una infección se propague. Primero, debe ocurrir la transmisión del reservorio al individuo. Entonces, el individuo debe transmitir el agente infeccioso a otros individuos susceptibles, ya sea directa o indirectamente. Los microorganismos patógenos emplean diversos mecanismos de transmisión.
Contacto Transmisión
La transmisión de contacto incluye contacto directo o contacto indirecto. La transmisión de persona a persona es una forma de transmisión de contacto directo. Aquí el agente se transmite por contacto físico entre dos individuos (Figura\(\PageIndex{1}\)) a través de acciones como tocar, besar, relaciones sexuales o aerosoles de gotas. El contacto directo se puede clasificar como transmisión vertical, horizontal o de gotitas. La transmisión vertical de contacto directo ocurre cuando los patógenos se transmiten de madre a hijo durante el embarazo, el parto o la lactancia. Otros tipos de transmisión de contacto directo se denominan transmisión de contacto directo horizontal. A menudo, se requiere el contacto entre las membranas mucosas para la entrada del patógeno en el nuevo hospedador, aunque el contacto piel con piel puede conducir al contacto con la membrana mucosa si el nuevo huésped toca posteriormente una membrana mucosa. La transmisión por contacto también puede ser específica del sitio; por ejemplo, algunas enfermedades pueden transmitirse por contacto sexual pero no por otras formas de contacto.
Cuando un individuo tose o estornuda, se expulsan pequeñas gotas de moco que pueden contener patógenos. Esto conduce a la transmisión directa de gotitas, que se refiere a la transmisión de gotitas de un patógeno a un nuevo huésped a distancias de un metro o menos. Una amplia variedad de enfermedades se transmiten por gotitas, incluyendo la influenza y muchas formas de neumonía. La transmisión en distancias mayores a un metro se llama transmisión aérea.
La transmisión por contacto indirecto involucra objetos inanimados llamados fomites que se contaminan por patógenos de un individuo o reservorio infectado (Figura\(\PageIndex{2}\)). Por ejemplo, un individuo con el resfriado común puede estornudar, haciendo que las gotas caigan sobre un fomite como un mantel o una alfombra, o el individuo puede limpiarse la nariz y luego transferir moco a un fomite como un pomo o toalla. La transmisión ocurre indirectamente cuando un nuevo huésped susceptible luego toca el fomite y transfiere el material contaminado a un portal de entrada susceptible. Los fomites también pueden incluir objetos utilizados en entornos clínicos que no están debidamente esterilizados, como jeringas, agujas, catéteres y equipo quirúrgico. Los patógenos transmitidos indirectamente a través de dichos fomitos son una de las principales causas de infecciones asociadas a la atención médica (ver Control del crecimiento microbiano).


Transmisión Vehicular
El término transmisión vehicular se refiere a la transmisión de patógenos a través de vehículos como el agua, los alimentos y el aire. La contaminación del agua por métodos de saneamiento deficientes conduce a la transmisión de enfermedades transmitidas por el agua Las enfermedades transmitidas por el agua siguen siendo un problema grave en muchas regiones del mundo. La Organización Mundial de la Salud (OMS) estima que el agua potable contaminada es responsable de más de 500 mil muertes cada año. 3 De igual manera, los alimentos contaminados por un manejo o almacenamiento deficiente pueden conducir a la transmisión de enfermedades transmitidas por los alimentos (Figura\(\PageIndex{3}\)).
El polvo y las partículas finas conocidas como aerosoles, que pueden flotar en el aire, pueden transportar patógenos y facilitar la transmisión de enfermedades en el aire. Por ejemplo, las partículas de polvo son el modo dominante de transmisión del hantavirus a los humanos. El hantavirus se encuentra en las heces de los ratones, la orina y la saliva, pero cuando estas sustancias se secan, pueden desintegrarse en partículas finas que pueden llegar a ser transportadas por el aire cuando se alteran; la inhalación de estas partículas puede conducir a una infección respiratoria grave y a veces fatal.
Aunque la transmisión de gotitas a distancias cortas se considera transmisión por contacto como se discutió anteriormente, la transmisión de gotitas a mayor distancia a través del aire se considera transmisión del vehículo. A diferencia de las partículas más grandes que caen rápidamente de la columna de aire, las gotitas finas de moco producidas por la tos o los estornudos pueden permanecer suspendidas durante largos períodos de tiempo, recorriendo distancias considerables. En ciertas condiciones, las gotitas se desecan rápidamente para producir un núcleo de gotitas que es capaz de transmitir patógenos; la temperatura y la humedad del aire pueden tener un impacto en la efectividad de la transmisión aerotransportada.
La tuberculosis a menudo se transmite por transmisión aérea cuando el agente causante, Mycobacterium tuberculosis, se libera en pequeñas partículas con tos. Debido a que la tuberculosis requiere de tan solo 10 microbios para iniciar una nueva infección, los pacientes con tuberculosis deben ser tratados en habitaciones equipadas con ventilación especial, y cualquier persona que ingrese a la habitación debe usar mascarilla.

Foco Clínico: Resolución
Después de identificar la fuente de los turduckens contaminados, la oficina de salud pública de Florida notificó a los CDC, los cuales solicitaron una inspección expedita de la instalación por parte de inspectores estatales. Los inspectores encontraron que una máquina utilizada para procesar el pollo estaba contaminada con Salmonella como resultado de protocolos de limpieza deficientes. Los inspectores también encontraron que el proceso de relleno y envasado de los turduckens previo a la refrigeración permitió que la carne permaneciera a temperaturas propicias para el crecimiento bacteriano durante demasiado tiempo. La contaminación y la refrigeración retardada llevaron a la transmisión vehicular (alimentaria) de las bacterias en turduckens.
Con base en estos hallazgos, la planta se cerró para una descontaminación completa y completa. Todos los turduckens producidos en la planta fueron retirados del mercado y sacados de las estanterías de las tiendas antes de la temporada navideña de diciembre, evitando nuevos brotes.
Transmisión vectorial
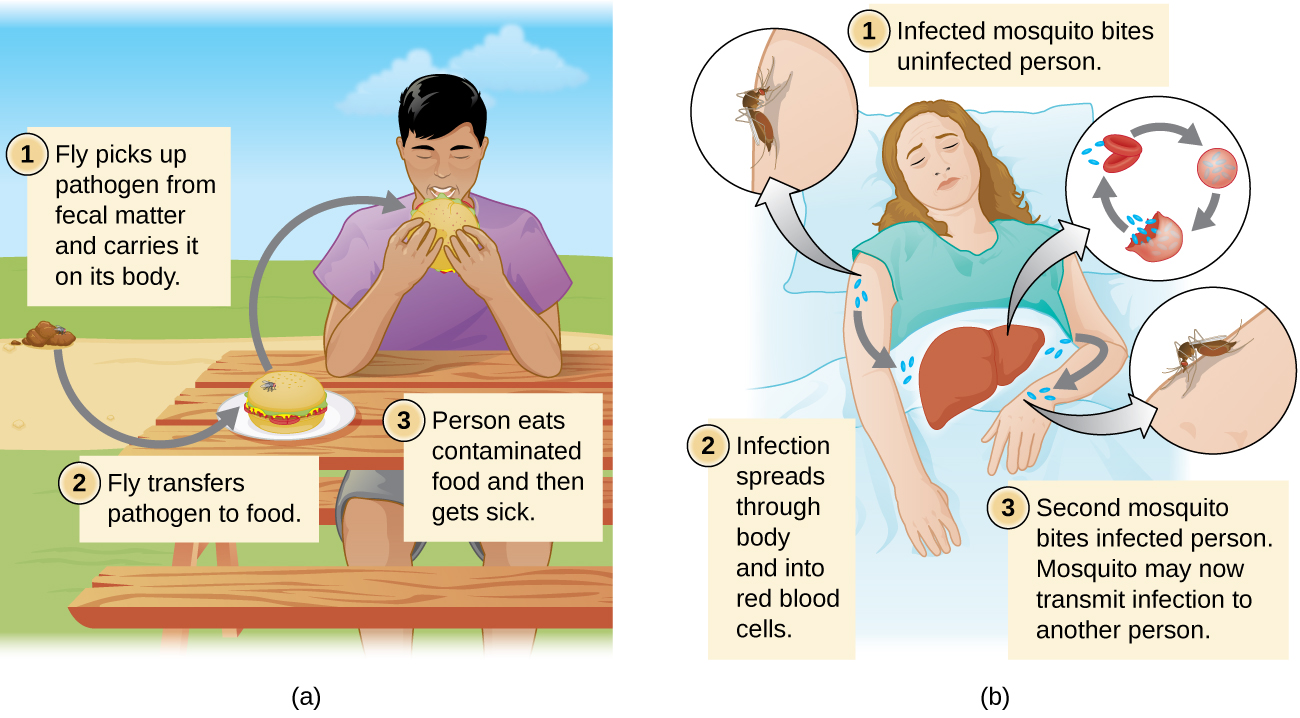
Las enfermedades también pueden transmitirse por un vector mecánico o biológico, un animal (típicamente un artrópodo) que transporta la enfermedad de un huésped a otro. La transmisión mecánica es facilitada por un vector mecánico, un animal que transporta un patógeno de un huésped a otro sin ser infectado por sí mismo. Por ejemplo, una mosca puede aterrizar sobre la materia fecal y posteriormente transmitir bacterias de las heces a los alimentos sobre los que aterriza; un humano que come el alimento puede entonces infectarse por la bacteria, resultando en un caso de diarrea o disentería (Figura\(\PageIndex{4}\)).
La transmisión biológica ocurre cuando el patógeno se reproduce dentro de un vector biológico que transmite el patógeno de un huésped a otro (Figura\(\PageIndex{4}\)). Los artrópodos son los principales vectores responsables de la transmisión biológica (Figura\(\PageIndex{5}\)). La mayoría de los vectores artrópodos transmiten el patógeno mordiendo al huésped, creando una herida que sirve como portal de entrada. El patógeno puede pasar por parte de su ciclo reproductivo en el intestino o glándulas salivales del artrópodo para facilitar su transmisión a través de la picadura. Por ejemplo, los hemípteros (llamados “bichos besadores” o “insectos asesinos”) transmiten la enfermedad de Chagas a los humanos al defecar cuando muerden, después de lo cual el humano se rasca o frota las heces infectadas en una membrana mucosa o se rompen en la piel.
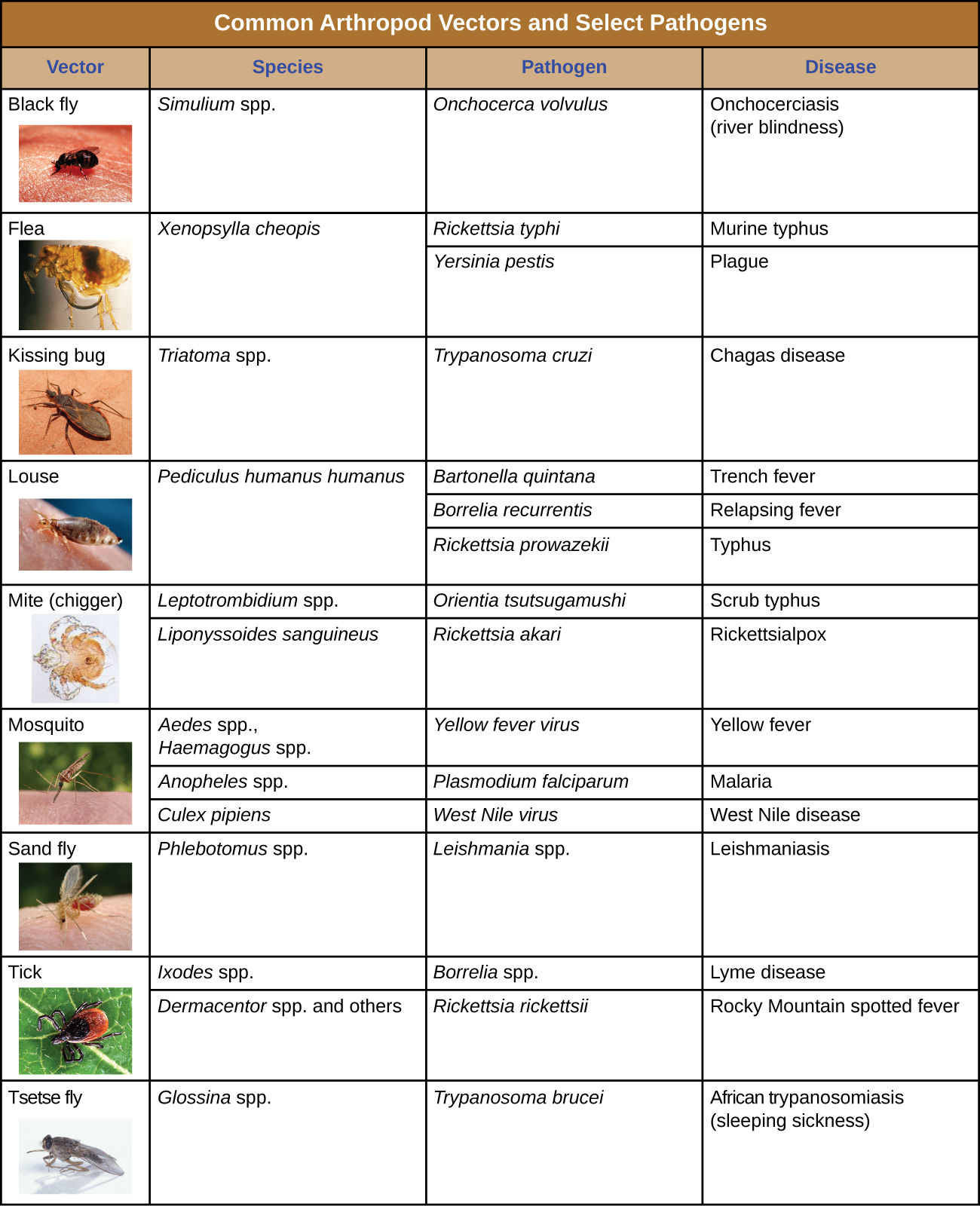
Los insectos vectores biológicos incluyen mosquitos, que transmiten malaria y otras enfermedades, y piojos, que transmiten tifus. Otros vectores artrópodos pueden incluir arácnidos, principalmente garrapatas, que transmiten la enfermedad de Lyme y otras enfermedades, y ácaros, que transmiten tifus matorrales y viruela rickettsial. La transmisión biológica, debido a que implica supervivencia y reproducción dentro de un vector parasitado, complica la biología del patógeno y su transmisión. También hay importantes vectores de enfermedades no artrópodos, incluyendo mamíferos y aves. Diversas especies de mamíferos pueden transmitir la rabia a los humanos, generalmente por medio de una picadura que transmite el virus de la rabia. Los pollos y otras aves de corral domésticas pueden transmitir la influenza aviar a los humanos a través del contacto directo o indirecto con el virus de la influenza aviar A que se desprende en la saliva, las mucosas y las heces
Ejercicio\(\PageIndex{2}\)
- Describir cómo las enfermedades pueden transmitirse por el aire.
- Explicar la diferencia entre un vector mecánico y un vector biológico.
Uso de OGM para Detener la Propagación del Zika
En 2016, una epidemia del virus Zika se vinculó a una alta incidencia de defectos congénitos en América del Sur y Centroamérica. A medida que el invierno se volvió primavera en el hemisferio norte, los funcionarios de salud predijeron correctamente que el virus se extendería a América del Norte, coincidiendo con la época de reproducción de su principal vector, el mosquito Aedes aegypti.
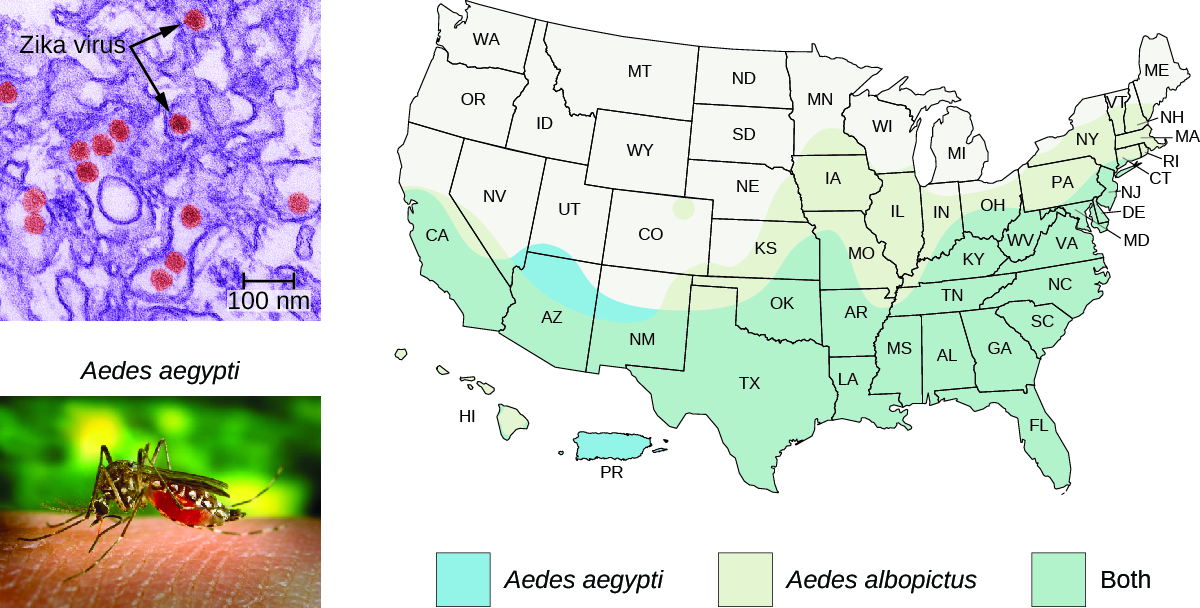
El área de distribución del mosquito A. aegypti se extiende hasta el sur de Estados Unidos (Figura\(\PageIndex{6}\)). Debido a que estos mismos mosquitos sirven como vectores para otras enfermedades problemáticas (dengue, fiebre amarilla y otras), se han propuesto diversos métodos de control de mosquitos como soluciones. Los pesticidas químicos se han utilizado efectivamente en el pasado, y es probable que se vuelvan a usar; pero debido a que los pesticidas químicos pueden tener impactos negativos en el medio ambiente, algunos científicos han propuesto una alternativa que involucra la ingeniería genética A. aegypti para que no pueda reproducirse. Este método, sin embargo, ha sido objeto de cierta controversia.
Un método que ha funcionado en el pasado para controlar plagas, con poca desventaja aparente, ha sido la introducción estéril de machos. Este método controló la plaga de la mosca del gusano tornillo en el suroeste de Estados Unidos y las plagas de la mosca de la fruta en cultivos frutales. En este método, los machos de la especie diana son criados en laboratorio, esterilizados con radiación y liberados al ambiente donde se aparean con hembras silvestres, que posteriormente no tienen descendencia viva. Las liberaciones repetidas encogen la población de plagas.
Un método similar, aprovechando la tecnología de ADN recombinante, 4 introduce un alelo letal dominante en mosquitos machos que se suprime en presencia de tetraciclina (un antibiótico) durante la cría de laboratorio. Los machos son liberados al ambiente y se aparean con mosquitos hembra. A diferencia del método masculino estéril, estos apareamientos producen descendencia, pero mueren como larvas del gen letal en ausencia de tetraciclina en el ambiente. A partir de 2016, este método aún no se ha implementado en Estados Unidos, pero una compañía británica probó el método en Piracicaba, Brasil, y encontró una reducción de 82% en larvas silvestres de A. aegypti y una reducción de 91% en los casos de dengue en el área tratada. 5 En agosto de 2016, en medio de noticias de infecciones por zika en varias comunidades de Florida, la FDA dio permiso a la compañía británica para probar este mismo método de control de mosquitos en Key West, Florida, en espera del cumplimiento de las regulaciones locales y estatales y de un referéndum en las comunidades afectadas.
El uso de organismos genéticamente modificados (OGM) para controlar un vector de enfermedad tiene tanto sus defensores como sus oponentes. En teoría, el sistema podría ser utilizado para impulsar la extinción del mosquito A. aegypti, un noble objetivo según algunos, dado el daño que causan a las poblaciones humanas. 6 Pero a los oponentes de la idea les preocupa que el gen pueda escapar del límite de especies de A. aegypti y causar problemas en otras especies, lo que lleva a consecuencias ecológicas imprevistas. Los opositores también desconfían del programa porque está siendo administrado por una corporación con fines de lucro, creando el potencial de conflictos de intereses que tendrían que estar estrictamente regulados; y no está claro cómo podrían revertirse las consecuencias no deseadas del programa.
También hay otras consideraciones epidemiológicas. Aedes aegypti aparentemente no es el único vector para el virus Zika. Aedes albopictus, el mosquito tigre asiático, también es un vector para el virus Zika. 7 A. albopictus ahora está muy extendido en todo el planeta incluyendo gran parte de Estados Unidos (Figura\(\PageIndex{6}\)). Se ha encontrado que muchos otros mosquitos albergan el virus del Zika, aunque se desconoce su capacidad para actuar como vectores. 8 Las cepas genéticamente modificadas de A. aegypti no controlarán las otras especies de vectores. Por último, el virus Zika aparentemente puede transmitirse sexualmente entre huéspedes humanos, de madre a hijo, y posiblemente a través de transfusiones de sangre. Todos estos factores deben ser considerados en cualquier enfoque para controlar la propagación del virus.
Claramente, hay riesgos e incógnitas involucradas en la realización de un experimento de ambiente abierto de una tecnología aún poco conocida. Pero permitir que el virus Zika se propague sin control también es arriesgado. ¿La amenaza de una epidemia de zika justifica el riesgo ecológico de los mosquitos de ingeniería genética? ¿Son los métodos actuales de control de mosquitos lo suficientemente ineficaces o dañinos que necesitamos para probar alternativas no probadas? Estas son las preguntas que ahora se hacen a los funcionarios de salud pública.
Cuarentenas
Los individuos sospechosos o que se sabe que han estado expuestos a ciertos patógenos contagiosos pueden ser puestos en cuarentena o aislados para evitar la transmisión de la enfermedad a otros. Los hospitales y otros centros de salud generalmente establecen salas especiales para aislar a los pacientes con enfermedades particularmente peligrosas como la tuberculosis o el ébola (Figura\(\PageIndex{7}\)). Dependiendo del entorno, estas salas pueden estar equipadas con métodos especiales de manejo de aire, y el personal puede implementar protocolos especiales para limitar el riesgo de transmisión, como equipo de protección personal o el uso de aerosoles desinfectantes químicos al ingreso y salida del personal médico.
La duración de la cuarentena depende de factores como el periodo de incubación de la enfermedad y la evidencia sugestiva de una infección. El paciente puede ser liberado si los signos y síntomas no se materializan cuando se espera o si se puede administrar un tratamiento preventivo para limitar el riesgo de transmisión. Si se confirma la infección, el paciente puede verse obligado a permanecer en aislamiento hasta que la enfermedad ya no se considere contagiosa.
En Estados Unidos, las autoridades de salud pública solo pueden poner en cuarentena a los pacientes por ciertas enfermedades, como el cólera, la difteria, la tuberculosis infecciosa y las cepas de influenza capaces de causar una pandemia. Los individuos que ingresan a Estados Unidos o se mueven entre estados pueden ser puestos en cuarentena por los CDC si se sospecha que han estado expuestos a una de estas enfermedades. Aunque los CDC monitorean rutinariamente los puntos de entrada a Estados Unidos para la tripulación o pasajeros que presenten enfermedades, rara vez se implementa la cuarentena.

Infecciones asociadas a la atención de la salud (nosocomiales)
Hospitales, hogares de ancianos y prisiones atraen la atención de epidemiólogos porque estos entornos están asociados con una mayor incidencia de ciertas enfermedades. Las tasas más altas de transmisión pueden ser causadas por características del propio entorno, características de la población, o ambas. En consecuencia, se deben realizar esfuerzos especiales para limitar los riesgos de infección en estos entornos.
Las infecciones adquiridas en los centros de salud, incluidos los hospitales, se denominan infecciones nosocomiales o infecciones asociadas a la atención médica (HAI). Las HAI suelen estar conectadas con cirugía u otros procedimientos invasivos que proporcionan al patógeno acceso al portal de la infección. Para que una infección se clasifique como HAI, el paciente debe haber sido ingresado en el centro de salud por un motivo distinto a la infección. En estos entornos, los pacientes que sufren de enfermedad primaria a menudo sufren de inmunidad comprometida y son más susceptibles a la infección secundaria y patógenos oportunistas.
En 2011, más de 720,000 HAI ocurrieron en hospitales de Estados Unidos, según los CDC. Alrededor del 22% de estas HAI se presentaron en un sitio quirúrgico, y los casos de neumonía representaron otro 22%; las infecciones del tracto urinario representaron un 13% adicional, y las infecciones primarias del torrente sanguíneo 10%. 9 Tales HAI a menudo ocurren cuando los patógenos se introducen en el cuerpo de los pacientes a través de equipos quirúrgicos o médicos contaminados, como catéteres y respiradores respiratorios. Los centros de salud buscan limitar las infecciones nosocomiales a través de protocolos de entrenamiento e higiene como los descritos en Control del crecimiento microbiano.
Ejercicio\(\PageIndex{3}\)
Dar algunas razones por las que ocurren las HAI.
Conceptos clave y resumen
- Los reservorios de enfermedades humanas pueden incluir las poblaciones humanas y animales, el suelo, el agua y los objetos o materiales inanimados.
- La transmisión por contacto puede ser directa o indirecta a través del contacto físico con un huésped infectado (directo) o el contacto con un fómito con el que un huésped infectado haya hecho contacto previamente (indirecto).
- La transmisión del vector ocurre cuando un organismo vivo transporta un agente infeccioso en su cuerpo (mecánico) o como huésped infeccioso (biológico), a un nuevo hospedador.
- La transmisión vehicular ocurre cuando una sustancia, como el suelo, el agua o el aire, transporta un agente infeccioso a un nuevo hospedador.
- Las infecciones asociadas a la atención médica (HAI), o infecciones nosocomiales, se adquieren en un entorno clínico. La transmisión se ve facilitada por intervenciones médicas y la alta concentración de individuos susceptibles e inmunodeprimidos en entornos clínicos.
Notas al pie
- 1 Yves Thomas, Guido Vogel, Werner Wunderli, Patricia Suter, Mark Witschi, Daniel Koch, Caroline Taparel y Laurent Kaiser. “Supervivencia del Virus Influenza en Billetes”. Microbiología Aplicada y Ambiental 74, núm. 10 (2008): 3002—3007.
- 2 Filio Marineli, Gregory Tsoucalas, Marianna Karamanou, y George Androutsos. “Mary Mallon (1869—1938) y la historia de la fiebre tifoidea”. Anales de Gastroenterología 26 (2013): 132—134. www.ncbi.nlm.nih.gov/pmc/arti... rol-26-132.pdf.
- 3 Organización Mundial de la Salud. Hoja informativa No. 391 —Agua Potable. Junio 2005. www.who.int/mediacentre/factsheets/fs391/es.
- 4 Blandine Massonnet-Bruneel, Nicole Corre-Catelin, Renaud Lacroix, Rosemary S. Lees, Kim Phuc Hoang, Derric Nimmo, Luke Alphey y Paul Reiter. “Aptitud de los machos del mosquito transgénico Aedes aegypti que portan un sistema genético letal dominante”. PLOS ONE 8, núm. 5 (2013): e62711.
- 5 Richard Levine. “Los casos de Dengue bajan 91 por ciento debido a los mosquitos genéticamente modificados”. Entomología Hoy. entomologíatoday.org/2016/07/... mosquitos ied-.
- 6 Olivia Judson. “La muerte de un insecto”. The New York Times, 25 de septiembre de 2003. www.nytimes.com/2003/09/25/op... g-s-death.html.
- 7 Gilda Grard, Mélanie Caron, Illich Manfred Mombo, Dieudonné Nkoghe, Statiana Mbaui Ondo, Davy Jiolle, Didier Fontenille, Christophe Paupy y Eric Maurice Leroy. “El virus del Zika en Gabón (África Central) —2007: ¿una nueva amenaza de Aedes albopictus?” PLOS Enfermedades Tropicales Desatendidas 8, núm. 2 (2014): e2681.
- 8 Constância F.J. Ayres. “Identificación de Vectores del Virus Zika e Implicaciones para el Control”. La Lanceta Enfermedades Infecciosas 16, núm. 3 (2016): 278—279.
- 9 Centros de Control y Prevención de Enfermedades. “HAI Datos y Estadísticas”. 2016. http://www.cdc.gov/hai/surveillance. Accedido ene 2, 2016.


