22.4: Micosis Respiratorias
- Page ID
- 54748
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Identificar los hongos más comunes que pueden causar infecciones de las vías respiratorias
- Comparar las principales características de enfermedades fúngicas específicas de las vías respiratorias
Los patógenos fúngicos son ubicuos en el medio ambiente. Estudios serológicos han demostrado que la mayoría de las personas han estado expuestas a patógenos respiratorios fúngicos durante su vida. Sin embargo, las infecciones sintomáticas por estos microbios son raras en individuos sanos. Esto demuestra la eficacia de las defensas de nuestro sistema respiratorio. En esta sección, examinaremos algunos de los hongos que pueden causar infecciones respiratorias.
Histoplasmosis
La histoplasmosis es una enfermedad fúngica del sistema respiratorio y ocurre con mayor frecuencia en el Valle del Mississippi de los Estados Unidos y en partes de América Central y del Sur, África, Asia y Australia. El agente causante, Histoplasma capsulatum, es un hongo dimórfico. Este microbio crece como un moho filamentoso en el ambiente pero se presenta como una levadura en ciernes durante las infecciones humanas. El reservorio primario de este patógeno es el suelo, particularmente en lugares ricos en heces de murciélagos o aves.
La histoplasmosis se adquiere inhalando esporas microconidiales en el aire; esta enfermedad no se transmite de humano a humano. La incidencia de exposición a histoplasmosis es alta en áreas endémicas, con 60% — 90% de la población que tiene anticuerpos anti- Histoplasma, dependiendo de la ubicación; 1 sin embargo, relativamente pocos individuos expuestos al hongo realmente experimentan síntomas. Los más propensos a ser afectados son los muy jóvenes, los ancianos y las personas inmunodeprimidas.
En muchos sentidos, el curso de esta enfermedad es similar al de la tuberculosis. Después de la inhalación, las esporas ingresan a los pulmones y son fagocitadas por macrófagos alveolares. Las células fúngicas sobreviven y se multiplican dentro de estos fagocitos (ver Figura 5.3.2). Las infecciones focales provocan la formación de lesiones granulomatosas, lo que puede conducir a calcificaciones que se asemejan a los complejos Ghon de tuberculosis, incluso en casos asintomáticos. También al igual que la tuberculosis, la histoplasmosis puede volverse crónica y puede ocurrir la reactivación, junto con la diseminación a otras áreas del cuerpo (por ejemplo, el hígado o el bazo).
Los signos y síntomas de la histoplasmosis pulmonar incluyen fiebre, dolor de cabeza y debilidad con algunas molestias en el pecho. El diagnóstico inicial a menudo se basa en radiografías de tórax y cultivos cultivados en medios selectivos fúngicos como el agar dextrosa de Sabouraud. También se puede utilizar la tinción de anticuerpos de fluorescencia directa y la tinción de Giemsa para detectar este patógeno. Además, se pueden utilizar pruebas serológicas que incluyen un ensayo de fijación del complemento y sensibilidad a la histoplasmina para confirmar el diagnóstico. En la mayoría de los casos, estas infecciones son autolimitantes y no se requiere terapia antifúngica. Sin embargo, en la enfermedad diseminada, los antifúngicos anfotericina B y ketoconazol son efectivos; el itraconazol puede ser efectivo en pacientes inmunocomprometidos, en los que la enfermedad puede ser más grave.
Ejercicio\(\PageIndex{1}\)
- ¿En qué ambientes es más probable que se infecte con histoplasmosis?
- Identificar al menos dos similitudes entre histoplasmosis y tuberculosis.
Coccidioidomicosis
La infección por el hongo dimórfico Coccidioides immitis causa coccidioidomicosis. Debido a que el microbio es endémico del Valle de San Joaquín de California, la enfermedad a veces se le conoce como fiebre del Valle. Una especie relacionada que causa infecciones similares se encuentra en regiones semiáridas y áridas del suroeste de Estados Unidos, México y América Central y del Sur. 2
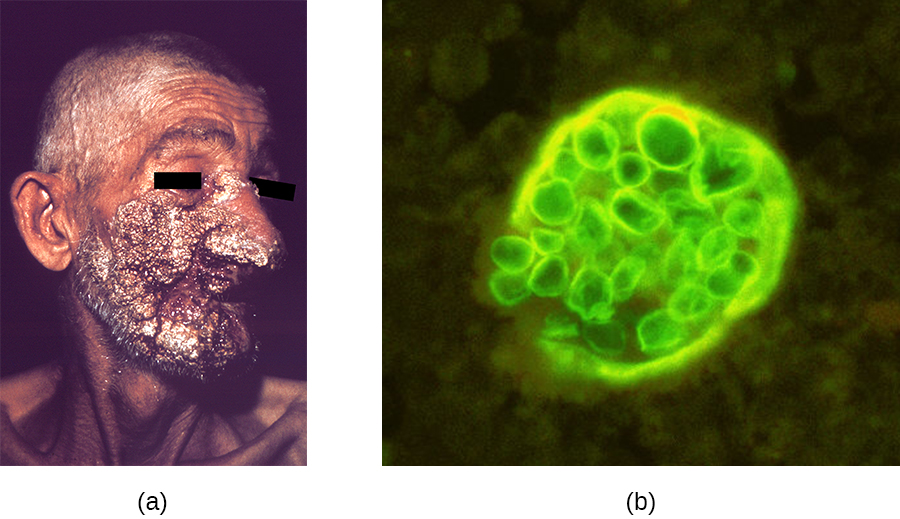
Al igual que la histoplasmosis, la coccidioidomicosis se adquiere inhalando esporas fúngicas, en este caso, artrosporas formadas por fragmentación hifal. Una vez en el cuerpo, el hongo se diferencia en esférulas que se rellenan con endosporas. La mayoría de las infecciones por C. immitis son asintomáticas y autolimitantes. Sin embargo, la infección puede ser muy grave para los pacientes inmunocomprometidos. Las endoesporas pueden ser transportadas en la sangre, diseminando la infección y dando lugar a la formación de lesiones granulomatosas en la cara y la nariz (Figura\(\PageIndex{1}\)). En casos severos, otros órganos principales pueden infectarse, lo que lleva a complicaciones graves como meningitis fatal.
La coccidioidomicosis se puede diagnosticar mediante el cultivo de muestras clínicas. C. immitis crece fácilmente en medios fúngicos de laboratorio, como el agar dextrosa de Sabouraud, a 35 °C (95 °F). Cultivar el hongo, sin embargo, es bastante peligroso. C. immitis es uno de los patógenos fúngicos más infecciosos conocidos y es capaz de causar infecciones adquiridas en laboratorio. En efecto, hasta 2012, este organismo fue considerado un “agente selecto” del bioterrorismo y clasificado como un microbio BSL-3. Las pruebas serológicas para la producción de anticuerpos se utilizan con mayor frecuencia para el diagnóstico. Aunque los casos leves generalmente no requieren intervención, las infecciones diseminadas pueden tratarse con antifúngicos intravenosos como la anfotericina B.
Las pruebas RIDT negativas de John no descartan la influenza, ya que los resultados falso-negativos son comunes, pero la infección por Legionella aún debe tratarse con terapia antibiótica y es el padecimiento más grave. El pronóstico de John es bueno, siempre que el médico pueda encontrar una terapia antibiótica a la que responda la infección.
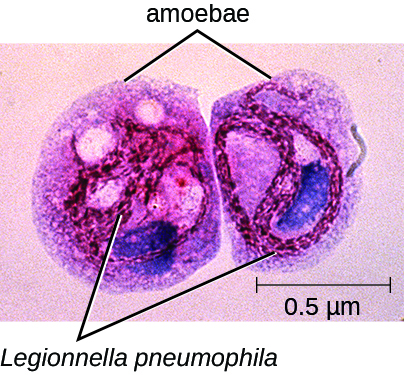
Mientras John estaba en tratamiento, tres de los empleados de la tienda de mejoras para el hogar también reportaron a la clínica con síntomas muy similares. Los tres tenían más de 55 años y tenían antígeno de Legionella en la orina; también se aisló L. pneumophila de su esputo. Un equipo del departamento de salud fue enviado a la tienda de mejoras para el hogar para identificar una probable fuente de estas infecciones. Su investigación reveló que aproximadamente 3 semanas antes, el sistema de aire acondicionado de la tienda, que se ubicaba donde almorzaban los empleados, había estado en mantenimiento. L. pneumophila se aisló de los serpentines de enfriamiento del sistema de aire acondicionado y también se observó L. pneumophila intracelular en amebas en muestras de agua condensada de los serpentines de enfriamiento (Figura\(\PageIndex{2}\)). Las amebas proporcionan protección a la bacteria Legionella y se sabe que mejoran su patogenicidad. 3
A raíz de las infecciones, la tienda ordenó una limpieza integral del sistema de aire acondicionado e implementó un programa de mantenimiento regular para evitar el crecimiento de biopelículas dentro de la torre de enfriamiento. También revisaron prácticas en sus otras instalaciones.
Después de un mes de descanso en casa, John se recuperó de su infección lo suficiente como para regresar al trabajo, al igual que los otros tres empleados de la tienda. Sin embargo, John experimentó letargo y dolor articular durante más de un año después de su tratamiento.
Blastomicosis
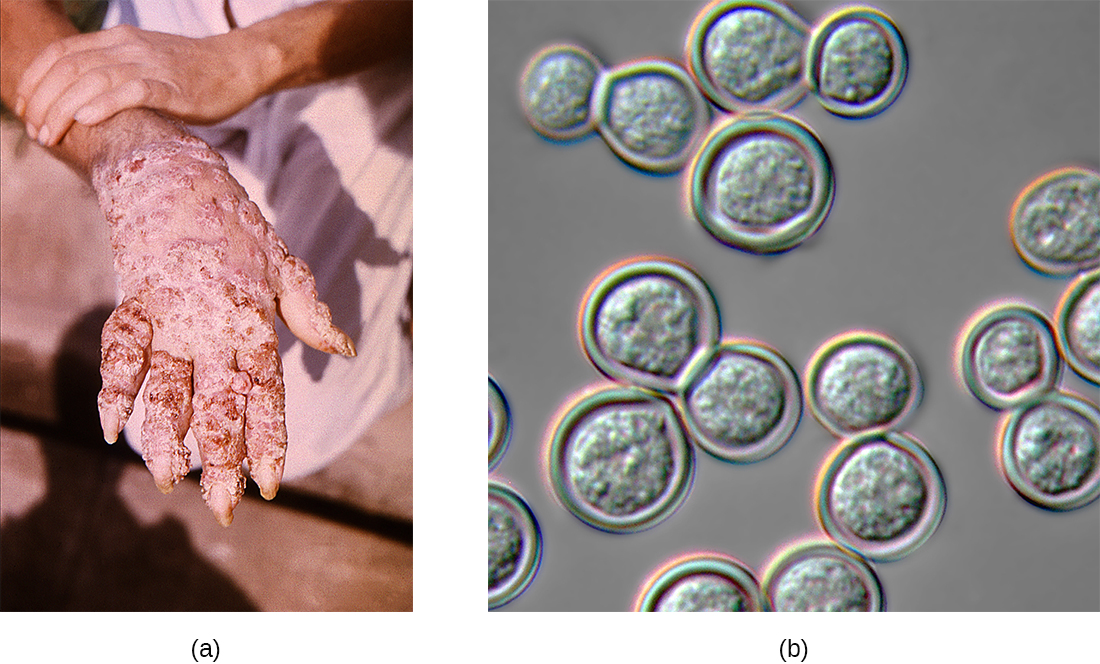
La blastomicosis es una enfermedad rara causada por otro hongo dimórfico, Blastomyces dermatitidis. Al igual que Histoplasma y Coccidioides, Blastomyces utiliza el suelo como reservorio, y las esporas de hongos pueden inhalarse del suelo alterado. La forma pulmonar de blastomicosis generalmente causa síntomas leves similares a la gripe y es autolimitante. Sin embargo, puede diseminarse en personas inmunodeprimidas, dando lugar a una enfermedad cutánea crónica con lesiones subcutáneas en la cara y las manos (Figura\(\PageIndex{3}\)). Estas lesiones cutáneas eventualmente se vuelven costras y decoloradas y pueden resultar en cicatrices deformantes. La blastomicosis sistémica es rara, pero si no se trata, siempre es fatal.
El diagnóstico preliminar de blastomicosis pulmonar se puede hacer observando las formas características de levadura en gemación en muestras de esputo. Las pruebas de antígeno de orina disponibles comercialmente ahora también están disponibles. Las pruebas confirmatorias adicionales incluyen ensayos serológicos como pruebas de inmunodifusión o EIA. La mayoría de los casos de blastomicosis responden bien a los tratamientos con anfotericina Bor ketoconazol.
Mucormicosis
Una variedad de hongos del orden Mucorales causan mucormicosis, una rara enfermedad fúngica. Estos incluyen moldes de pan, como Rhizopus y Mucor; la especie más comúnmente asociada es Rhizopus arrhizus (oryzae) (ver Figura 5.3.4). Estos hongos pueden colonizar muchos tejidos diferentes en pacientes inmunocomprometidos, pero a menudo infectan la piel, los senos paranasales o los pulmones.
Aunque la mayoría de las personas están expuestas regularmente a los agentes causantes de la mucormicosis, las infecciones en individuos sanos son raras. La exposición a esporas del ambiente generalmente ocurre a través de la inhalación, pero las esporas también pueden infectar la piel a través de una herida o el tracto gastrointestinal si se ingieren. La mucormicosis respiratoria afecta principalmente a individuos inmunodeprimidos, como pacientes con cáncer o aquellos que han tenido un trasplante. 4
Después de inhalar las esporas, los hongos crecen extendiendo las hifas hacia los tejidos del huésped. Las infecciones pueden ocurrir tanto en el tracto respiratorio superior como en el inferior. La mucormicosis rinocerebral es una infección de los senos paranasales y del cerebro; los síntomas incluyen dolor de cabeza, fiebre, hinchazón facial, congestión y necrosis tisular que causa lesiones negras en la cavidad oral. La mucormicosis pulmonar es una infección de los pulmones; los síntomas incluyen fiebre, tos, dolor en el pecho y dificultad para respirar. En casos severos, las infecciones pueden diseminarse e involucrar al sistema nervioso central, lo que lleva al coma y la muerte. 5
Diagnosticar la mucormicosis puede ser un desafío. Actualmente, no hay pruebas serológicas o basadas en PCR disponibles para identificar estas infecciones. Las muestras de biopsia de tejido deben ser examinadas para detectar la presencia de los patógenos fúngicos. Sin embargo, los agentes causantes suelen ser difíciles de distinguir de otros hongos filamentosos. Las infecciones se tratan típicamente mediante la administración intravenosa de anfotericina B, y las infecciones superficiales se eliminan por desbridamiento quirúrgico. Dado que los pacientes suelen estar inmunocomprometidos, comúnmente se desarrollan infecciones secundarias virales y bacterianas. Las tasas de mortalidad varían según el sitio de la infección, el hongo causante y otros factores, pero un estudio reciente encontró una tasa de mortalidad general de 54%. 6
Ejercicio\(\PageIndex{2}\)
- Comparar los modos de transmisión de coccidioidomicosis, blastomicosis y mucormicosis.
- En general, ¿cuáles son más graves: las formas pulmonares o diseminadas de estas infecciones?
Aspergilosis
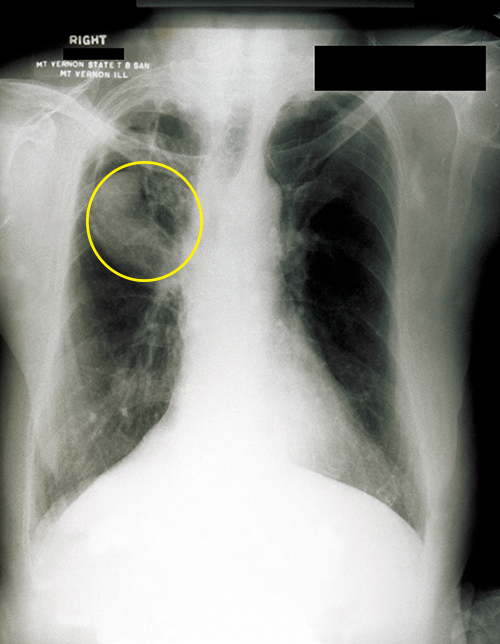
Aspergillus es un hongo filamentoso común que se encuentra en suelos y desechos orgánicos. Casi todos han estado expuestos a este molde, sin embargo, muy pocas personas se enferman. En pacientes inmunocomprometidos, sin embargo, Aspergillus puede establecerse y causar aspergilosis. La inhalación de esporas puede provocar reacciones alérgicas similares al asma. Los síntomas comúnmente incluyen dificultad para respirar, sibilancias, tos, secreción nasal y dolores de cabeza. Se pueden formar bolas fúngicas, o aspergiloma, cuando las colonias hifales se acumulan en los pulmones (Figura\(\PageIndex{4}\)). Las hifas fúngicas pueden invadir los tejidos del huésped, provocando hemorragia pulmonar y tos sanguinolenta. En casos severos, la enfermedad puede progresar a una forma diseminada que a menudo es mortal. La muerte suele ser el resultado de neumonía o hemorragias cerebrales.
El diagnóstico de laboratorio generalmente requiere radiografías de tórax y un examen microscópico de muestras de tejido y líquido respiratorio. Se dispone de pruebas serológicas para identificar antígenos de Aspergillus. Además, se puede realizar una prueba cutánea para determinar si el paciente ha estado expuesto al hongo. Esta prueba es similar a la prueba cutánea de tuberculina de Mantoux utilizada para la tuberculosis. La aspergilosis se trata con agentes antifúngicos intravenosos, incluyendo itraconazol y voriconazol. Los síntomas alérgicos se pueden manejar con corticosteroides porque estos medicamentos suprimen el sistema inmunológico y reducen la inflamación. Sin embargo, en infecciones diseminadas, los corticosteroides deben suspenderse para permitir que se produzca una respuesta inmune protectora.
Neumonía por Pneumocystis
Un tipo de neumonía llamada neumonía por Pneumocystis (PCP) es causada por Pneumocystis jirovecii. Anteriormente se pensó que era un protozoo, este organismo se llamaba anteriormente P. carinii pero ha sido reclasificado como hongo y renombrado en base a análisis bioquímicos y genéticos. Pneumocystis es una de las principales causas de neumonía en pacientes con síndrome de inmunodeficiencia adquirida (SIDA) y se puede ver en otros pacientes comprometidos y prematuros. La infección respiratoria conduce a fiebre, tos y dificultad para respirar. El diagnóstico de estas infecciones puede ser difícil. El organismo se identifica típicamente mediante el examen microscópico de muestras de tejido y líquido de los pulmones (Figura\(\PageIndex{5}\)). Se dispone de una prueba basada en PCR para detectar P. jirovecii en pacientes asintomáticos con SIDA. El mejor tratamiento para estas infecciones es el fármaco combinado trimetoprim-sulfametoxazol (TMP/SMZ). Estos sulfa suelen tener efectos adversos, pero los beneficios superan estos riesgos. Si no se trata, las infecciones por PCP suelen ser fatales.
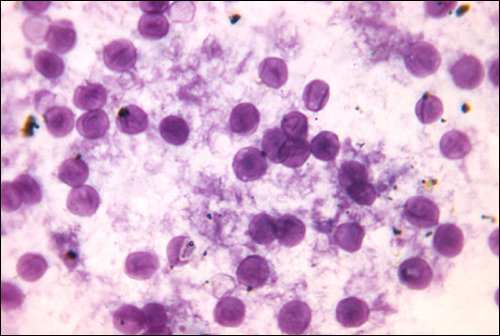
Criptococosis
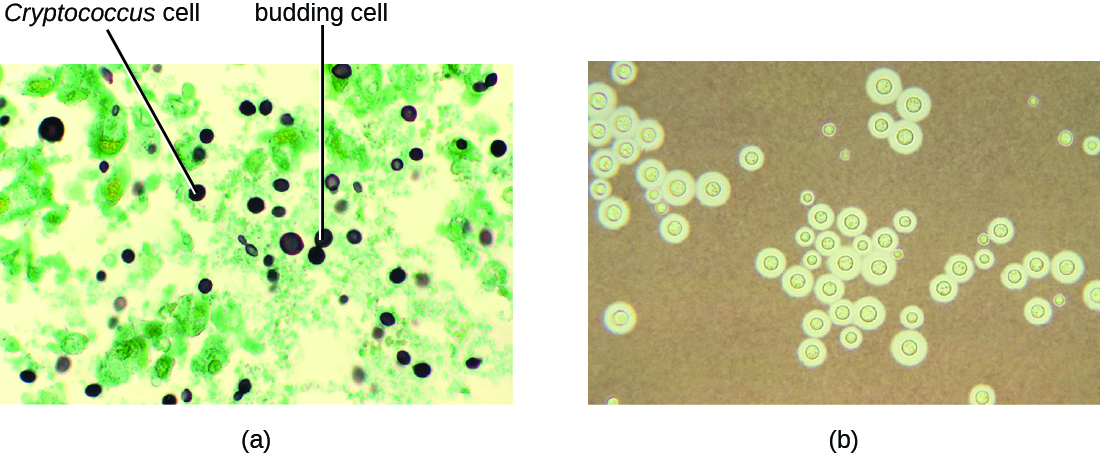
La infección por la levadura encapsulada Cryptococcus neoformans causa criptococosis. Este hongo es ubicuo en el suelo y puede aislarse de las heces de aves. Las personas inmunodeprimidas se infectan al inhalar basidiosporas que se encuentran en los aerosoles. La gruesa cápsula de polisacáridos que rodea estos microbios les permite evitar el aclaramiento por parte de los macrófagos alveolares. Los síntomas iniciales de infección incluyen fiebre, fatiga y tos seca. En pacientes inmunodeprimidos, las infecciones pulmonares a menudo se diseminan al cerebro. La meningitis resultante produce dolores de cabeza, sensibilidad a la luz y confusión. Si no se tratan, tales infecciones suelen ser fatales.
Las infecciones por criptococos a menudo se diagnostican con base en el examen microscópico de los tejidos pulmonares o de los líquidos Las preparaciones de tinta India (Figura\(\PageIndex{6}\)) se pueden utilizar para visualizar las extensas cápsulas que rodean las células de levadura. También se dispone de pruebas serológicas para confirmar el diagnóstico. La anfotericina B, en combinación con flucitosina, se usa típicamente para el tratamiento inicial de infecciones pulmonares. La anfotericina B es un fármaco antifúngico de amplio espectro que se dirige a las membranas celulares fúngicas. También puede afectar negativamente a las células hospedadoras y producir efectos secundarios. Por esta razón, los médicos deben equilibrar cuidadosamente los riesgos y beneficios de los tratamientos en estos pacientes. Debido a que es difícil erradicar las infecciones criptocócicas, los pacientes suelen necesitar tomar fluconazol hasta por 6 meses después del tratamiento con anfotericina B y flucitosina para eliminar el hongo. Las infecciones criptocócicas son más comunes en personas inmunodeprimidas, como las que tienen SIDA. Estos pacientes suelen requerir terapia supresora de por vida para controlar esta infección fúngica.
Ejercicio\(\PageIndex{3}\)
- ¿Qué poblaciones tienen mayor riesgo de desarrollar neumonía por Pneumocystis o criptococosis?
- ¿Por qué estas infecciones son fatales si no se tratan?
Enfermedades fúngicas de las vías respiratorias
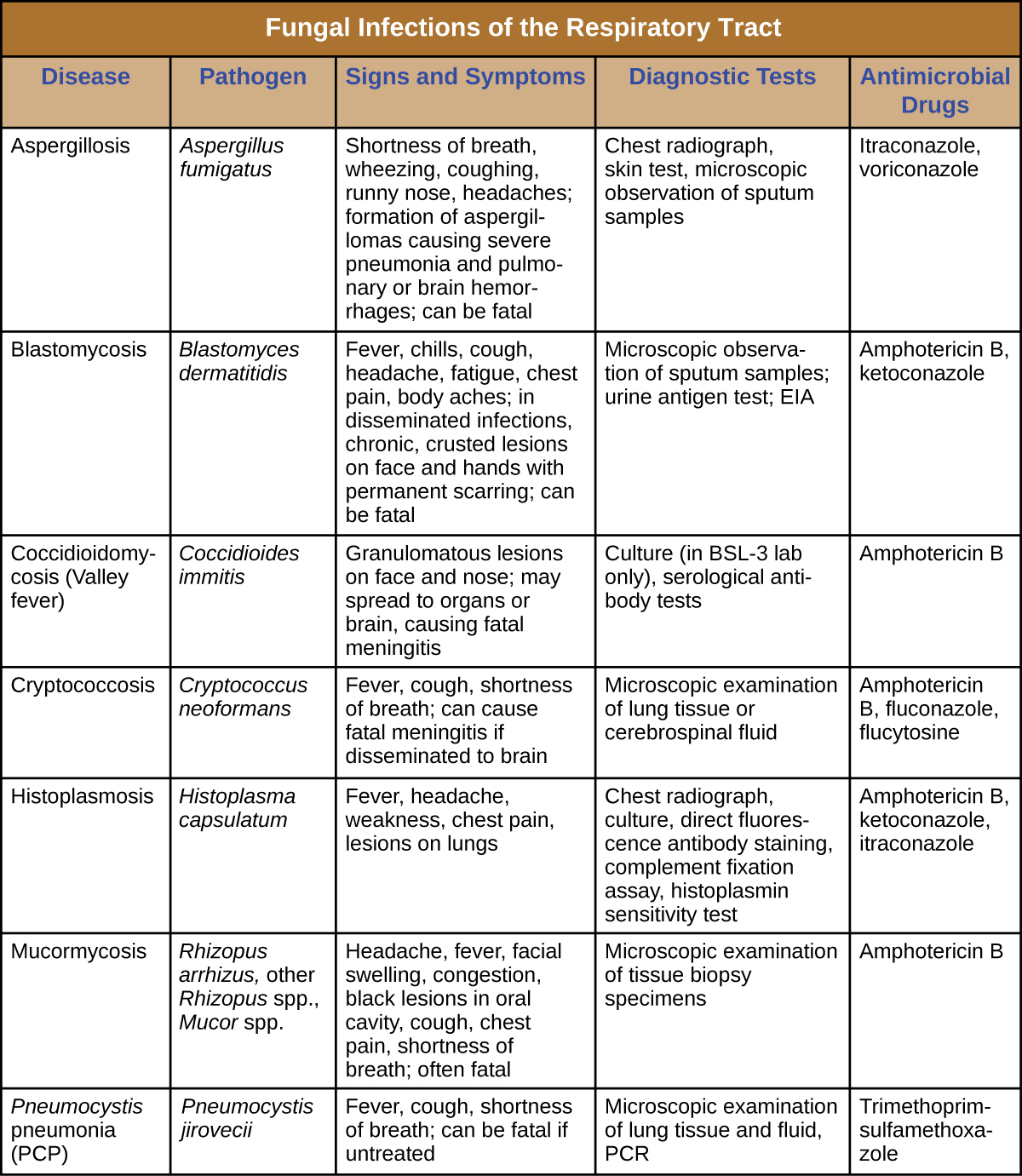
La mayoría de las micosis respiratorias son causadas por hongos que habitan el ambiente. Dichas infecciones generalmente se transmiten a través de la inhalación de esporas de hongos y no pueden transmitirse entre humanos. Además, las personas sanas generalmente no son susceptibles a la infección incluso cuando están expuestas; los hongos solo son lo suficientemente virulentos como para establecer infección en pacientes con VIH, SIDA, u otra afección que comprometa las defensas inmunitarias. La figura\(\PageIndex{7}\) resume las características de importantes micosis respiratorias.
Conceptos clave y resumen
- Los patógenos fúngicos rara vez causan enfermedades respiratorias en individuos sanos, pero la inhalación de esporas fúngicas puede causar neumonía grave e infecciones sistémicas en pacientes inmunocomprometidos.
- Los medicamentos antimicóticos como la anfotericina B pueden controlar la mayoría de las infecciones respiratorias fúngicas.
- La histoplasmosis es causada por un moho que crece en suelos ricos en excrementos de aves o murciélagos. Pocos individuos expuestos se enferman, pero los individuos vulnerables son susceptibles. Las células infecciosas similares a levaduras crecen dentro de los fagocitos.
- La coccidioidomicosis también se adquiere del suelo y, en algunos individuos, causará lesiones en la cara. Los casos extremos pueden infectar otros órganos, causando la muerte.
- La blastomicosis, una enfermedad rara causada por un hongo del suelo, generalmente produce una infección pulmonar leve pero puede diseminarse en los inmunodeprimidos. Los casos sistémicos son mortales si no se tratan.
- La mucormicosis es una enfermedad rara, causada por hongos del orden Mucorales. Afecta principalmente a personas inmunodeprimidas. La infección implica el crecimiento de las hifas en tejidos infectados y puede conducir a la muerte en algunos casos.
- La aspergilosis, causada por el hongo común del suelo Aspergillus, infecta a personas inmunodeprimidas. Las bolas hifales pueden impedir la función pulmonar y el crecimiento hifal en los tejidos puede causar daño. Las formas diseminadas pueden llevar a la muerte.
- La neumonía por Pneumocystis es causada por el hongo P. jirovecii. La enfermedad se encuentra en pacientes con SIDA y otros individuos inmunodeprimidos. Los tratamientos con medicamentos con sulfa tienen efectos secundarios, pero los casos no tratados pueden ser fatales.
- La criptococosis es causada por Cryptococcus neoformans. Las infecciones pulmonares pueden trasladarse al cerebro, causando meningitis, que puede ser fatal.
Notas al pie
- 1 NE Manos et al. “Variación Geográfica en la Prevalencia de Sensibilidad a Histoplasmina”. Dis Cofre 29, núm. 6 (1956) :649—668.
- 2 DR Hospenthal. “Coccioidomicosis”. Medscape. 2015. http://emedicine.medscape.com/article/215978-overview. Consultado el 7 de julio de 2016.
- 3 HY Lau y NJ Ashbolt. “El papel de las biopelículas y los protozoos en la patogénesis de la legionela: implicaciones para el agua potable”. Revista de Microbiología Aplicada 107 núm. 2 (2009) :368—378.
- 4 Centros de Control y Prevención de Enfermedades. “Enfermedades fúngicas. Definición de mucormicosis.” 2015 http://www.cdc.gov/fungal/diseases/m...efinition.html. Consultado el 7 de julio de 2016.
- 5 Centros de Control y Prevención de Enfermedades. “Enfermedades fúngicas. Síntomas de la mucormicosis.” 2015 http://www.cdc.gov/fungal/diseases/m... /symptoms.html. Consultado el 7 de julio de 2016.
- 6 MM Roden et al. “Epidemiología y Resultado de la Cigomicosis: Una Revisión de 929 Casos Reportados”. Enfermedades Infecciosas Clínicas 41 núm. 5 (2005) :634—653.


