2: Microscopios
- Page ID
- 56162
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Probablemente te hayas dado cuenta de que los microbios (también conocido como microorganismos) son bastante pequeños, ¿verdad? Sí, bueno, el tamaño no lo es todo. Pero los números, eso es algo. Si tomaras un gramo de tierra y comenzaras a contar los microbios que contiene a razón de 1 microbico/segundo, tardarías más de 33 años en completar tu conteo. Entonces la mayoría de ustedes estarían en sus 50 y teniendo una crisis de mediana edad, así que no vayamos ahí... pero el pequeño tamaño de los microbios ciertamente ha dificultado su estudio, particularmente al principio. (Si quieres una idea visual de escala, consulta la herramienta Tamaño de Celda y Escala, que te permite acercar de un grano de café a un átomo de carbono. ¡Asegúrate de prestar mucha atención a los microbios en el medio!)
O.k., si quieres ver algo muy, muy, muy pequeño, ¿a quién vas a llamar? No Ghostbusters TM, eso es seguro. Yo intentaría con alguien con un microscopio. (Microscopio Hombre? Tal vez no.) Ahora voy a admitir, con el advenimiento de la biología molecular hay mucha microbiología hoy en día que sucede sin un microscopio. Pero si realmente quieres visualizar microbios, necesitarás la capacidad de magnificar — necesitarás un microscopio de algún tipo. Y, como “ver es creer”, fue la visualización de microbios lo que hizo que la gente se interesara por ellos en primer lugar.
Microscopía en el 1600
Se cree que Robert Hooke fue uno de los primeros científicos en observar realmente microbios, en 1665. Sus ilustraciones y observaciones de una variedad de objetos vistos bajo un microscopio fueron publicadas en el libro Micrographia. Hooke utilizó un microscopio compuesto, lo que significa que contenía dos juegos de lentes para la ampliación: la lente ocular junto al ojo y la lente objetivo, junto al espécimen u objeto. La ampliación de un microscopio compuesto es un producto de la ampliación de la lente ocular y la ampliación de la lente objetivo. Así, un microscopio con un aumento ocular de 10x y un aumento objetivo de 50x tendría un aumento total de 500x. Se puede ver un dibujo del microscopio de Hooke.
Antonie van Leeuwenhoek, a menudo llamado el “Padre de la Microbiología”, no era un científico de profesión. Era un comerciante de telas de Holanda que se creía que se inspiraba en la obra del señor Hooke, probablemente con la intención original de examinar los textiles para determinar la calidad. Muy rápidamente van Leeuwenhoek comenzó a examinar casi todo bajo el microscopio y lo sabemos porque guardó notas detalladas tanto sobre sus muestras como sobre sus observaciones. Van Leeuwenhoek estaba usando lo que se llama un microscopio simple, un microscopio con una sola lente. Esencialmente, se trata de una lupa. Pero los lentes que produjo eran de tan alta calidad que se le da crédito por el descubrimiento de formas de vida unicelulares. Puedes conocer más sobre las observaciones de van Leeuwenhoek.
Microscopía Moderna: Microscopios
Seamos realistas, un microscopio moderno es una herramienta bastante técnica, incluso una de las versiones más baratas. Si quieres entender las limitaciones de un microscopio óptico tienes que entender conceptos como resolución, longitud de onda y apertura numérica, donde su relación entre sí se resume en la ecuación de Abbé:

En microscopía, la definición de resolución suele ser la capacidad de una lente para distinguir dos objetos que están muy cerca entre sí. Entonces, en el Abbé la ecuación d se convierte en la distancia mínima donde dos objetos uno al lado del otro pueden resolverse o distinguirse como objetos individuales. La resolución depende de la longitud de onda de iluminación que se utilice, donde una longitud de onda más corta dará como resultado una d más pequeña. Por último, tenemos el efecto de la apertura numérica, que es una función de la lente objetivo y su capacidad para captar luz. El valor de apertura numérica en realidad se define por dos componentes: n, que es el índice de refracción del medio en el que está trabajando la lente, y sin θ, que es una medida del cono de luz que ingresa al objetivo. Una lente puede funcionar típicamente en dos medios: aire, con un índice de refracción de 1.00, o aceite, con un índice de refracción de 1.25. El petróleo permitirá que se recoja más luz, dirigiendo más de los rayos de luz hacia la lente del objetivo. El aumento total máximo para un microscopio que usa luz visual para iluminación es de alrededor de 1500X, donde el microscopio podría tener oculares de 15x y un objetivo de inmersión en aceite de 100x. La resolución más alta posible es de alrededor de 0.2 μm. Si los objetos o las celdas están más cerca que esto, no pueden distinguirse como entidades separadas.
Aquí hay una buena descripción de Nikon, que incluye un tutorial interactivo sobre apertura numérica y resolución de imagen. Y luego hay tantos microscopios, ¡tan poco tiempo! El tipo que necesites depende del tipo específico de microbios que quieras visualizar.
Para los microscopios de luz hay seis tipos diferentes de microscopios, todos usando la luz como fuente de iluminación: microscopio de campo brillante, microscopio de campo oscuro, microscopio de contraste de fase, contraste de interferencia diferencial (DIC), microscopio de fluorescencia y microscopio láser de barrido confocal (CSLM). Veamos los detalles de cada tipo:
Microscopio de campo brillante
El microscopio de campo brillante es su microscopio estándar que puede comprar para su sobrina o sobrino en cualquier juguetería. Aquí hay un sitio web sobre las partes básicas de un microscopio compuesto de campo brillante, en caso de que no esté inscrito en el laboratorio de microbiología general. El espécimen es iluminado por una fuente de luz en la base del microscopio y luego inicialmente magnificado por la lente objetivo, antes de ser magnificado nuevamente por el cristalino ocular. Recuerde que la ampliación total lograda es producto de la ampliación de ambas lentes.
El espécimen se visualiza típicamente debido a las diferencias de contraste entre el espécimen mismo y su entorno circundante. Pero eso no se aplica a las bacterias sin teñir, que tienen muy poco contraste con su entorno, a menos que las células estén pigmentadas de forma natural. Es por ello que la tinción (ver sección a continuación) es un concepto tan importante en microscopía. Un microscopio de campo brillante funcionará razonablemente bien para ver los microbios eucariotas más grandes (es decir, protozoos, algas) sin manchas, pero las bacterias sin teñir serán casi invisibles. Las bacterias manchadas aparecerán oscuras sobre un fondo brillante (ah, sabía que había una razón para el término “campo brillante”).
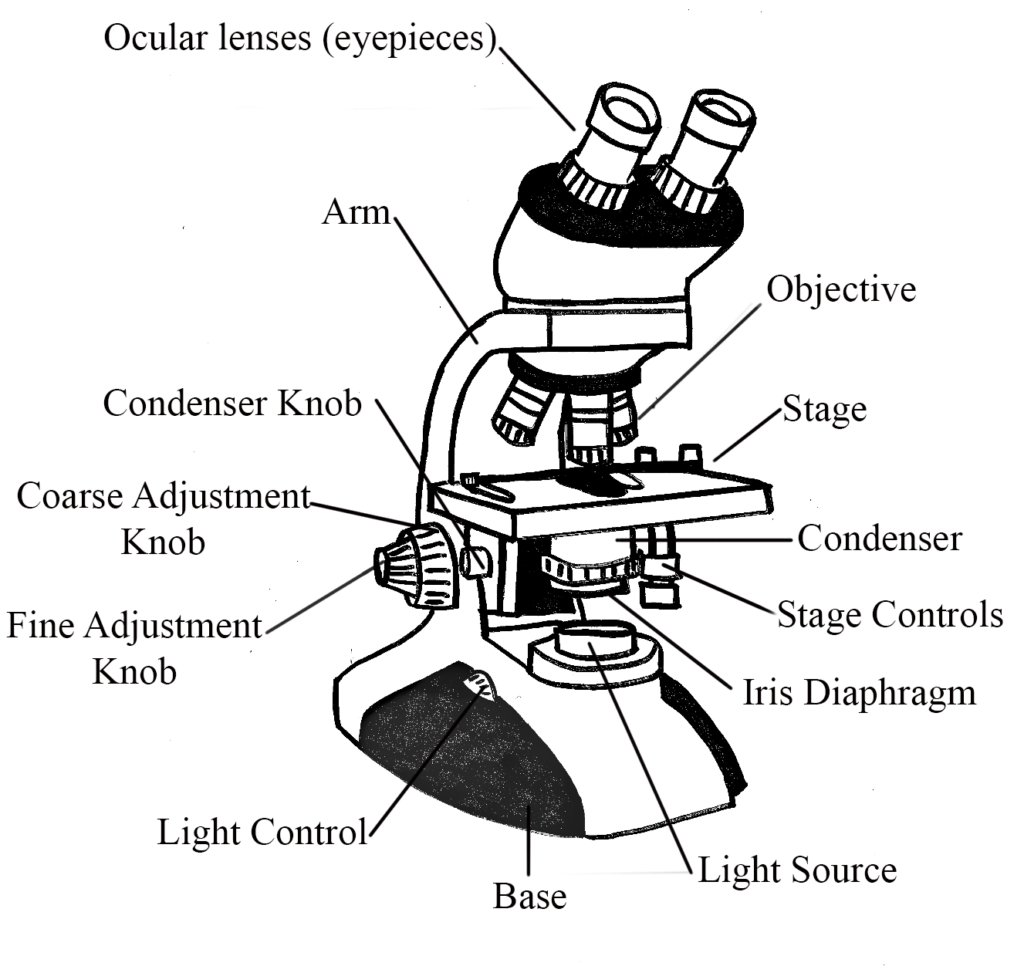
Microscopio de campo brillante
Microscopio de campo oscuro
El microscopio de campo oscuro es realmente solo un microscopio de campo brillante ligeramente modificado. De hecho, ¡podrías hacer esta modificación al microscopio que tienes en casa! Hace uso de lo que se conoce como tope de campo oscuro, un disco opaco que bloquea la luz directamente debajo del espécimen para que la luz la llegue desde los lados. El resultado es que sólo la luz que ha sido reflejada o refractada por el espécimen será recogida por la lente objetivo, dando como resultado células que aparecen brillantes contra un fondo oscuro (de ahí el término “campo oscuro”. Sí, ahora todo tiene sentido). Esto permite la observación de células vivas sin teñir, lo cual es particularmente agradable si se desea observar la motilidad u orgánulos eucariotas.
Microscopio de Contraste
El microscopio de contraste de fase también es un microscopio de campo brillante modificado, aunque las modificaciones son cada vez más complejas, así como más caras. Este microscopio también utiliza un anillo opaco o tope anular, pero este tiene un anillo transparente que solo libera luz en un cono hueco. El principio de este microscopio vuelve a la idea del índice de refracción y al hecho de que las células tienen un índice de refracción diferente al de su entorno, dando como resultado una luz que difiere ligeramente en fase. La diferencia es amplificada por un anillo de fase que se encuentra en un objetivo de fase especial. Las diferencias de fase pueden traducirse en diferencias de brillo, dando como resultado una imagen oscura en medio de un fondo brillante. Esto permite la observación de células vivas, no teñidas, una vez más útiles para observar la motilidad u orgánulos eucariotas.
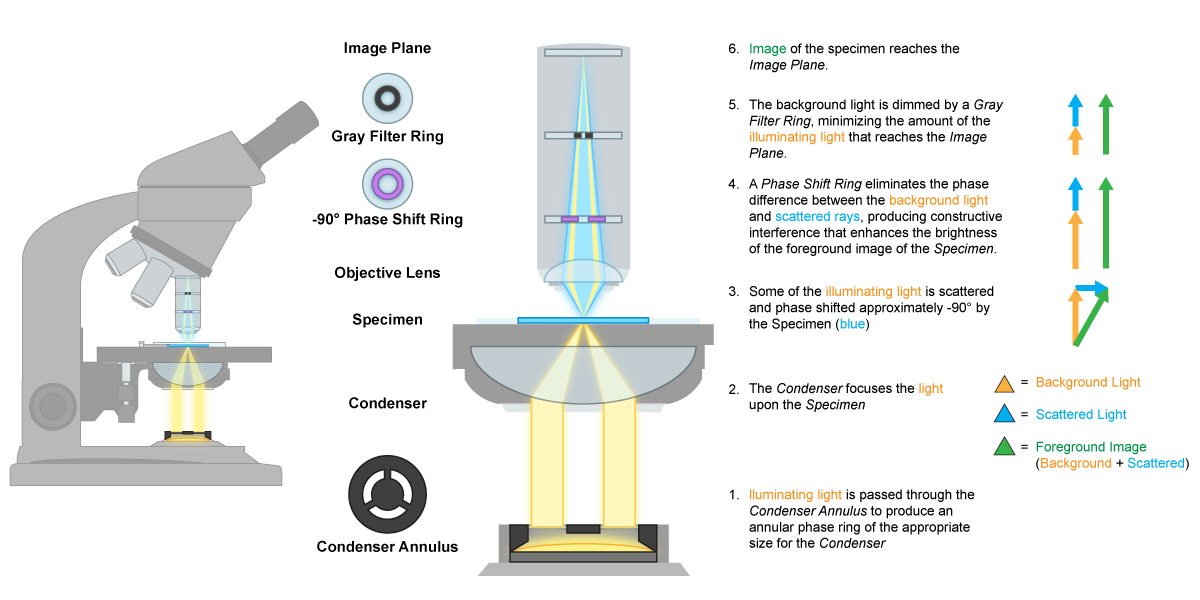
Microscopio de Contraste de Fase.
Microscopio de Contraste de Interferencia Diferencial
El microscopio de contraste de interferencia diferencial opera sobre el mismo principio que el microscopio de contraste de fase, al aprovechar las diferencias en el índice de refracción de un espécimen y su entorno. Pero usa luz polarizada que luego se divide en dos haces por un prisma. Un haz de luz pasa a través del espécimen, el otro pasa por el área circundante. Cuando los haces se combinan a través de un segundo prisma, “interfieren” entre sí, debido a que están desfasados. Las imágenes resultantes tienen un efecto casi 3D, útil para observar células vivas sin teñir.
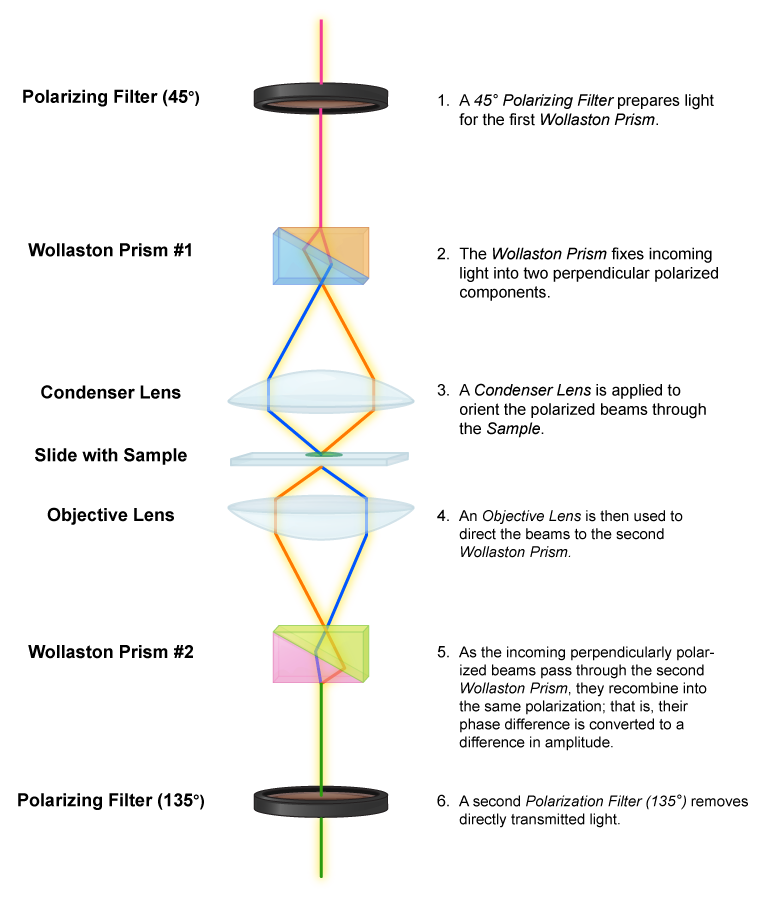
Microscopio de Contraste Diferencial.
Microscopio de fluorescencia
Un microscopio de fluorescencia utiliza luz que ha sido emitida por un espécimen, en lugar de pasar a través de él. Se utiliza una lámpara de arco de mercurio para generar un haz de luz intenso que se filtra para producir una longitud de onda específica de luz dirigida al espécimen mediante el uso de espejo dicromático, que refleja longitudes de onda cortas y transmite longitudes de onda más largas. Los organismos naturalmente fluorescentes absorberán las longitudes de onda cortas y emitirán luz fluorescente con una longitud de onda más larga que pasará a través del espejo dicromático y se podrá visualizar. Hay una variedad de microbios con fluorescencia natural pero ciertamente hay muchos más organismos que carecen de esta calidad. La visualización de estos últimos organismos depende del uso de fluorocromos, colorantes fluorescentes que se unen a componentes celulares específicos. Los fluorocromos también pueden unirse a anticuerpos, para resaltar estructuras o áreas específicas de la célula, o incluso diferentes organismos.
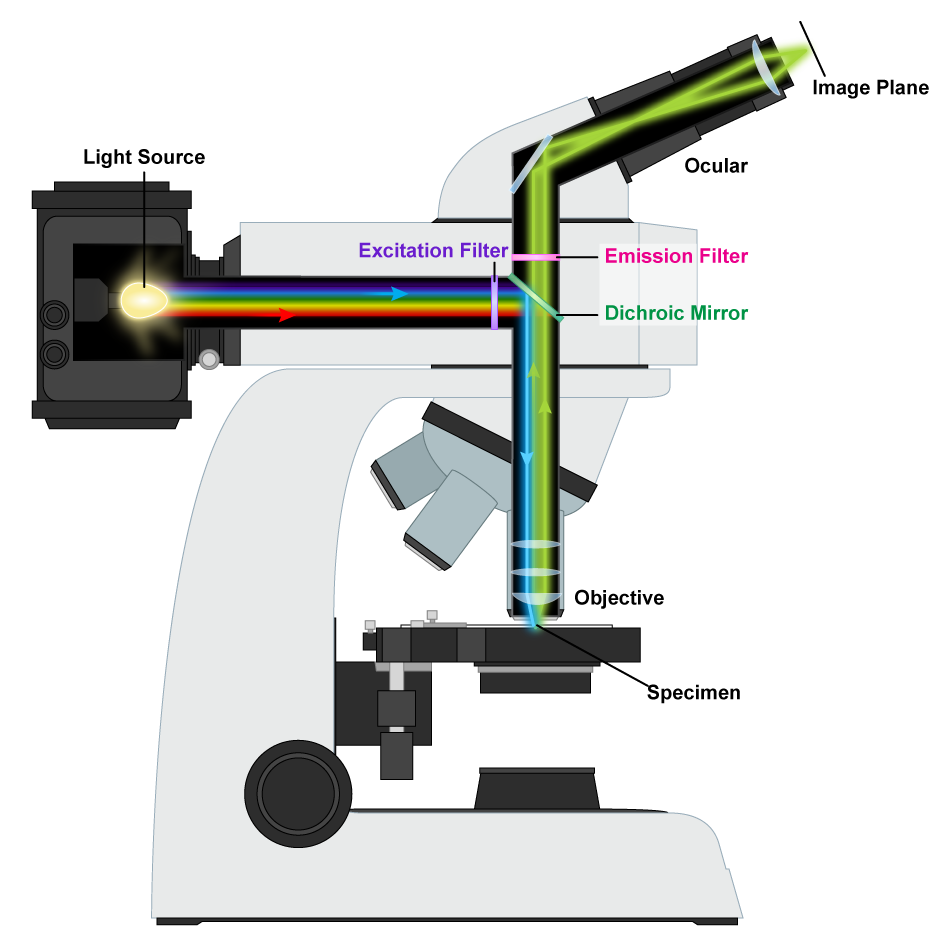
Microscopio de fluorescencia. Por Masur (Obra propia) [GFDL, CC-BY-SA-3.0 o CC BY-SA 2.5-2.0-1.0], vía Wikimedia Commons
Mecanismo Microscopio Fluorescente
Microscopio láser de barrido confocal (CSLM)
Para entender cómo funciona un microscopio láser de barrido confocal, es útil entender cómo funciona un microscopio de fluorescencia, así que ojalá ya hayas leído la sección anterior. Un CSLM utiliza un láser para la iluminación, debido a la alta intensidad. La luz se dirige a los espejos dicromáticos que se mueven, “escaneando” el espécimen. Las longitudes de onda más largas emitidas por el espécimen teñido fluorescentemente pasan de nuevo a través de los espejos, a través de un orificio, y son medidas por un detector. El estenopeico sirve para conyugar el punto focal de la lente (¡ah, de ahí vino el término confocal!) , lo que significa que permite el enfoque completo de un punto dado. Dado que todo el espécimen es escaneado en los planos x-z (los tres ejes), la información adquirida por el detector puede ser compilada por una computadora para crear una sola imagen 3D completamente enfocada. Esta es una herramienta particularmente útil para visualizar estructuras complejas como biopelículas.
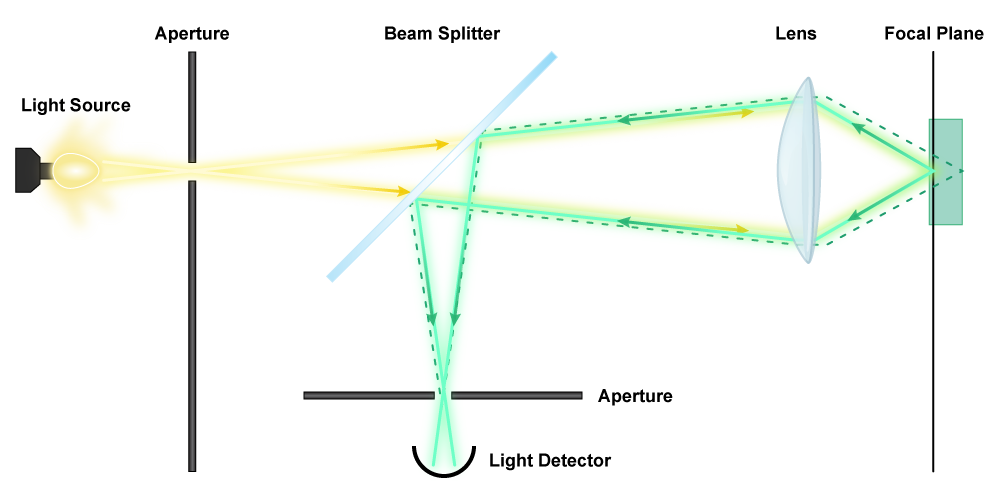
Mecanismo de Microscopio Láser de Escaneo Confocal
Tinción
La mayoría de los microbios, particularmente los microbios unicelulares, no serían evidentes sin la ayuda de la tinción. Ayuda a hacer algo tan pequeño un poco más fácil de ver, al proporcionar contraste entre el microorganismo y su fondo. Una simple tinción hace uso de un solo tinte, ya sea para teñir las células directamente (tinción directa) o para teñir el fondo que rodea a las células (tinción negativa). A partir de esto, un investigador puede recopilar información básica sobre el tamaño, la morfología (forma) y la disposición celular de una célula.
También hay manchas más complejas, conocidas como tinciones diferenciales, que combinan las manchas para permitir la diferenciación de organismos en función de sus características. La tinción Gram, desarrollada en 1884, es la tinción diferencial más común utilizada en microbiología, donde las células bacterianas se separan en función de su tipo de pared celular: bacterias gram positivas que tiñen púrpura y bacterias gram negativas que se tiñen de rosa. Algunas bacterias tienen una pared celular especializada que debe teñirse con la tinción ácido-resistente, donde las bacterias ácido-resistentes se tiñen de rojo y las bacterias no ácido-resistentes se tiñen de azul Otras tinciones diferenciales se dirigen a estructuras bacterianas específicas, como endosporas, cápsulas y flagelos, de las que se hablará más adelante.
Microscopía Aún Más Moderna: Microscopios Electrónicos
Los microscopios de luz son geniales si estás observando microbios eucariotas y podrían funcionar para observar bacterias y arqueas, pero no van a funcionar en absoluto para observar virus. Recuerde que el límite de resolución para un microscopio óptico es de 0.2 μm o 200 nm y la mayoría de los virus son menores que eso. Entonces, necesitamos algo más poderoso. Ingresa a los microscopios electrónicos, que reemplazan la luz con electrones para su visualización. Dado que los electrones tienen una longitud de onda de 1.23 nm (a diferencia de la longitud de onda de 530 nm de la luz azul-verde), la resolución aumenta a alrededor de 0.5 nm, con aumentos por encima de 150,000x. El inconveniente de usar electrones es que deben estar contenidos en un vacío, eliminando la posibilidad de trabajar con células vivas. También existe cierta preocupación de que la preparación extensa de la muestra pueda distorsionar las características del espécimen o provocar la formación de artefactos.
Existen dos tipos diferentes de microscopio electrónico, el microscopio electrónico de transmisión (TEM) y el microscopio electrónico de barrido (SEM):
Microscopio Electrónico de Transmisión (TEM)
El microscopio electrónico de transmisión utiliza un haz de electrones dirigido al espécimen con el uso de electroimanes. Las áreas densas dispersan los electrones, dando como resultado un área oscura en la imagen, mientras que los electrones pueden pasar (o “transmitir”) a través de las áreas menos densas, resultando en una sección más brillante. La imagen se genera en una pantalla fluorescente y luego se puede capturar.
Dado que los electrones son fácilmente dispersados por especímenes extremadamente gruesos, las muestras deben cortarse hasta 20-100 nm de espesor, generalmente incrustadas en algún tipo de plástico y luego cortarse con un cuchillo de diamante en secciones extremadamente delgadas. Las imágenes resultantes representan una rebanada o plano del espécimen.
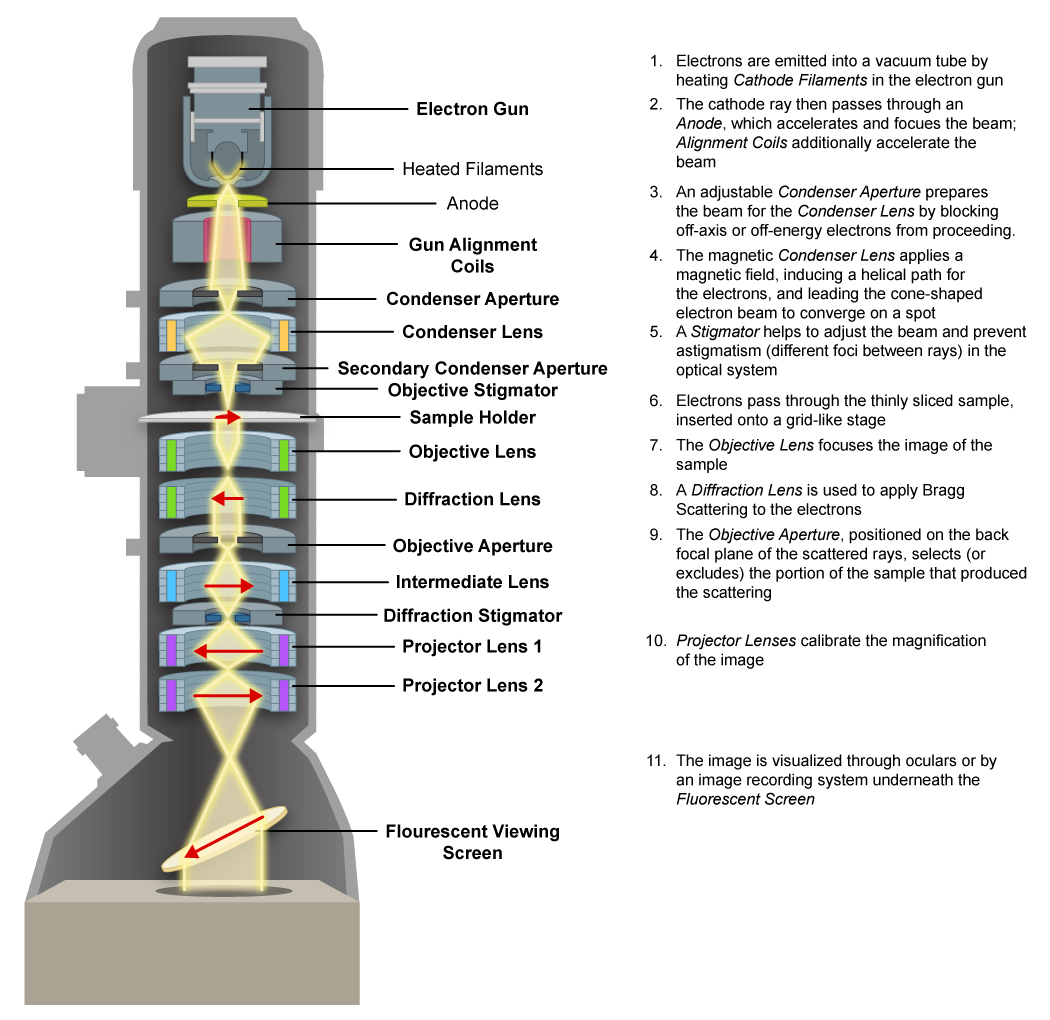
Microscopio Electrónico de Transmisión.

Microscopio Electrónico de Transmisión. Por kallerna (Obra propia) [Dominio público], vía Wikimedia Commons
Microscopio electrónico de barrido (SEM)
El microscopio electrónico de barrido también utiliza un haz de electrones pero la imagen se forma a partir de electrones secundarios que fueron liberados de la superficie del espécimen y luego recogidos por un detector. Se liberan más electrones de las áreas elevadas del espécimen, mientras que se recogerán menos electrones secundarios de las áreas hundidas. Además, el haz de electrones se escanea sobre la superficie del espécimen, produciendo una imagen 3D de las características externas.
Si quieres ver algunas hermosas fotomicrografías TEM y SEM, consulta el sitio de Dennis Kunkel. La mayoría han sido coloridas, pero son bastante impresionantes. En el otro extremo del espectro, aquí hay fotos tomadas con el Intel Play QX3, un microscopio de plástico para niños. Ten cuidado, podrías perderte en este sitio web. ¡Pero es genial ver lo que un microscopio económico puede producir en manos de alguien que sabe lo que está haciendo! Estas fotos también son impresionantes.
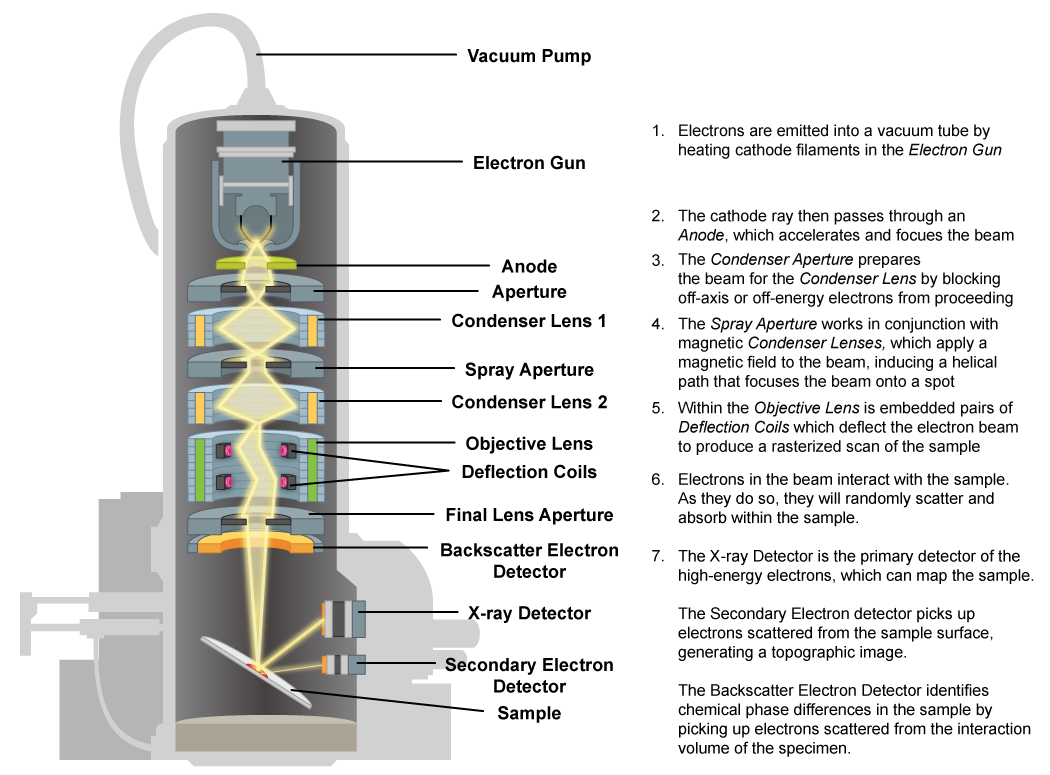
Mecanismo Microscopio Electrónico de Barrido.

Microscopio Electrónico de Barrido Por es:Usuario:olaboy [CC BY-SA 2.5], Vía Wikipedia Commons
Microscopía del siglo XXI: microscopios con sonda de barrido
A medida que la tecnología ha avanzado, se han inventado microscopios aún más potentes, unos que incluso pueden permitir la visualización a nivel atómico. Estos microscopios se pueden utilizar en microbiología, pero con mayor frecuencia se utilizan en otros campos, para permitir la visualización de productos químicos, metales, muestras magnéticas y nanopartículas, donde sea necesaria la resolución de 0.1 nm y el aumento de 100.000.000x.
Los microscopios de sonda de barrido se llaman así porque mueven algún tipo de sonda sobre la superficie de una muestra en los planos x-z, permitiendo que las computadoras generen una imagen 3D extremadamente detallada del espécimen. La resolución es muy alta porque el tamaño de la sonda es mucho menor que la longitud de onda de la luz visible o los electrones. Ambos microscopios pueden ser utilizados para estudiar objetos en líquido, permitiendo el examen de moléculas biológicas. Hay dos tipos diferentes de microscopios de sonda de barrido, el microscopio de túnel de barrido (STM) y el microscopio de fuerza atómica (AFM):
Microscopio de túnel de barrido (STM)
El microscopio de túnel de barrido tiene una sonda extremadamente afilada, de 1 átomo de grosor, que mantiene un voltaje constante con la superficie de la muestra permitiendo que los electrones viajen entre ellos. Esta corriente de tunelización se mantiene elevando y bajando la sonda para mantener una altura constante por encima de la muestra. El movimiento resultante es rastreado por una computadora, que genera la imagen final.
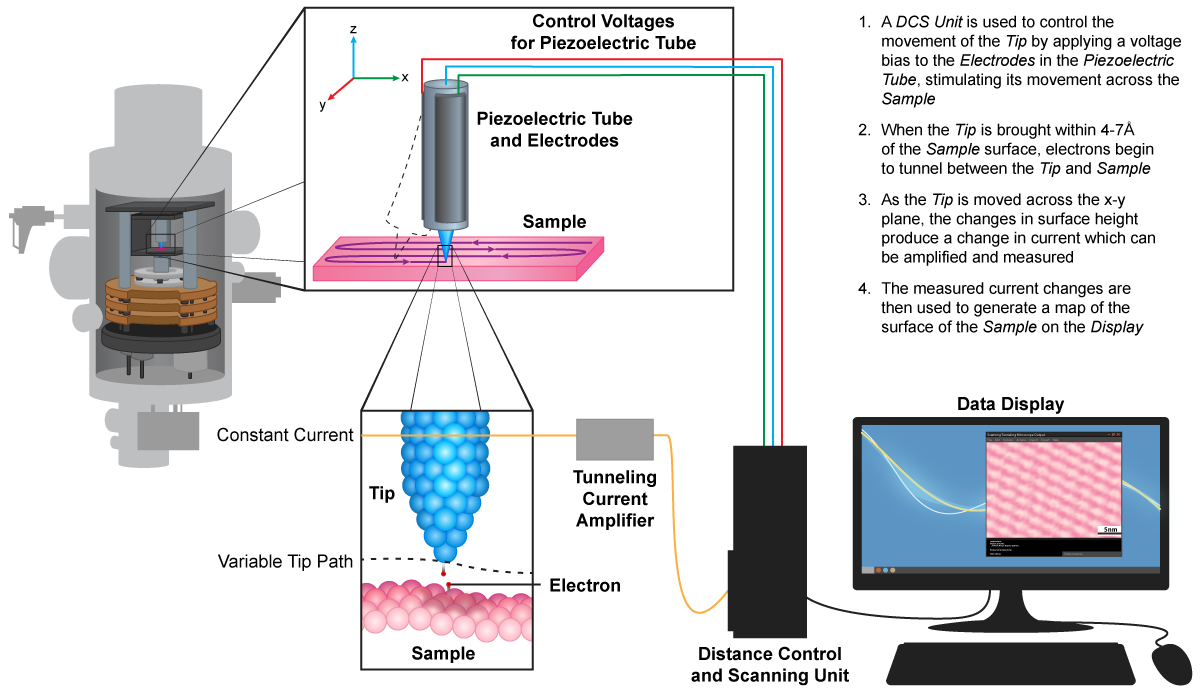
Microscopio de Túnel de Escaneo
Microscopio de Fuerza Atómica (AFM)
El microscopio de fuerza atómica se desarrolló como una alternativa al STM, para su uso con muestras que no conducen bien la electricidad. El microscopio utiliza un voladizo con una punta de sonda extremadamente afilada que mantiene una altura constante por encima de la muestra, típicamente por contacto directo con la muestra. El movimiento del voladizo para mantener este contacto desvía un rayo láser, traduciéndose en una imagen del objeto. Una vez más, se utilizan computadoras para generar la imagen.
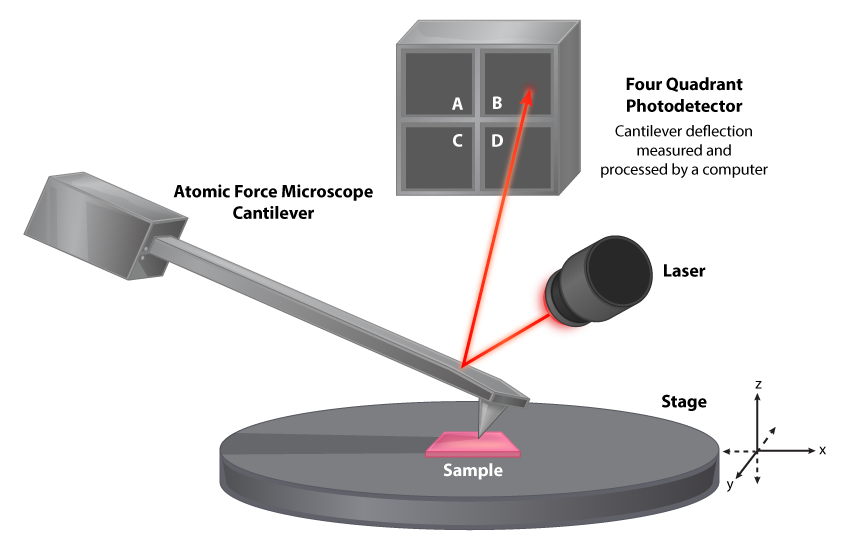
Mecanismo Microscopio de Fuerza Atómica.
Palabras clave
ampliación, Robert Hooke, microscopio compuesto, lente ocular, lente de objetivo, aumento total, van Leeuwenhoek, microscopio simple, ecuación Abbé, resolución, longitud de onda, apertura numérica, índice de refracción, objetivo de inmersión en aceite, microscopio óptico, microscopio de campo brillante, microscopio de campo oscuro, fase microscopio de contraste, microscopio de contraste de interferencia diferencial (DIC), microscopio de fluorescencia, fluorocromo, microscopio láser de barrido confocal (CSLM), tinción simple, tinción directa, tinción negativa, tinción diferencial, tinción Gram, tinción ácido-resistente, microscopio electrónico (EM), microscopio electrónico de transmisión (TEM), microscopio electrónico de barrido (SEM), microscopios de sonda de barrido, microscopios de túnel de barrido (STM), microscopio de fuerza atómica (AFM).
Preguntas/Objetivos Esenciales
- ¿Qué papeles desempeñaron Hooke y van Leeuwenhoek en el desarrollo de la microscopía? ¿En qué se diferenciaron sus contribuciones?
- ¿En qué se diferencian el aumento y la resolución? ¿Cómo se determina el aumento total?
- ¿Cómo explica la ecuación de Abbé la resolución de un microscopio? ¿Qué componentes impactan en la resolución? ¿Cuál es la función del aceite de inmersión?
- Conocer los principales usos y comprender la mecánica principal de los siguientes microscopios de luz: campo claro, campo oscuro, contraste de fase, fluorescencia y contraste de interferencia diferencial.
- ¿Cómo funciona el microscopio láser de barrido confocal para formar una imagen tridimensional? ¿Cómo mejora la resolución en comparación con otros microscopios de luz?
- ¿Cómo se usa la tinción en microscopía? ¿Cuáles son las categorías generales de manchas y cómo se utilizan?
- ¿Cuáles son las ventajas y problemas de los microscopios electrónicos? ¿Cuáles son la ampliación efectiva, la resolución y los principales usos de los microscopios electrónicos?
- ¿En qué se diferencia el TEM del SEM en términos de función y producto final?
- ¿Cómo funcionan los microscopios con sonda de barrido y qué nos permiten ver? ¿Por qué son útiles para estudiar moléculas biológicas? ¿Cuál es la diferencia en el túnel de barrido y el microscopio de fuerza atómica?
Preguntas Exploratorias (OPCIONAL)
- ¿Cómo han mejorado los microscopios nuestra comprensión de los microbios? ¿Cuáles son las limitaciones de los microscopios y la información que obtenemos de ellos?

