7.1: Moléculas orgánicas
- Page ID
- 54783
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivos de aprendizaje
- Identificar elementos y estructuras comunes que se encuentran en las moléculas orgánicas
- Explicar el concepto de isomería
- Identificar ejemplos de grupos funcionales
- Describir el papel de los grupos funcionales en la síntesis de polímeros
Enfoque Clínico: Parte 1
Penny es una estudiante de 16 años que visitó a su médico, quejándose de una erupción cutánea con comezón. Tenía antecedentes de episodios alérgicos. El médico miró su piel bronceada por el sol y le preguntó si se cambiaba a otro protector solar. Dijo que tenía, por lo que el médico le diagnosticó un eccema alérgico. Los síntomas fueron leves por lo que el médico le dijo a Penny que evitara usar el protector solar que causó la reacción y le recetó una crema hidratante de venta libre para mantener su piel hidratada y para ayudar con el picor.
Ejercicio\(\PageIndex{1}\)
- ¿Qué tipo de sustancias esperarías encontrar en una crema hidratante?
- ¿Qué propiedades físicas o químicas de estas sustancias ayudarían a aliviar el picor y la inflamación de la piel?
La bioquímica es la disciplina que estudia la química de la vida, y su objetivo es explicar la forma y la función a partir de principios químicos. La química orgánica es la disciplina dedicada al estudio de la química basada en carbono, que es la base para el estudio de las biomoléculas y la disciplina de la bioquímica. Tanto la bioquímica como la química orgánica se basan en los conceptos de química general, algunos de los cuales se presentan en el Apéndice A.
Elementos en Células Vivas
El elemento más abundante en las células es hidrógeno (H), seguido del carbono (C), oxígeno (O), nitrógeno (N), fósforo (P) y azufre (S). A estos elementos los llamamos macronutrientes, y representan cerca del 99% del peso seco de las células. Algunos elementos, como sodio (Na), potasio (K), magnesio (Mg), zinc (Zn), hierro (Fe), calcio (Ca), molibdeno (Mo), cobre (Cu), cobalto (Co), manganeso (Mn), o vanadio (Va), son requeridos por algunas células en cantidades muy pequeñas y se denominan micronutrientes o oligoelementos. Todos estos elementos son esenciales para la función de muchas reacciones bioquímicas, y, por lo tanto, son esenciales para la vida.
Los cuatro elementos más abundantes en la materia viva (C, N, O y H) tienen números atómicos bajos y, por lo tanto, son elementos ligeros capaces de formar fuertes enlaces con otros átomos para producir moléculas (Figura\(\PageIndex{1}\)). El carbono forma cuatro enlaces químicos, mientras que el nitrógeno forma tres, el oxígeno forma dos y el hidrógeno forma uno. Cuando se unen entre sí dentro de moléculas, el oxígeno, el azufre y el nitrógeno a menudo tienen uno o más “pares solitarios” de electrones que desempeñan un papel importante en la determinación de muchas de las propiedades físicas y químicas de las moléculas (ver Apéndice A). Estos rasgos en combinación permiten la formación de un gran número de especies moleculares diversas necesarias para formar las estructuras y habilitar las funciones de los organismos vivos.
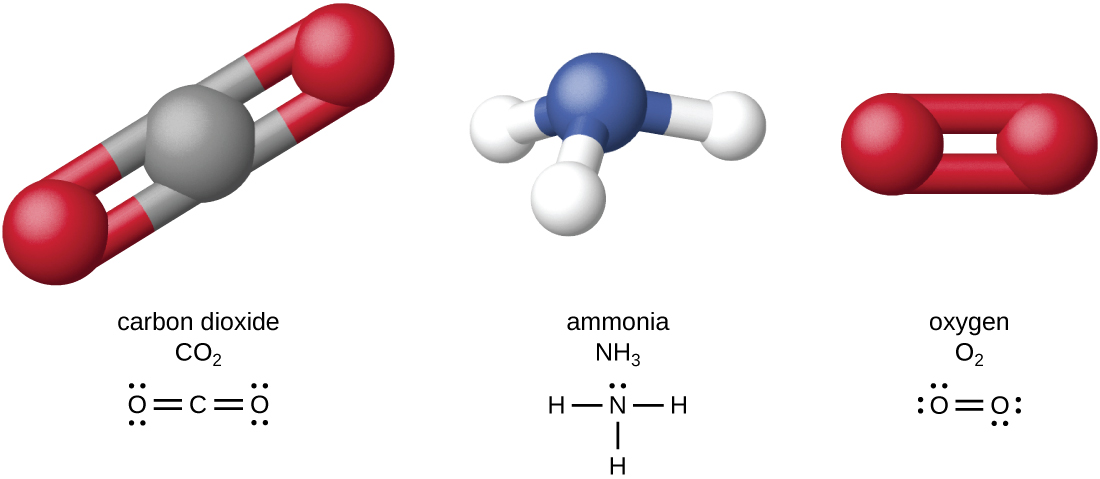
Los organismos vivos contienen compuestos inorgánicos (principalmente agua y sales; ver Apéndice A) y moléculas orgánicas. Las moléculas orgánicas contienen carbono; los compuestos inorgánicos no. Los óxidos de carbono y carbonatos son excepciones; contienen carbono pero se consideran inorgánicos porque no contienen hidrógeno. Los átomos de una molécula orgánica se organizan típicamente alrededor de cadenas de átomos de carbono.
Los compuestos inorgánicos constituyen 1% — 1.5% de la masa de una célula viva. Son compuestos pequeños y simples que juegan un papel importante en la célula, aunque no forman estructuras celulares. La mayor parte del carbono que se encuentra en las moléculas orgánicas proviene de fuentes de carbono inorgánicas como el dióxido de carbono capturado mediante la fijación de carbono por microorganismos.
Ejercicio\(\PageIndex{2}\)
- Describir los elementos más abundantes en la naturaleza.
- ¿Cuáles son las diferencias entre moléculas orgánicas e inorgánicas?
Moléculas Orgánicas e Isomería
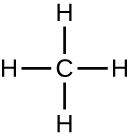
Las moléculas orgánicas en los organismos son generalmente más grandes y más complejas que las moléculas inorgánicas. Sus esqueletos de carbono se mantienen unidos por enlaces covalentes. Forman las células de un organismo y realizan las reacciones químicas que facilitan la vida. Todas estas moléculas, llamadas biomoléculas por ser parte de la materia viva, contienen carbono, que es el bloque de construcción de la vida. El carbono es un elemento muy singular en el sentido de que tiene cuatro electrones de valencia en sus orbitales exteriores y puede formar cuatro enlaces covalentes sencillos con hasta otros cuatro átomos al mismo tiempo (ver Apéndice A). Estos átomos suelen ser oxígeno, hidrógeno, nitrógeno, azufre, fósforo y carbono mismo; el compuesto orgánico más simple es el metano, en el que el carbono se une únicamente al hidrógeno (Figura\(\PageIndex{2}\)).
Como resultado de la combinación única de tamaño y propiedades de unión del carbono, los átomos de carbono pueden unirse en grandes cantidades, produciendo así una cadena o esqueleto de carbono. El esqueleto de carbono de las moléculas orgánicas puede ser lineal, ramificado o en forma de anillo (cíclico). Las moléculas orgánicas se construyen sobre cadenas de átomos de carbono de diferentes longitudes; la mayoría suelen ser muy largas, lo que permite una gran cantidad y variedad de compuestos. Ningún otro elemento tiene la capacidad de formar tantas moléculas diferentes de tantos tamaños y formas diferentes.
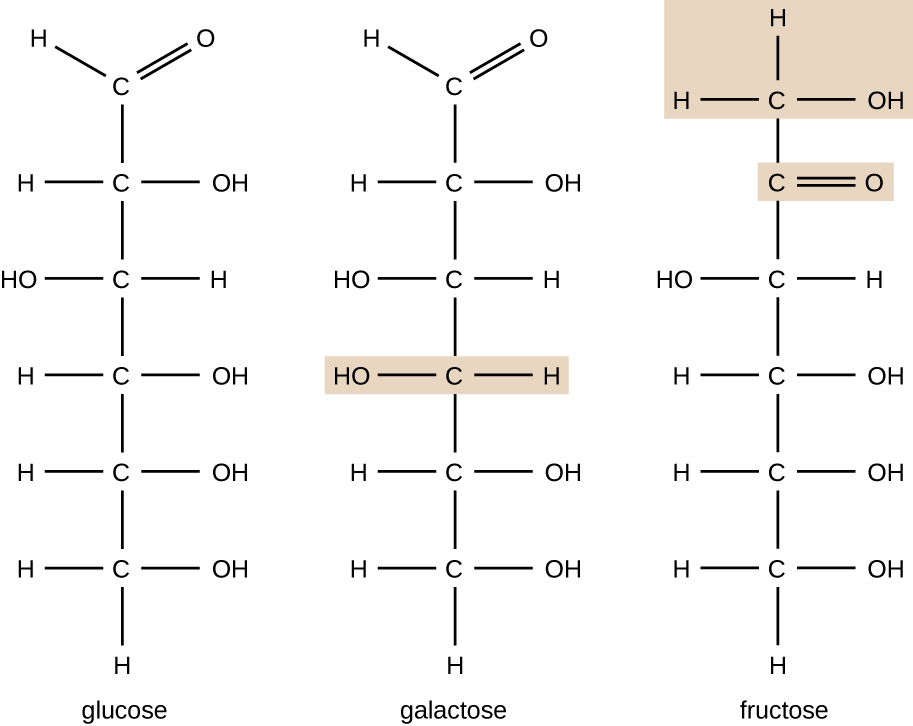
Las moléculas con la misma composición atómica pero diferente disposición estructural de los átomos se denominan isómeros. El concepto de isomería es muy importante en la química porque la estructura de una molécula siempre está directamente relacionada con su función. Pequeños cambios en las disposiciones estructurales de los átomos en una molécula pueden conducir a propiedades muy diferentes. Los químicos representan las moléculas por su fórmula estructural, que es una representación gráfica de la estructura molecular, mostrando cómo están dispuestos los átomos. Los compuestos que tienen fórmulas moleculares idénticas pero difieren en la secuencia de unión de los átomos se denominan isómeros estructurales. Los monosacáridos glucosa, galactosa y fructosa tienen todos la misma fórmula molecular, C 6 H 12 O 6, pero podemos ver en la Figura\(\PageIndex{3}\) que los átomos están unidos entre sí de manera diferente.
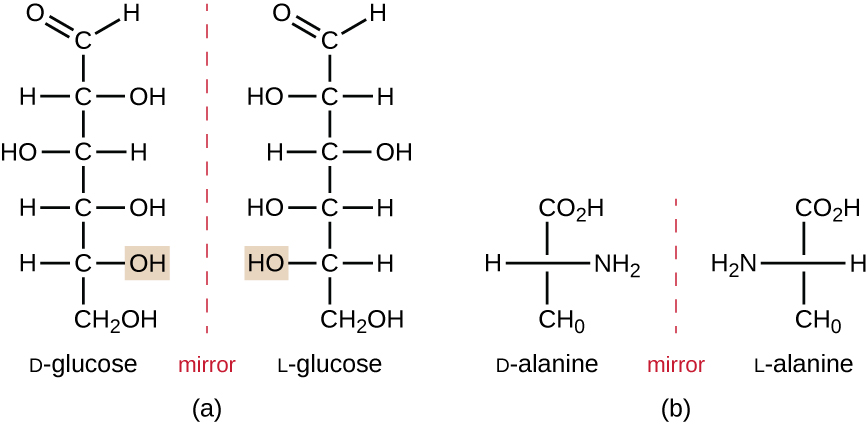
Los isómeros que difieren en las disposiciones espaciales de los átomos se denominan estereoisómeros; un tipo único son los enantiómeros. Las propiedades de los enantiómeros fueron descubiertas originalmente por Louis Pasteur en 1848 mientras se usaba un microscopio para analizar los productos de fermentación cristalizados del vino. Los enantiómeros son moléculas que tienen la característica de quiralidad, en la que sus estructuras son imágenes especulares no superponibles entre sí. La quiralidad es una característica importante en muchas moléculas biológicamente importantes, como lo ilustran los ejemplos de diferencias estructurales en las formas enantioméricas del monosacárido glucosa o el aminoácido alanina (Figura\(\PageIndex{4}\)).
Muchos organismos solo pueden usar una forma enantiomérica de ciertos tipos de moléculas como nutrientes y como bloques de construcción para hacer estructuras dentro de una célula. Algunas formas enantioméricas de aminoácidos tienen sabores y olores claramente diferentes cuando se consumen como alimento. Por ejemplo, el L-aspartamo, comúnmente llamado aspartamo, sabe dulce, mientras que el D-aspartamo es insípido. Los enantiómeros de fármacos pueden tener efectos farmacológicos muy diferentes. Por ejemplo, el compuesto metorfano existe como dos enantiómeros, uno de los cuales actúa como antitusivo (dextro metorfano, un supresor de la tos), mientras que el otro actúa como analgésico (levo metorfano, un fármaco similar en efecto a la codeína).
Los enantiómeros también se denominan isómeros ópticos porque pueden rotar el plano de la luz polarizada. Algunos de los cristales que Pasteur observó de la fermentación del vino giraban a la luz en el sentido de las agujas del reloj, mientras que Hoy, denotamos enantiómeros que rotan la luz polarizada en el sentido de las agujas del reloj (+) como formas d, y la imagen especular de la misma molécula que gira la luz polarizada en sentido antihorario (−) como la forma l. Las etiquetas d y l se derivan de las palabras latinas dexter (a la derecha) y laevus (a la izquierda), respectivamente. Estos dos isómeros ópticos diferentes a menudo tienen propiedades y actividades biológicas muy diferentes. Ciertas especies de mohos, levaduras y bacterias, como Rhizopus, Yarrowia y Lactobacillus spp., respectivamente, solo pueden metabolizar un tipo de isómero óptico; el isómero opuesto no es adecuado como fuente de nutrientes. Otra razón importante para estar al tanto de los isómeros ópticos es el uso terapéutico de este tipo de químicos para el tratamiento farmacológico, ya que algunos microorganismos solo pueden verse afectados por un isómero óptico específico.
Ejercicio\(\PageIndex{3}\)
Decimos que la vida es a base de carbono. ¿Qué hace que el carbono sea tan adecuado para formar parte de todas las macromoléculas de los organismos vivos?
Grupos funcionales biológicamente significativos
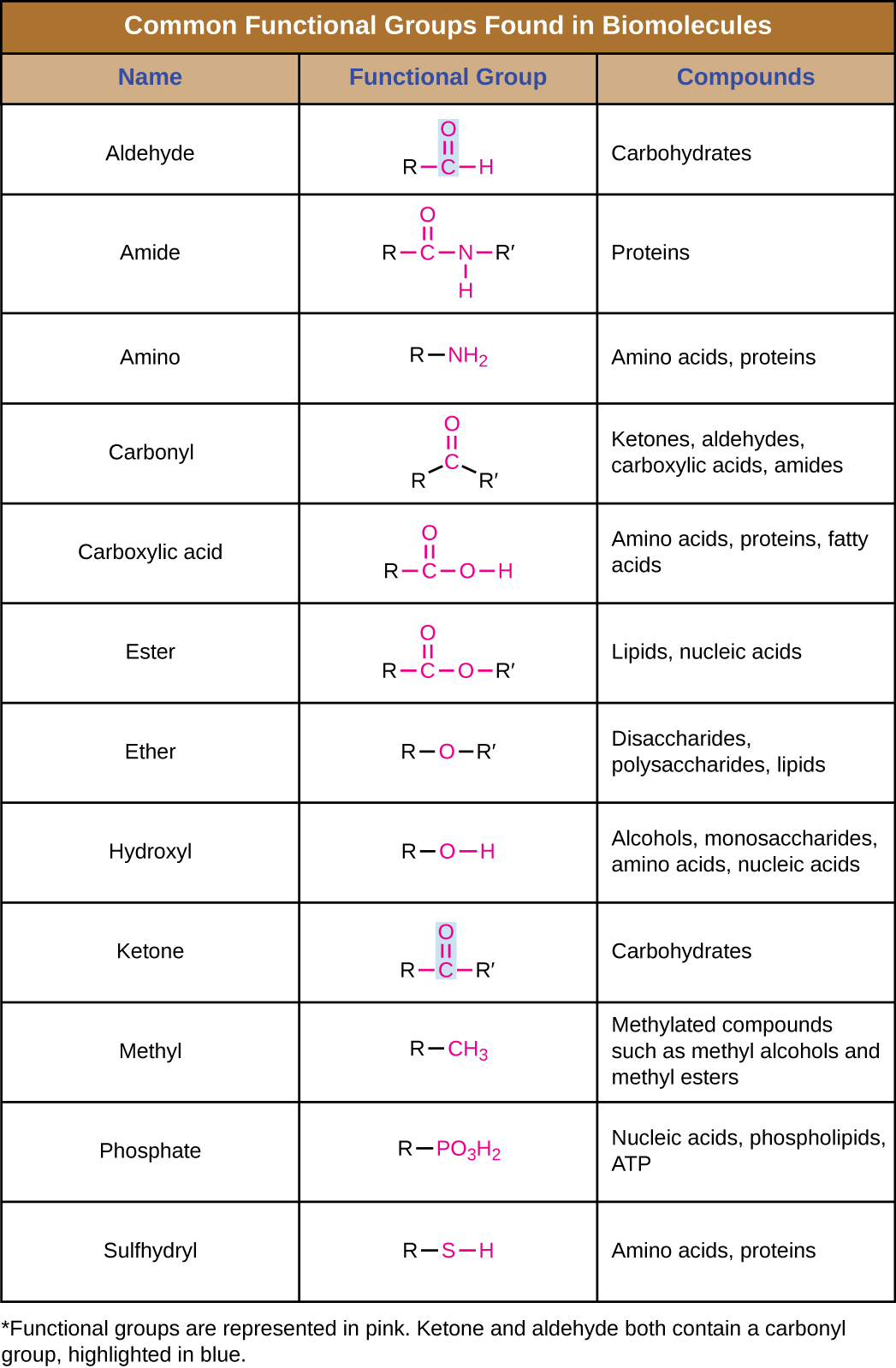
Además de contener átomos de carbono, las biomoléculas también contienen grupos funcionales, grupos de átomos dentro de moléculas que se clasifican por su composición química específica y las reacciones químicas que realizan, independientemente de la molécula en la que se encuentre el grupo. Algunos de los grupos funcionales más comunes se enumeran en la Figura\(\PageIndex{5}\). En las fórmulas, el símbolo R significa “residuo” y representa el resto de la molécula. R podría simbolizar solo un solo átomo de hidrógeno o puede representar un grupo de muchos átomos. Observe que algunos grupos funcionales son relativamente simples, consistentes en solo uno o dos átomos, mientras que algunos comprenden dos de estos grupos funcionales más simples. Por ejemplo, un grupo carbonilo es un grupo funcional compuesto por un átomo de carbono doble enlazado a un átomo de oxígeno: C=O. Está presente en varias clases de compuestos orgánicos como parte de grupos funcionales más grandes como cetonas, aldehídos, ácidos carboxílicos y amidas. En las cetonas, el carbonilo está presente como un grupo interno, mientras que en los aldehídos es un grupo terminal.
Macromoléculas
Las cadenas de carbono forman los esqueletos de la mayoría de las moléculas orgánicas. Los grupos funcionales se combinan con la cadena para formar biomoléculas. Debido a que estas biomoléculas suelen ser grandes, las llamamos macromoléculas. Muchas macromoléculas biológicamente relevantes se forman uniendo entre sí un gran número de moléculas orgánicas idénticas, o muy similares, más pequeñas. Las moléculas más pequeñas actúan como bloques de construcción y se llaman monómeros, y las macromoléculas que resultan de su unión se llaman polímeros. Las células y estructuras celulares incluyen cuatro grupos principales de macromoléculas que contienen carbono: polisacáridos, proteínas, lípidos y ácidos nucleicos. Los tres primeros grupos de moléculas serán estudiados a lo largo de este capítulo. La bioquímica de los ácidos nucleicos se discutirá en Bioquímica del Genoma.
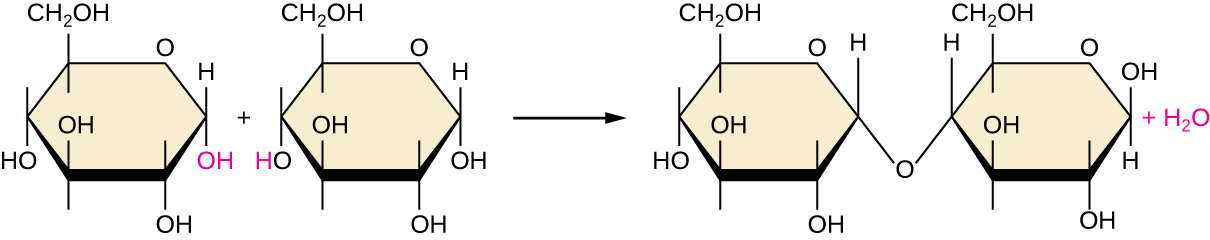
De las muchas formas posibles en que los monómeros pueden combinarse para producir polímeros, un enfoque común que se encuentra en la formación de macromoléculas biológicas es la síntesis por deshidratación. En esta reacción química, las moléculas monoméricas se unen de extremo a extremo en un proceso que da como resultado la formación de moléculas de agua como subproducto:
\[\text{H—monomer—OH} + \text{H—monomer—OH} ⟶ \text{H—monomer—monomer—OH} + \ce{H2O}\]
La figura\(\PageIndex{6}\) muestra la síntesis de deshidratación de glucosa que se une entre sí para formar maltosa y una molécula de agua. La tabla\(\PageIndex{1}\) resume las macromoléculas y algunas de sus funciones.
| Macromolécula | Funciones |
|---|---|
| Carbohidratos | Almacenamiento de energía, receptores, alimentos, papel estructural en plantas, paredes celulares fúngicas, exoesqueletos de insectos |
| Lípidos | Almacenamiento de energía, estructura de membrana, aislamiento, hormonas, pigmentos |
| Ácidos nucleicos | Almacenamiento y transferencia de información genética |
| Proteínas | Enzimas, estructura, receptores, transporte, papel estructural en el citoesqueleto de una célula y la matriz extracelular |
Ejercicio\(\PageIndex{4}\)
¿Cuál es el subproducto de una reacción de síntesis de deshidratación?
Conceptos clave y resumen
- Los elementos más abundantes en las células son hidrógeno, carbono, oxígeno, nitrógeno, fósforo y azufre.
- La vida se basa en carbono. Cada átomo de carbono puede unirse a otro produciendo un esqueleto de carbono que puede ser lineal, ramificado o en forma de anillo.
- Los mismos números y tipos de átomos pueden unirse de diferentes maneras para producir diferentes moléculas llamadas isómeros. Los isómeros pueden diferir en la secuencia de unión de sus átomos (isómeros estructurales) o en la disposición espacial de los átomos cuyas secuencias de enlace son las mismas (estereoisómeros), y sus propiedades físicas y químicas pueden variar ligeramente o drásticamente.
- Los grupos funcionales confieren propiedades químicas específicas a las moléculas que los portan. Los grupos funcionales comunes en las biomoléculas son hidroxilo, metilo, carbonilo, carboxilo, amino, fosfato y sulfhidrilo.
- Las macromoléculas son polímeros ensamblados a partir de unidades individuales, los monómeros, que se unen como bloques de construcción. Muchas macromoléculas biológicamente significativas se forman por síntesis de deshidratación, un proceso en el que los monómeros se unen combinando sus grupos funcionales y generando moléculas de agua como subproductos.


