4.4: Epigenética en Psicología
- Page ID
- 146453
Ian Weaver
Las experiencias de vida temprana ejercen una profunda y duradera influencia en la salud física y mental a lo largo de la vida. Los esfuerzos para identificar las causas primarias de esto se han beneficiado significativamente de los estudios del epigenoma, una capa dinámica de información asociada al ADN que difiere entre individuos y puede ser alterada a través de diversas experiencias y entornos. El epigenoma ha sido anunciado como una “pieza faltante” clave del rompecabezas etiológico para entender cómo el desarrollo de los trastornos psicológicos puede ser influenciado por el entorno circundante, en concordancia con el genoma. Comprender los mecanismos involucrados en la iniciación, mantenimiento y heredabilidad de los estados epigenéticos es, por lo tanto, un aspecto importante de la investigación en biología actual, particularmente en el estudio del aprendizaje y la memoria, la emoción y el comportamiento social en humanos. Además, la epigenética en psicología proporciona un marco para comprender cómo la expresión de genes es influenciada por las experiencias y el entorno para producir diferencias individuales en el comportamiento, la cognición, la personalidad y la salud mental. En este módulo, estudiamos desarrollos recientes revelando aspectos epigenéticos de la salud mental y revisamos algunos de los desafíos de los enfoques epigenéticos en psicología para ayudar a explicar cómo la crianza da forma a la naturaleza.
Objetivos de aprendizaje
- Explicar qué significa el término epigenética y la maquinaria molecular involucrada.
- Nombrar y discutir importantes vías neuronales y de desarrollo reguladas por factores epigenéticos, y proporcionar ejemplos de efectos epigenéticos sobre los rasgos de personalidad y el comportamiento cognitivo.
- Entender cómo la mala regulación de los mecanismos epigenéticos puede conducir a estados de enfermedad, y ser capaz de discutir ejemplos.
- Reconocer cómo la maquinaria epigenética puede ser dianas para los agentes terapéuticos y discutir ejemplos.
Introducción

Figura 4.10: ADN significa Ácido desoxirribonucleico, y aunque el ADN de cada persona es único para ese individuo, es 99.9% similar a cualquier otro ser humano del planeta.
La primera infancia no es solo un período de crecimiento físico; también es un tiempo de desarrollo mental relacionado con cambios en la anatomía, fisiología y química del sistema nervioso que influyen en la salud mental a lo largo de la vida. Las habilidades cognitivas asociadas al aprendizaje y la memoria, el razonamiento, la resolución de problemas y el desarrollo de relaciones continúan emergiendo durante la infancia. El desarrollo cerebral es más rápido durante este período crítico o sensible que en cualquier otro, con más de 700 conexiones neuronales creadas cada segundo. Aquí, las interacciones genes-ambiente complejas (o interacciones genotipo—ambiente, G×E) sirven para aumentar el número de posibles contactos entre neuronas, ya que perfeccionan sus propiedades sinápticas adultas y excitabilidad. Muchas conexiones débiles se forman con diferentes dianas neuronales; posteriormente, se someten a remodelación en la que la mayoría de las conexiones desaparecen y quedan algunas conexiones estables. Estos cambios estructurales (o plasticidad) pueden ser cruciales para el desarrollo de redes neuronales maduras que apoyan el comportamiento emocional, cognitivo y social. La generación de diferentes resultados de morfología, fisiología y comportamiento a partir de un solo genoma en respuesta a los cambios en el ambiente forma la base de la “plasticidad fenotípica”, que es fundamental para la forma en que los organismos hacen frente a la variación ambiental, navegan por el mundo presente y resuelven problemas futuros .
El reto para la psicología ha sido integrar los hallazgos de la genética y los factores ambientales (sociales, biológicos, químicos), incluyendo la calidad de los apegos bebé-madre, en el estudio de la personalidad y nuestra comprensión del surgimiento de enfermedades mentales. Estos estudios han demostrado que la variación común de la secuencia de ADN y las mutaciones raras representan solo una pequeña fracción (1% — 2%) del riesgo total de herencia de rasgos de personalidad y trastornos mentales (Dick, Riley, & Kendler, 2010; Gershon, Alliey-Rodriguez, & Liu, 2011). Adicionalmente, estudios que han intentado examinar los mecanismos y condiciones bajo los cuales la variación de la secuencia de ADN influye en el desarrollo y la función del cerebro han sido confundidos por complejas relaciones de causa y efecto (Petronis, 2010). La gran heredabilidad no contabilizada de los rasgos de personalidad y la salud mental sugiere que están involucrados mecanismos moleculares y celulares adicionales.
La epigenética tiene el potencial de dar respuestas a estas importantes preguntas y se refiere a la transmisión del fenotipo en términos de expresión génica en ausencia de cambios en la secuencia del ADN —de ahí el nombre epi- (griego: επ⸺- sobre, arriba) genética (Waddington, 1942; Wolffe & Matzke, 1999). El advenimiento de técnicas de alto rendimiento como enfoques basados en secuenciación para estudiar las distribuciones de reguladores de la expresión génica a lo largo del genoma condujo a la descripción colectiva del “epigenoma”. A diferencia de la secuencia del genoma, que es estática y lo mismo en casi todas las células, el epigenoma es altamente dinámico, diferenciándose entre tipos de células, tejidos y regiones cerebrales (Gregg et al., 2010). Estudios recientes han proporcionado información sobre la regulación epigenética de las vías de desarrollo en respuesta a una variedad de factores ambientales externos (Dolinoy, Weidman, & Jirtle, 2007). Estos factores ambientales durante la primera infancia y adolescencia pueden provocar cambios en la expresión de genes que confieren riesgo de salud mental y condiciones físicas crónicas. Así, el examen de las interacciones genética-epigenética-ambiente desde una perspectiva de desarrollo puede determinar la naturaleza de la mala regulación génica en los trastornos psicológicos.
Este módulo proporcionará una visión general de los principales componentes del epigenoma y revisará temas en investigaciones epigenéticas recientes que tienen relevancia para la psicología, para formar la base biológica para la interacción entre las señales ambientales y el genoma en la regulación de las diferencias individuales en la fisiología, emoción, cognición y comportamiento.
Control molecular de la expresión génica: el epigenoma dinámico

Figura 4.11: Los gemelos idénticos son el ejemplo perfecto de epigenética. Aunque comparten exactamente el mismo ADN, sus experiencias únicas en la vida harán que algunos genes (y no otros) se expresen. Es por ello que, con el tiempo, los gemelos idénticos llegan a verse y comportarse de manera diferente.
Casi todas las células de nuestro cuerpo son genéticamente idénticas, sin embargo, nuestro cuerpo genera muchos tipos de células diferentes, organizadas en diferentes tejidos y órganos, y expresa diferentes proteínas. Dentro de cada tipo de célula de mamífero, aproximadamente 2 metros de ADN genómico se dividen en cromosomas nucleares. Sin embargo, el núcleo de una célula humana, que contiene los cromosomas, tiene solo alrededor de 2 μm de diámetro. Para lograr esta compactación de mil mil mil veces, el ADN se envuelve alrededor de un grupo de 8 proteínas llamadas histonas. Esta combinación de proteínas de ADN e histonas forma una estructura especial llamada “nucleosoma”, la unidad básica de la cromatina, que representa una solución estructural para mantener y acceder al genoma estrechamente compactado. Estos factores alteran la probabilidad de que un gen sea expresado o silenciado. Las funciones celulares como la expresión génica, la replicación del ADN y la generación de tipos celulares específicos están influenciadas por distintos patrones de estructura de la cromatina, que implican la modificación covalente de ambas histonas (Kadonaga, 1998) y ADN (Razin, 1998).
Es importante destacar que la variación epigenética también emerge a lo largo de la vida útil. Por ejemplo, aunque los gemelos idénticos comparten un genotipo común y son genéticamente idénticos y epigenéticamente similares cuando son jóvenes, a medida que envejecen se vuelven más disímiles en sus patrones epigenéticos y a menudo muestran diferencias de comportamiento, personalidad o incluso físicas, y tienen diferentes niveles de riesgo de enfermedad grave. Por lo tanto, comprender la estructura del nucleosoma es clave para comprender el control preciso y estable de la expresión y regulación génica, proporcionando una interfaz molecular entre los genes y los cambios inducidos ambientalmente en la actividad celular.
La marca epigenética primaria: modificación del ADN
La metilación del ADN es la modificación epigenética mejor entendida que influye en la expresión génica. El ADN está compuesto por cuatro tipos de bases nitrogenadas naturales: adenina (A), timina (T), guanina (G) y citosina (C). En los genomas de mamíferos, la metilación del ADN ocurre principalmente en los residuos de citosina en el contexto de citosinas que son seguidas por guaninas (dinucleótidos CpG), para formar 5-metilcitosina en un patrón específico de célula (Goll & Bestor, 2005; Law & Jacobsen, 2010; Suzuki & Bird, 2008). Las enzimas que realizan la metilación del ADN se denominan ADN metiltransferasas (DNMT), que catalizan la transferencia de un grupo metilo a la citosina (Adams, McKay, Craig, & Burdon, 1979). Todas estas enzimas se expresan en el sistema nervioso central y se regulan dinámicamente durante el desarrollo (Feng, Chang, Li, & Fan, 2005; Goto et al., 1994). El efecto de la metilación del ADN sobre la función génica varía según el período de desarrollo durante el cual se produce la metilación y la ubicación de la citosina metilada. La metilación del ADN en regiones reguladoras génicas (regiones promotoras y potenciadoras) generalmente da como resultado silenciamiento génico y expresión génica reducida (Oosi, O'Donnell, & Bestor, 2009; Suzuki & Bird, 2008; Sutter y Doerfler, 1980; Vardimon et al., 1982). Este es un poderoso mecanismo regulador que asegura que los genes se expresen solo cuando sea necesario. Por lo tanto, la metilación del ADN puede afectar ampliamente el desarrollo del cerebro humano, y la mala regulación relacionada con la edad de la metilación del ADN se asocia con la patogénesis molecular de los trastornos del desarrollo
Modificación de histonas y código de histonas
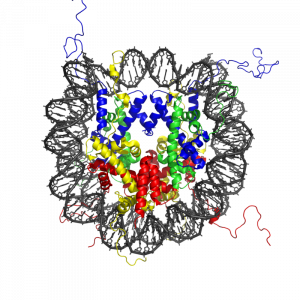
Figura 4.12: Las experiencias de vida, como un evento estresante en la infancia, pueden provocar la modificación de las proteínas histonas (en la foto) para ayudar a adaptarse al propio entorno. Por ejemplo, en respuesta a un evento estresante, la modificación histona del ADN de uno podría ocurrir para fomentar una personalidad más cautelosa, con el fin de evitar futuros encuentros estresantes.
La modificación de las proteínas histonas comprende una importante marca epigenética relacionada con la expresión génica. Una de las modificaciones más estudiadas es la acetilación de histonas, que se asocia con la activación génica y el aumento de la expresión génica (Wade, Pruss, & Wolffe, 1997). La acetilación en las colas de histonas está mediada por las actividades enzimáticas opuestas de las histonas acetiltransferasas (HAT) y las histonas desacetilasas (HDAC) (Kuo & Allis, 1998). Por ejemplo, la acetilación de histona en regiones reguladoras génicas por enzimas HAT generalmente se asocia con la desmetilación del ADN, la activación génica y el aumento de la expresión génica (Hong, Schroth, Matthews, Yau, & Bradbury, 1993; Sealy & Chalkley, 1978). Por otro lado, la eliminación del grupo acetilo (desacetilación) por las enzimas HDAC generalmente se asocia con la metilación del ADN, el silenciamiento génico y la disminución de la expresión génica (Davie & Chadee, 1998). La relación entre los patrones de modificaciones de histonas y la actividad génica proporciona evidencia de la existencia de un “código de histonas” para determinar programas de expresión génica específicos de células (Jenuwein & Allis, 2001). Curiosamente, investigaciones recientes que utilizan modelos animales han demostrado que las modificaciones de histonas y la metilación del ADN de ciertos genes median los efectos conductuales a largo plazo del nivel de atención experimentado durante la infancia.
Experiencia en la primera infancia
El desarrollo de un individuo es un proceso activo de adaptación que ocurre dentro de un contexto social y económico. Por ejemplo, la cercanía o grado de apego positivo del padre (típicamente madre) —vínculo infantil y la inversión parental (incluido el suministro de nutrientes proporcionado por el padre) que definen la experiencia de la primera infancia también programan el desarrollo de diferencias individuales en las respuestas de estrés en el cerebro, que luego afectan la memoria, la atención y la emoción. En términos de evolución, este proceso proporciona a la descendencia la capacidad de ajustar fisiológicamente los perfiles de expresión génica contribuyendo a la organización y función de circuitos neuronales y vías moleculares que apoyan (1) sistemas biológicos defensivos para la supervivencia (por ejemplo, resiliencia al estrés), (2) éxito reproductivo para promover el establecimiento y persistencia en el ambiente actual, y (3) la crianza adecuada en la próxima generación (Bradshaw, 1965).
Inversión parental y programación de respuestas al estrés en la descendencia
El estudio más completo hasta la fecha de las variaciones en la inversión parental y la herencia epigenética en mamíferos es el de las respuestas de transmisión materna al estrés en ratas. En crías de rata, la crianza materna (lamiendo y arreglando) durante la primera semana de vida se asocia con la programación a largo plazo de las diferencias individuales en respuesta al estrés, emocionalidad, rendimiento cognitivo y comportamiento reproductivo (Caldji et al., 1998; Francis, Diorio, Liu, & Meaney, 1999; Liu et al. ., 1997; Myers, Brunelli, Shair, Squire, & Hofer, 1989; Stern, 1997). En la edad adulta, las crías de madres que presentan mayores niveles de lamer y acicalamiento de las crías durante la primera semana de vida muestran una mayor expresión del receptor de glucocorticoides en el hipocampo (una estructura cerebral asociada con la capacidad de respuesta al estrés, así como el aprendizaje y la memoria) y una disminución hormonal respuesta al estrés en comparación con animales adultos criados por madres con bajo lamido y aseo (Francis et al., 1999; Liu et al., 1997). Además, las crías de rata que recibieron bajos niveles de lamer y acicalamiento materno durante la primera semana de vida mostraron una disminución de la acetilación de histonas y un aumento de la metilación del ADN de un promotor específico de neuronas del gen del receptor de glucocorticoides (Weaver et al., 2004). Luego se reduce la expresión de este gen, disminuye el número de receptores de glucocorticoides en el cerebro y los animales muestran una mayor respuesta hormonal al estrés a lo largo de su vida. Los efectos de la atención materna sobre las respuestas y el comportamiento de las hormonas del estrés en la descendencia pueden eliminarse en la edad adulta mediante tratamiento farmacológico (inhibidor de HDAC tricostatina A, TSA) o suplementación dietética de aminoácidos (donante de metilo L-metionina), tratamientos que influyen en la acetilación de histonas, metilación del ADN , y expresión del gen del receptor de glucocorticoides (Weaver et al., 2004; Weaver et al., 2005). Esta serie de experimentos muestra que la acetilación de histonas y la metilación del ADN del promotor del gen receptor de glucocorticoides es un eslabón necesario en el proceso que conduce a las secuelas fisiológicas y conductuales a largo plazo de la mala atención materna. Esto apunta a una posible diana molecular para tratamientos que pueden revertir o mejorar las huellas del maltrato infantil.

Figura 4.13: El cuidado parental durante la infancia tiene efectos importantes y consecuentes en el desarrollo de un individuo, efectos que persisten incluso hasta la edad adulta.
Varios estudios han intentado determinar en qué medida los hallazgos de animales modelo son transferibles a los humanos. El examen del tejido cerebral post-mortem de sujetos humanos sanos encontró que el equivalente humano del promotor del gen del receptor de glucocorticoides (promotor del exón 1F NR3C1) también es único para el individuo (Turner, Pelascini, Macedo, & Muller, 2008). Un estudio similar al examinar a los recién nacidos mostró que la metilación del promotor del gen del receptor de glucocorticoides puede ser un marcador epigenético temprano del estado de ánimo materno y riesgo de aumento de las respuestas hormonales al estrés en lactantes de 3 meses de edad (Oberlander et al., 2008). Aunque se requieren más estudios para examinar la consecuencia funcional de esta metilación del ADN, estos hallazgos son consistentes con nuestros estudios en el recién nacido y la descendencia adulta de madres con bajo lamer y aseo que muestran un aumento de la metilación del ADN del promotor del gen del receptor de glucocorticoides. disminuyó la expresión génica del receptor de glucocorticoides y aumentó las respuestas hormonales al estrés (Weaver et al., 2004). El examen del tejido cerebral de víctimas de suicidio encontró que el promotor del gen del receptor de glucocorticoides humanos también está más metilado en los cerebros de individuos que habían experimentado malos tratos durante la infancia (McGowan et al., 2009). Estos hallazgos sugieren que la metilación del ADN media los efectos del ambiente temprano tanto en roedores como en humanos y apunta a la posibilidad de nuevos enfoques terapéuticos derivados de la investigación epigenética traslacional. De hecho, procesos similares en regiones lábiles epigenéticas comparables podrían explicar por qué la descendencia adulta de madres de alta y baja lamida/acicalamiento exhiben diferencias generalizadas en la expresión génica del hipocampo y la función cognitiva (Weaver, Meaney, & Szyf, 2006).
Sin embargo, este tipo de investigación está limitada por la inaccesibilidad de las muestras de cerebro humano. El potencial traslacional de este hallazgo se vería muy potenciado si la modificación epigenética relevante se pudiera medir en un tejido accesible. El examen de muestras de sangre de pacientes adultos con trastorno bipolar, quienes también reportaron retrospectivamente sobre sus experiencias de abuso y abandono infantil, encontró que el grado de metilación del ADN del promotor del gen receptor de glucocorticoides humano se relacionó fuertemente positivamente con la experiencia reportada de maltrato infantil décadas antes. Para una relación entre una medida molecular y la exposición histórica reportada, el tamaño de los efectos es extraordinariamente grande. Esto abre una gama de nuevas posibilidades: dado el gran tamaño del efecto y la consistencia de esta asociación, la medición de la metilación del promotor GR puede convertirse efectivamente en un análisis de sangre que mide las huellas fisiológicas dejadas en el genoma por experiencias tempranas. Si bien este análisis de sangre no puede reemplazar los métodos actuales de diagnóstico, esta información única y adicional se suma a nuestro conocimiento de cómo la enfermedad puede surgir y manifestarse a lo largo de la vida. La investigación en el futuro cercano examinará si esta medida agrega valor más allá de la simple notificación de adversidades tempranas cuando se trata de predecir resultados importantes, como la respuesta al tratamiento o el suicidio.
La nutrición infantil y el epigenoma

Figura 4.14: Si tus padres conocían o no la ciencia detrás de esto, decirte que comas tus verduras cuando eras niño realmente te hace más saludable y más fuerte, al menos tu ADN, es decir.
El viejo adagio “eres lo que comes” puede ser cierto en algo más que a nivel físico: La comida que elijas (e incluso lo que tus padres y abuelos eligieron) se refleja en tu propio desarrollo personal y riesgo de enfermedad en la vida adulta (Wells, 2003). Los nutrientes pueden revertir o cambiar la metilación del ADN y las modificaciones de histonas, modificando así la expresión de genes críticos asociados con procesos fisiológicos y patológicos, incluyendo el desarrollo embrionario, el envejecimiento y la carcinogénesis. Parece que los nutrientes pueden influir en el epigenoma ya sea inhibiendo directamente enzimas que catalizan la metilación del ADN o modificaciones de histonas, o alterando la disponibilidad de sustratos necesarios para esas reacciones enzimáticas. Por ejemplo, las madres ratas alimentadas con una dieta baja en donantes del grupo metilo durante el embarazo producen crías con expresión reducida de DNMT-1, disminución de la metilación del ADN y aumento de la acetilación de histonas en regiones promotoras de genes específicos, incluido el receptor de glucocorticoides, y aumento de la expresión génica en el hígado de descendencia juvenil (Lillycrop, Phillips, Jackson, Hanson, & Burdge, 2005) y descendencia adulta (Lillycrop et al., 2007). Estos datos sugieren que la nutrición temprana de la vida tiene el potencial de influir en la programación epigenética en el cerebro no solo durante el desarrollo temprano sino también en la vida adulta, modulando así la salud a lo largo de la vida. En este sentido, la epigenética nutricional ha sido vista como una herramienta atractiva para prevenir enfermedades pediátricas del desarrollo y cáncer, así como para retrasar los procesos asociados al envejecimiento.
La mejor evidencia relacionada con el impacto de las condiciones ambientales adversas en el desarrollo y la salud proviene de estudios de los hijos de mujeres que estuvieron embarazadas durante dos hambrunas civiles de la Segunda Guerra Mundial: el Asedio de Leningrado (1941-44) (Bateson, 2001) y la holandesa Hunger Winter (1944—1945) (Stanner et al., 1997). En los Países Bajos, las mujeres que anteriormente estaban bien nutridas fueron sometidas a una baja ingesta calórica y a factores estresantes ambientales asociados. Las mujeres que soportaron la hambruna en las últimas etapas del embarazo dieron a luz a bebés más pequeños (Lumey & Stein, 1997) y estos niños tuvieron un mayor riesgo de resistencia a la insulina más adelante en la vida (Painter, Roseboom, & Bleker, 2005). Además, las crías que murieron de hambre prenatalmente más tarde experimentaron alteración de la tolerancia a la glucosa en la edad adulta, incluso cuando la comida era más abundante (Stanner et al., 1997). La exposición a la hambruna en diversas etapas de la gestación se asoció con una amplia gama de riesgos como aumento de la obesidad, mayores tasas de enfermedad coronaria y menor peso al nacer (Lumey & Stein, 1997). Curiosamente, cuando se examinaron 60 años después, las personas expuestas a la hambruna prenatalmente mostraron una metilación del ADN reducida en comparación con sus hermanos del mismo sexo no expuestos (Heijmans et al., 2008).
Regulación epigenética del aprendizaje y la memoria
Figura 4.15: La plasticidad neural es el cambio de vías neuronales y sinapsis que nos permite aprender cosas nuevas y recordarlas.
Los recuerdos son recuerdos de eventos reales almacenados dentro de nuestros cerebros. Pero, ¿cómo es capaz nuestro cerebro de formar y almacenar estos recuerdos? Los mecanismos epigenéticos influyen en las actividades genómicas en el cerebro para producir cambios a largo plazo en la señalización sináptica, la organización y la morfología, que a su vez apoyan el aprendizaje y la memoria (Day & Sweatt, 2011).
La actividad neuronal en el hipocampo de ratones se asocia con cambios en la metilación del ADN (Guo et al., 2011), y la interrupción de los genes que codifican la maquinaria de metilación del ADN causa problemas de aprendizaje y memoria (Feng et al., 2010). La metilación del ADN también se ha implicado en el mantenimiento de memorias a largo plazo, como la inhibición farmacológica de la metilación del ADN y la alteración de la memoria (Day & Sweatt, 2011; Miller et al., 2010). Estos hallazgos indican la importancia de la metilación del ADN en la mediación de la plasticidad sináptica y las funciones cognitivas, ambas perturbadas en la enfermedad psicológica.
Los cambios en las modificaciones de histonas también pueden influir en la formación de memoria a largo plazo al alterar la accesibilidad de la cromatina y la expresión de genes relevantes para el aprendizaje y la memoria. La formación de memoria y las mejoras asociadas en la transmisión sináptica están acompañadas de aumentos en la acetilación de histonas (Guan et al., 2002) y alteraciones en la metilación de histonas (Schaefer et al., 2009), que promueven la expresión génica. Por el contrario, un aumento neuronal en la actividad histona desacetilasa, que promueve el silenciamiento génico, da como resultado una plasticidad sináptica reducida y deteriora la memoria (Guan et al., 2009). La inhibición farmacológica de las histonas desacetilasas aumenta la formación de memoria (Guan et al., 2009; Levenson et al., 2004), sugiriendo además que la (de) acetilación de histonas regula este proceso.
En humanos, los defectos genéticos en los genes que codifican la metilación del ADN y la maquinaria de la cromatina exhiben profundos efectos sobre la función cognitiva y la salud mental (Jiang, Bressler, & Beaudet, 2004). Los dos ejemplos mejor caracterizados son el síndrome de Rett (Amir et al., 1999) y el síndrome de Rubinstein-Taybi (RTS) (Alarcon et al., 2004), que son trastornos profundos de la discapacidad intelectual. Tanto MECP2 como CBP están altamente expresados en neuronas y están involucrados en la regulación de la expresión de genes neuronales (Chen et al., 2003; Martinowich et al., 2003).
Los pacientes con síndrome de Rett tienen una mutación en su secuencia de ADN en un gen llamado MECP2. MECP2 juega muchos papeles importantes dentro de la célula: Uno de estos roles es leer la secuencia de ADN, verificar la metilación del ADN y unirse a áreas que contienen metilación, evitando así que las proteínas incorrectas estén presentes. Otras funciones para MECP2 incluyen promover la presencia de proteínas particulares, necesarias, asegurando que el ADN se empaqueta adecuadamente dentro de la célula y ayudar con la producción de proteínas. La función MECP2 también influye en la expresión génica que apoya el desarrollo dendrítico y sináptico y la memoria dependiente del hipocampo (Li, Zhong, Chau, Williams, & Chang, 2011; Skene et al., 2010). Los ratones con expresión alterada de MECP2 exhiben aumentos en todo el genoma en la acetilación de histonas, muerte celular neuronal, aumento de la ansiedad, déficits cognitivos y abstinencia social (Shahbazian et al., 2002). Estos hallazgos apoyan un modelo en el que la metilación del ADN y MECP2 constituyen un mecanismo epigenético específico de la célula para la regulación de la modificación de histonas y la expresión génica, que puede verse alterada en el síndrome de Rett.
Los pacientes con RTS tienen una mutación en su secuencia de ADN en un gen llamado CBP. Una de estas funciones de CBP es unirse a histonas específicas y promover la acetilación de histonas, promoviendo así la expresión génica. Consistente con esta función, los pacientes con RTS presentan una disminución en todo el genoma en la acetilación de histonas y la disfunción cognitiva en la edad adulta (Kalkhoven et al., 2003). Los déficits de aprendizaje y memoria se atribuyen a la plasticidad neural alterada (Korzus, Rosenfeld, & Mayford, 2004). Similar al RTS en humanos, los ratones con una mutación de CBP se desempeñan mal en las tareas cognitivas y muestran una disminución de la acetilación de histonas en todo el genoma (para revisión, ver Josselyn, 2005). En el cerebro del ratón se encontró que la CBP actuaba como un interruptor epigenético para promover el nacimiento de nuevas neuronas en el cerebro. Curiosamente, este mecanismo epigenético se ve alterado en los cerebros fetales de ratones con una mutación de CBP, que, como crías, presentan déficits conductuales tempranos tras la extracción y separación de su madre (Wang et al., 2010). Estos hallazgos proporcionan un mecanismo novedoso mediante el cual las señales ambientales, actuando a través de enzimas modificadoras de histonas, pueden regular el estado epigenético y así promover directamente la neurogénesis, que regula el desarrollo neuroconductual.
Juntos, estos estudios demuestran que la mala regulación de las modificaciones epigenéticas y sus enzimas reguladoras es capaz de orquestar destacados deficits en la plasticidad neuronal y la función cognitiva. El conocimiento de estos estudios puede proporcionar una mayor comprensión de otros trastornos mentales como la depresión y las conductas suicidas.
Mecanismos epigenéticos en los trastornos psicológicos
Figura 4.16: En la imagen de arriba se muestra una cromatina, la macromolécula de aspecto espiral involucrada en la depresión.
Estudios de todo el epigenoma han identificado varias docenas de sitios con alteraciones de metilación del ADN en genes involucrados en el desarrollo cerebral y vías de neurotransmisores, que previamente se habían asociado con enfermedades mentales (Mill et al., 2008). Estos trastornos son complejos y suelen comenzar a una edad temprana y causan discapacidad de por vida. A menudo, los limitados beneficios del tratamiento hacen de estas enfermedades algunos de los trastornos más gravosos para los individuos, las familias y la sociedad. Se ha hecho evidente que los esfuerzos para identificar las causas primarias de trastornos psiquiátricos complejos pueden beneficiarse significativamente de estudios que vinculan los efectos ambientales con los cambios observados dentro de las células individuales.
Los eventos epigenéticos que alteran la estructura de la cromatina para regular los programas de expresión génica se han asociado con el comportamiento relacionado con la depresión y la acción de medicamentos antidepresivos, con evidencia creciente de mecanismos similares que ocurren en cerebros post-mortem de individuos deprimidos. En ratones, la evitación social resultó en una disminución de la expresión de genes del hipocampo importantes en la mediación de las respuestas depresivas (Tsankova et al., 2006). De manera similar, se encontró que el estrés crónico por derrota social disminuye la expresión de genes implicados en el procesamiento normal de las emociones (Lutter et al., 2008). De acuerdo con estos hallazgos, los niveles de marcadores de histonas de expresión génica incrementada se regularon negativamente en muestras de cerebro post mortem humano de individuos con antecedentes de depresión clínica (Covington et al., 2009).
La administración de antidepresivos incrementó los marcadores de histonas de expresión génica incrementada e invirtió la represión génica inducida por el estrés por derrota (Lee, Wynder, Schmidt, McCafferty, & Shiekhattar, 2006; Tsankova et al., 2006; Wilkinson et al., 2009). Estos resultados brindan apoyo para el uso de inhibidores de HDAC contra la depresión. En consecuencia, se ha encontrado que varios inhibidores de HDAC ejercen efectos antidepresivos modificando cada uno de los distintos objetivos celulares (Cassel et al., 2006; Schroeder, Lin, Crusio, & Akbarian, 2007).
También hay evidencia creciente de que la expresión génica aberrante resultante de una regulación epigenética alterada se asocia con la fisiopatología del suicidio (McGowan et al., 2008; Poulter et al., 2008). Por lo tanto, resulta tentador especular que existe una capacidad reducida de expresión génica determinada epigenéticamente, que se requiere para el aprendizaje y la memoria, en los cerebros de las víctimas de suicidio.
Estrategia epigenética para comprender las interacciones genes-ambiente

Figura 4.17: Aunque hay alguna evidencia de que una crianza disfuncional puede aumentar la probabilidad de esquizofrenia (una enfermedad epigenéticamente heredada), algunas personas que tienen tanto la predisposición como el ambiente estresante nunca desarrollan la enfermedad mental.
Si bien los mecanismos celulares y moleculares que influyen en la salud física y mental han sido durante mucho tiempo un foco central de la neurociencia, solo en los últimos años se ha centrado la atención en los mecanismos epigenéticos detrás de los cambios dinámicos en la expresión génica responsables de la función cognitiva normal y aumento del riesgo para enfermedades mentales. Los vínculos entre el ambiente temprano y las modificaciones epigenéticas sugieren un mecanismo subyacente a las interacciones gene-ambiente. La adversidad ambiental temprana por sí sola no es una causa suficiente de enfermedad mental, porque muchos individuos con antecedentes de maltrato infantil grave o trauma permanecen saludables. Cada vez es más evidente que las diferencias heredadas en los segmentos de genes específicos pueden moderar los efectos de la adversidad y determinar quién es sensible y quién es resiliente a través de una interacción gene-ambiente. Genes como el receptor de glucocorticoides parecen moderar los efectos de la adversidad infantil sobre la enfermedad mental. Sorprendentemente, se han identificado modificaciones epigenéticas del ADN que pueden ser la base de los efectos duraderos del medio ambiente sobre las funciones biológicas. Esta nueva investigación epigenética apunta a una nueva estrategia para comprender las interacciones genes-ambiente.
La próxima década de investigación mostrará si este potencial puede ser explotado en el desarrollo de nuevas opciones terapéuticas que puedan alterar las huellas que el ambiente temprano deja en el genoma. Sin embargo, como se discute en este módulo, el epigenoma no es estático y puede ser moldeado por señales de desarrollo, perturbaciones ambientales y estados de enfermedad, los cuales presentan un desafío experimental en la búsqueda de factores de riesgo epigenéticos en trastornos psicológicos (Rakyan, Down, Balding, & Beck, 2011). El tamaño de la muestra y el ensayo epigenómico requerido depende del número de tejidos afectados, así como del tipo y distribución de modificaciones epigenéticas. La combinación de estudios de mapas de asociación genética con estudios de desarrollo de todo el epigenoma puede ayudar a identificar nuevos mecanismos moleculares para explicar las características de la herencia de los rasgos de personalidad y transformar nuestra comprensión de las bases biológicas de la psicología. Es importante destacar que estos estudios epigenéticos pueden conducir a la identificación de nuevas dianas terapéuticas y permitir el desarrollo de estrategias mejoradas para el diagnóstico precoz, la prevención y el mejor tratamiento de los trastornos psicológicos y conductuales.
Recursos Externos
Referencia: El proyecto “Encyclopedia of DNA Elements” (ENCODE) http://encodeproject.org/ENCODE/
Referencia: HILOS — Una nueva forma de explorar el Proyecto ENCODE http://www.nature.com/encode/#/threads
Web: Explore, vea y descargue mapas genómicos de modificaciones de ADN e histonas del Portal de Epigenómica del NCBI http://www.ncbi.nlm.nih.gov/epigenomics
Web: NOVA ScienceNow — Introducción a la Epigenética http://www.pbs.org/wgbh/nova/genes
Web: El Centro de Aprendizaje de Ciencias Genéticas de la Universidad de Utah http://learn.genetics.utah.edu/content/epigenetics/
Preguntas de Discusión
- Describir el estado físico del genoma cuando los genes están activos e inactivos.
- A menudo, las características físicas de los gemelos genéticamente idénticos se vuelven cada vez más diferentes a medida que envejecen, incluso a nivel molecular. Explique por qué esto es así (use los términos “ambiente” y “epigenoma”).
- Nombra 3—4 factores ambientales que influyen en el epigenoma y describen sus efectos.
- El ejemplo de crianza de ratas nos muestra cómo el comportamiento de los padres puede dar forma al comportamiento de la descendencia a nivel bioquímico. Discutir cómo esto se relaciona con los humanos e incluye las implicaciones personales y sociales.
- Explicar cómo los alimentos que comemos afectan la expresión génica.
- ¿Las dietas de los padres pueden afectar el epigenoma de sus crías?
- ¿Por qué la evidencia convergente es el mejor tipo de evidencia en el estudio de la función cerebral?
- Si te interesaba si un área determinada del cerebro estaba involucrada en un comportamiento específico, ¿qué métodos de neurociencia podrías usar?
- Si te interesaba el momento preciso en el que ocurrió un proceso cerebral en particular, ¿qué métodos de neurociencia podrías usar?
Atribuciones de imagen
Figura 4.10: CC0 Dominio Público, https://goo.gl/m25gce
Figura 4.11: M., https://goo.gl/VU5iJv, CC BY-NC-SA 2.0, https://goo.gl/Toc0ZF
Figura 4.12: Zephyris, https://goo.gl/gGrSQd, CC BY-SA 3.0, https://goo.gl/kB1Ogc
Figura 4.13: La Alianza Cinta Blanca, https://goo.gl/KgY6N5, CC BY-NC-SA 2.0, https://goo.gl/Toc0ZF
Figura 4.14: Departamento de Agricultura de Estados Unidos, https://goo.gl/tpyYzA, CC BY 2.0, https://goo.gl/BRvSA7
Figura 4.15: Gerry Shaw, https://goo.gl/JBqlY7, CC BY-SA 3.0, https://goo.gl/eLCn2O
Figura 4.16: Zephyris, https://goo.gl/6DBQ1g, CC BY-SA 3.0, https://goo.gl/eLCn2O
Figura 4.17: Steve White, CC0 Dominio Público, https://goo.gl/m25gce
Referencias
Adams, R. L., McKay, E. L., Craig, L. M., & Burdon, R. H. (1979). ADN metilasa de ratón: metilación de ADN nativo. Biochimica et Biophysica Acta, 561 (2), 345—357.
Alarcón, J. M., Malleret, G., Touzani, K., Vronskaya, S., Ishii, S., Kandel, E. R., & Barco, A. (2004). La acetilación de la cromatina, la memoria y la LTP están deterioradas en ratones CBP+/-: un modelo para el déficit cognitivo en el síndrome de Rubinstein-Taybi y su mejoría. Neurona, 42 (6), 947—959. doi: 10.1016/j.neuron.2004.05.021, S0896627304003022 [pii]
Amir, R. E., Van den Veyver, I. B., Wan, M., Tran, C. Q., Francke, U., & Zoghbi, H. Y. (1999). El síndrome de Rett es causado por mutaciones en MECP2 ligada al X, que codifica la proteína de unión a metil-CPG Nature Genetics, 23 (2), 185—188.
Bateson, P. (2001). Experiencia fetal y buen diseño adulto. Revista Internacional de Epidemiología, 30 (5), 928—934.
Bradshaw, A.D. (1965). Importancia evolutiva de la plasticidad fenotípica en plantas. Avances en Genética, 13, 115—155.
Caldji, C., Tannenbaum, B., Sharma, S., Francis, D., Plotsky, P. M., & Meaney, M. J. (1998). El cuidado materno durante la infancia regula el desarrollo de sistemas neuronales mediando la expresión del miedo en la rata. Actas de la Academia Nacional de Ciencias U S A, 95 (9), 5335—5340.
Cassel, S., Carouge, D., Gensburger, C., Anglard, P., Burgun, C., Dietrich, J. B.,. Zwiller, J. (2006). Fluoxetina y cocaína inducen los factores epigenéticos MeCP2 y MBD1 en cerebro de rata adulta. Farmacología Molecular, 70 (2), 487—492. doi: 10.1124/mol.106.022301
Chen, W. G., Chang, Q., Lin, Y., Meissner, A., Oeste, A. E., Griffith, E. C.,. Greenberg, M. E. (2003). La desrepresión de la transcripción del BDNF implica la fosforilación de MeCP2 dependiente de calcio. Ciencia, 302 (5646), 885—889.
Covington, H. E., 3rd, Maze, I., LaPlant, Q. C., Vialou, V. F., Ohnishi, Y. N., Berton, O.,. Nestler, E. J. (2009). Acciones antidepresivas de los inhibidores de la histona desacetilasa. Revista de Neurociencia, 29 (37), 11451—11460. doi: 10.1523/JNEUROSCI.1758-09.2009
Davie, J. R., & Chadee, D. N. (1998). Regulación y parámetros regulatorios de las modificaciones de histonas. *Revista de Bioquímica Celular Supl, 30—31 *, 203—213.
Day, J. J., & Sweatt, J. D. (2011). Mecanismos epigenéticos en la cognición. Neurona, 70 (5), 813—829. doi: 10.1016/j.neuron.2011.05.019
Dick, D. M., Riley, B., & Kendler, K. S. (2010). Naturaleza y crianza en la genética neuropsiquiátrica: ¿dónde nos encontramos? Diálogos en Neurociencia Clínica, 12 (1), 7—23.
Dolinoy, D. C., Weidman, J. R., & Jirtle, R. L. (2007). Regulación genética epigenética: vinculando el ambiente de desarrollo temprano con la enfermedad del adulto. Toxicología reproductiva, 23 (3), 297—307. doi: S0890-6238 (06) 00197-3 [pii], 10.1016/j.reprotox.2006.08.012
Feng, J., Chang, H., Li, E., & Fan, G. (2005). Expresión dinámica de ADN metiltransferasas de novo Dnmt3a y Dnmt3b en el sistema nervioso central. Revista de Investigación en Neurociencia, 79 (6), 734—746. doi: 10.1002/jnr.20404
Feng, J., Zhou, Y., Campbell, S. L., Le, T., Li, E., Sweatt, J. D.,. Fan, G. (2010). Dnmt1 y Dnmt3a mantienen la metilación del ADN y regulan la función sináptica en neuronas del prosencéfalo adultas. Neurociencia de la naturaleza, 13 (4), 423—430. doi: 10.1038/nn.2514
Francis, D., Diorio, J., Liu, D., & Meaney, M. J. (1999). Transmisión no genómica a través de generaciones de comportamiento materno y respuestas al estrés en la rata. Ciencia, 286 (5442), 1155—1158.
Gershon, E. S., Alliey-Rodríguez, N., & Liu, C. (2011). Después de GWAS: búsqueda de riesgo genético de esquizofrenia y trastorno bipolar. Revista Americana de Psiquiatría, 168 (3), 253—256. doi: 10.1176/appi.ajp.2010.10091340
Goll, M. G., & Bestor, T. H. (2005). Metiltransferasas de citosina eucariotas. Revisión Anual de Bioquímica, 74, 481—514. doi: 10.1146/annurev.biochem.74.010904.153721
Goto, K., Numata, M., Komura, J. I., Ono, T., Bestor, T. H., & Kondo, H. (1994). Expresión del gen de ADN metiltransferasa en neuronas maduras e inmaduras así como células proliferantes en ratones. Diferenciación, 56 (1—2), 39—44.
Gregg, C., Zhang, J., Weissbourd, B., Luo, S., Schroth, G. P., Haig, D., & Dulac, C. (2010). Análisis de alta resolución de la expresión alélica de origen parental en el cerebro de ratón. Ciencia, 329 (5992), 643—648. doi: 10.1126/ciencia.1190830
Guan, J. S., Haggarty, S. J., Giacometti, E., Dannenberg, J. H., Joseph, N., Gao, J.,. Tsai, L. H. (2009). HDAC2 regula negativamente la formación de memoria y la plasticidad sináptica. Naturaleza, 459 (7243), 55-60. doi: 10.1038/naturaleza07925
Guan, Z., Giustetto, M., Lomvardas, S., Kim, J. H., Miniaci, M. C., Schwartz, J. H.,. Kandel, E. R. (2002). La integración de la plasticidad sináptica relacionada con la memoria a largo plazo implica la regulación bidireccional de la expresión génica y la estructura de la cromatina. Celda, 111 (4), 483—493.
Guo, J. U., Ma, D. K., Mo, H., Ball, M. P., Jang, M. H., Bonaguidi, M. A.,. Canción, H. (2011). La actividad neuronal modifica el paisaje de metilación del ADN en el cerebro adulto. Neurociencia de la naturaleza, 14 (10), 1345—1351. doi: 10.1038/nn.2900
Heijmans, B. T., Tobi, E. W., Stein, A. D., Putter, H., Blauw, G. J., Susser, E. S.,. Lumey, L. H. (2008). Diferencias epigenéticas persistentes asociadas a la exposición prenatal a la hambruna en humanos. Actas de la Academia Nacional de Ciencias U S A, 105 (44), 17046—17049. doi: 0806560105 [pii] 10.1073/pnas.0806560105
Hong, L., Schroth, G. P., Matthews, H. R., Yau, P., & Bradbury, E. M. (1993). Estudios de las propiedades de unión al ADN del extremo amino de la histona H4. Los estudios de desnaturalización térmica revelan que la acetilación reduce notablemente la constante de unión de la “cola” H4 al ADN. Revista de Química Biológica, 268 (1), 305—314.
Jenuwein, T., & Allis, C. D. (2001). Traducir el código de histonas. Ciencia, 293 (5532), 1074—1080. doi: 10.1126/Ciencia.1063127293/5532/1074 [pii]
Jiang, Y. H., Bressler, J., & Beaudet, A. L. (2004). Epigenética y enfermedad humana. Revisión Anual de Genómica y Genética Humana, 5, 479—510. doi: 10.1146/annurev.genom.5.061903.180014
Josselyn, S. A. (2005). ¿Qué es lo correcto con mi modelo de ratón? Nuevos conocimientos sobre las bases moleculares y celulares de la cognición a partir de modelos de ratón del síndrome de Rubinstein-Taybi. Aprendizaje y memoria, 12 (2), 80—83. doi: 12/2/80 [pii] 10.1101/lm.93505
Kadonaga, J. T. (1998). Transcripción eucariota: una red entrelazada de factores de transcripción y máquinas modificadoras de cromatina. Celda, 92 (3), 307—313.
Kalkhoven, E., Roelfsema, J. H., Teunissen, H., den Boer, A., Ariyurek, Y., Zantema, A.,. Peters, D. J. (2003). Pérdida de la actividad de la CBP acetiltransferasa por mutaciones en los dedos PHD en el síndrome de Rubinstein-Taybi. Genética Molecular Humana, 12 (4), 441—450.
Korzus, E., Rosenfeld, M. G., & Mayford, M. (2004). La actividad histona acetiltransferasa de CBP es un componente crítico de la consolidación de la memoria. Neurona, 42 (6), 961—972. doi: 10.1016/j.neuron.2004.06.002S0896627304003526 [pii]
Kuo, M. H., & Allis, C. D. (1998). Papel de las histonas acetiltransferasas y desacetilasas en la regulación génica. Bioensayos, 20 (8), 615—626. doi: 10.1002/ (SICI) 1521—1878 (199808) 20:8 <615::AID-BIES4>3.0.CO; 2-H [pii] 10.1002/ (SICI) 1521-1878 (199808) 20:8 <615::AID-BIES4>3.0.CO; 2-H
Derecho, J. A., & Jacobsen, S. E. (2010). Establecer, mantener y modificar patrones de metilación del ADN en plantas y animales. Nature Opiniones Genética, 11 (3), 204—220. doi: nrg2719 [pii] 10.1038/nrg2719
Lee, M. G., Wynder, C., Schmidt, D. M., McCafferty, D. G., & Shiekhattar, R. (2006). La desmetilación de histona H3 lisina 4 es un objetivo de los medicamentos antidepresivos no selectivos. Química y biología, 13 (6), 563—567. doi: 10.1016/j.chembiol.2006.05.004
Levenson, J. M., O'Riordan, K. J., Brown, K. D., Trinh, M. A., Molfese, D. L., & Sweatt, J. D. (2004). Regulación de la acetilación de histonas durante la formación de memoria en el hipocampo. Revista de Química Biológica, 279 (39), 40545—40559.
Li, H., Zhong, X., Chau, K. F., Williams, E. C., & Chang, Q. (2011). La pérdida de actividad inducida por la fosforilación de MeCP2 mejora la sinaptogénesis, LTP y memoria espacial. Neurociencia de la naturaleza, 14 (8), 1001—1008. doi: 10.1038/nn.2866
Lillycrop, K. A., Phillips, E. S., Jackson, A. A., Hanson, M. A., & Burdge, G. C. (2005). La restricción de proteínas dietéticas en ratas preñadas induce y la suplementación con ácido fólico impide la modificación epigenética de la expresión génica hepática en la descendencia. Diario de Nutrición, 135 (6), 1382—1386. doi: 135/6/1382 [pii]
Lillycrop, K. A., Slater-Jefferies, J. L., Hanson, M. A., Godfrey, K. M., Jackson, A. A., & Burdge, G. C. (2007). La inducción de una regulación epigenética alterada del receptor hepático de glucocorticoides en las crías de ratas alimentadas con una dieta restringida en proteínas durante el embarazo sugiere que la expresión reducida de metiltransferasa-1 de ADN está involucrada en la metilación alterada del ADN y cambios en las modificaciones de histonas. Revista Británica de Nutrición, 97 (6), 1064—1073. doi: S000711450769196X [pii] 10.1017/S000711450769196X
Liu, D., Diorio, J., Tannenbaum, B., Caldji, C., Francis, D., Freedman, A.,. Meaney, M. J. (1997). Atención materna, receptores glucocorticoides hipocampales y respuestas hipotalámico-pituitario-suprarrenales al estrés [ver comentarios]. Ciencia, 277 (5332), 1659—1662.
Lumey, L. H., & Stein, A. D. (1997). Pesos al nacer de la descendencia después de desnutrición intrauterina materna: una comparación dentro de las sibías Revista Americana de Epidemiología, 146 (10), 810—819.
Lutter, M., Krishnan, V., Russo, S. J., Jung, S., McClung, C. A., & Nestler, E. J. (2008). La señalización de orexina media el efecto antidepresivo de la restricción calórica. Revista de Neurociencia, 28 (12), 3071—3075. doi: 10.1523/JNEUROSCI.5584-07.2008
Martinowich, K., Hattori, D., Wu, H., Fouse, S., Él, F., Hu, Y.,. Dom, Y. E. (2003). Remodelación de cromatina relacionada con la metilación del ADN en la regulación génica del BDNF dependiente Ciencia, 302 (5646), 890—893.
McGowan, P. O., Sasaki, A., D'Alessio, A. C., Dymov, S., Labonte, B., Szyf, M.,. Meaney, M. J. (2009). La regulación epigenética del receptor de glucocorticoides en el cerebro humano se asocia con el abuso infantil. Neurociencia de la naturaleza, 12 (3), 342—348. doi: nn.2270 [pii] 10.1038/nn.2270
McGowan, P. O., Sasaki, A., Huang, T. C., Unterberger, A., Suderman, M., Ernst, C.,. Szyf, M. (2008). Himetilación en todo el promotor del promotor del gen del ARN ribosómico en el cerebro suicida. PLoS ONE, 3 (5), e2085. doi: 10.1371/periodista.pone.0002085
Mill, J., Tang, T., Kaminsky, Z., Khare, T., Yazdanpanah, S., Bouchard, L.,. Petronis, A. (2008). El perfil epigenómico revela cambios en la metilación del ADN asociados con psicosis mayor. Revista Americana de Genética Humana, 82 (3), 696—711. doi: 10.1016/j.ajhg.2008.01.008
Miller, C. A., Gavin, C. F., Blanco, J. A., Parrish, R. R., Honasoge, A., Yancey, C. R.,. Sweatt, J. D. (2010). La metilación cortical del ADN mantiene la memoria remota. Neurociencia de la naturaleza, 13 (6), 664—666. doi: 10.1038/nn.2560
Myers, M. M., Brunelli, S. A., Shair, H. N., Escudero, J. M., & Hofer, M. A. (1989). Relaciones entre el comportamiento materno de las presas SHR y WKY y la presión arterial adulta de crías F1 de crianza cruzada. Psicobiología del desarrollo, 22 (1), 55—67.
Oberlander, T. F., Weinberg, J., Papsdorf, M., Grunau, R., Misri, S., & Devlin, A. M. (2008). Exposición prenatal a depresión materna, metilación neonatal del gen receptor de glucocorticoides humanos (NR3C1) y respuestas al estrés por cortisol infantil. Epigenética, 3 (2), 97—106. doi: 6034 [pii]
Ooi, S. K., O'Donnell, A. H., & Bestor, T. H. (2009). Metilación de citosina en mamíferos de un vistazo. Revista de Ciencia Celular, 122 (Pt 16), 2787—2791. doi: 122/16/2787 [pii] 10.1242/jcs.015123
Pintor, R. C., Roseboom, T. J., & Bleker, O. P. (2005). Exposición prenatal a la hambruna y enfermedad holandesas en la vejez: una visión general. Toxicología reproductiva, 20 (3), 345—352. doi: S0890-6238 (05) 00088-2 [pii] 10.1016/j. Toxicología reproductiva.2005.04.005
Petronis, A. (2010). La epigenética como principio unificador en la etiología de rasgos complejos y enfermedades. Naturaleza, 465 (7299), 721—727. doi: 10.1038/naturaleza09230
Poulter, M. O., Du, L., Tejedor, I. C., Palkovits, M., Faludi, G., Merali, Z.,. Anisman, H. (2008). Hipermetilación promotora del receptor GABAA en cerebro suicida: implicaciones para la implicación de procesos epigenéticos. Psiquiatría Biológica, 64 (8), 645—652. doi: 10.1016/j.biopsych.2008.05.028
Rakyan, V. K., Down, T. A., Balding, D. J., & Beck, S. (2011). Estudios de asociación epigenómica para enfermedades humanas comunes. Naturaleza Opiniones Genética, 12 (8), 529—541. doi: 10.1038/nrg3000
Razin, A. (1998). Metilación CpG, estructura de cromatina y silenciamiento génico: una conexión de tres vías. Organización Europea de Biología Molecular, 17 (17), 4905—4908.
Schaefer, A., Sampath, S. C., Intrator, A., Min, A., Gertler, T. S., Surmeier, D. J.,. Greengard, P. (2009). Control de cognición y comportamiento adaptativo por el complejo supresor epigenético GLP/G9a. Neurona, 64 (5), 678—691. doi: 10.1016/j.neuron.2009.11.019
Schroeder, F. A., Lin, C. L., Crusio, W. E., & Akbarian, S. (2007). Efectos antidepresivos del inhibidor de histona desacetilasa, butirato de sodio, en el ratón. Psiquiatría Biológica, 62 (1), 55-64. doi: 10.1016/j.biopsych.2006.06.036
Sealy, L., & Chalkley, R. (1978). El ADN asociado con histona hiperacetilada es preferentemente digerido por DNasa I. Nucleic Acids Research, 5 (6), 1863—1876.
Shahbazian, M., Joven, J., Yuva-Paylor, L., Spencer, C., Antalffy, B., Noebels, J.,. Zoghbi, H. (2002). Los ratones con MeCP2 truncado recapitulan muchas características del síndrome de Rett y muestran hiperacetilación de la histona H3. Neurona, 35 (2), 243—254.
Skene, P. J., Illingworth, R. S., Webb, S., Kerr, A. R., James, K. D., Turner, D. J.,. Bird, A. P. (2010). MeCP2 neuronal se expresa a niveles cercanos a histona-octámero y altera globalmente el estado de la cromatina. Celular Molecular, 37 (4), 457—468. doi: 10.1016/j.molcel.2010.01.030
Stanner, S. A., Bulmer, K., Andrés, C., Lantseva, O. E., Borodina, V., Poteen, V. V., & Yudkin, J. S. (1997). ¿La desnutrición en el útero determina la diabetes y la enfermedad coronaria en la edad adulta? Resultados del estudio de asedio de Leningrado, un estudio transversal. British Medical Journal, 315 (7119), 1342—1348.
Stern, J. M. (1997). Cultivación inducida por descendencia: paralelismos animal-humano. Psicobiolgia del Desarrollo, 31 (1), 19—37.
Sutter, D., Doerfler, W., 1980. La metilación de secuencias de ADN de adenovirus tipo 12 integradas en células transformadas está inversamente correlacionada con la expresión génica viral. Actas de la Academia Nacional de Ciencias U S A. 77, 253—256.
Suzuki, M. M., & Bird, A. (2008). Paisajes de metilación del ADN: percepciones provocativas desde la epigenómica. Nature Opiniones Genética, 9 (6), 465—476. doi: nrg2341 [pii] 10.1038/nrg2341
Tsankova, N. M., Berton, O., Renthal, W., Kumar, A., Neve, R. L., & Nestler, E. J. (2006). Regulación sostenida de la cromatina hipocampal en un modelo de ratón de depresión y acción antidepresiva. Naturaleza Neurociencia. 9 (4): 519—525. doi:10.1038/nn1659
Turner, J. D., Pelascini, L. P., Macedo, J. A., & Muller, C. P. (2008). Los patrones de metilación altamente individuales de promotores de receptores de glucocorticoides alternativos sugieren mecanismos reguladores epigenéticos individualizados. Investigación de ácidos nucleicos, 36 (22), 7207—7218. doi: gkn897 [pii] 10.1093/nar/gkn897
Vardimon, L., Kressmann, A., Cedar, H., Maechler, M., Doerfler, W., 1982. La expresión de un gen de adenovirus clonado es inhibida por metilación in vitro. Actas de la Academia Nacional de Ciencias U S A. 79, 1073-1077.
Waddington, C. H. (1942). Epigenotipo. Endeavour (1), 18—21.
Wade, P. A., Puss, D., & Wolffe, A. P. (1997). Acetilación de histonas: cromatina en acción. Tendencias en Ciencias Bioquímicas, 22 (4), 128—132. doi: S0968000497010165 [pii]
Wang, J., Tejedor, I. C., Gauthier-Fisher, A., Wang, H., Él, L., Yeomans, J.,. Miller, F. D. (2010). La actividad histona acetiltransferasa de CBP regula la diferenciación neuronal embrionaria en el cerebro normal y con síndrome de Rubinstein-Taybi. Célula del Desarrollo, 18 (1), 114—125. doi: 10.1016/j.devcel.2009.10.023
Tejedor, I. C., Cervoni, N., Champán, F. A., D'Alessio, A. C., Sharma, S., Seckl, J. R.,. Meaney, M. J. (2004). Programación epigenética por comportamiento materno. Neurociencia de la naturaleza, 7 (8), 847—854. doi: 10.1038/nn1276
Weaver, I. C., Champagne, F. A., Brown, S. E., Dymov, S., Sharma, S., Meaney, M. J., & Szyf, M. (2005). Reversión de la programación materna de las respuestas al estrés en crías adultas mediante la suplementación con metilo: alterando el marcado epigenético más adelante en la vida. Revista de Neurociencia, 25 (47), 11045—11054. doi: 10.1523/JNEUROSCI.3652-05.2005
Weaver, I. C., Meaney, M. J., & Szyf, M. (2006). Efectos del cuidado materno sobre el transcriptoma hipocampal y comportamientos mediados por ansiedad en la descendencia que son reversibles en la edad adulta. Actas de la Academia Nacional de Ciencias U S A, 103 (9), 3480—3485. doi: 10.1073/pnas.0507526103
Wells, J. C. (2003). La hipótesis del fenotipo ahorrativo: ¿descendencia ahorrativa o madre ahorrativa? Revista de Biología Teórica, 221 (1), 143—161.
Wilkinson, M. B., Xiao, G., Kumar, A., LaPlant, Q., Renthal, W., Sikder, D.,. Nestler, E. J. (2009). El tratamiento con imipramina y la resiliencia presentan una regulación similar de la cromatina en el núcleo accumbens de ratón en modelos de depresión. Revista de Neurociencia, 29 (24), 7820—7832. doi: 10.1523/JNEUROSCI.0932-09.2009
Wolffe, A. P., & Matzke, M. A. (1999). Epigenética: regulación a través de la represión. Ciencia, 286 (5439), 481—486.
Colaboradores y Atribuciones
- Introducción a la Psicología por Jorden A. Cummings & Lee Sanders está bajo una Licencia Creative Commons Reconocimiento-NoComercial-CompartirIgual 4.0 Internacional, excepto cuando se indique lo contrario.
- Refiérase a Atribuciones del Capítulo Fuente para obtener más detalles


