2.3: Ósmosis
- Page ID
- 108829
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
¿Peces de agua salada vs. peces de agua dulce?
Las células de peces, como todas las células, tienen membranas semipermeables. Eventualmente, la concentración de “cosas” a cada lado de ellas se igualará. Un pez que vive en agua salada tendrá agua algo salada dentro de sí mismo. Póngalo en el agua dulce, y el agua dulce, por ósmosis, entrará al pez, haciendo que sus células se hinchen, y los peces morirán. ¿Qué pasará con un pez de agua dulce en el océano?
Osmosis
Imagina que tienes una taza que tiene 100ml de agua, y le agregas 15g de azúcar de mesa al agua. El azúcar se disuelve y la mezcla que ahora está en la taza se compone de un soluto (el azúcar) que se disuelve en el disolvente (el agua). La mezcla de un soluto en un disolvente se llama solución.
Imagina ahora que tienes una segunda taza con 100ml de agua, y agregas 45 gramos de azúcar de mesa al agua. Al igual que la primera taza, el azúcar es el soluto, y el agua es el solvente. Pero ahora tienes dos mezclas de diferentes concentraciones de soluto. Al comparar dos soluciones de concentración desigual de soluto, la solución con mayor concentración de soluto es hipertónica y la solución con menor concentración de soluto es hipotónica. Las soluciones de igual concentración de soluto son isotónicas. La primera solución de azúcar es hipotónica a la segunda solución. La segunda solución de azúcar es hipertónica a la primera.
Ahora agrega las dos soluciones a un vaso de precipitados que ha sido dividido por una membrana selectivamente permeable, con poros que son demasiado pequeños para que pasen las moléculas de azúcar, pero que son lo suficientemente grandes para que pasen las moléculas de agua. La solución hipertónica está en un lado de la membrana y la solución hipotónica en el otro. La solución hipertónica tiene una concentración de agua menor que la solución hipotónica, por lo que ahora existe un gradiente de concentración de agua a través de la membrana. Las moléculas de agua se moverán del lado de mayor concentración de agua al lado de menor concentración hasta que ambas soluciones sean isotónicas. En este punto, se alcanza el equilibrio.
La ósmosis es la difusión de moléculas de agua a través de una membrana selectivamente permeable desde un área de mayor concentración a un área de menor concentración. El agua entra y sale de las células por ósmosis. Si una célula está en una solución hipertónica, la solución tiene una concentración de agua menor que el citosol celular, y el agua se mueve fuera de la célula hasta que ambas soluciones son isotónicas. Las células colocadas en una solución hipotónica tomarán agua a través de su membrana hasta que tanto la solución externa como el citosol sean isotónicos.
Una célula que no tiene una pared celular rígida, como un glóbulo rojo, se hinchará y lisará (estallará) cuando se coloque en una solución hipotónica. Las células con una pared celular se hincharán cuando se colocan en una solución hipotónica, pero una vez que la célula está turgida (firme), la pared celular dura evita que más agua entre en la célula. Cuando se coloca en una solución hipertónica, una célula sin pared celular perderá agua para el ambiente, se marchará y probablemente morirá. En una solución hipertónica, una célula con pared celular también perderá agua. La membrana plasmática se aleja de la pared celular a medida que se margina, un proceso llamado plasmólisis. Las células animales tienden a funcionar mejor en un ambiente isotónico, las células vegetales tienden a hacerlo mejor en un ambiente hipotónico. Esto se demuestra en la siguiente figura.
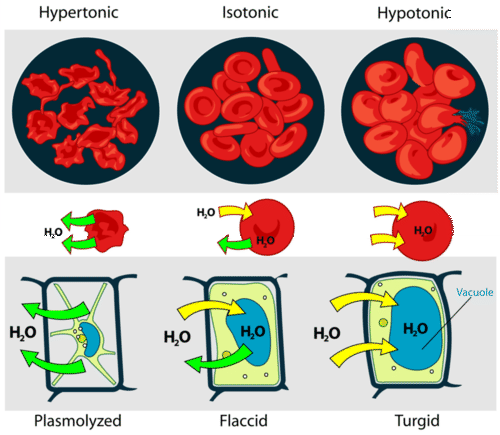 A menos que una célula animal (como el glóbulo rojo en el panel superior) tenga una adaptación que le permita alterar la absorción osmótica de agua, perderá demasiada agua y se marchará en un ambiente hipertónico. Si se coloca en una solución hipotónica, las moléculas de agua entrarán en la célula, haciendo que se hinche y explote. Las células vegetales (panel inferior) se plasmolizan en una solución hipertónica, pero tienden a funcionar mejor en un ambiente hipotónico. El agua se almacena en la vacuola central de la célula vegetal.
A menos que una célula animal (como el glóbulo rojo en el panel superior) tenga una adaptación que le permita alterar la absorción osmótica de agua, perderá demasiada agua y se marchará en un ambiente hipertónico. Si se coloca en una solución hipotónica, las moléculas de agua entrarán en la célula, haciendo que se hinche y explote. Las células vegetales (panel inferior) se plasmolizan en una solución hipertónica, pero tienden a funcionar mejor en un ambiente hipotónico. El agua se almacena en la vacuola central de la célula vegetal. Presión osmótica
Cuando el agua entra en una celda por ósmosis, la presión osmótica puede acumularse dentro de la celda. Si una célula tiene una pared celular, la pared ayuda a mantener el equilibrio hídrico de la célula. La presión osmótica es la principal causa de apoyo en muchas plantas. Cuando una célula vegetal se encuentra en un ambiente hipotónico, la entrada osmótica de agua eleva la presión de turgencia ejercida contra la pared celular hasta que la presión impide que entre más agua en la célula. En este punto la célula vegetal está turgida (ver la Figura a continuación). Los efectos de las presiones osmóticas sobre las células vegetales se muestran en la siguiente figura.
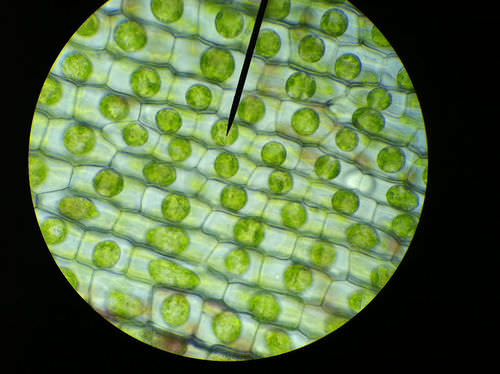 Las vacuolas centrales de las células vegetales en esta imagen están llenas de agua, por lo que las células son turgentes.
Las vacuolas centrales de las células vegetales en esta imagen están llenas de agua, por lo que las células son turgentes. La acción de la ósmosis puede ser muy dañina para los organismos, especialmente aquellos sin paredes celulares. Por ejemplo, si un pez de agua salada (cuyas células son isotónicas con el agua de mar), se coloca en agua dulce, sus células tomarán exceso de agua, lisarán y los peces morirán. Otro ejemplo de un efecto osmótico dañino es el uso de sal de mesa para matar babosas y caracoles.
Controlar la ósmosis
Los organismos que viven en un ambiente hipotónico como el agua dulce, necesitan una forma de evitar que sus células absorban demasiada agua por ósmosis. Una vacuola contráctil es un tipo de vacuola que elimina el exceso de agua de una celda. Los protistas de agua dulce, como el paramecio que se muestra en la Figura siguiente, tienen una vacuola contráctil. La vacuola está rodeada por varios canales, los cuales absorben agua por ósmosis del citoplasma. Después de que los canales se llenan de agua, el agua se bombea a la vacuola. Cuando la vacuola está llena, empuja el agua fuera de la celda a través de un poro.
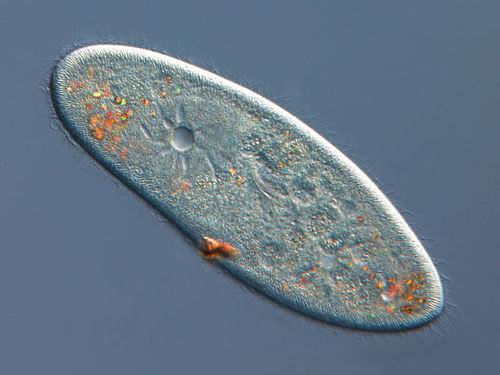 La vacuola contráctil es la estructura estrellada dentro de la parametricia.
La vacuola contráctil es la estructura estrellada dentro de la parametricia. Resumen
- La ósmosis es la difusión del agua.
- Al comparar dos soluciones de concentración desigual de soluto, la solución con mayor concentración de soluto es hipertónica, y la solución con menor concentración es hipotónica. Las soluciones de igual concentración de soluto son isotónicas.
- Una vacuola contráctil es un tipo de vacuola que elimina el exceso de agua de una celda.
Revisar
- ¿Qué es la ósmosis? ¿Qué tipo de transporte es?
- ¿En qué se diferencia la ósmosis de la difusión?
- ¿Qué sucede con los glóbulos rojos cuando se colocan en una solución hipotónica?
- ¿Qué pasará con un pez de agua salada si se coloca en agua dulce?
| Imagen | Referencia | Atribuciones |
 |
[Figura 1] | Crédito: Derechos de autor de la imagen Lebendkulturen.de, 2014; Hana Zavadska, basada en imagen de Mariana Ruiz Villarreal (LadyofHats) (Commons.wikimedia.org/wiki/Fi... embrane-en.svg); Por LadyofHats (lo hice yo mismo basado en [1], [2], [3] y [4].) [Dominio público], vía Wikimedia Commons; OpenStax College Fuente: http://www.shutterstock.com; Fundación CK-12; Commons.wikimedia.org/wiki/Archivo:0307_Osmosis.jpg Licencia: Licencia de Shutterstock; CC BY-NC 3 .0 |
 |
[Figura 2] | Crédito: Mariana Ruiz Villarreal (Usuario:Ladyofhats/Wikimedia Commons); Usuario:Pidalka44/Wikimedia Commons; Hana Zavadska, basada en imagen de Mariana Ruiz Villarreal (LadyofHats) (Commons.wikimedia.org/wiki/Fi... embrane-en.svg) Fuente: Commons.wikimedia.org/wiki/file :osmotic_presure_on_blood_cells_diagram.svg; commons.wikimedia.org/wiki/file:turgor_presión_on_plant_cells_diagram.svg; commons.wikimedia.org/wiki/file:semipermeable_membrane.png; CK-12 Licencia de Fundación: Dominio público; CC BY-NC 3.0 |
 |
[Figura 3] | Crédito: Flickr:FickleandPecosa; Usuario:Pidalka44/Wikimedia Commons; Hana Zavadska, basada en imagen de Mariana Ruiz Villarreal (Ladyofhats) (Commons.wikimedia.org/wiki/Fi... embrane-en.svg) Fuente: http://www.flickr.com/photos/ficklea...ed/7980692858/; Commons.wikimedia.org/wiki/Archivo:Semipermeable_membrana.png; CK-12 Licencia de Fundación: CC BY 2.0; Dominio público; CC BY-NC 3.0 |
 |
[Figura 4] | Crédito: Derechos de autor de la imagen Lebendkulturen.de, 2014; Usuario:Pidalka44/Wikimedia Commons; Hana Zavadska, basada en imagen de Mariana Ruiz Villarreal (LadyofHats) (Commons.wikimedia.org/wiki/Fi... embrane-en.svg) Fuente: http://www.shutterstock.com; Commons.wikimedia.org/wiki/Archivo:Semipermeable_membrane.png; CK-12 Foundation Licencia: Licencia de Shutterstock; Dominio público; CC BY-NC 3.0 |

