2.1: ¿Qué es la termodinámica?
- Page ID
- 126559
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
La termodinámica es el estudio de las relaciones entre las variables de estado que describen un sistema termodinámico, y de las transformaciones del calor en trabajo y viceversa.
Sistemas termodinámicos y variables de estado
Los sistemas termodinámicos contienen un gran número de partículas constituyentes, y son descritos por un conjunto de variables de estado que describen las propiedades del sistema en un sentido promedio. Las variables de estado se clasifican como extensas o intensivas.
Variables extensas, como volumen\(V\), número de partículas\(N\), energía interna total\(E\), magnetización\(M\), escala linealmente con el tamaño del sistema, como la primera potencia del volumen del sistema. Si tomamos dos sistemas termodinámicos idénticos, los colocamos uno al lado del otro, y eliminamos cualquier barrera entre ellos, entonces todas las variables extensas duplicarán su tamaño.
Las variables intensivas, como la presión\(p\), la temperatura\(T\), el potencial químico\(\mu\), el campo eléctrico\(\BE\), son independientes del tamaño del sistema, escalando como la potencia cero del volumen. Son los mismos en todo el sistema, si ese sistema se encuentra en un adecuado estado de equilibrio. La relación de cualquiera de dos variables extensas es una variable intensiva. Por ejemplo, escribimos\(n=N/V\) para la densidad numérica, que escala como\(V^0\). Las variables intensivas también pueden ser no homogéneas. Por ejemplo,\(n(\Br)\) es la densidad numérica en la posición\(\Br\), y se define como el límite\(\RDelta N/\RDelta V\) del número de partículas\(\RDelta N\) dentro de un volumen\(\RDelta V\) que contiene el punto\(\Br\), en el límite\(V \gg \RDelta V \gg V/N\).
Clásicamente, el movimiento completo de un sistema de partículas\(N\)\(6N\) puntuales requiere variables para describirlo completamente (\(3N\)posiciones y\(3N\) velocidades o momentos, en tres dimensiones espaciales) 1. Dado que los constituyentes son muy pequeños,\(N\) suele ser muy grande. Un sólido o líquido típico, por ejemplo, tiene una densidad de masa del orden de\(\vrh\sim 1\,\Rg/{cm}^3\); para gases,\(\vrh\sim 10^{-3}\,\Rg/{cm}^3\). Los átomos constituyentes tienen masas de\(10^0\) a\(10^2\) gramos por mol, donde un mol de\(X\) contiene\(\NA\) de\(X\), y\(\NA=6.0221415\times 10^{23}\) es el número 2 de Avogadro. Así, para sólidos y líquidos esperamos aproximadamente densidades numéricas\(n\) de\(10^{-2} - 10^{0}\,{mol}/{cm}^3\) para sólidos y líquidos, y\(10^{-5} - 10^{-3}\,{mol}/{cm}^3\) para gases. Claramente estamos tratando con números fantásticamente grandes de partículas constituyentes en un sistema termodinámico típico. La base teórica subyacente para la termodinámica, donde utilizamos un pequeño número de variables de estado para describir un sistema, es proporcionada por la teoría microscópica de la mecánica estadística, que estudiaremos en las próximas semanas.
Cantidades intensivas como\(p\),\(T\), y\(n\) en última instancia implican promedios tanto en espacio como en tiempo. Consideremos por ejemplo el caso de un gas encerrado en un contenedor. Podemos medir la presión (relativa a la presión atmosférica) sujetando un resorte a una pared móvil, como se muestra en la Fig. [presión]. A partir del desplazamiento del muelle y el valor de su constante de resorte\(k\) determinamos la fuerza\(F\). Esta fuerza se debe a la diferencia de presiones, entonces\(p=p\ns_0+F/A\). Microscópicamente, el gas consiste en átomos o moléculas constituyentes, que están constantemente experimentando colisiones entre sí y con las paredes del contenedor. Cuando una partícula rebota en una pared, imparte un impulso\(2\nhat (\nhat\cdot\Bp)\), donde\(\Bp\) está el impulso de la partícula y\(\nhat\) es el vector unitario normal a la pared. (Solo las partículas con\(\Bp\cdot\nhat>0\) chocarán contra la pared.) Multiplique esto por el número de partículas que chocan con la pared por unidad de tiempo, y uno encuentra la fuerza neta en la pared; dividiendo por el área da la presión\(p\). Dentro del gas, cada partícula viaja una distancia\(\ell\), llamada trayectoria libre media, antes de sufrir una colisión. Podemos escribir\(\ell={\bar v}\tau\), donde\({\bar v}\) está la velocidad media de las partículas y\(\tau\) es el tiempo libre medio. Cuando estudiemos la teoría cinética de los gases, derivaremos fórmulas para\(\ell\) y\({\bar v}\) (y por lo tanto\(\tau\)). Por ahora es útil citar algunos números para tener una idea de las escalas de distancia y tiempo relevantes. Para el\(\RO\ns_2\) gas a temperatura y presión estándar (\(T=0^\circ\,\)C,\(p=1\,\) atm), la trayectoria libre media es\(\ell\approx 1.1\times 10^{-5}\) cm, la velocidad promedio es\({\bar v}\approx 480\, \Rm/\Rs\), y el tiempo libre medio es\(\tau\approx 2.5\times 10^{-10}\,\) s. Así, las partículas en el gas sufren colisiones a una velocidad\(\tau^{-1}\approx 4.0\times 10^9\,\Rs^{-1}\). Un dispositivo de medición, como nuestro resorte, o un termómetro, realiza efectivamente promedios de tiempo y espacio. Si hay\(N\ns_\Rc\) colisiones con un parche particular de pared durante algún intervalo de tiempo en el que nuestro dispositivo de medición responde, entonces las fluctuaciones relativas de raíz cuadrática media en la presión local serán del orden de\(N_\Rc^{-1/2}\) veces el promedio. Dado que\(N\ns_\Rc\) es un número muy grande, las fluctuaciones son insignificantes.

Si el sistema está en estado estacionario, las variables de estado no cambian con el tiempo. Si además no hay corrientes macroscópicas de energía o número de partículas fluyendo a través del sistema, se dice que el sistema está en equilibrio. Una sucesión continua de estados de equilibrio se conoce como trayectoria termodinámica, que puede representarse como una curva suave en un espacio multidimensional cuyos ejes están etiquetados por variables de estado. Un proceso termodinámico es cualquier cambio o sucesión de cambios que resulta en un cambio de las variables de estado. En un proceso cíclico, los estados inicial y final son los mismos. En un proceso cuasistático, el sistema pasa por una sucesión continua de equilibrios. Un proceso reversible es aquel en el que se pueden revertir las condiciones externas y la trayectoria termodinámica del sistema; es cuasiestático y no disipativo (sin fricción). La lenta expansión de un gas contra una cabeza de pistón, cuya contrafuerza es siempre infinitesimalmente menor que la fuerza\(pA\) ejercida por el gas, es reversible. Para revertir este proceso, simplemente agregamos infinitesimalmente más fuerza\(pA\) y el gas se comprime. Un ejemplo de un proceso cuasistático que no es reversible: arrastrando lentamente un bloque por el piso, o la lenta fuga de aire de una llanta. Los procesos irreversibles, por regla general, son disipativos. Otros procesos especiales incluyen isotérmico (\(dT=0\)), isobárico (\(dp=0\)), isocórico (\(dV=0\)) y adiabático (\(\dbar Q=0\), sin intercambio de calor): Más adelante\[\begin{aligned} \hbox{\sl reversible:}\ &\dbar Q = T\,dS & \hbox{\sl isothermal:}\ dT&=0 \\ \hbox{\sl spontaneous:}\ &\dbar Q < T\,dS & \hbox{\sl isochoric:}\ dV&=0 \\ \hbox{\sl adiabatic:}\ &\dbar Q =0 & \hbox{\sl isobaric:}\ dp&=0\quad.\end{aligned}\] discutiremos la entropía\(S\) y su conexión con la irreversibilidad.

¿Cuántas variables de estado son necesarias para especificar completamente el estado de equilibrio de un sistema termodinámico? Para un sistema de un solo componente, como el agua que está compuesta por una molécula constituyente, la respuesta es tres. Estos se pueden tomar como\(T\),\(p\), y\(V\). Siempre se debe especificar al menos una variable extensa, de lo contrario no podemos determinar el tamaño general del sistema. Para un sistema multicomponente con\(g\) diferentes especies, debemos especificar variables de\(g+2\) estado, que pueden ser\(\{T,p,N\ns_1,\ldots,N\ns_g\}\), donde\(N\ns_a\) está el número de partículas de especies\(a\). Otra posibilidad es el conjunto\((T,p,V, x\ns_1,\ldots,x\ns_{g-1}\}\), donde\(a\) está la concentración de especies\(x\ns_a=N\ns_a/N\). Aquí,\(N=\sum_{a=1}^g N\ns_a\) está el número total de partículas. Tenga en cuenta que\(\sum_{a=1}^g x\ns_a=1\).
Si entonces se sigue que si especificamos más que variables de\(g+2\) estado, debe existir una relación entre ellas. Tales relaciones se conocen como ecuaciones de estado. El ejemplo más famoso es la ley de gas ideal,\[pV=N\kT\ ,\] relacionando las cuatro variables de estado\(T\),\(p\),\(V\), y\(N\). Aquí\(\kB=1.3806503\times 10^{-16}\,{erg}/\RK\) está la constante de Boltzmann. Otro ejemplo es la ecuación de van der Waals,\[\bigg(p+{aN^2\over V^2}\bigg) (V-bN) = N\kT\ ,\] donde\(a\) y\(b\) son constantes que dependen de la molécula que forma el gas. Para un tercer ejemplo, considere un paramagnet,\[{M\over V}={CH\over T}\ ,\] donde\(M\) está la magnetización,\(H\) el campo magnético y\(C\) la constante de Curie.
Cualquier cantidad que, en equilibrio, dependa únicamente de las variables de estado se denomina función de estado. Por ejemplo, la energía interna total\(E\) de un sistema termodinámico es una función de estado, y podemos escribir\(E=E(T,p,V)\). Las funciones de estado también pueden servir como variables de estado, aunque las variables de estado más naturales son las que se pueden medir directamente.
Calor
Una vez pensado como un tipo de fluido, el calor ahora se entiende en términos de la teoría cinética de gases, líquidos y sólidos como una forma de energía almacenada en el movimiento desordenado de las partículas constituyentes. Las unidades de calor son por lo tanto unidades de energía, y es apropiado hablar de energía térmica, que simplemente abreviaremos como calor: 3\[1\,\RJ = 10^7\,{erg} = 6.242\times 10^{18}\,{eV}= 2.390\times 10^{-4}\,{kcal} = 9.478\times 10^{-4}\,{BTU}\ .\] Usaremos el símbolo\(Q\) para denotar la cantidad de energía térmica absorbida por un sistema durante algún proceso termodinámico dado, y\(\dbar Q\) para denotar una cantidad diferencial de energía térmica. El símbolo\(\dbar\) indica un 'diferencial inexacto', sobre el cual tendremos más que decir actualmente. Esto significa que el calor no es una función de estado: no hay 'función de calor'\(Q(T,p,V)\).
Trabajo
En general escribiremos el elemento diferencial del trabajo\(\dbar W\) realizado por el sistema como\[\dbar W=\sum_i F\ns_i\,dX\ns_i\ ,\] donde\(F\ns_i\) está una fuerza generalizada y\(dX\ns_i\) un desplazamiento generalizado 4. Las fuerzas generalizadas y los desplazamientos son en sí mismas variables de estado, y por convención tomaremos las fuerzas generalizadas como intensivas y las generalizadas como extensas. Como ejemplo, en un sistema sencillo de un componente, tenemos\(\dbar W=p\,dV\). De manera más general, escribimos\[\qquad\dbar W =\ \stackrel{-\sum_j y\ns_j \, dX\ns_j}{\overbrace{\big(p\,dV- \BH\cdot d\BM - \BE\cdot d\BP - \sigma\,dA + \ldots \big)}} -\stackrel{\sum_a \mu\ns_a\, dN\ns_a}{\overbrace{\big(\mu\ns_1 \,dN\ns_1 + \mu\ns_2\,d N\ns_2 + \ldots\big) }} \label{dwork}\] Aquí distinguimos entre dos tipos de trabajo. El primero implica cambios en cantidades como volumen, magnetización, polarización eléctrica, área, Las fuerzas conjugadas\(y\ns_i\) aplicadas al sistema son entonces\(-p\), el campo magnético\(\BH\), el campo eléctrico\(\BE\), la tensión superficial\(\sigma\), respectivamente. El segundo tipo de trabajo implica cambios en el número de componentes de una especie determinada. Por ejemplo, se requiere energía para disociar dos átomos de hidrógeno en una\(\RH\ns_2\) molécula. El efecto de tal proceso es\(dN\ns_{\RH\ns_2}=-1\) y\(dN\ns_\RH=+2\).
Al igual que con el calor,\(\dbar W\) es un diferencial inexacto, y el trabajo no\(W\) es una variable de estado, ya que es dependiente de ruta. No hay 'función de trabajo'\(W(T,p,V)\).
Presión y temperatura
Las unidades de presión (\(p\)) son fuerza por unidad de área. La unidad SI es el Pascal (Pa):\(1\,{Pa}=1\,\RN/\Rm^2=1\,{kg}/\Rm\,\Rs^2\). Otras unidades de presión que encontraremos:\[\begin{aligned} 1\,{bar}&\equiv 10^5\,{Pa}\\ 1\,{atm}&\equiv 1.01325\times 10^5\,{Pa}\\ 1\,{torr}&\equiv 133.3\,{Pa}\ .\end{aligned}\]
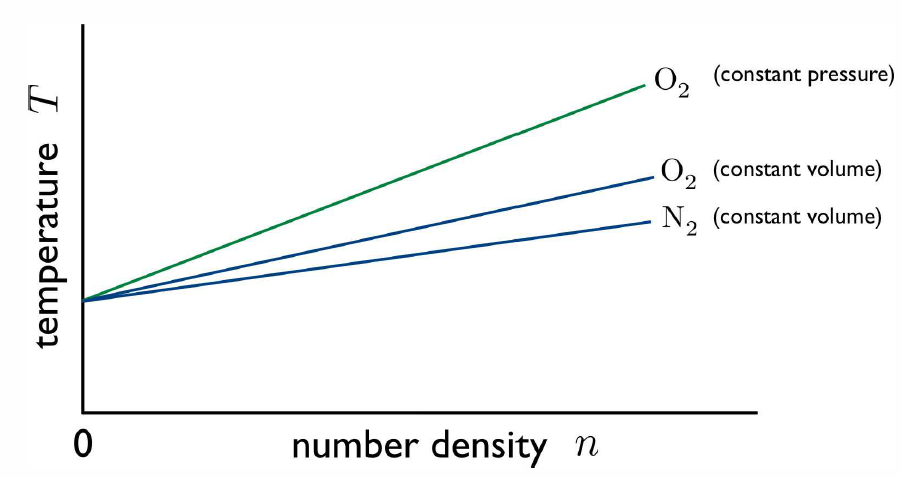
Temperatura (\(T\)) tiene una definición muy precisa desde el punto de vista de la mecánica estadística, como veremos. Muchas propiedades físicas dependen de la temperatura, tales propiedades se denominan propiedades termométricas. Por ejemplo, la resistividad de un metal\(\rho(T,p)\) o la densidad numérica de un gas\(n(T,p)\) son propiedades termométricas, y pueden usarse para definir una escala de temperatura. Considere el dispositivo conocido como el 'termómetro de gas de volumen constante' representado en la Fig. [CVgta], en el que el volumen o presión de un gas puede ser utilizado para medir la temperatura. Se supone que el gas está en equilibrio a cierta presión\(p\)\(V\), volumen y temperatura\(T\). \(\vrh\)Se utiliza un fluido incompresible de densidad para medir la diferencia de presión\(\RDelta p = p-p\ns_0\), donde\(p\ns_0\) esta la presión ambiente en la parte superior del reservorio:\[p-p\ns_0=\vrh g (h\ns_2-h\ns_1)\ ,\] donde\(g\) esta la aceleracion debida a la gravedad. La altura\(h\ns_1\) de la columna izquierda de fluido en el tubo en U proporciona una medida del cambio en el volumen del gas:\[V(h\ns_1)=V(0)-A h\ns_1\ ,\] donde\(A\) está el área de sección transversal (supuesta constante) del brazo izquierdo del tubo en U. El dispositivo puede funcionar en dos modos:
- Modo de presión constante: La altura del depósito se ajusta para que la diferencia de altura\(h\ns_2-h\ns_1\) se mantenga constante. Esto fija la presión\(p\) del gas. El volumen de gas aún varía con la temperatura\(T\), y podemos definir\[{T\over T\ns_{ref}} = {V\over V\ns_{ref}}\ ,\] dónde\(T\ns_{ref}\) y\(V\ns_{ref}\) son la temperatura y el volumen de referencia, respectivamente.
- Modo de volumen constante: La altura del depósito se ajusta para que\(h\ns_1=0\), de ahí que el volumen del gas se mantenga fijo, y la presión varíe con la temperatura. Luego definimos\[{T\over T\ns_{ref}} = {p\over p\ns_{ref}}\ ,\] dónde\(T\ns_{ref}\) y\(p\ns_{ref}\) son la temperatura y presión de referencia, respectivamente.

¿Qué debemos usar para una referencia? Uno podría pensar que una olla de agua hirviendo servirá, pero cualquiera que haya ido a acampar a la montaña sabe que el agua hierve a temperaturas más bajas a gran altitud (menor presión). Este fenómeno se refleja en el diagrama de fases para\(\RH\ns_2\RO\), representado en la Fig. [H2Opd]. Sin embargo, hay dos puntos especiales en el diagrama de fases. Uno es el punto triple, donde coexisten las fases sólida, líquida y vapor (gas). El segundo es el punto crítico, que es el término de la curva que separa el líquido del gas. En el punto crítico, el calor latente de transición entre las fases líquida y gaseosa se desvanece (más sobre esto más adelante). La\(T\ns_\Rt\) temperatura del punto triple es así única y es por definición\(T\ns_\Rt=273.16\,\) K. La presión en el punto triple es\(611.7\,{Pa}=6.056\times 10^{-3}\,{atm}\).

Queda una pregunta: ¿son compatibles los dos modos del termómetro? si hervimos agua en\(p=p\ns_0=1\,\) atm, ¿rinden el mismo valor para\(T\)? Y ¿y si usamos un gas diferente en nuestras mediciones? De hecho, todas estas mediciones serán en general incompatibles, arrojando diferentes resultados para la temperatura\(T\). Sin embargo, en el límite de que utilizamos un gas de muy baja densidad, todos los resultados convergen. Esto se debe a que todos los gases de baja densidad se comportan como gases ideales, y obedecen a la ecuación de estado del gas ideal\(pV=N\kT\).
Temperatura y presión estándar
Es costumbre en las ciencias físicas definir ciertas condiciones estándar con respecto a las cuales se pueda comparar cualquier condición arbitraria. En la termodinámica, existe una noción de temperatura y presión estándar, abreviada STP. Desafortunadamente, existen dos definiciones diferentes de STP actualmente en uso, una de la Unión Internacional de Química Pura y Aplicada (IUPAC) y la otra del Instituto Nacional de Estándares y Tecnología de Estados Unidos (NIST). Los dos estándares son:\[\begin{aligned} {IUPAC}\ &:\ T\ns_0=0^\circ\,\RC=273.15\,\RK\quad\ \ ,\quad p\ns_0=10^5\,{Pa}\\ {NIST}\ &:\ T\ns_0=20^\circ\,\RC=293.15\,\RK\quad,\quad p\ns_0=1\,{atm}=1.01325\times 10^5\,{Pa}\end{aligned}\] Para empeorar las cosas, en el pasado era costumbre definir STP como\(T\ns_0=0^\circ\,\RC\) y\(p\ns_0=1\,\) atm. Usaremos la definición del NIST en este curso. A menos que resbale y use la definición de la IUPAC. Descubrir a lo que me refiero con STP te mantendrá en los dedos de los pies.
El volumen de un mol de gas ideal en STP es entonces\[V={\NA\kB T\ns_0\over p\ns_0}=\begin{cases} 22.711 \> \ell& {(IUPAC)} \\ 24.219 \> \ell & {(NIST)}\ , \end{cases}\] donde\(1\,\ell=10^6\,{cm}^3=10^{-3}\,\Rm^3\) está un litro. Bajo la antigua definición de STP as\(T\ns_0=0^\circ\,\RC\) y\(p\ns_0=1\,\) atm, el volumen de un mol de gas en STP es\(22.414\>\ell\), que es una cifra que recuerdo de mi clase de química de\(10^{th}\) grado con el señor Lawrence.