3.1: Mineralogía de Suelos
- Page ID
- 89506
Jim Warren y Graeme Spiers
Objetivos de aprendizaje
Al concluir este capítulo, los alumnos deberán ser capaces de:
- Identificar fases minerales comunes que se encuentran en el suelo
- Explicar la diferencia entre minerales primarios y secundarios
- Describir la influencia de la glaciación continental en las distribuciones minerales en suelos canadienses
- Describir la relación entre el tamaño de partícula y los minerales del suelo
- Definir la sustitución isomorfa y la base de la capacidad de intercambio catiónico
- Explicar las diferencias en la composición de filosilicatos de suelos entre el este y el oeste de Canadá
INTRODUCCIÓN
La mineralogía del suelo se refiere “a los minerales inorgánicos que se encuentran en la pedosfera y a la profundidad de la meteorización” (Finkl, 1983). Aunque la mineralogía del suelo se basa en gran medida en las disciplinas de mineralogía, geología, química inorgánica y cristalografía, que son disciplinas científicas en sí mismas, no se requiere que el lector tenga muchos conocimientos previos en estas áreas para comprender la información aquí presentada. El enfoque general que se toma aquí se basa en las fracciones texturales del suelo (arena, limo y arcilla) y los componentes minerales contenidos en el mismo.
Importancia de la Fracción Mineral del Suelo
La mayoría de los suelos están compuestos por materiales minerales inorgánicos que comprenden el grueso abrumador de un suelo. Los suelos bien estructurados están compuestos por alrededor de 50% de sólidos de los cuales la mayoría son materiales minerales (Figura 14.1), siendo los suelos orgánicos (> 30% de materia orgánica) la excepción obvia.
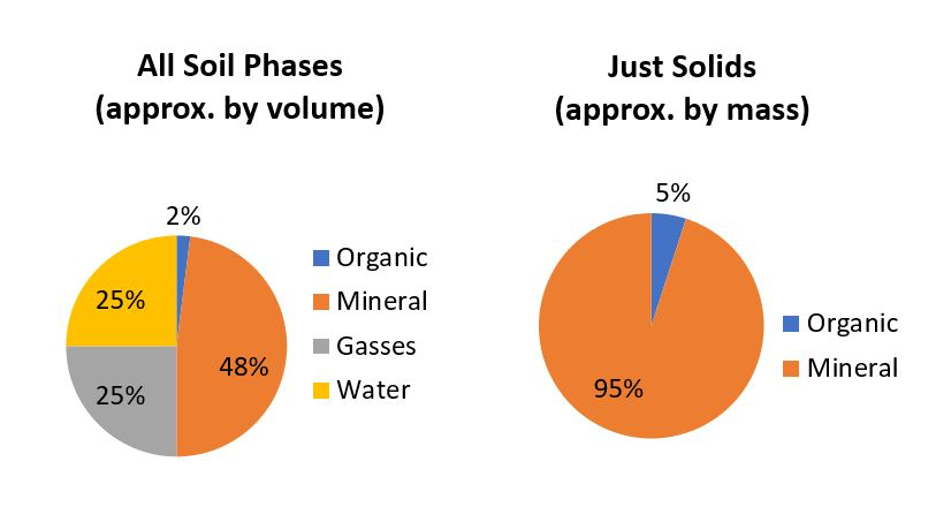
Hay alrededor de 4,500 a 5,000 minerales nombrados identificados en este planeta (MSA, 1997—2020; MSA, 2004-2020; Mindat, 2020), siendo la mayoría raros o encontrados en bolsas aisladas (por ejemplo, depósitos minerales económicos) en lo profundo de la corteza terrestre. Los minerales son cristales inorgánicos de origen natural con un rango definible de composición química. Por ejemplo, con mucho el mineral terrestre más común que se encuentra en los suelos canadienses es α-cuarzo (α-SiO 2); pronunciado “cuarzo alfa” donde alfa se refiere a la forma cristalina. Los fragmentos de roca también se encuentran en el suelo, pero estos difieren de los minerales en que las rocas son “compuestos minerales” formados por mezclas físicas de varios minerales individuales. Por ejemplo, el granito es una roca ígnea que constituye la gran mayoría del Escudo Canadiense. El granito se compone comúnmente de una mezcla de cuatro tipos de minerales: α-cuarzo, feldespatos, anfíboles y micas que, debido a las acciones de molienda y mezcla en los glaciares, también son minerales comunes que se encuentran en nuestros suelos. Los fragmentos de roca solo se encuentran entre las partículas de suelo más grandes (es decir, de tamaño de arena y más grandes) porque a medida que las rocas se descomponen en fragmentos cada vez más pequeños, su descomposición física ocurre típicamente a lo largo de los límites entre los minerales adyacentes, que son los puntos más débiles dentro de las rocas, dejando al individuo minerales discretos como los fragmentos más pequeños.
La mayoría de los minerales que se encuentran en el suelo son de la variedad común, lo que significa que son ubicuos y están presentes en grandes cantidades generalmente con poco o ningún valor económico. Los tipos de minerales en el suelo representan solo un puñado (<100) en comparación con todos los minerales conocidos; sin embargo, su comportamiento en el suelo al interactuar con la solución del suelo (agua del suelo), la atmósfera del suelo y la materia orgánica del suelo tienen una gran influencia en las características químicas y la naturaleza de nuestros suelos.
Los minerales del suelo son la fuente natural de nutrientes de las plantas que se liberan lentamente con el tiempo durante la meteorización química. Todas las plantas requieren un mínimo de 17 elementos nutritivos para completar su ciclo de vida (ver Capítulo 7). Con excepción de C, H y O, plantas que obtienen del aire y del agua, las plantas obtienen los 14 elementos restantes (N, P, K, Ca, S, Mg, Fe, B, Cl, Mn, Zn, Cu, Mo y Ni) principalmente del propio suelo y mediante la adición de fertilizantes, abonos y otras enmiendas (Parikh y James, 2012; Singh y Schulze, 2015). Cuatro elementos adicionales (Na, Si, V y Se) son esenciales para el crecimiento de algunas plantas (Havlin et al., 2005). Los minerales del suelo también contribuyen a la capacidad del suelo para retener nutrientes vegetales a través de los procesos de intercambio de cationes y aniones.
MATERIALES PARENTALES DEL SUELO
Los suelos canadienses son muy jóvenes comparados con los del trópico, que nunca han sido reelaborados por los glaciares (ver Capítulo 2). Canadá contiene más terreno glaciado que cualquier otro país del mundo (Rutter, 2015) y casi todos los suelos canadienses se desarrollan en sedimentos glaciares tardíos de Wisconsin que se depositaron entre aproximadamente 5,000 y 18,000 años atrás. Las únicas excepciones son algunas áreas pequeñas como la región de Cypress Hills en el sur de Alberta y Saskatchewan; áreas no glaciadas del norte del Yukón y pequeñas partes de los Territorios del Noroeste occidentales que no estaban cubiertas de hielo durante la glaciación tardía de Wisconsin (ver Capítulo 2 ). En comparación, los suelos como los del sur de Estados Unidos, Australia, África y Sudamérica tienen varios millones de años. Por lo tanto, los suelos canadienses están compuestos por minerales heredados derivados principalmente del lecho rocoso subyacente y a través del transporte y deposición por el hielo glacial durante el avance del hielo o por las aguas de deshielo glacial y el viento durante la desglaciación.
PRIMARIA vs. MINERALES SECUNDARIOS
La corteza terrestre puede describirse en un contexto muy amplio como compuesta por dos litologías principales: la corteza oceánica compuesta principalmente por rocas máficas y ultramáficas (ricas en Fe y Mg); y la corteza continental que contiene rocas más graníticas, metamórficas y sedimentarias. Dado que los suelos se encuentran en áreas terrestres, se desarrollan principalmente a partir de las rocas de la corteza continental, que en el contexto canadiense son alrededor de 85% rocas ígneas y metamórficas y 15% rocas sedimentarias.
Los minerales derivados directamente de procesos geológicos y geoquímicos en la corteza terrestre se denominan minerales primarios. El examen de las superficies minerales con un microscopio puede revelar algunos cambios debidos a la meteorización biogeoquímica (Spiers, et al., 1989), pero la mayoría de los minerales primarios en los suelos canadienses solo han sido mínimamente alterados por acciones químicas en los últimos 5,000 a 18,000 años.
Una vez traídos a la superficie terrestre, la mayoría de los minerales primarios no son químicamente estables. Aunque persisten en nuestros suelos, dado el tiempo geológico suficiente, eventualmente sucumbirán a los procesos biogeoquímicos del ambiente y liberarán gradualmente sus componentes elementales al ambiente. Los minerales primarios climatan y se disuelven a diferentes velocidades. Generalmente, los minerales que contienen Na y K se disuelven más rápido que los que contienen Ca y Mg, los cuales a su vez se disuelven más rápido que los minerales compuestos por Si, Al y Fe. El hierro es un caso ligeramente especial ya que es el único elemento principal con dos valencias (Fe 2 + y Fe 3 +) con solubilidad que difiere mucho dependiendo del entorno químico. Bajo condiciones reductoras (ausencia de oxígeno), el Fe tiende a ser soluble y estar presente como el ion Fe 2 +. Bajo condiciones oxidantes, el Fe 2+ reacciona con el oxígeno (oxidado) para formar iones Fe 3+ que a su vez forman minerales de oxihidróxido insolubles (efectivamente la composición de la roya). Otros elementos menores (p. ej., Mn, As, U, etc.) se transforman de manera similar. El resultado es que a medida que avanza la intemperie, los suelos se agotan generalmente en Na, K, Ca y Mg, los cuales se lixivian de los suelos mientras se enriquecen en Si, Al y Fe 3+ (ver Figura 14.2). Esto también explica por qué los océanos contienen concentraciones elevadas de sales solubles (Na, K, Cl y SO 4). Los minerales carbonatados (principalmente CaCO 3) se forman o disuelven dependiendo del pH de su solución portante. Se precipitan en condiciones alcalinas y se disuelven en condiciones ácidas. El CO 2 atmosférico reacciona con el agua para producir un ácido débil (H 2 CO 3) que disuelve el carbonato (y otros tipos de rocas). Las aguas subterráneas más profundas tienden a ser alcalinas, favoreciendo así la precipitación de carbonato que se encuentra típicamente más profunda en los perfiles del suelo (horizontes C).
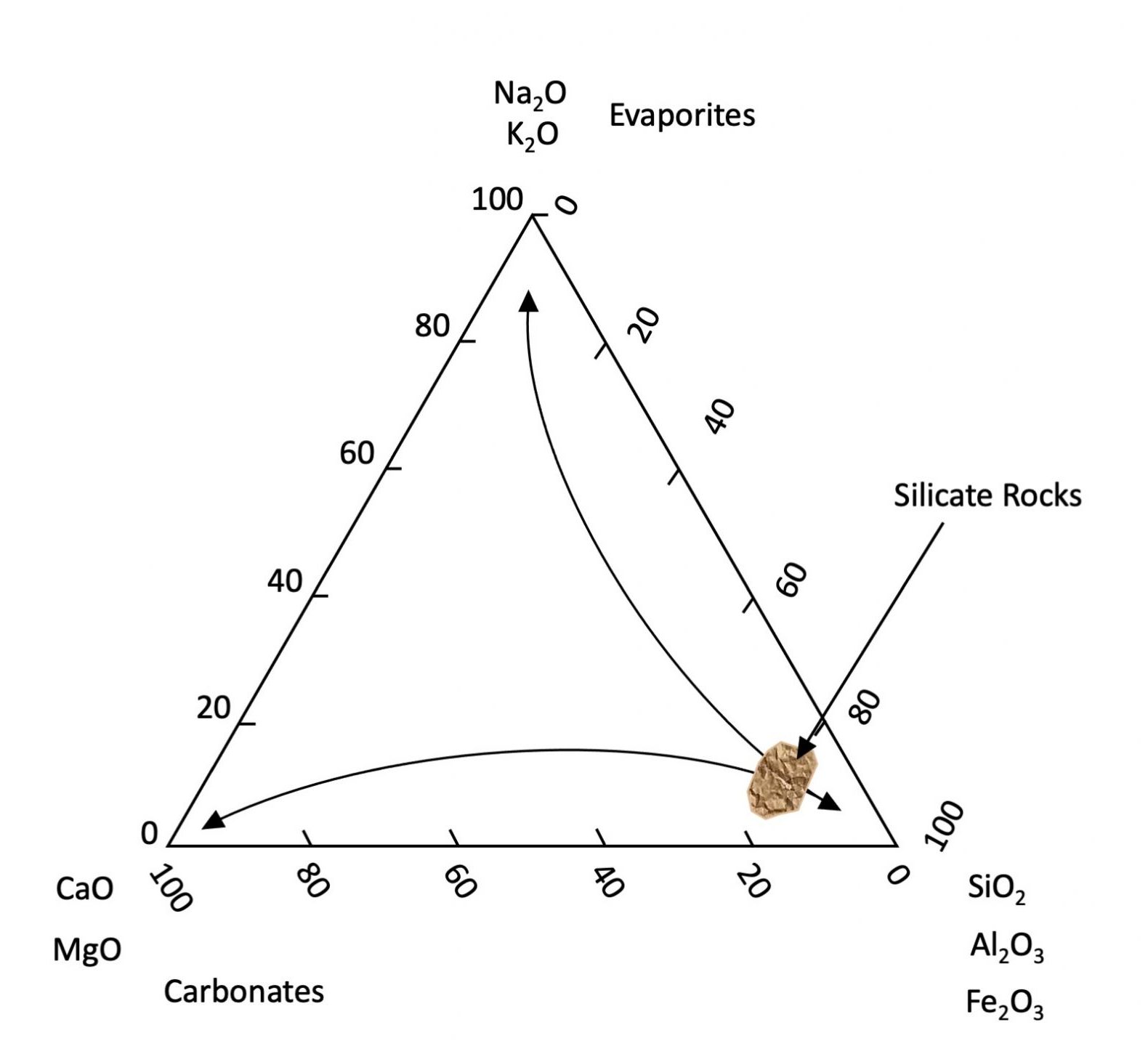
Mientras que los minerales primarios se forman por procesos geológicos, los minerales secundarios son un subproducto de la meteorización química formada ya sea a través de la alteración química parcial de minerales primarios o a través de la precipitación química de la reacción de componentes disueltos de otros minerales. La mayoría de los minerales secundarios son aluminosilicatos hidratados o oxihidróxidos de Fe y Al que son estables en los suelos. La mayoría de los aluminosilicatos hidratados se clasifican como filosilicatos o minerales arcillosos que son los minerales secundarios más abundantes en suelos canadienses. Se trata de partículas laminares de grano muy fino con una relación de área superficial a masa muy alta, denominada área de superficie específica (SSA). Dado que el área superficial está inversamente relacionada con el diámetro de partícula, la fracción del tamaño de arcilla representa con mucho la mayor porción mineral de la superficie disponible asociada con los minerales del suelo (Capítulo 5, Cuadro 5.1).
Los minerales arcillosos también son las fases inorgánicas químicamente reactivas en los suelos y tanto la cantidad como el tipo de mineral arcilloso influyen en muchas propiedades del suelo, incluyendo
- porosidad y tamaño de poro;
- comportamiento de hinchazón;
- compresibilidad y compactabilidad;
- capacidad de sorción;
- capacidad de intercambio; y
- conductividad hidráulica.
¡Puedes Cavar!
Aunque los minerales secundarios se forman y son estables en suelos en la superficie de la Tierra, la gran mayoría de los minerales secundarios encontrados en suelos canadienses se formaron en el pasado distante, previo a la glaciación tardía de Wisconsin. La mayoría de los minerales del suelo redepositados durante la última glaciación se derivaron de sedimentos superficiales formados y depositados, probablemente repetidamente, durante los milenios previos a la última glaciación. Aunque los minerales secundarios continúan formándose en nuestros suelos en respuesta a la meteorización química, las cantidades totales producidas desde el último evento glacial son muy pequeñas en comparación con las cantidades re-depositadas durante muchas glaciaciones repetidas en el pasado.
MINERALES vs tamaño de partícula
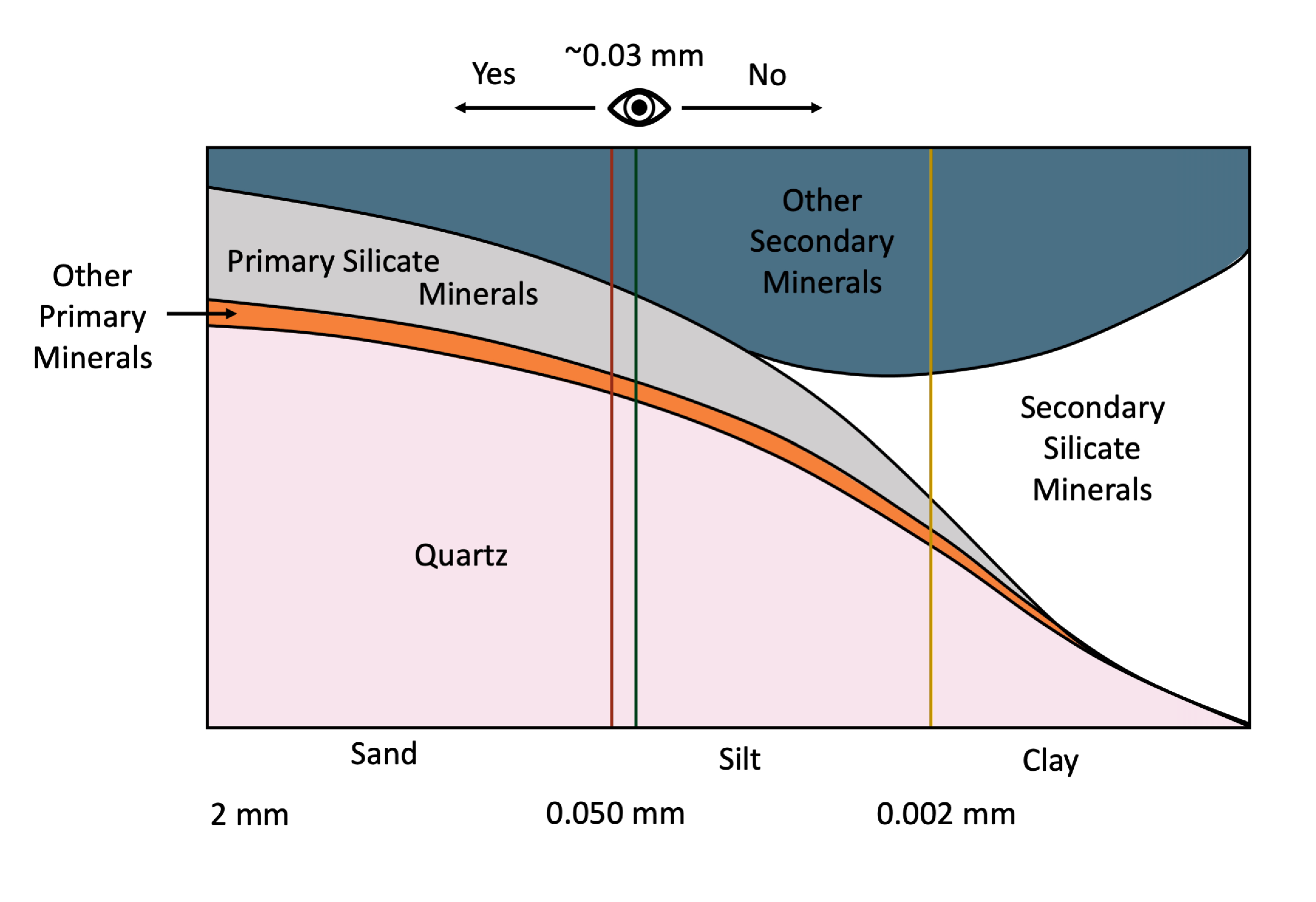
La persona promedio con visión 20:20 puede resolver partículas individuales tan pequeñas como aproximadamente 30 μm (0.03 mm) a simple vista. Esta es la división aproximada (0.05 mm) entre arena y partículas de suelo de tamaño limo (Figura 14.3). En comparación, el grosor del cabello humano está en el rango de 0.1 a 0.04 mm. Esto significa que el individuo promedio con una vista razonablemente buena puede distinguir fácilmente las partículas individuales del tamaño de arena a simple vista (sin aumento) pero no puede diferenciar entre la mayoría de las partículas de limo individuales y definitivamente no puede resolver las partículas del tamaño de arcilla. El examen de partículas de tamaño limo requiere aumento mediante el uso de un microscopio óptico, mientras que las partículas del tamaño de arcilla solo pueden resolverse mediante microscopía electrónica (Smart y Tovey, 1981) o microscopía de fuerza atómica (Liu, 2003).
La distribución de los minerales del suelo varía con el tamaño de partícula (Figura 14.3). Con base en las fracciones de tamaño de grano definidas en el Sistema Canadiense de Clasificación de Suelos (SCWG 1998), la fracción de tamaño de arena (partículas con diámetro en el rango de 2-0.050 mm) está dominada por minerales primarios. Los minerales primarios son principalmente cuarzo, feldespatos y otros minerales de silicato primario, mientras que la fracción de tamaño de arcilla (<0.002 mm de diámetro) está dominada por filosilicatos secundarios y oxihidróxidos de hierro y aluminio. La fracción de tamaño de limo (0.05-0.002 mm de diámetro) es de tamaño intermedio entre la arena y la arcilla y típicamente contiene una mezcla de minerales primarios y secundarios.
Abundancia elemental y estructuras minerales
Hay 91 elementos naturales, todos los cuales se encuentran a cierta concentración en el suelo. El Cuadro 14.1 proporciona una lista de 70 elementos en orden decreciente de abundancia en rocas corticales y en suelos. La mayoría de los elementos se sustituyen entre sí dentro de la estructura cristalina de los minerales dependiendo de su tamaño y valencia. Esto se discutirá con más detalle más adelante en este capítulo. Dependiendo de la solubilidad y resistencia a la intemperie química, el contenido de algunos elementos contenidos en los minerales del suelo aumenta en relación con la abundancia de la corteza (por ejemplo, Si y O) mientras que la concentración de la mayoría de los elementos disminuye a medida que se liberan al ambiente (compare la abundancia elemental de la corteza con el suelo abundancia; Cuadro 14.1).
Cuadro 14.1. Contenido total (mg kg -1) de elementos seleccionados en orden de abundancia en rocas de corteza continental y en suelos (Adaptado de Bowen, 1979)
| Elemento | Corteza | Suelo | Elemento | Corteza | Suelo | |
|---|---|---|---|---|---|---|
| O | 464000 | 490000 | B | 10 | 38 | |
| Si | 281500 | 330000 | Th | 9.6 | 14 | |
| Al | 81650 | 71000 | Sm | 6 | 6 | |
| Fe | 53000 | 32000 | Gd | 5.4 | 3.5 | |
| Ca | 38650 | 15000 | Cs | 3 | 3 | |
| Na | 26150 | 10900 | Dy | 3 | 5.7 | |
| K | 23950 | 18300 | Yb | 3 | 3.9 | |
| Mg | 21950 | 8300 | Hf | 3 | 7.7 | |
| Ti | 5050 | 5100 | Be | 2.8 | 1.5 | |
| P | 1050 | 800 | Er | 2.8 | 3 | |
| Mn | 950 | 760 | U | 2.7 | 2.2 | |
| F | 625 | 270 | Br | 2.5 | 43 | |
| Ba | 425 | 568 | Sn | 2 | 5.8 | |
| Sr | 375 | 278 | Ta | 2 | 1.2 | |
| S | 260 | 433 | Como | 1.8 | 11 | |
| Zr | 165 | 345 | Ge | 1.5 | 3 | |
| V | 135 | 108 | Mo | 1.5 | 1.9 | |
| Cl | 130 | 485 | W | 1.5 | 1.1 | |
| Cr | 100 | 84 | Eu | 1.2 | 1.3 | |
| Rb | 90 | 120 | Ho | 1.2 | 0.8 | |
| Ni | 75 | 34 | Tb | 0.9 | 0.85 | |
| Zn | 70 | 60 | I | 0.5 | 7.1 | |
| Ce | 60 | 84 | Lu | 0.5 | 0.46 | |
| Cu | 55 | 26 | Tm | 0.48 | 0.62 | |
| Y | 33 | 28 | Tl | 0.45 | 0.25 | |
| La | 30 | 41 | Cd | 0.2 | 0.6 | |
| Nd | 28 | 44 | Sb | 0.2 | 1.7 | |
| Co | 25 | 12 | Bi | 0.17 | 0.5 | |
| Sc | 22 | 10 | En | 0.1 | 1 | |
| Li | 20 | 31 | Hg | 0.08 | 0.1 | |
| Nb | 20 | 14 | Ag | 0.07 | 0.05 | |
| Ga | 15 | 21 | Se | 0.05 | 0.4 | |
| Pb | 12 | 29 | Pt | 0.001 | 0.001 | |
| Pr | 11 | 6.5 | Au | 0.001 | 0.001 | |
| Nota: No incluye hidrógeno, carbono, nitrógeno, gases nobles o elementos que se encuentran en cantidades ultra-traza (<0.001 mg kg -1). Consulte https://earthref.org/GERMRD/10/ para obtener la versión más actualizada de esta tabla. Ver Spiers et al. (1989a) para elementos seleccionados en suelos de Alberta. | ||||||
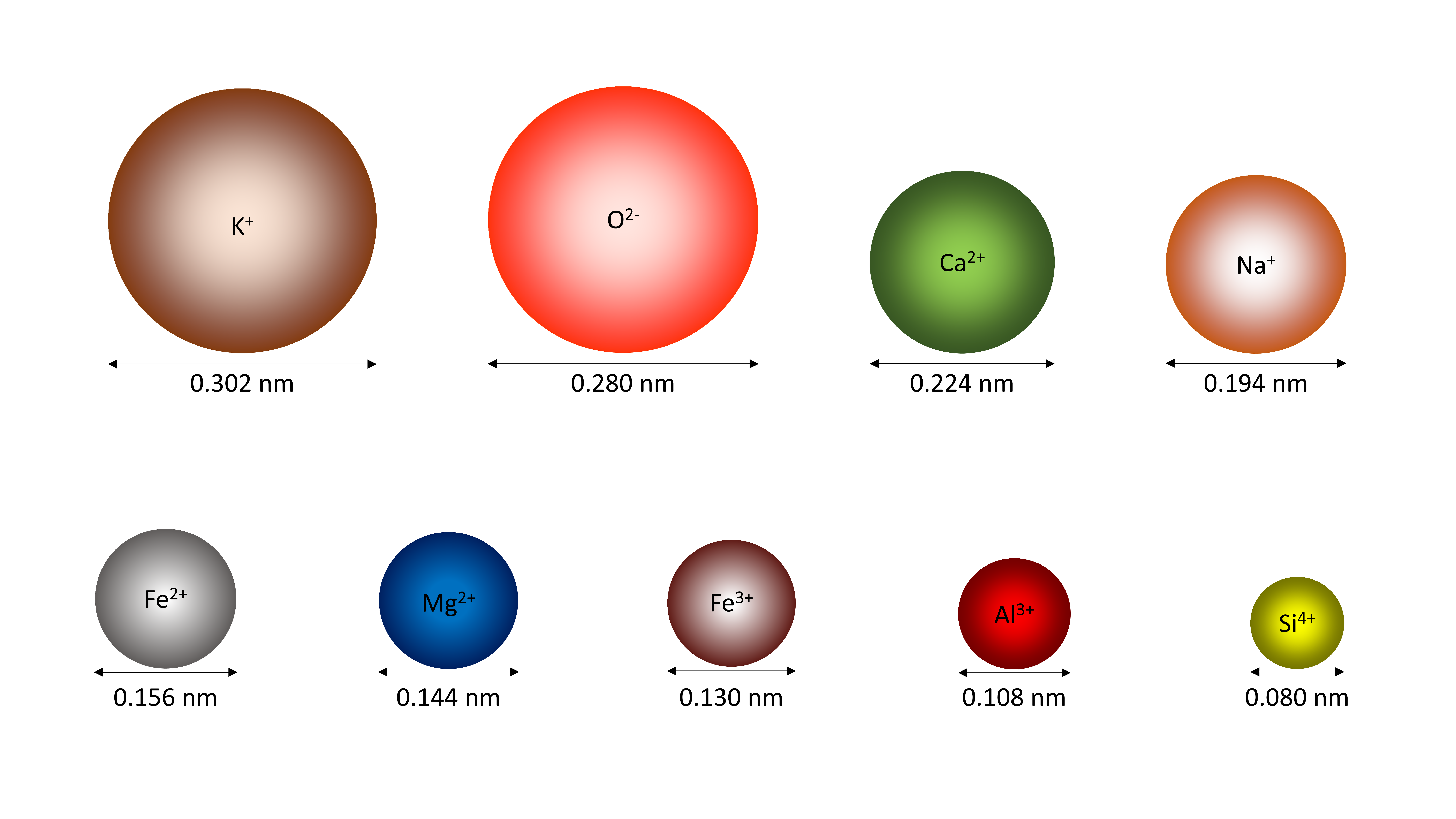
Un examen más detenido de las abundancias elementales indica que los ocho elementos más abundantes (O, Si, Al, Fe, Ca, Na, K y Mg) representan casi toda la masa (99%) de la corteza terrestre (Cuadro 14.2). Considerando los radios atómicos indica además que casi 85% de la corteza terrestre en volumen está compuesta por oxígeno como óxidos. Específicamente, los minerales a base de óxido (O 2-) forman el marco fundamental de la mayoría de los minerales en la corteza terrestre con los cationes principales (Si, Al, Fe, Ca, Na, K y Mg) encajando entre los átomos de oxígeno a nivel atómico.
Cuadro 14.2. Radio de O 2- y cationes principales, abundancia de la corteza, relaciones de radio y números de coordinación previstos
| Elemento | Radio atómico (nm) | Abundancia por Masa (%) | Abundancia por Volumen (%) | Relación de radio | Número de coordinación previsto (CN) |
|---|---|---|---|---|---|
| O 2- | 0.14 | 0.464 | 0.845 | na* | na* |
| Si 4+ | 0.04 | 0.282 | 0.012 | 0.29 | 4 |
| Al 3+ | 0.054 | 0.0817 | 0.0083 | 0.38 | 4 |
| Fe 3+ | 0.065 | 0.053 | 0.0094 | 0.46 | 6 |
| Fe 2+ | 0.078 | Incl.** | Incl.** | 0.56 | 6 |
| Ca 2+ | 0.112 | 0.0387 | 0.0361 | 0.80 | 8 |
| Na + | 0.097 | 0.0262 | 0.0285 | 0.69 | 6 |
| K + | 0.151 | 0.022 | 0.0548 | 1.08 | 12 |
| Mg 2+ | 0.072 | 0.024 | 0.0054 | 0.51 | 6 |
| Total | 0.9909 | 1 | |||
| Nota: *na = no aplica. **: abundancia de Fe 2+ incluida con Fe 3+ | |||||
La estructura cristalina de los minerales a nivel atómico puede visualizarse fácilmente si asumimos que el oxígeno y los otros iones metálicos actúan como esferas rígidas con radios fijos. Aunque no es estrictamente cierto, este es un conceptual útil para visualizar estructuras cristalinas. La geometría de estas esferas rígidas se rige por las Reglas de Pauling (Pauling 1929) donde la primera regla establece que la distancia entre un catión y un anión es la suma de sus radios. Los iones en una estructura cristalina tienden a reunir tantos iones cargados opuestamente alrededor de sí mismos como el tamaño lo permita. El número de iones O 2- que pueden rodear un catión central se denomina número de coordinación (CN). Los cationes grandes (por ejemplo, K +) tienen números de coordinación altos debido a sus grandes volúmenes, mientras que los cationes pequeños (por ejemplo, Si 4+) tienen números de coordinación bajos (Figura 14.4). También tenga en cuenta que aquellos cationes con radios atómicos grandes y baja valencia (K + y Na +) son los más móviles mientras que aquellos con radios más pequeños y carga alta (Si 4+, Al 3+ y Fe 3+) son mucho menos móviles.
Dado que los iones tienden a rodearse de tantos iones cargados opuestamente como sea posible, predecir los números de coordinación requiere usar solo los tamaños relativos de los iones expresados como la relación de radio:
(1)
El Cuadro 14.3 proporciona rangos de relaciones de radio que corresponden a números de coordinación comunes y a las unidades estructurales correspondientes. Algunos solapamientos e incertidumbre surgen porque el supuesto de tratar iones como esferas rígidas con radios constantes no es estrictamente cierto. Con esto en mente, los iones suelen ser intercambiables si su tamaño no difiere en más de aproximadamente 15%, y sus valencias no difieren en más de una unidad. En realidad, los iones no son esféricos y sus radios cambian ligeramente con diferentes números de coordinación. Como resultado, algunos elementos tienen más de una geometría de coordinación común. Por ejemplo, el aluminio se encuentra comúnmente en unidades tetraédricas (CN=4) y octaédricas (CN=6). La sustitución de cationes dentro de las estructuras minerales se denomina sustitución isomorfa y se discutirá con más detalle más adelante en este capítulo.
La geometría de los iones alrededor de un ion central se puede visualizar como un poliedro coordinante. En mineralogía, estos poliedros generalmente se construyen a partir de la disposición de aniones; alrededor de los cationes pero a veces los cationes pueden estar ausentes por completo. Con mucho, las estructuras poliédricas más comunes que componen la mayoría de los minerales del suelo son el tetraedro (estructura de cuatro lados con cuatro átomos de oxígeno coordinados alrededor del Si) y el octaedro (estructura de ocho lados con seis átomos de oxígeno coordinados alrededor del aluminio; Figura 14.5). Dado que el Si y el O son, con mucho, los elementos más abundantes en el suelo, los minerales con estructuras tetraédricas forman la base de muchos de los minerales primarios comunes. Los filosilicatos laminares compuestos por una combinación de tetraedros de sílice y octaedros de aluminio son minerales secundarios que dominan la fracción de tamaño de arcilla (<0.002 mm). Los filosilicatos serán discutidos con mayor detalle más adelante en este capítulo.
Cuadro 14.3. Números de coordinación de relaciones de radio y unidades estructurales asociadas para la mayoría de los cationes en relación con el oxígeno estructural (O 2-) en minerales
| R catión /R (O 2-) Rango | Número de Coordinación (CN) | Unidad de Poliedro |
|---|---|---|
| 0.155-0.225 | 3 | Triangular |
| 0.225-0.414 | 4 | Tetraédrico |
| 0.414-0.732 | 6 | Octaédrica |
| 0.732-1 | 8 | Cúbico |
| >1 | 12 | Cuboctaedro |
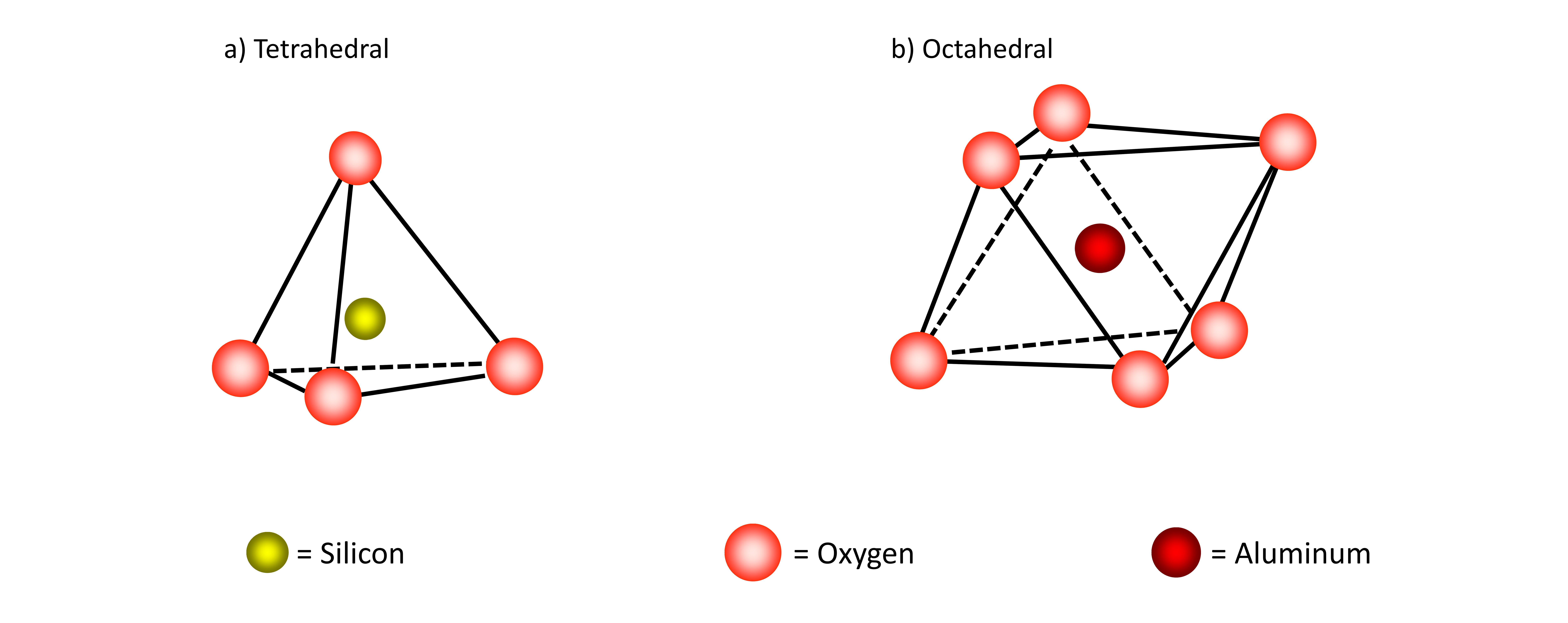
La diferencia fundamental entre las estructuras minerales es el número de átomos de oxígeno compartidos que ocurre entre los tetraedros adyacentes. Si bien existen varios tipos de estructuras y clasificaciones minerales; en términos generales, los minerales del suelo más comunes están compuestos por unidades repetitivas de tetraedro de silicato (SiO 4) que caen en uno de los cuatro tipos generales simplificados de estructuras:
- tetraedros de sílice aislados (neosilicatos);
- cadenas de tetraedros de sílice (inosilicatos);
- tetraedros de entramado (tectosilicatos); y,
- láminas de tetraedros (combinados con unidades octaédricas; filosilicatos).
Algunos minerales comunes del suelo listados de acuerdo con la cantidad de átomos de oxígeno compartidos entre tetraedros adyacentes se dan en la Tabla 14.4.
Cuadro 14.4. Algunos de los minerales comunes del suelo
| Compartición de Oxígeno en Tetraedros | Grupos Minerales Comunes | Nombre del mineral de ejemplo | Composición Ideal Generalizada |
|---|---|---|---|
| Neosilicatos | Olivinos | Fosterite | Mg 2 SiO 4 |
| No compartir | |||
| Tetraedros aislados | Fayalita | Fe (II) 2 SiO 4 | |
| Inosilicatos | Piroxenos | Enstatita | MgSiO 3 |
| Un oxígeno compartido | Diópsido | (Ca, Mg) SiO 3 | |
| Augite | (Ca, Mg, Fe (II), Al) SiO 3 | ||
| Inosilicatos | Anfíboles | Temolita | Ca 2 Mg 5 [Si 8 O 22 (OH) 2] |
| Dos oxígeno compartido | Actinolita | Ca 2 (Mg, Fe (II)) 5 [Si 8 O 22 (OH) 2] | |
| Hornblende | (Ca, Na) (Mg, Fe (II), Al) 5 [(Al, Si) 8 O 22 (OH) 2] | ||
| Filosilicatos | Caolinita | Si 2 Al 2 O 5 (OH) 4 | |
| Tres oxígenos compartidos | Moscovita | Kal 3 (AlSi 3) O 10 (OH) 2 | |
| Tectosilicatos los cuatro oxígenos compartidos | Silicatos de Marco | Cuarzo | α-SiO 2 |
| Feldespatos | (Ca, Na, K) (Al x Si (3-x)) O 8 |
MINERALES DE LA FRACCIÓN DEL TAMAÑO DE LA ARENEA (2 mm
Cuarzo
El cuarzo (SiO 2) o más específicamente, α-cuarzo (α-SiO 2), es el mineral más común que se encuentra en los suelos canadienses, generalmente representando la mayor parte de la fracción de arena (Figura 14.3). El cuarzo es un silicato estructural (tectosilicato) con los cuatro átomos de oxígeno en sus tetraedros de sílice compartidos entre tetraedros adyacentes de Al, Si 3 (Figura 14.6). Pertenece al sistema de cristales hexagonales.
Cuando los tetraedros comparten todos los átomos de oxígeno con los tetraedros adyacentes, forman un marco tridimensional muy fuerte de enlaces Si-O. El cuarzo es esencialmente puro SiO 2. La carga negativa de los átomos de O se equilibra exactamente por Si que no requiere otros iones de enlace. Bajo un microscopio, la mayoría de los especímenes suelen ser fragmentos lustrosos de forma irregular que aparecen blancos, lechosos y a veces claros. La estructura química del marco 3D del cuarzo es típica de los tectosilicatos. Las unidades repetitivas son SiO 2 en una configuración tetraédrica. Los enlaces Si-O son enlaces covalentes muy fuertes, altamente resistentes a la intemperie pero en general no químicamente estables en el suelo. La solubilidad del cuarzo es muy baja y la velocidad de meteorización (disolución) es extremadamente lenta. Por lo tanto, el cuarzo es altamente persistente en suelos con una velocidad de disolución lenta en comparación con la mayoría de los otros minerales, lo que lleva a una persistencia mucho más larga, con cantidades relativas acumulándose a lo largo del tiempo (por ejemplo, horizontes Ae de suelos podzólicos y luvisólicos). Visualmente el cuarzo aparece generalmente como fragmentos vítreos claros, blancos o grises pero a veces existe como fragmentos amarillos, marrones, morados, rosados o rojos que se pueden ver fácilmente a simple vista o con una lente de mano. El cuarzo generalmente constituye alrededor del 40-60% de la fracción de arena (2.0—0.05 mm), una fracción principal del rango del tamaño del limo (0.05-0.002 mm) y también está presente en pequeñas cantidades en la fracción del tamaño de arcilla (<0.002 mm) de los suelos canadienses (ver Figura 14.3).
Feldespatos
Los feldespatos son en realidad un grupo de minerales que constituyen el segundo grupo de tectosilicato más común que se encuentra en el suelo (después del cuarzo), representando típicamente 15-35% de la fracción de arena (Figura 14.3). Los feldespatos constituyen una gran porción de rocas graníticas y metamórficas. Por lo tanto, los feldespatos constituyen una porción significativa de nuestro suelo. Existen muchas especies minerales que conforman el grupo del feldespato, teniendo todas una fórmula general de X (Al, Si) 4 O 8 donde X es más comúnmente K, Na o Ca con iones Al y Si que conforman las unidades tetraédricas. Otros iones como Ba, Zn, Rb, Sr y Fe 2+ también sustituyen a X en estructuras de feldespato (King 2020). Los feldespatos suelen aparecer blanquecinos, con varios tonos de rojo, naranja, marrón y ocasionalmente verde existentes. El armazón 3D de los feldespatos está conformado por unidades que van desde AlSi 3 O 8 hasta Al 2 Si 2 O 8 en una configuración de “cinta retorcida” (Figura 14.7a). El K, Na o Ca encontraron en los huecos de las torceduras con suficiente Al sustituyendo al Si dentro de la estructura de cinta retorcida para producir una carga estructural negativa para neutralizar la carga positiva en los cationes.
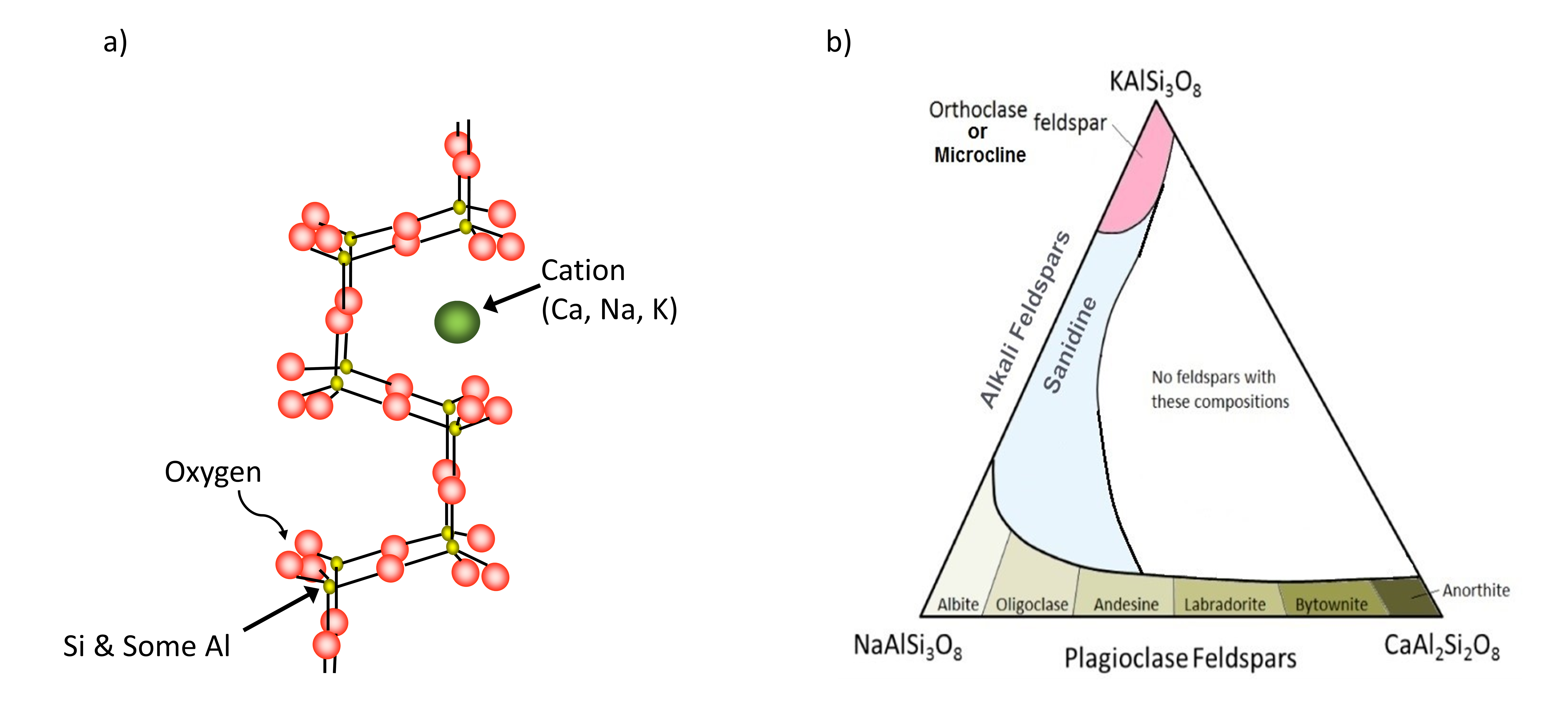
Los minerales de feldespato más comunes y sus rangos en composición se ilustran en el diagrama ternario (Figura 14.7b). Ortoclasa y microclina son los nombres minerales dados a los feldespatos con la misma composición química dominada por el potasio (KalSi 3 O 8) con cantidades menores (hasta aproximadamente 25%) de Na sustituyendo a K en la estructura (Figura 14.7B). La ortoclasa y la microclina son polimorfos, lo que significa que tienen la misma composición química pero diferentes formas cristalinas. La ortoclasa tiene una forma cristalina monoclínica mientras que la microclina es triclínica. Los feldespatos que contienen más de aproximadamente 25% de Na pero menos de 75% de K constituyen el mineral sanidina [(K, Na) AlSi 3 O 8]. Los feldespatos dentro del rango completo de las composiciones de K y Na (ortoclasa/microclina, sanidina a albita) generalmente se denominan feldespatos alcalinos (Figura 14.7B). Los feldespatos de sodio y Ca se presentan en una serie continua llamada serie plagioclasa con composiciones que van desde NaAlSi 3 O 8 hasta CaAl 2 Si 2 O 8 donde la carga sobre la cantidad de Na y Ca en la estructura se neutraliza por sustitución de Al por Si en los torceduras tetraédricas. A los feldespatos de plagioclasa con composiciones específicas se les dan nombres minerales específicos enumerados en la Tabla 14.5. La serie de minerales plagioclasa es un ejemplo de una serie de soluciones sólidas donde la composición varía entre dos minerales miembros finales (es decir, albita; NaAlSi 3 O 8 y anortita; CaAl 2 Si 2 O 8) que comparten la misma fórmula química básica pero experimentar la sustitución de elementos en uno o más sitios atómicos.
El cuarzo y los feldespatos tienen una gravedad específica y dureza similares, por lo que tienden a transportarse y depositarse juntos. A diferencia del cuarzo, los feldespatos tienen varios planos de escisión a lo largo de los cuales se fracturan los minerales, haciéndolos frágiles y más propensos a la descomposición mecánica al impactar durante el transporte físico Estos planos de escisión son planos de debilidad a lo largo de los cuales el agua y los exudados microbianos pueden infiltrarse y acelerar su alteración química. Organismos como bacterias e hifas fúngicas también se infiltran en estos planos de debilidad para mejorar la degradación del feldespato. De ahí que los feldespatos tienden a capear y disolverse a un ritmo más rápido en comparación con el cuarzo (Cousineau, 2020).
Cuadro 14.5. Rango en composición para feldespatos de plagioclasa
| Nombre del mineral | % NaalSi 3 O 8 | % CaAl 2 Si 2 O 8 | Rango de composición |
|---|---|---|---|
| Albita | 90-100 | 0-10 | Na (Al, Si 3 O 8) — Na 0.9 Ca 0.1 (Al 1.1 Si 2.9 O 8) |
| Oligoclasa | 70-90 | 10-30 | Na 0.9 Ca 0.1 (Al 1.1 Si 2.9 O 8) — Na 0.7 Ca 0.3 (Al 1.3 Si 2.7 O 8) |
| Andesine | 50-70 | 30-50 | Na 0.7 Ca 0.3 (Al 1.3 Si 2.7 O 8) - Na 0.5 Ca 0.5 (Al 1.5 Si 2.5 O 8) |
| Labradorita | 30-50 | 50-70 | Na 0.5 Ca 0.5 (Al 1.5 Si 2.5 O 8) - Na 0.3 Ca 0.7 (Al 1.7 Si 2.3 O 8) |
| Bytownite | 10-30 | 70-90 | Na 0.3 Ca 0.7 (Al 1.7 Si 2.3 O 8) - Na 0.1 Ca 0.9 (Al 1.9 Si 2.9 O 8) |
| Anortita | 0-10 | 90-100 | Na 0.1 Ca 0.9 (Al 1.9 Si 2.9 O 8) - Ca (Al 2 Si 2 O 8) |
Minerales “pesados”
Los minerales “pesados” representan un grupo generalizado de “otros” minerales primarios que generalmente se encuentran solo en cantidades menores (2-5%) en la fracción arenosa de los suelos canadienses. Varios de estos minerales son de color oscuro debido a su alto contenido de Fe y Mg. Otros como el granate y la hematita son de color rojo oscuro y el circón es de amarillo a incoloro. Los minerales pesados pueden aislarse de las fracciones de arena y limo en función de la separación por densidad (Andò, 2020). Los minerales pesados no se encuentran típicamente en la fracción del tamaño de arcilla. Los minerales pesados en su mayor parte se definen generalmente como que tienen una densidad de partículas (gravedad específica) mayor a 2.90 g/cm 3 (Andò, 2020). Algunos minerales comunes que se encuentran en la fracción arenosa de los suelos se proporcionan en el Cuadro 14.6. Aunque el componente mineral pesado es solo un componente mineral menor de la fracción de arena, puede suministrar muchos nutrientes críticos a las plantas a través de la meteorización progresiva.
Una vez aislada, la fracción mineral pesada puede ser examinada por varios métodos que incluyen microscopía óptica y electrónica acoplada con técnicas de aprendizaje automático por computadora (Maitre et al., 2019), difracción de rayos X en polvo y otros métodos físicos o químicos. Los minerales pesados generalmente incluyen minerales máficos típicamente con altas concentraciones de Fe y Mg. Macroscópicamente los piroxenos y anfíboles pueden ser difíciles de distinguir entre sí, ya que ambos son de color oscuro. Típicamente, los cristales de piroxeno son cristales más cortos mientras que los anfíboles tienen cristales más largos en forma de aguja. Otros minerales en la fracción mineral pesada pueden incluir granates (X 3 Al 2 Si 3 O 12 fueron X puede ser Mg, Fe (II), Mn o Ca), magnetita (Fe 3 O 4), cromita (Fe, Cr (III) 2 O 4), hematita (Fe 2 O 3 ), circón (ZrSiO 4), rutilo (TiO 2).
Cuadro 14.6. Algunos minerales comunes en la fracción de tamaño de arena con densidades asociadas
| Fracción de Densidad | Mineral | Densidad (g cm -3) |
|---|---|---|
| Fracción “ligera” (Densidad <2.9 g cm -3) |
cuarzo | 2.65 |
| feldespatos | 2.55-2.76 | |
| Fracción “pesada” (Densidad >2.9 g cm -3) |
olivino | 3.22-4.39 |
| augite (piroxeno) | 2.96-3.52 | |
| hornblende (anfíbol) | 3.02-3.45 | |
| hematita (Fe 2 O 3) | 5.26 | |
| magnetita (Fe 3 O 4) | 5.2 |
MINERALES DE LA FRACCIÓN DEL TAMAÑO DE LAMENTO (0.05 — 0.00
La fracción de tamaño de limo de los suelos es intermedia en tamaño y mineralogía entre las fracciones de arena y arcilla. Por lo tanto, la fracción de limo contiene efectivamente una mezcla física de minerales que se encuentran tanto en la fracción de tamaño de arena como en la fracción de tamaño de arcilla. Por lo tanto, se dirige a los lectores a esas secciones de este capítulo para su posterior discusión.
¡Puedes Cavar!
Los términos “arcilla” y “mineral arcilloso” a menudo se usan indistintamente y ven uso común en la literatura científica; sin embargo, su uso puede ser ambiguo y a veces engañoso. El término “arcilla” se usa típicamente para referirse a un suelo arcilloso o a la fracción del tamaño de arcilla (partículas <0.002 mm de diámetro). Los “minerales arcillosos” se refieren específicamente a filosilicatos que representan la mayoría de la “arcilla” en el suelo pero no incluyen oxihidróxidos y aluminosilicatos amorfos. Aunque no los filosilicatos, numerosos minerales de tamaño arena descritos anteriormente también pueden estar presentes en la fracción de tamaño de arcilla.
MINERALES DE LA FRACCIÓN DEL TAMAÑO DE ARCILLA (MENOS DE
Como se discutió anteriormente, la fracción de tamaño de arcilla está compuesta principalmente por aluminosilicatos hidratados secundarios. Estos minerales son de grano muy fino y por lo tanto tienen un SSA muy alto y representan la mayor porción de la superficie mineral disponible y reactiva en el suelo (Capítulo 5, Cuadro 5.1). Además, los minerales en la fracción arcillosa tienen carga tanto permanente como variable de pH capaces de atraer y retener nutrientes vegetales con impactos directos e indirectos en la fertilidad del suelo. En definitiva, son las fases inorgánicas más activas químicamente en el suelo.
SILICATOS EN LÁMINA: FILOSILICATOS
Con mucho, el tipo de minerales más común en la fracción de tamaño de arcilla son los silicatos de lámina o capa llamados filosilicatos (griego; filón significa hoja u hoja), que aparecen como estructuras de lámina plana en fotomicrografías (e.g., Beutelspacher y Van Der Marel, 1968). Los filosilicatos son minerales cristalinos, con una estructura que consiste en capas de unidades atómicas repetitivas; así se le da el nombre de aluminosilicatos “capa” u “hoja”. Las capas fundamentales están compuestas por láminas tetraédricas y octaédricas que se presentan en diferentes combinaciones para formar diferentes especies minerales de filosilicato.
Las láminas tetraédricas están compuestas por unidades repetitivas de tetraedro (cuatro lados), cada una de las cuales contiene un átomo de Si rodeado por cuatro átomos de O. Tres de los cuatro átomos de O se comparten con unidades tetraédricas adyacentes, denominadas átomos de O basales. El O no compartido se conoce como el O apical (Figura 14.8). Los átomos de O basales compartidos se combinan para formar láminas que continúan en dos dimensiones ad infinitum.
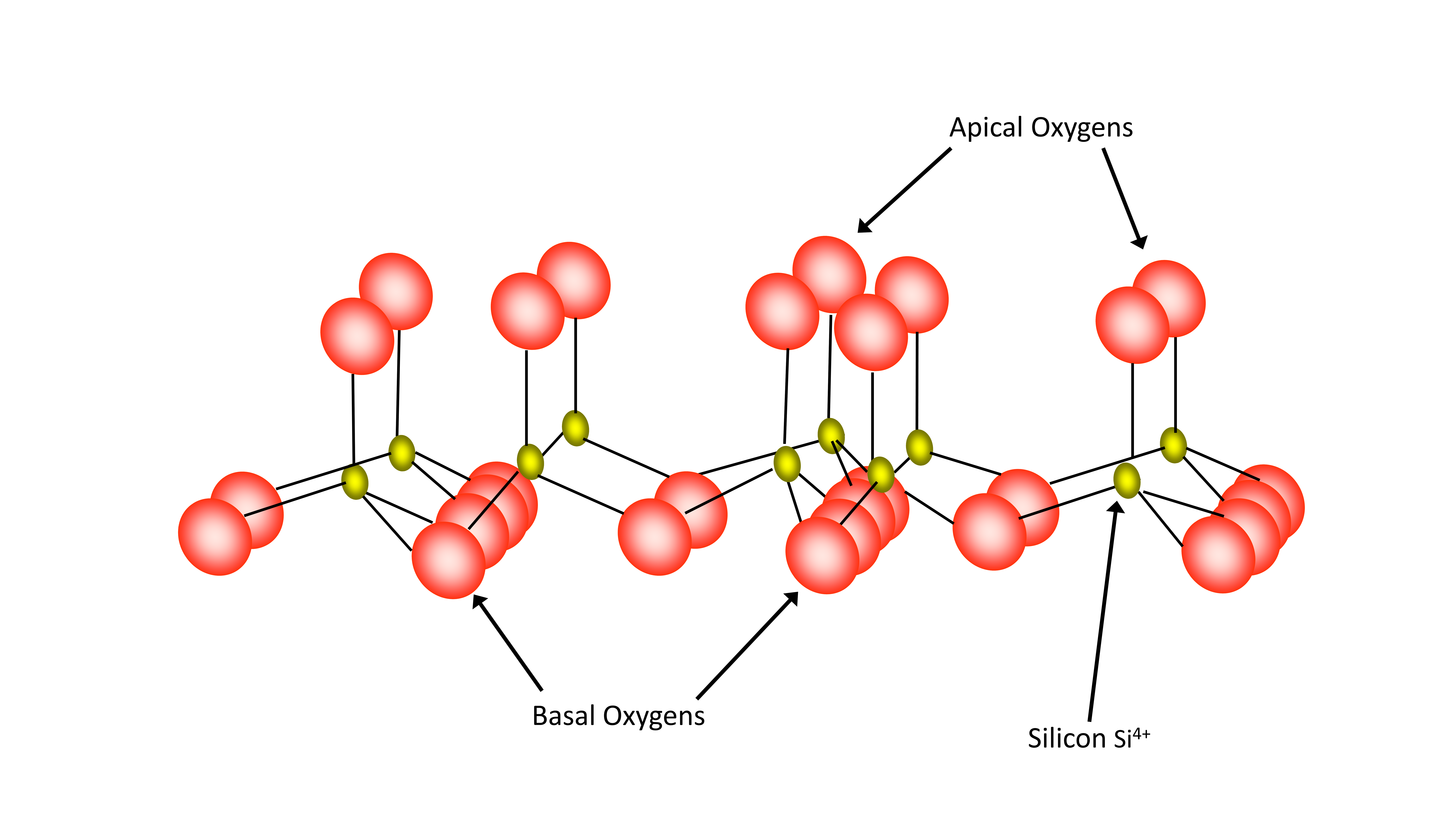
Las láminas octaédricas que se encuentran en los filosilicatos están compuestas por múltiples unidades de octaedro, cada unidad contiene átomos de Al y/o Mg rodeados por seis átomos de O o grupos OH —. Tres átomos de O (o grupos OH —) ocurren en el plano inferior, con tres átomos de oxígeno (o grupos hidroxilo) en el plano superior intercalando átomos de aluminio o magnesio entre ellos, formando una configuración de ocho lados (octaédrica) y una forma pseudohexagonal. Estas unidades se combinan compartiendo átomos de O para formar una lámina octaédrica que se extiende en dos dimensiones ad infinitum (Figura 14.9). Cuando el catión central del octaedro es trivalente, como el aluminio (Al 3+), solo dos de tres (2/3) sitios catiónicos en una lámina octaédrica requieren relleno para neutralizar la carga por los átomos O circundantes o iones OH —. En este caso, la lámina octaédrica se denomina dioctaédrica (Figura 14.9). Cuando el catión central del octaedro es divalente, como Mg 2+, entonces los tres de los tres (3/3) sitios catiónicos en una lámina octaédrica requieren relleno para neutralizar la carga negativa del O u OH circundante —. En este caso, la lámina octaédrica se denomina trioctaédrica (Figura 14.9).
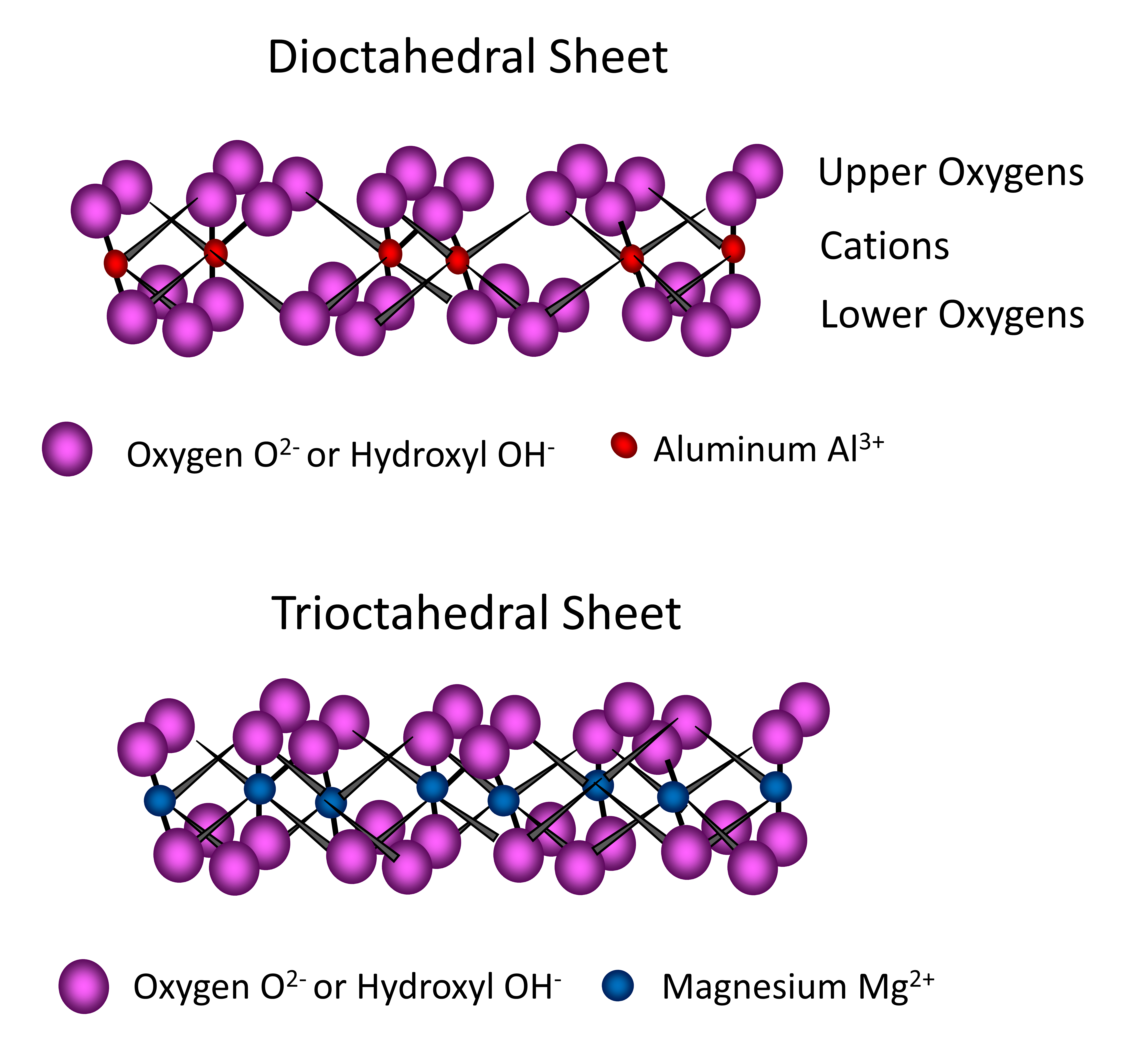
Las estructuras de filosilicato tienen láminas tetraédricas y octaédricas combinadas para formar capas a través del intercambio del átomo de O apical de la lámina tetraédrica con los átomos de O en la lámina octaédrica. Los filosilicatos compuestos por una lámina tetraédrica y una lámina octaédrica se denominan filosilicatos de tipo 1:1. Los compuestos por dos láminas tetraédricas que intercalan una lámina octaédrica entre ellas se denominan filosilicatos de tipo 2:1. Los filosilicatos constan de muchas capas (tipo 1:1 o tipo 2:1) apiladas una encima de la otra con alguna forma de unión entre las capas. La región ubicada entre dos capas adyacentes 1:1 o 2:1 se conoce como la región entre capas. Algunos filosilicatos de tipo 2:1 también pueden contener una lámina octaédrica adicional compuesta completamente de hidróxidos en la región de la capa intermedia. Estos se denominan filosilicatos de tipo 2:1:1 o 2:2. El comportamiento básico y las propiedades de los diferentes filosilicatos están dictados en gran parte por las características asociadas a la región intercapa de las arcillas que se encuentran en un suelo determinado.
Sustitución isomorfa
Además de su SSA extremadamente grande, los filosilicatos también se cargan eléctricamente debido a la sustitución de los cationes centrales dentro de las láminas tetraédricas u octaédricas por otros de tamaño similar pero diferente valencia (Cuadro 14.2). En el Cuadro 14.3 se proporcionan los rangos de relaciones de radio correspondientes a los números de coordinación comunes y sus correspondientes unidades estructurales. Los iones son típicamente intercambiables dentro de una estructura si su tamaño no difiere en más de aproximadamente 15% y las valencias no difieren en más de una unidad. La sustitución ocurre en el momento en que se forman los filosilicatos. La sustitución de un catión de valencia inferior por otro de tamaño similar imparte una carga neta negativa a la estructura del mineral debido a que la carga en los átomos de O circundantes no se equilibra completamente. Por ejemplo, el aluminio trivalente (Al 3+) puede sustituir algunos de los átomos de silicio tetravalente (Si 4+) en la lámina tetraédrica. La menor carga del Al en comparación con el Si crea un déficit de carga con una carga neta negativa resultante dentro de la lámina tetraédrica de la estructura. De igual manera, en láminas dioctaédricas, Mg 2+, Fe 2+, u otros cationes divalentes, pueden sustituir a algunos Al 3+ dando como resultado una carga extra negativa asociada con la lámina octaédrica de la estructura. De igual manera, Li +, aunque ocurre en baja abundancia (Cuadro 14.1), también a veces sustituye al Mg 2+ en filosilicatos trioctaédricos (lepidolita).
Para neutralizar las cargas negativas producidas por la sustitución isomorfa dentro de la estructura de filosilicatos, los cationes cargados positivamente son atraídos de la solución del suelo a la superficie de los minerales. Estos cationes neutralizantes cargados que migran a la región intercapa de los filosilicatos se denominan cationes intercambiables. Estos cationes son capaces de intercambiar con otros cationes en la solución del suelo. Colectivamente, la abundancia general de carga negativa en la estructura arcillosa se conoce como la capacidad de intercambio catiónico (CEC). La abundancia de sitios de carga negativa (la densidad de carga); la ubicación de las cargas negativas (lámina tetraédrica y/o octaédrica), y el tipo de catión en la región intercapa neutralizando la carga (por ejemplo, Na +, Ca 2+, Mg 2+, K + u otro) todos determinar la capacidad del filosilicato para ser expandible (arcilla hinchable) y controlar la capacidad de retener los nutrientes del suelo y de las plantas.
La región entre capas
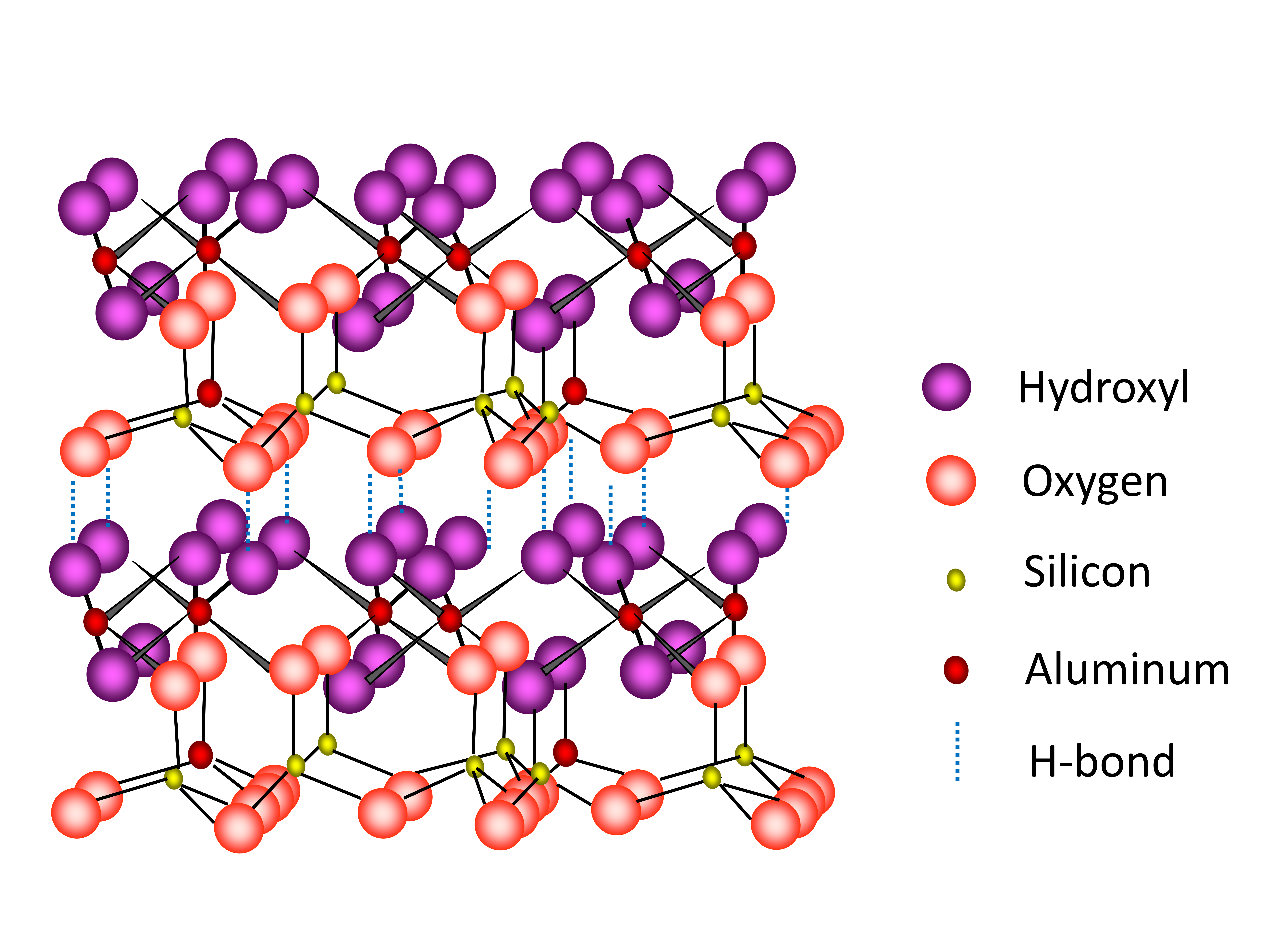
Además de atraer y retener cationes, la naturaleza de la región de capa intermedia de algunos filosilicatos también puede controlarse mediante enlaces de hidrógeno. En los minerales arcillosos tipo 1:1, los grupos hidroxilo asociados a la lámina octaédrica en la estructura se enfrentan a una capa de átomos de O formada por el Os apical en la capa 1:1 adyacente (Figura 14.10). El resultado es que los enlaces de hidrógeno mantienen las capas 1:1 juntas formando una estructura muy estable. En consecuencia, todos los filosilicatos de tipo 1:1 no se expanden y, por lo tanto, no se hinchan.
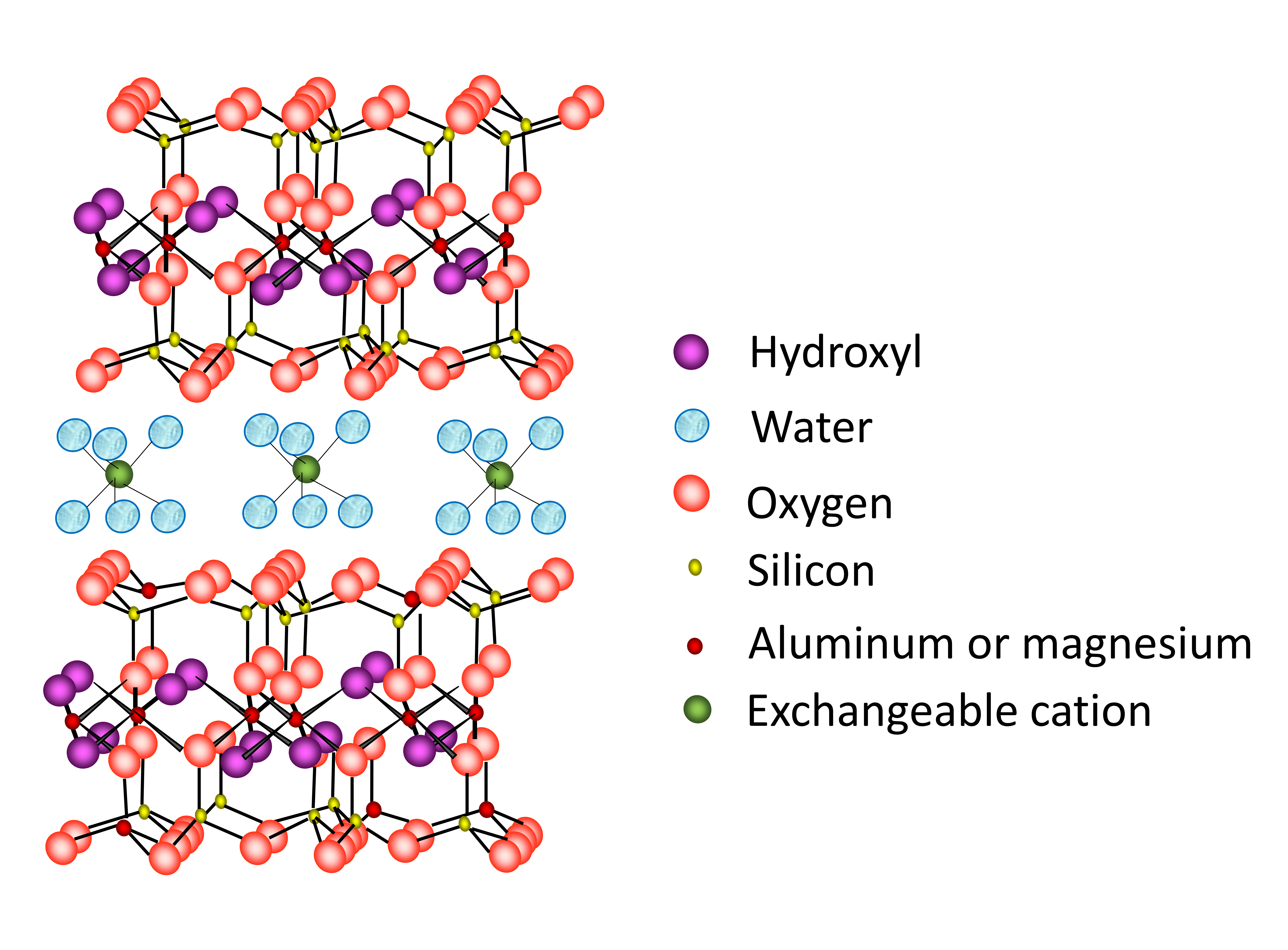
Por el contrario, los enlaces de hidrógeno no ocurren en minerales arcillosos 2:1 ya que los átomos de O basales en dos capas adyacentes se enfrentan entre sí sin grupos OH — (Figura 14.11). Así, las capas unitarias se mantienen unidas por las fuerzas electrostáticas más débiles asociadas con cualquier catión neutralizante que ocupe la región de la capa intermedia para neutralizar las cargas negativas asociadas con la sustitución isomorfa dentro de las estructuras de capa. Los cationes intercapa pueden ser cualquier combinación de Ca 2+, Mg 2+, Na +, K +, NH 4+, nutrientes vegetales (Zn 2+ Cu 2+, Mn 2+, Ni 2+), hierro (Fe 2+, Fe 3+), aluminio (Al 3+) u otros cationes. Estos cationes son típicamente intercambiables y tienen cierta cantidad de agua asociada con el catión.
El grado de expansibilidad de un mineral arcilloso 2:1 depende de la carga total de la capa; la ubicación de la carga de capa (sitios tetraédricos vs. octaédricos) y la naturaleza del catión intercambiable. Los filosilicatos 2:1 con una carga de capa baja (<0.6 por unidad de fórmula), generalmente asociados con la lámina octaédrica, suelen exhibir la capacidad de hinchamiento. Las propiedades de hinchamiento suelen estar asociadas con las esmectitas (ver Cuadro 14.7). Los filosilicatos 2:1 con una carga de capa más alta (>0.6 por unidad de fórmula), generalmente asociados con las láminas tetraédricas, tienen muchas menos probabilidades de exhibir propiedades de hinchamiento. Las filosilicatías 2:1 no hinchables son las vermiculitas y micas (Cuadro 14.7).
El agua es una molécula polar, permitiendo el desarrollo de esferas de hidratación con el catión intercambiable. Los cationes divalentes como Ca 2+ y Mg 2+ suelen tener dos capas de agua asociadas a él en la región intercalada de minerales arcillosos 2:1 con menor carga de capa total. Los cationes monovalentes grandes como Na + y K + obviamente, que tienen una carga menor, no son tan capaces como los cationes divalentes para mantener juntas las estructuras 2:1 y, por lo tanto, pueden permitir que se incorporen más moléculas de agua en la región intercalada. Bajo estas condiciones las estructuras 2:1 separan muchas veces su configuración original (“seca”) y se dice que la arcilla es una arcilla hinchable. Esto es típico del grupo esmectita de filosilicatos 2:1 (ver abajo). Tenga en cuenta que además del agua, las moléculas orgánicas polares también pueden migrar a la región de la capa intermedia.
En algunos casos, el catión intercapa en filosilicatos de tipo 2:1 puede llegar a ser hidroxilado en seis veces (coordinación octaédrica). Tal es el caso de Al, Mg y Fe. En estos casos, la capa intermedia se rellena con una lámina octaédrica adicional que no comparte átomos de O con la capa principal 2:1 sino que está unida por hidrógeno a las superficies de óxido adyacentes formando un filosilicato que tiene una estructura de tipo 2:1:1 (o 2:2). A estos tipos de filosilicatos se les conoce como el grupo clorito o, más generalmente, clorito.
Filosilicatos comunes
Hay alrededor de 50 especies diferentes de filosilicatos pero la mayoría son raras o ocurren en suelos que se encuentran en asociación con depósitos geológicos específicos (por ejemplo, halloysita en suelos de ceniza volcánica en regiones húmedas). En el Cuadro 14.7 se muestra un esquema general de clasificación para algunos de los filosilicatos más comunes. Las cinco especies de filosilicatos (caolinita, esmectita (montmorillonita y beidelita), micas (incluyendo mica hidratada o illita), vermiculita y clorito) comúnmente identificadas en suelos canadienses se discuten en detalle a continuación.
Cuadro 14.7. Un esquema general de clasificación para algunos filosilicatos
| Tipo | Grupo x = carga por unidad de fórmula |
Subgrupo | Especies de ejemplo | Unidad de fórmula idealizada* |
|---|---|---|---|---|
| 1:1 | Caolinita x~0 |
Caolinita | Caolinita | Si 2, Al 2 O 5 (OH) 4 |
| Halloysita | Si 2, Al 2 O 5 (OH) 4 2H 2 O | |||
| Serpentinas | Serpentina | Si 2, Mg 3 O 5 (OH) 4 | ||
| 2:1 | Pirofillita-talco x~0 |
Pirofilita | Pirofilita | Si 4, Al 2 O 10 (OH) 2 |
| Talco | Talco | Si 4, Mg 3 O 10 (OH) 2 | ||
| Esmectita x ≈ 0.25—0.6 |
Dioctaédrico | Montmorillonita | 0.33M+Si 4 (Al 1.67, Mg 0.33) O 10 (OH) 2 | |
| Beidellita | 0.33M+ (Si 3.67 Al 0.33) (Al 2.00) O 10 (OH) 2 | |||
| Nontronita | 0.33M+ (Si 3.67 Al 0.33) (Fe (III) 2.00) O 10 (OH) 2 | |||
| Trioctaédrico | Saponita | 0.33M+ (Si 3.67 Al 0.33) (Mg 3.00) O 10 (OH) 2 | ||
| Hectorita | ||||
| Vermiculita x ≈ 0.6—0.9 |
Dioctaédrico | Vermiculita dioctaédrica | 0.86M+ (Si 3.47 Al 0.53) (Al 1.67 Mg 0.33) O 10 (OH) 2 | |
| Trioctaédrico | Vermiculita trioctaédrica | 0.86M+ (Si 3.47 Al 0.53) (Al 1.67 Mg 0.33) O 10 (OH) 2 | ||
| Micas x ≈ 1 |
Dioctaédrico | Moscovita | K 1.00 (Si 3.00 Al 1.00) (Al 2.00) O 10 (OH) 2 | |
| Paragonita | ||||
| Trioctaédrico | Biotita | K 1.00 (Si 3.00 Al 1.00) (Fe (II) 3.00) O 10 (OH) 2 | ||
| Flogopita | ||||
| 2:1:1 | Clorita x = variable |
Di-Dioctaédrico | Donbassite | (Al 2 (OH) 6) (Si, Al) 4 Al 2 O 10 (OH) 2 |
| Tri-dioctaédrico | Sudoita | (Mg 3 (OH) 6) (Si, Al) 4 Al 2 O 10 (OH) 2 | ||
| Di-Trioctaédrico | Ferri-sudoita | (Al 2 (OH) 6) (Si, Al) 4 (Mg, Fe) 3 O 10 (OH) 2 | ||
| Tri-Trioctaédrico | Clinochlore | (Mg 3 (OH) 6) (Si, Al) 4 (Mg, Fe) 3 O 10 (OH) 2 | ||
| *La secuencia de elementos dentro de la unidad de fórmula idealizada sigue el orden: catión intercambiable (si lo hay) o lámina octaédrica intercalada; cationes tetraédricos; cationes octaédricos; oxígenos e hidroxilos. Dentro de cada lámina, el catión principal (por ejemplo, sílice) es seguido por el catión o cationes que sustituyen isomorficamente. | ||||
La caolinita es un mineral arcilloso tipo 1:1 construido de una lámina tetraédrica y una lámina octaédrica (Figura 14.10). Las capas 1:1 se mantienen unidas por enlaces de hidrógeno entre las capas para que la estructura no sea expandible ya que las moléculas de agua no pueden ingresar a la región de la capa intermedia. La caolinita exhibe muy poca hinchazón cuando está húmeda, o contracción en la desecación. La capa intermedia no está expuesta y por lo tanto la superficie específica es baja. El mineral casi no tiene sustitución isomorfa; por lo tanto, estos minerales de caolinita tienen una carga superficial baja y una CEC baja, aunque tienen sitios de carga variable menor en los bordes. La caolinita es el filosilicato de tipo 1:1 más común y es ubicua en suelos canadienses.
La esmectita es un filosilicato de tipo 2:1 libremente expandible (Figura 14.11). Hay dos especies comunes de esmectita: montmorillonita y beidellita. La cantidad de sustitución isomorfa en ambos minerales es moderada en comparación con otros filosilicatos de tipo 2:1. La carga de capa para esmectitas está en el intervalo de aproximadamente 0.25 a 0.6 sitios por unidad de fórmula (M x+ (Si, Al) 4 (Al, Mg) 2 O 10 (OH) 2) donde M x+ generalmente se refiere a cationes intercambiables (por ejemplo, Na +, Mg 2+, K + , Ca 2+, etc.). La montmorillonita y la beidellita se encuentran dentro del mismo rango de carga de capa total pero se diferencian en función de la ubicación de la carga de capa en la estructura (Cuadro 14.7). La mayor parte de la carga de capa en montmorillonita se asienta en la lámina octaédrica, mientras que la mayor parte se asocia con la lámina tetraédrica de beidelita. La superficie específica es alta (alrededor de 800 m 2 g -1) y tanto las moléculas de agua como los cationes pueden ingresar al espacio intercapa.
Los suelos ricos en esmectitas son pegajosos cuando están mojados y forman grandes grietas en condiciones secas. Los suelos con textura arcillosa pesada que contienen > 60% de arcilla de los cuales al menos la mitad es esmectita se definen como Vertisoles en Canadá (SCGW, 1998). Estos suelos se describen como “auto acolchado”, ya que los ciclos repetidos de humectación y secado forman slickenslides, que son superficies pulidas en superficies ped opuestas a lo largo de las fisuras del suelo formadas donde los materiales del suelo se mueven de un lado a otro a medida que las grandes grietas continuas se vuelven a abrir y cerrar con humectación y desecación. El proceso de formación del suelo que provoca la formación de slickenslides se llama argilli-pedoturbación, siendo especialmente común en suelos vertisólicos formados en los materiales parentales glacio-lacustres ricos en esmectitas que se encuentran en las provincias de las praderas.
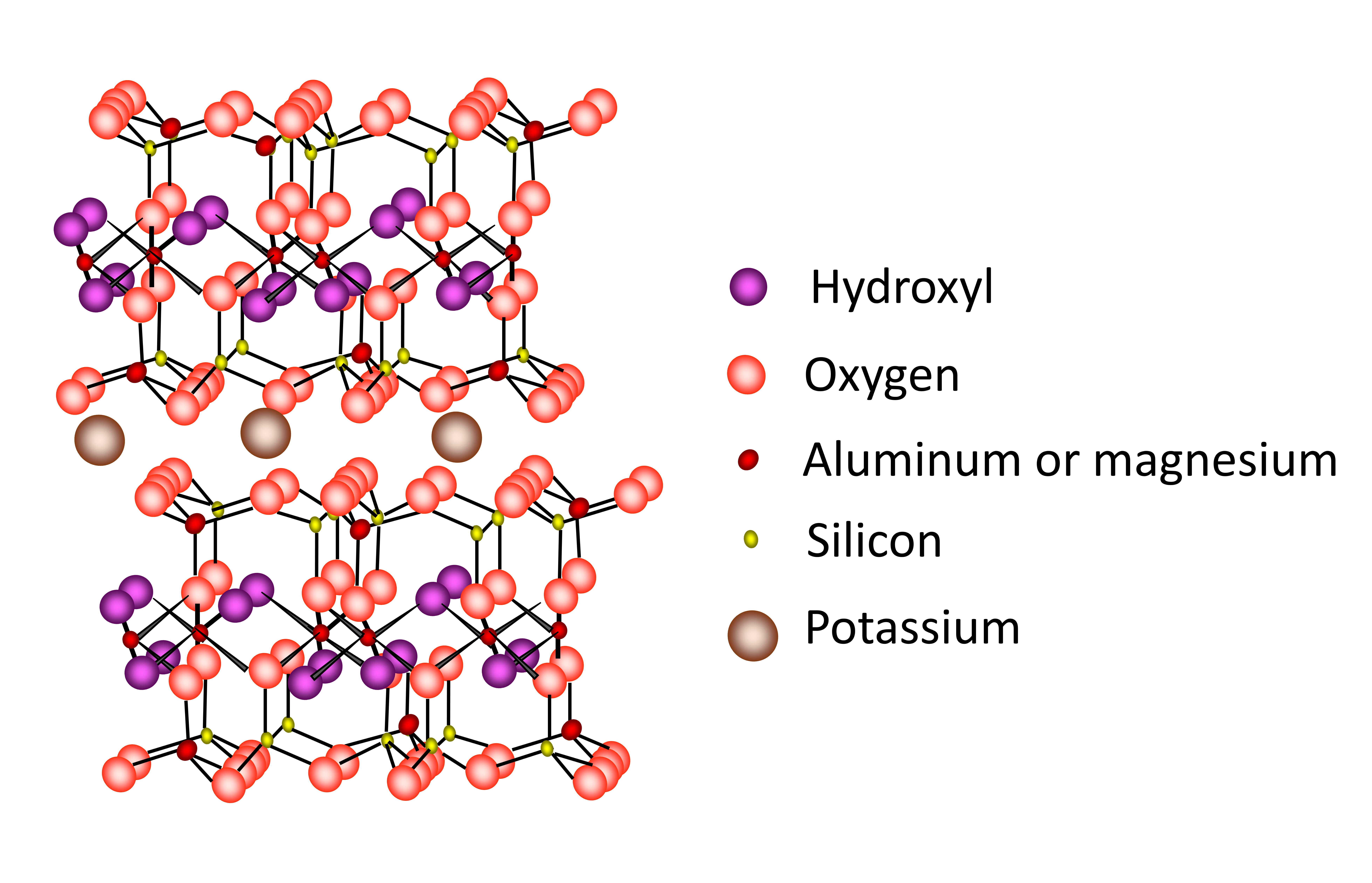
Las micas, incluyendo mica/ilita hidratada son minerales arcillosos de tipo 2:1 con dos láminas tetraédricas que intercalan una lámina octaédrica. Las capas 2:1 se mantienen firmemente juntas por K + grande en la región de la capa intermedia (Figura 14.12). La estructura de las micas es similar a la de las esmectitas excepto que la carga de capa es mucho mayor (aproximadamente 1 por unidad de fórmula) y la sustitución isomorfa ocurre casi exclusivamente en las láminas tetraédricas. El potasio ocupa casi exclusivamente la región de la capa intermedia. La carga de capa muy alta, combinada con la ubicación de la carga en las láminas tetraédricas muy cerca de la región intercalada, impide la expansión del mineral. Las micas son minerales primarios derivados del granito y rocas metamórficas del Escudo Canadiense. Las micas/ilitas hidratadas se forman en el suelo a partir de la meteorización parcial de las micas. Las micas y la mica/ilita hidratada se encuentran en casi todos los suelos de Canadá. Existen dos especies comunes de mica diferenciadas por la naturaleza de la lámina octaédrica, a saber, la moscovita dioctaédrica y la biotita trioctaédrica (Cuadro 14.7).
La mica/ilita hidratada es un producto de meteorización parcial de las micas, con parte (hasta 20-30%) de la capa intermedia K + siendo removida de la región intercalada y reemplazada por otros cationes intercambiables. También hay pérdida de Al 3+ tetraédrico de la estructura. La mica/ilita hidratada generalmente se produce a través de la meteorización de la moscovita dioctaédrica, mientras que la estructura de la biotita trioctaédrica generalmente se descompone por completo debido a la relativa facilidad de ataque químico sobre el hierro (Fe (II)) en la estructura.
Si bien la estructura básica de las micas y la mica/ilita hidratada son similares a la esmectita, las propiedades son muy diferentes principalmente debido a la mayor cantidad de sustitución isomorfa en la lámina tetraédrica, donde Al 3+ se sustituye por Si 4+ (Figura 14.12). La fuerte carga negativa localizada en las láminas tetraédricas cercanas a la superficie de la capa intermedia se equilibra con K +, bloqueando las capas adyacentes juntas. Por lo tanto, el mineral tiene una expansión limitada ya que las moléculas de agua no pueden ingresar al espacio intercapa. Dado que K + están atrapados en la celosía impidiendo la expansión, la CEC es baja.
La vermicullita es un filosilicato de tipo 2:1 que es similar estructuralmente a la esmectita y a las micas. La carga de capa está en el rango de 0.6 a 0.9 sitios por unidad de fórmula (M x+ (Si, Al) 4 Al 2 O 10 (OH) 2), que es intermedia entre las micas y las esmectitas (Figura 14.13). Al igual que en las micas, la carga de capa se ubica casi exclusivamente dentro de la lámina tetraédrica. La capacidad de expansión de la vermiculita es limitada y tiene características moderadas de hinchazón y contracción. Con una combinación de una carga de capa menor que las micas pero mayor que la esmectita y con la mayor sustitución isomorfa se encuentra en la lámina tetraédrica la vermiculita tiene una carga superficial alta y una alta CEC. Como la estructura es similar a las micas, la vermiculita es capaz de capturar iones K + en la región de la capa intermedia, revertiendo la estructura para parecerse parcialmente a mica/ilita hidratada.
Clorita es el nombre de un mineral, así como un grupo de filosilicatos de tipo 2:1:1 (o 2:2) construidos con una estructura de capas 2:1 con una capa de hidróxido en la región intercalada (Kohut y Warren 2002). El clorito mineral es la especie mineral más común dentro del grupo clorito. La estructura está compuesta por una capa de hidróxido de Al, Mg o Fe en coordinación seis veces (octaédrica) en la región intercapa entre capas de tipo 2:1 (Figura 14.13). Esta capa de hidroxilo intercapa no comparte átomos de O con la capa principal 2:1. La capa de hidróxido está unida por hidrógeno a las capas 2:1 adyacentes y no es expandible (Figura 14.13). La cantidad de sustitución isomorfa es variable, pero como la estructura no es expandible por lo que la CEC global es baja.
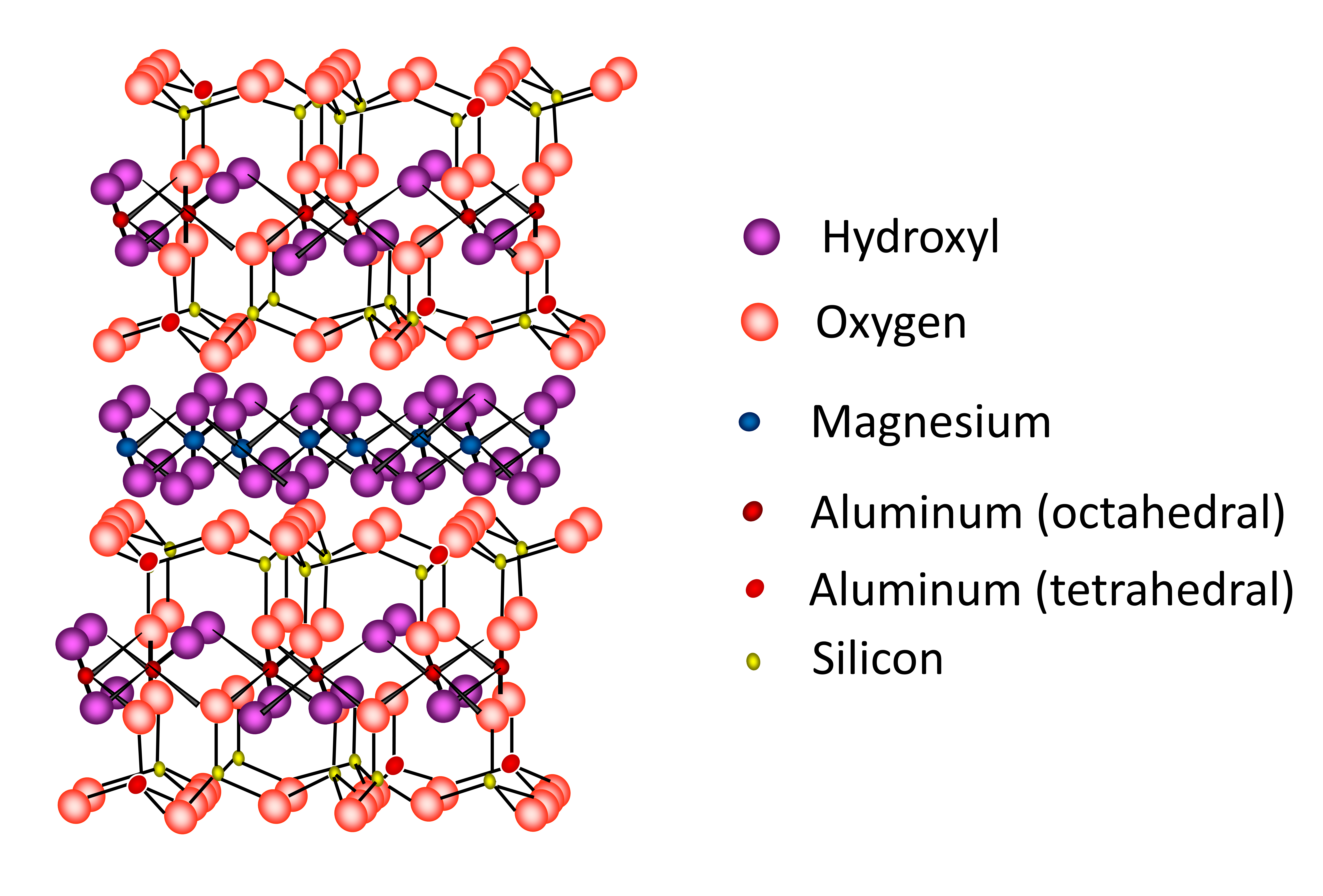
Capacidad de intercambio y superficie específica
La fracción de tamaño arcilloso de la mayoría de los suelos canadienses generalmente contiene una mezcla de los cinco filosilicatos comunes junto con pequeñas cantidades de aluminosilicatos amorfos y oxi-hidróxido de Fe y/o Al. Las proporciones son principalmente una función de los orígenes de los materiales parentales del suelo. Las variaciones en el intercambio iónico global y las propiedades adsorbentes de los suelos dependen de la mezcla de filosilicatos presentes. Las dos diferencias principales entre los filosilicatos es su CEC y la cantidad de superficie reactiva se resume en la Tabla 14.8. La caolinita tiene muy poca sustitución isomorfa y no se expande. En consecuencia, tiene un CEC muy bajo y toda la superficie está asociada con las superficies externas de la estructura. La mica/ilita hidratada y los cloritos tienen una cantidad significativa de sustitución isomorfa; sin embargo, como sus regiones intercapa contienen K + fuertemente unida o una capa de hidróxido adicional, respectivamente, lo que inhibe la expansión de la capa. Así, la CEC es limitada y las estructuras no son expandibles. Las esmectitas tienen una cantidad intermedia de sustitución isomorfa junto con la capacidad de admitir cationes intercambiables en la región de la capa intermedia. En consecuencia, tanto la CEC como la superficie total son altas. Los suelos que contienen esmectitas se destacan por su alta plasticidad, cohesión y marcada capacidad de hincharse cuando están mojados y encogerse cuando se secan. Las vermiculitas tienen más sustitución isomorfa en comparación con las esmectitas y por lo tanto tienen una CEC mayor; sin embargo, la mayor parte de la carga en las vermiculitas se concentra dentro de las láminas tetraédricas más cercanas a la región de la capa intermedia y por lo tanto tiene una mayor atracción electrostática para cationes intercambiables en el región de capa intermedia. Como resultado, aunque la superficie total de la vermiculita es similar a la de las esmectitas, la expansión de capas de las estructuras de vermiculita es limitada debido a la entrada restringida de agua a la región intercalada.
Cuadro 14.8. Rangos de capacidad de intercambio catiónico (CEC) y superficie interna y externa en filosilicatos comunes y otros coloides. (Adaptado de Weil y Brady, 2017)
| Filosilicato/Coloide | CCA (cmol (+) kg -1) |
Superficie Externa (m 2 g -1) |
Área de superficie interna (m 2 g -1) |
|---|---|---|---|
| Caolinita | 2-16 | 5-15 | ~0 |
| Clorita | 10 - 40 | 5-20 | ~0 |
| Mica/ilita hidratada | 20 - 40 | 100 - 125 | ~0 |
| Esmectita | 60 - 120 | 80 - 140 | 570 - 660 |
| Vermiculita | 100 - 150 | 70 - 120 | 600 - 700 |
| Aluminosilicatos amorfos | 5 - 350 | 500 - 1450 | ~0 |
| Fe/Al | ~0 - 3 | 200 - 500 | ~0 |
| oxihidróxidos |
¡Puedes Cavar!
Aunque no se confirmó, algunos datos sugieren que los filosilicatos podrían ser una plantilla para sintetizar ARN a partir de componentes simples y fueron el catalizador del origen abiótico de la vida misma en este planeta (Berman, 2019). Los minerales arcillosos actúan como catalizadores muy eficientes en la polimerización de aminoácidos y nucleótidos. El ARN adsorbido a minerales arcillosos se puede encapsular dentro de vesículas. Una vez formadas, tales vesículas podrían crecer y dividirse incorporando ácidos grasos mediando así la replicación de las vesículas a través de ciclos de crecimiento y división (Brack, 2013)
DISTRIBUCIÓN DE FILOSILICATOS EN SUELOS CANADIENSES
La distribución de los filosilicatos en el suelo canadiense varía un poco según la región fisiográfica (Kodama, 1979); la mayoría de los filosilicatos son heredados de los materiales progenitores depositados por la retirada de los glaciares continentales durante el Pleistoceno tardío. Por ejemplo, algunos minerales arcillosos como la caolinita, la mica, (es decir, la biotita y la moscovita) y la clorito se heredan directamente del Escudo Canadiense. Otros en la región cordillerana y las regiones de las llanuras interiores se derivan de la degradación glacial de sedimentos del período Cretácico (hace 65 millones de años). La comparación de los datos para las separaciones arcillosas de suelos, por ejemplo, de las Llanuras Interiores del oeste de Canadá con los encontrados en el este de Canadá (St. Lawrence Lowlands) muestran una clara diferencia entre el conjunto de minerales arcillosos (Cuadro 14.9). Comúnmente se reporta que la región de las Llanuras Interiores del oeste de Canadá contiene esmectita, mica del tamaño de arcilla, clorito y algo de caolinita, (Kodama, 1979; Dudas y Pawluk, 1982; Spiers et al. 1989a; Spiers et al. 1989b; Warren y Dudas, 1992). En contraste, la fracción del tamaño arcilloso de los suelos de las Tierras Bajas Occidentales de San Lorenzo (Ontario) deriva de sedimentos mucho más antiguos formados durante los períodos Devónico (359 millones) y Silúrico (443 millones) y están dominados por mica, clorito, vermiculita y caolinita del tamaño de arcilla con algunos reportes de trazas de esmectita (Kodama, 1979). Los materiales para padres en ambas regiones tuvieron contribuciones del Escudo Canadiense. Solo hay evidencia débil de alteración en los diversos conjuntos de minerales arcillosos de las diversas regiones fisiográficas y la correlación es inútil entre los tipos genéricos de suelo. Una excepción son los suelos podzólicos y en menor medida los suelos Brunisólicos y Gleysólicos donde los minerales clorito heredados parecen resistir a filosilicatos expandibles (Kodama, 1979).
Cuadro 14.9. Rango de abundancias para filosilicatos que se encuentran típicamente en las fracciones de tamaño arcilloso de suelos de las Llanuras Interiores y de las Tierras Bajas Occidentales de San Lorenzo
| Región Llanuras Interiores | Tierras bajas de San Lorenzo | |||
|---|---|---|---|---|
| Filosilicato | g kg -1 | Filosilicato | g kg -1 | |
| Caolinita | 70-110 | Caolinita | 120-150 | |
| Moscovita Discreta | 250-340 | Moscovita Discreta | 350-450 | |
| Montmorillonita | 470-490 | Vermiculita | 180-220 | |
| Clorita | 120-160 | Clorita | 240-300 | |
| Vermiculita | trazar | Esmectita | trazar | |
Aluminosilicatos amorfos
Otros aluminosilicatos hidratados también se encuentran en el suelo pero son estructuralmente diferentes de los filosilicatos. Estos se describen como amorfos (carentes de forma o forma) o nanocristalinos y no tienen una estructura cristalina ordenada definida como los filosilicatos. El alofano y la imogolita son ejemplos de minerales de aluminosilicato amorfo, comúnmente formados durante la rápida meteorización en suelos de ceniza volcánica que se encuentran en climas húmedos de países como Nueva Zelanda, Chile y Japón. La ceniza volcánica se endurece rápidamente y normalmente se disuelve liberando grandes cantidades de aluminio soluble y sílice, que puede precipitar como alofano o imogolita. Los aluminosilicatos amorfos no son expansibles, pero son extremadamente pequeños (<4 nm de diámetro) con una superficie específica extremadamente alta (700-1500 m 2 g -1) y capacidades de intercambio iónico muy altas. Aunque ocurren en abundancia en suelos de ceniza volcánica, pueden ocurrir en pequeñas cantidades en algunos suelos junto con filosilicatos. La imogolita, por ejemplo, está documentada en algunos suelos podzólicos humo-férricos en Columbia Británica (Grand y Lavkulich, 2013; 2015); en otras partes de Canadá (McKeague y Kodama, 1981; Wang et al., 1991) y Solodized Solonetzic en Alberta (Spiers et al., 1984).
OXIHIDRÓXIDOS DE HIERRO Y ALUMINIO
Las arcillas oxihidróxido (sesquióxidos) son óxidos secundarios, hidróxidos y minerales de óxido hidratado de Fe, Al y Mn. Algunos están bien cristalizados (por ejemplo, gibbsita, hematita, goetita), mientras que otros son amorfos. Estos minerales son la fuente habitual de tonos rojos, amarillos, marrones y azulados observados en el suelo. Las arcillas de óxido cristalino están compuestas por láminas de oxígeno y/o grupos hidroxilo en disposición octaédrica con Fe, Al o Mn. No tienen láminas tetraédricas de Si en sus estructuras. Las estructuras octaédricas de estos minerales se mantienen unidas por enlaces de hidrógeno, por lo tanto, no se expanden. Posteriormente se descubrió que los óxidos e hidróxidos de hierro que alguna vez se llamaban “limonita” eran realmente una mezcla de minerales de oxihidróxido de Fe.
Estos minerales no llevan cargas negativas permanentes identificables, pero sí tienen una alta carga superficial asociada con grupos hidroxilo superficiales. Como tal, la capacidad de intercambio de oxihidróxidos es altamente dependiente del pH con la variación en las cargas superficiales debido a la protonación de grupos hidroxilo a pH bajo produciendo cargas positivas y disociación de grupos hidroxilo a pH alto produciendo cargas negativas. Los minerales oxihidróxido son referidos como anfóteros debido a su variable CEC. Estos minerales suelen tener una CEC neta a pH alto y una capacidad neta de intercambio de aniones en rangos de pH bajos.
Los oxihidróxidos suelen encontrarse en pequeñas cantidades en suelos canadienses (Grand y Lavkulich, 2013; 2015; Spiers et al., 1984). Son altamente reactivos con una superficie específica muy alta. La presencia de estos minerales influye significativamente en las propiedades del suelo como la adsorción e intercambio de iones. Por ejemplo, los oxihidróxidos de Fe son capaces de adsorber y retener grandes cantidades de iones fosfato, molibdato y borato de la solución del suelo, así como eliminar metales como Cu, Pb, Zn, Co, Cr y Ni. Algunos oxihidróxidos comunes de Fe se enumeran en el Cuadro 14.10.
Cuadro 14.10. Algunos oxihidróxidos de hierro secundarios comunes encontrados en el suelo
| Mineral | Fórmula | Notas |
|---|---|---|
| Goethita | α-Feooh | Los oxihidróxidos de hierro más comunes y abundantes en suelos. De amarillo a amarillo parduzco. Tamaño de partícula muy fino. Precipita rápidamente de Fe 3+ en solución. Cristales similares a agujas muy pequeños (<0.5 um). |
| Lepidocrocita | γ-Feooh | Se encuentra en suelos mal drenados como moteados de color naranja brillante pero NO comunes. Formado por oxidación de Fe (II) (OH) 2 precipitado en ausencia de CO 2 a pH 5-7. Cristales extremadamente pequeños (0.1-0.5 um) en forma de listón. |
| Hematita | α-FE 2 O 3 | Segundo en abundancia a la goetita. Prevalentes en suelos tropicales. Formas por deshidratación de goethita y ferrihidrita. Cantidades muy pequeñas imparten un color rojo al suelo. |
| Ferrihidrita (también conocido como hidróxido férrico hidratado) |
(Fe (III)) 2 O 3 ·0.5H 2 O pero también 5Fe 2 O 3 ·9H 2 O |
Composición altamente variable. Precipita directamente de agua oxigenada rica en Fe o bacterias a través de la actividad biológica. Naranja rojizo. Forma nanocristales. Metaestable. |
CARBONATOS
Algunos minerales carbonatados comunes que se encuentran en el suelo se presentan en el Cuadro 14.11. La mayoría de los carbonatos del suelo provienen de fuentes primarias, siendo heredados de rocas sedimentarias, y algunos son precipitados secundarios que generalmente se encuentran en horizontes subsuperficiales. La estructura cristalina de muchos minerales carbonatados refleja la simetría trigonal del ion carbonato que generalmente ocurre en combinación con Ca, Na, U, Fe, Al, Mn, Ba, Zn, Cu, Pb y otros elementos. Hay alrededor de 80 minerales carbonatados conocidos; sin embargo, los minerales carbonatados más comunes que se encuentran en suelos canadienses son la calcita (CaCo 3) y la dolomita ((Ca, Mg) CO 3) derivados principalmente del lecho rocoso paleozoico. La mayoría de los minerales carbonatados suelen contener trazas de otros elementos relacionados con el carbonato (ver arriba) sustituidos en sus estructuras.
La calcita es escasamente soluble, pero la solubilidad aumenta a valores de pH más bajos del suelo y no suele encontrarse en suelos con valores de pH menores a 6.0. La calcita se disuelve típicamente del solum y se lixivia para volver a depositarse en el perfil inferior del suelo, algunas veces observadas como nódulos de calcita secundarios (Miller et al., 1987; Wang y Anderson, 2000). La aragonita y otros minerales de carbonato de calcio no son comunes ni estables en los suelos.
Cuadro 14.11. Algunos minerales carbonatados comunes
| Mineral | Fórmula Ideal | Notas |
|---|---|---|
| Calcita* | CaCo 3 | Componente mineral principal en piedra caliza. Típicamente inestable y se disuelve en el solumn superior pero puede precipitar en el horizonte C generalmente bajo regímenes climáticos subhúmedos o secos. |
| Aragonita* | CaCo 3 | Derivado de conchas fósiles de origen geológico. Inestable y se disuelve en suelo. |
| Dolomita | (Ca, Mg) CO 3 | Derivado de rocas sedimentarias (dolostone) de origen geológico. Inestable y se disuelve en suelo. |
| Siderita | Fe (II) CO 3 | Derivado de rocas sedimentarias o metamórficas. Inestable en suelo pero muy lento para disolverse. |
| Magnesita | MgCo 3 | Altamente soluble en suelo. |
| trona | Na 2 CO 3 | Altamente soluble en suelo. Se encuentra principalmente en suelos Solonetzicos a pH alto (~9.5) |
| *La calcita y la aragonita son polimorfos con la misma fórmula química pero diferentes estructuras cristalinas. | ||
La dolomita (Ca, Mg (CO 3) 2) es un mineral común de carbonato de calcio-magnesio que se encuentra en suelos derivados del lecho rocoso de dolostone. Al igual que la calcita, la dolomita se disuelve desde el perfil superior, aportando calcio a la precipitación de calcita secundaria en el perfil inferior mientras que el componente de magnesio es principalmente lixiviado o absorbido por las raíces de las plantas. Algunos Mg 2+ pueden sustituir al Ca 2+ dentro de los carbonatos secundarios pero la cantidad es menor (< 10%), ocurriendo principalmente si la lixiviación está restringida (St. Arnaud, 1979).
Los carbonatos imparten una serie de propiedades al suelo que incluyen:
- mantener una alta saturación de base;
- mantener altos Ca y Mg intercambiables;
- mantenimiento de pH >7;
- adsorción/precipitación de iones PO 4 3-;
- adsorción/precipitación de metales (por ejemplo, Al, Zn, Pb, Fe, Ni, Mn); y
- estabilizando las arcillas y la estructura del suelo.
MINERALES DE FOSFATO
Minerales Fosfato Primario
La abundancia cortical promedio de P se reporta como 1050 mg kg -1, mientras que el contenido total de P en suelos se encuentra típicamente en el rango de 400—800 mg kg -1. El fosfato se puede combinar fácilmente con aproximadamente 30 elementos diferentes que forman más de 300 minerales que contienen P (Bleam, 2017). Algunos son minerales primarios que contienen fosfato derivados de rocas sedimentarias e ígneas, pero la mayoría son minerales que contienen fosfato que tienen PO 4 sustituido en sus estructuras como una “impureza” menor.
Los minerales de fosfato primarios “puros” más comunes son referidos por el nombre del grupo “apatita” y se les da la fórmula química general: Ca 5 (PO 4) 3 (F, Cl, OH). La apatita suele presentarse como cristales hexagonales muy pequeños con una variedad de colores incluyendo verde, verde azulado, marrón, blanco, amarillo, rojo, gris y otros dependiendo de las impurezas. Los nombres para minerales específicos para los tres miembros finales comunes de la apatita son los siguientes:
- fluoroapatita Ca 5 (PO 4) 3 F
- cloroapatita Ca 5 (PO 4) 3 Cl
- hidroxiapatita Ca 5 (PO 4) 3 OH
En la naturaleza, estos minerales se presentan como mezclas, generalmente dominadas por uno de los tres componentes (F, Cl y OH) dependiendo de la fuente. El fosfato de roca o fosforita generalmente contiene la mayor concentración de estos minerales y se extrae principalmente para la producción de fertilizantes fosfatados. En los suelos, la apatita puede originarse de casi cualquier roca ígnea o metamórfica que ocurre principalmente como fases accesorias (Nezat et al., 2007) pero raramente como una fase mineral principal en roca. La estructura mineral también puede contener sustituciones con una gran variedad de iones incluyendo carbonato (CO 3 2-), arseniato (AsO 4 2-), V, Th, Pb, Sr, Ba, U y elementos de tierras raras.
Minerales de fosfato secundario
Generalmente el fosfato en el suelo reacciona fácilmente con Ca 2+, Al 3+ y Fe 2+ y Fe 3+ formando una variedad de precipitados secundarios (Cuadro 14.12). Esto incluye fosfato derivado de fuentes minerales primarias y fertilizantes fosfatados. Los fosfatos de hierro (vivianita y strongita) son más comunes en suelos subóxicos donde el hierro disuelto es más abundante. Los fosfatos de aluminio (varisita) se asocian con mayor frecuencia con suelos ácidos donde el fosfato precipita primero como un intermedio amorfo que finalmente se transforma en varisita (Lindsay et al., 1959). Los fosfatos de calcio secundarios generalmente ocurren en suelos calcáreos que contienen piedra caliza (calcita mineral) como fuente de calcio (Kar et al., 2012). La brushita secundaria se precipita comúnmente en suelos calcáreos como resultado de colocar altas concentraciones de fertilizante en bandas para la producción de cultivos (McLaughlin et al., 2011).
Cuadro 14.12. Algunos minerales de fosfato secundarios comunes que ocurren en el suelo
| Grupo | Nombre del mineral | Fórmula Ideal | Ocurrencia |
|---|---|---|---|
| Hierro | Vivianita | Fe (II) 3 (PO 4) ·2.8H 2 O | Suelos inundados/húmedos |
| Fosfatos | Strengite | Fe (III) (OH) 2 (H 2 PO 4) o FePO 2 ·2H 2 O | Suelos inundados/húmedos |
| Fosfatos de aluminio | Variscita | Al (OH) 2 (H 2 PO 4) o AlPO 4 ·2H 2 O | Suelos ácidos |
| Fosfatos de calcio | Brushita | CaHpo 4 ·2H 2 O | Suelos calcáreos |
SULFATOS Y SULFUROS
Los minerales sulfurados no están presentes en suelos bien o imperfectamente drenados, pero pueden encontrarse en algunos suelos Gleysólicos u Orgánicos mal drenados. El mineral sulfurado pirita (FeS 2) es mineral primario muy común en los desechos mineros, pero puede presentarse en lutitas (una roca sedimentaria que contribuye a algunos suelos) y como precipitado en algunos suelos mareales en respuesta a condiciones altamente reductoras. La pirita una vez expuesta a la atmósfera se oxida fácilmente liberando hierro y ácido sulfúrico:
2FeS 2 + 7O 2 + 2H 2 O → 2Fe 2+ + 4H + + 4SO 4 2-
A medida que se libera hierro reducido (Fe (II)) en la estructura de sulfuro, se oxida y precipita como oxihidróxido. La oxidación del S reducido se combina con el agua para producir un ácido fuerte (H 2 SO 4). La exposición antropogénica de minerales sulfurados durante las operaciones mineras u otras excavaciones es la principal responsable del drenaje ácido de roca (ARD). Los valores de pH del suelo menores a 2.0 pueden ser el resultado de la oxidación de sulfuros. El sulfato derivado de la oxidación de sulfuros u otras fuentes forman yeso (Cuadro 14.13) generalmente en respuesta al pH alto y la presencia de Ca soluble.
Cuadro 14.13. Algunos minerales que contienen azufre
| Tipo | Mineral | Fórmula Ideal |
|---|---|---|
| Sulfuros | Pirita | FeS 2 |
| Pirrotita | Fe (1-x) S (x = 0 a 0.2) | |
| Esfalerita | ZnS | |
| Galena | PbS | |
| Calcopirita | CUFes 2 | |
| Arsenopirita | FeAsS | |
| Pentlandita | (Fe, Ni) 9 S 8 | |
| Cinabrio | HgS | |
| Marcasita | FeS 2 | |
| Sulfatos | Yeso | CASO 4 ·2H 2 O |
| Barita | BaSO 4 |
RESUMEN
En resumen, el material parental de la mayoría de los suelos minerales de Canadá fue depositado por la acción física de los glaciares. La mayoría de los minerales en estos suelos se derivan del Escudo Canadiense o se reelaboran y redepositan de otras fuentes durante las glaciaciones en los milenios anteriores a la glaciación tardía de Wisconsin. Los minerales primarios que componen la mayor parte de la fracción del tamaño de arena de los suelos canadienses generalmente están dominados por cuarzo y feldespatos, con una cantidad menor de minerales pesados. La meteorización química de la fracción de tamaño de arena aporta componentes a la formación de minerales secundarios y a los nutrientes para la absorción de las plantas. Los filosilicatos dominan la fracción de tamaño de arcilla y constituyen la fase inorgánica más activa químicamente en el suelo. Las diferencias entre la composición de filosilicato de la fracción de tamaño de arcilla que se encuentran en regiones del oeste y este de Canadá se deben principalmente a la fuente de los materiales parentales. El limo, intermedio en el rango de tamaño entre las fracciones tamaño arena y arcilla, contiene una mezcla física de minerales de estas fracciones.
REFERENCIAS
Ando, S. 2020. Separación gravimétrica de minerales pesados en sedimentos y rocas. Minerales. 10 (3): 273
Berman, J.J. 2019. Guía clínica de evoluciones. Traducir genes antiguos a medicina de precisión. Prensa Académica. 357pp.
Beutelspacher, H., y H. Van Der Marel, 1968. Atlas de microscopía electrónica de minerales arcillosos y sus mezclas. Un atlas de imágenes. Elsevier. 333pp.
Bleam, W.F. 2017. Química ambiental y de suelos, 2ª Edición. Prensa Académica. 573pp.
Brack, A. 2013. Los minerales arcillosos y el origen de la vida. Capítulo 10.4. Desarrollos en Ciencia de Arcilla. Elsevier. 507-521pp.
Bowen, H J M, 1979. Química ambiental de los elementos. Academic Press, Londres, Nueva York.
Cousineau, P.A. 2020. Comunicación Personal.
Dudas, M.J. y Pawluk, S. 1982. Reevaluación de la ocurrencia de filosilicatos interestratificados y otros filosilicatos en suelos del sur de Alberta. Revista Canadiense de Ciencia del Suelo. 62:61-69.
Fanning, D., Rabenhorst, M. y R. Fitzpatrick. 2017. Desarrollos históricos en la comprensión de suelos sulfatados ácidos. Geoderma 308:191-206. http://dx.doi.org/10.1016/j.geoderma.2017.07.006
Finkl C.W. 1981. Mineralogía de suelos. En: Mineralogía. Enciclopedia de Ciencias de la Tierra. Springer, Boston, MA. https://doi.org/10.1007/0-387-30720-6_133
Grand, S y L.M. Lavkulich. 2013. Influencia potencial de minerales poco cristalinos en la química del suelo en Podzols del suroeste de Canadá. Revista Europea de Ciencia del Suelo 64 (5) :651-660.
Grand, S y L.M. Lavkulich. 2015. Las fases minerales de orden corto controlan la distribución de macronutrientes importantes en suelos forestales de textura gruesa de la costa de Columbia Británica, Canadá. Planta y Suelo. DOI 10.1007/s11104-014-2372-6
Havlin, J. L, Tisdale S.L, Nelson W.L., Beaton, J.D. 2005. Fertilidad del suelo y fertilizantes: Una introducción al manejo nutrimental, 7ª edición. Pearson. 528pp.
Kar, G., Peak, D. y J. Schoenau. 2012. Distribución Espacial y Especiación Química del Fósforo del Suelo en una Aplicación de Banda. Soil Science Society of America Revista 76 (6) :2297-2306. DOI: 10.2136/sssaj2012.0146
King, H.M., 2020. Feldespato. Geology.com. https://geology.com/minerals/feldspar.shtml
Kodama, H. 1979. Minerales arcillosos en suelos canadienses; su origen, distribución y alteración. Revista Canadiense de Ciencia del Suelo. 59:37-58.
Kohut, C.K. y Warren, C.J., 2002. Cloritos. En Amonette, J.E. Bleam, W.F. Shultz, D.G. y J.B Dixon (eds.). Mineralogía de Suelos con Aplicaciones Ambientales. Serie de Libros de la Sociedad de Ciencias del Suelo de América. No. 7, Madison, WI. 531-553pp.
Lindsay, W.L. Peech, M. Clark, J.S. 1959. Criterios de solubilidad para la existencia de variscita en suelos. Revista Soil Science Society of America. 23 (5): 357-360.
Loganathan, P. 1987. Calidad del Suelo, Propiedades físicas del suelo. http://www.fao.org/3/AC172E/AC172E04.htm#ch4
Liu, C. Li, X. Xu, F. Huang, P.M. 2003. Microscopía de fuerza atómica de coloides inorgánicos del suelo. Ciencia del Suelo y Nutrición Vegetal. 49 (1): 17-23.
Maitre J., Bouchard K., Bédard L.P. 2019. Reconocimiento de granos minerales mediante visión por computador y aprendizaje automático. Computadoras y Geociencias 130:84-93.
McKeague, J.A. y H. Kodama. 1981. Imogolita en horizontes cementados de algunos suelos de Columbia Británica. Geoderma 25 (3-4): 189-197.
McLaughlin, M.J., McBeath, T.M., Smernik, R., Stacey, S.P., Ajiboye, B. y G. Guppy. 2011. La naturaleza química de la acumulación de P en suelos agrícolas: implicaciones para el manejo y diseño de fertilizantes: una perspectiva australiana. Suelo Vegetal 349:69 —87.
Miller, J. J., Dudas, M. J. y Longstaffe, F. J. 1987. Identificación de minerales carbonatados pedogénicos mediante isótopos estables de carbono y oxígeno, difracción de rayos X y análisis SEM. Revista Canadiense de Ciencia del Suelo. 67:953-958.
Mindat. 2020. https://www.mindat.org/
Sociedad Mineralógica de América (MSA) 1997-2020. http://www.minsocam.org/msa/collectors_corner/faq/faqmingen.htm
Sociedad Mineralógica de América (MSA) 2004-2020. http://www.handbookofmineralogy.org/search.html?p=all
Nezat, C.A. Blum, J.D. Yanai, R.D. y Hamburgo, S.P. 2007. Extracción secuencial para determinar la distribución de apatita en charcos minerales de suelo granitoide con aplicación a la intemperie en el Bosque Experimental Hubbard Brook, NH, EE. UU. Geoquímica Aplicada. 22 (11): 2406-2421.
Parikh, S. J. & James, B. R. 2012. Suelo: La base de la agricultura. Conocimiento de Educación de la Naturaleza. 3 (10): 2
Pauling, L. 1929. Los principios que determinan la estructura de los cristales iónicos complejos. Revista de la Sociedad Americana de Química. 51 (4): 1010-1026.
Rutter, N.W. y White, M. 2015. Glaciación. La Enciclopedia Canadiense. https://www.thecanadianencyclopedia.ca/en/article/glaciation
Smart, P. y Tovey, N.K. 1981. Microscopía electrónica de suelos y sedimentos: Ejemplos. Prensa de la Universidad de Oxford. 400pp.
Grupo de Trabajo de Clasificación de Suelos (SCWG), 1998. El sistema canadiense de clasificación de suelos. 3ª Edición. Agricultura y Agroalimentación Canadá. Publicación 1646. 187pp.
Spiers, G.A., M.J. Dudas y L.W. Turchenek. 1989a. La composición química y mineralógica de los materiales parentales del suelo en el noreste de Alberta. Revista Canadiense de Ciencia del Suelo. 69:721-738.
Spiers, G.A., M.J. Dudas, K Muehlenbachs y L.W. Turchenek. 1989b. Mineralogía y geoquímica isotópica de oxígeno de arcillas de depósitos superficiales en el área de Arenas Tar de Athabasca. Revista Canadiense de Ciencias de la Tierra. 21:53-60.
Spiers, G.A., Pawluk, S., M.J. Dudas. 1984. Formación mineral autígena por solodización. Revista Canadiense de Ciencia del Suelo. 64:515 532.
San Arnaud, R.J. 1979. Naturaleza y distribución de carbonatos secundarios del suelo dentro de paisajes en relación con las relaciones solubles Mg ++ /Ca ++. Revista Canadiense de Ciencia del Suelo. 59:87-98.
Wang, D. y Anderson, D.W. 2000. Carbonato pedogénico en suelos chernozémicos y paisajes del sureste de Saskatchewan. Revista Canadiense de Ciencia del Suelo. 80:251-261.
Wang, C., Ross G.J., Torrance, J.K., Kodama, H. 1991. La formación de horizontes B podzólicos e imogolita pedogénica influenciada por el microrrelieve dentro de un pedón. Geoderma. 50:63-77.
Warren, C.J. y Dudas, M.J. 1992. Acidificación adyacente a una reserva de azufre elemental: I Meteorología mineral. Revista Canadiense de Ciencia del Suelo. 72:113-126.
Weil, R.R. y Brady, N.C. 2017. La naturaleza y propiedades de los Suelos. 15a Edición. Educación Pearson. 1086pp.
Acerca de los Autores
C. James (Jim) Warren, Ph.D. P.Geo., Especialista en Recursos de Tierras, Ministerio de Agricultura de Ontario, Alimentación y Asuntos Rurales, Guelph, Ontario, Canadá.

Jim Warren P.Geo. es un científico ambiental del suelo con una formación diversa en investigación, consultoría y enseñanza. Soy egresado tanto de la Universidad de Guelph (B.Sc. (Agr), Ciencias del Suelo), y la Universidad de Alberta (M.Sc. Ciencias del Suelo; Ph.D. Química de Suelos). Realicé investigaciones en agronomía, geoquímica y mineralogía en la Universidad de Guelph y la Universidad de Waterloo antes de convertirme en consultora privada en drenaje de minas ácidas. Actualmente estoy empleado como Especialista en Recursos de Tierras realizando trabajos de levantamiento de suelos y pedología con el Ministerio de Agricultura de Ontario, Alimentación y Asuntos Rurales, y también soy Profesor Adjunto de la Universidad de Guelph. He impartido cursos de ciencias del suelo, mineralogía del suelo, química del suelo, geoquímica y pedología como profesor de sesión en cuatro universidades (Alberta, Guelph, Waterloo y Toronto). He sido autor o coautor de más de 100 publicaciones en revistas arbitradas; capítulos de libros, actas de conferencias e informes.
¿Cómo me interesaron los suelos? Bueno, crecí en una granja donde, cuando era adolescente, pasaba mucho tiempo en un tractor haciendo operaciones de labranza y tenía mucho tiempo para pensar. Una de las preguntas que me hice durante largos días en el campo fue: “¿Qué hace que las plantas crezcan?” Con eso pasé las siguientes décadas tratando de entender los suelos para responder a esa pregunta. La búsqueda continua..
Graeme Spiers, Cátedra de Monitoreo Ambiental y Profesor, Escuela del Medio Ambiente, Departamento de Ciencias de la Tierra/Departamento de Biología, Laurentian University, Sudbury, Ontario, Canadá.

Graeme Spiers es actualmente docente en la Escuela de Medio Ambiente, el Departamento de Ciencias de la Tierra y el Departamento de Biología de la Universidad Laurentian. Obtuve una licenciatura en Ciencias de la Tierra y Botánica en la Universidad de Waikato en Nueva Zelanda, y M.Sc. y Ph.D. de la Universidad de Alberta, especializándome en Pedología, Mineralogía de Arcilla y Química. Con experiencia en laboratorio comercial y consultoría en Canadá, me he asociado con programas de investigación en las Universidades de Alberta, Guelph, Waterloo, Laurentian y New Brunswick. Mi investigación ha resultado en numerosas publicaciones técnicas y científicas y presentaciones en química analítica, química acuática, geología ambiental, ecología, biología vegetal y ciencia del suelo. Antes de asistir a la universidad a tiempo completo, fui agricultor lechero de Nueva Zelanda durante 10 años, obteniendo mi licenciatura como pasatiempo a largo plazo entre ordeños. En Sudbury, estoy involucrado en iniciativas de investigación que examinan los efectos de las emisiones antropogénicas históricas y actuales de metales en suelos, ríos y lagos, así como la vegetación dentro de la Huella de Fundición de Sudbury. Estoy activamente involucrado en una variedad de programas de investigación en todo Canadá, y colaboro activamente con investigadores en Rusia (Universidad Estatal de Moscú y la Academia Rusa de Ciencias), Australia, Nueva Zelanda, China, Perú y Sudáfrica.


