1.4: La naturaleza del agua
- Page ID
- 88533
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
1.4.1 Introducción
Los seres humanos en general, y muchas veces incluso los científicos en particular, se inclinan a dar por sentada el agua: está casi literalmente en todas partes, y no podemos vivir sin ella. Es difícil citar un proceso —físico químico o biológico— que opere sobre o cerca de la superficie de la Tierra que no involucre el agua de una manera sustancial, si no esencial. Debido a que el agua parece tan ordinaria, tendemos a juzgar el comportamiento de tantas otras sustancias con referencia a ella. En realidad, sin embargo, el agua es un compuesto muy inusual, muy diferente en muchas (pero de ninguna manera todas) de sus propiedades y aspectos de comportamiento de lo que uno esperaría en vista de su composición aparentemente simple y bajo peso molecular. Solo un ejemplo debería bastar aquí: la expansión cuando el agua sólida se descongela a agua líquida. Esto está cerca de ser único, y tiene profundas implicaciones para los procesos y la vida en la superficie de la Tierra.
En esta sección se intenta realizar un estudio de la naturaleza y propiedades del agua. Su objetivo es mostrarle los hechos más importantes sobre la naturaleza y las relaciones entre el agua en sus estados sólido, líquido y gaseoso, y cómo estos pueden explicarse a nivel molecular. Este último esfuerzo será necesariamente algo superficial, porque un enfoque fundamental del comportamiento del agua es fuertemente cuántico-mecánico, y también porque todavía hay mucho que no se entiende bien.
1.4.2 La Molécula de Agua
Las propiedades inusuales del agua son una consecuencia directa de la estructura de la molécula de H2O, así que te daré algunos datos sobre su geometría, estructura y estado eléctrico antes de observar el comportamiento y las propiedades del agua.
Está bien establecido que la molécula de agua consiste en dos átomos de hidrógeno y un átomo de oxígeno dispuestos como un triángulo isósceles. El ángulo H-O-H es de aproximadamente 104.5°, y la longitud de enlace O-H es muy cercana a 0.1 nm (nanómetros; 10-9 metros). Suponiendo que el radio atómico efectivo del oxígeno sea de 0.14 nm y que el de los hidrógenos sea de 0.12 nm, una forma de esquematizar la molécula de agua se muestra en la Figura 1-24. Se sabe que esta geometría básica es poco afectada por el ambiente cambiante de la molécula en forma gaseosa, líquida o sólida en un amplio rango de temperaturas y presiones.
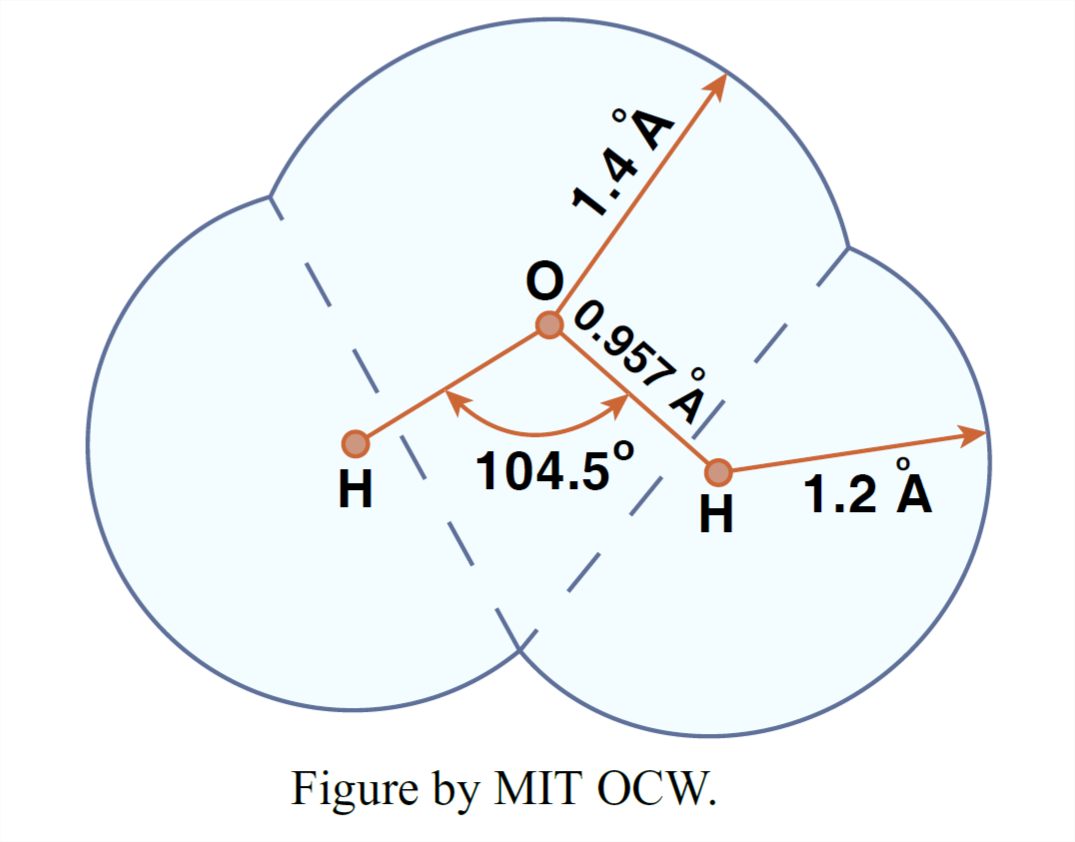
Tenga en cuenta, sin embargo, que la imagen en la Figura 1-24 es algo así como una falsificación, porque lo que realmente gobierna cómo se ve la molécula al mundo exterior es la distribución de electrones alrededor de los tres núcleos, porque eso es lo que determina qué tan cerca se puede llegar a la molécula desde cualquier dirección dada antes enormes fuerzas repulsivas se acumulan a medida que intentas penetrar en el campo de electrones.
Los tres núcleos de la molécula de agua están siempre experimentando vibraciones, de tres tipos (Figura 1-25): los dos hidrógenos oscilan hacia adelante y hacia atrás a lo largo de las direcciones oxígeno-hidrógeno en fase (esto se llama vibración de estiramiento simétrico); los dos hidrógenos oscilan hacia adelante y hacia atrás a lo largo de las direcciones oxígeno-hidrógeno un medio ciclo fuera de fase (esto se llama vibración de estiramiento asimétrico); y los dos hidrógenos se mueven en fase en direcciones opuestas a lo largo de arcos circulares que se encuentran en el plano de la molécula (esto se llama vibración de flexión). Estos son los modos fundamentales o normales de la vibración; la vibración real es una superposición lineal de estos (en otras palabras, todos se suman, sin que ninguno afecte a ninguno de los otros). Los periodos de las oscilaciones son extremadamente pequeños, ¡del orden de 10-14 s!

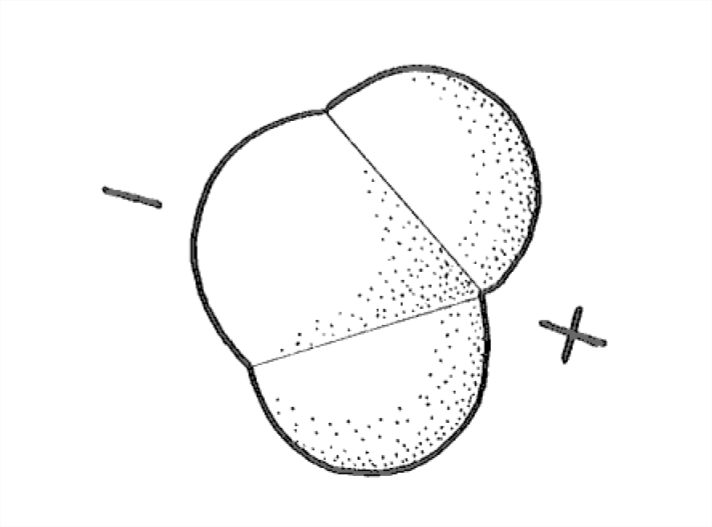
La distribución de los electrones, en el espacio, dentro y alrededor de la molécula de agua —la característica más importante de la molécula en términos de unión— no es lo que se podría adivinar. Debido a que el oxígeno está cerca del lado derecho de la tabla periódica y el hidrógeno está en el lado izquierdo, debería parecer razonable que los electrones tienden a estar más cerca del oxígeno que en las proximidades de los hidrógenos. La molécula es así lo que se llama una molécula polar: el “extremo” o “lado” de oxígeno tiene una carga eléctrica negativa, y el “extremo” o “lado” de hidrógeno tiene una carga eléctrica positiva (Figura 1-26).
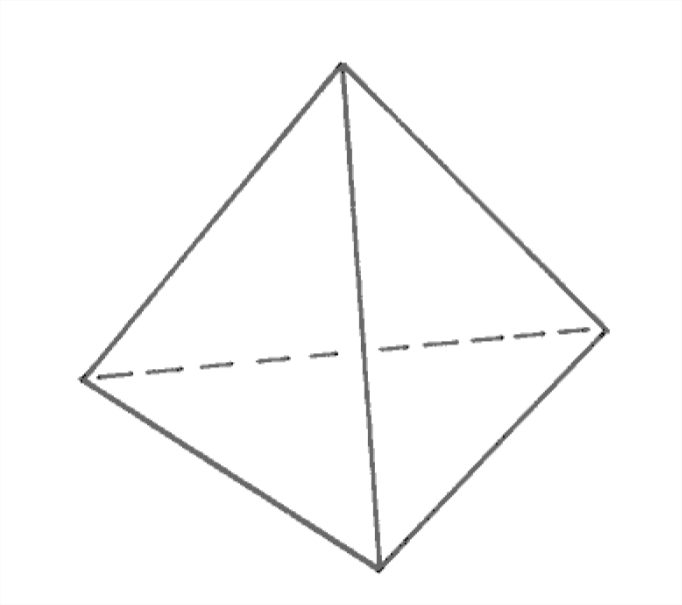
Pero una forma más fundamental de ver la distribución electrónica de la molécula de agua (una forma que está más allá del alcance de este curso) tiene que ver con la estructura cuántico-mecánica de las “órbitas” de electrones, o, más propiamente, orbitales electrónicos. Los seis electrones en la capa de electrones más externa del oxígeno (esos son los que intervienen en la unión con otros átomos) resultan estar en orbitales equivalentes, y la forma en que puedes organizar cuatro direcciones en el espacio de la manera más equivalente o no preferencial es tetraédricamente, es decir, partiendo del centro de un tetraedro, en las direcciones hacia los cuatro vértices del tetraedro (Figura 1-27). Dos de estas posiciones tetraédricas están asociadas con la unión con los dos hidrógenos, y las otras dos son lo que voy a llamar muy extraoficialmente aquí las posiciones abiertas. La Figura 1-28 es un boceto crudo de la geometría de las direcciones de unión.

1.4.3 Hielo
Analizaremos la estructura del hielo antes de preocuparnos por el agua líquida, porque su estructura es bien conocida, gracias a la técnica de difracción de rayos X. El hielo con el que tú y yo estamos familiarizados se conoce como hielo I (o, más precisamente, hielo Ih). Esta es la forma de hielo que se encuentra a presiones ambiente y bajas temperaturas. A presiones más altas hacen su aparición otros polimorfos de hielo, pero nunca ocurren bajo las condiciones de la superficie y la atmósfera de la tierra. (Los minerales que tienen la misma composición pero diferente estructura cristalina se denominan polimorfos entre sí).
Lo más llamativo y muy inusual del hielo Ih es la apertura de su estructura. Esto surge de la forma en que las moléculas de agua se unen entre sí. Las moléculas de agua están unidas por lo que se denominan enlaces de hidrógeno (Figura 1-29): uno de los átomos de hidrógeno de una molécula está unido electrostáticamente al átomo de oxígeno de la otra molécula, de tal manera que el hidrógeno se une al oxígeno en una de las posiciones abiertas, de las cuales hay dos, recuerden, en relación tetraédrica entre sí.
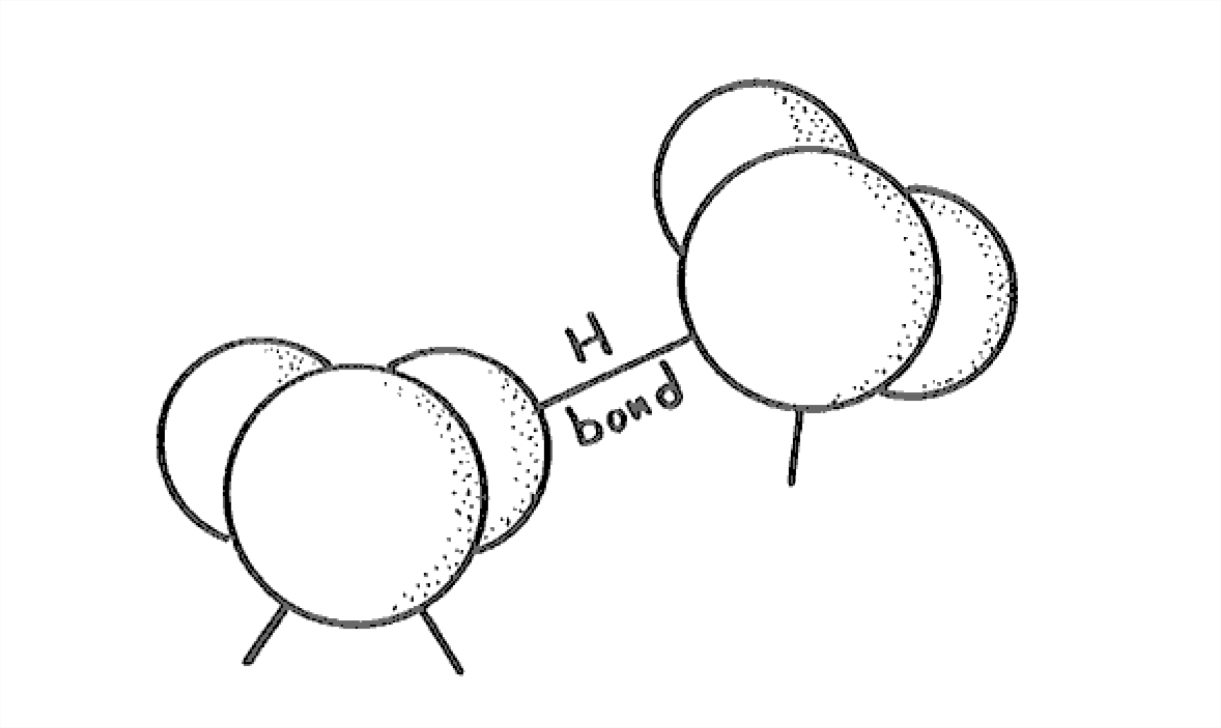
El enlace de hidrógeno no es tan fuerte como los enlaces de oxígeno, hidrógeno muy fuertes dentro de la propia molécula de agua, pero es lo suficientemente fuerte como para promover el enlace para formar una estructura cristalina estable (y, como verá pronto, también agua líquida) a temperaturas mucho más altas de lo que tenemos derecho a esperar.
En la estructura del hielo, cada molécula de agua está rodeada por, y unida a hidrógeno a, cuatro moléculas de agua, dispuestas tetraédricamente alrededor de esa molécula de agua dada. Dos de estas moléculas de agua vecinas más cercanas tienen uno de sus hidrógenos unidos en las posiciones abiertas del oxígeno de la molécula de agua dada, y cada una de las otras dos moléculas de agua vecinas más cercanas tienen una de las posiciones abiertas de su oxígeno unida a uno de los hidrógenos de la molécula de agua dada.
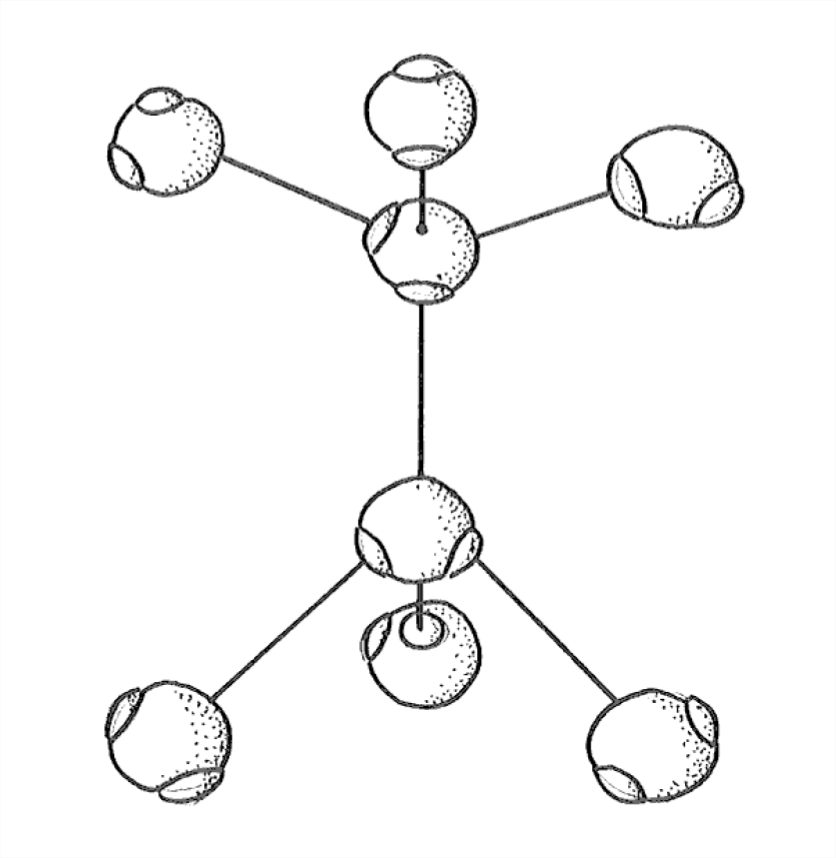
¿Eso suena demasiado complicado? Lee de nuevo el último párrafo, y luego mira la Figura 1-30, que es una vista explosiva de esta disposición tetraédrica de enlaces de hidrógeno, lo mejor que puedo dibujar para ti. Al mirar la Figura 1-30, tenga en cuenta que todas las moléculas de agua realmente deberían estar tocando.

Para construir la estructura de hielo, quiero que ahora se imaginen comenzando con los cuatro primeros de la disposición tetraédrica de cinco moléculas en la Figura 1-30 y agregando moléculas de agua en todas las direcciones horizontales, para formar una especie de lámina arrugada (término no oficial). A continuación, apile la hoja plegada sobre la hoja plegada y únelas entre sí por medio de los cuartos enlaces dirigidos verticalmente hacia arriba y hacia abajo que se extienden desde cada molécula en cada hoja plegada. La Figura 1-31 es un boceto de solo un pequeño segmento de dos láminas plegadas adyacentes, vistas desde un lado.
Si estiras un poco más tus poderes de visualización tridimensional, verás que las hojas plegadas tienen simetría hexagonal cuando se ven normales a las hojas. La Figura 1-32 muestra esquemáticamente la disposición de las moléculas de agua en una de las láminas plegadas. Las moléculas de agua en la lámina son alternativamente altas y bajas, y así están etiquetadas como H y L en la Figura 1-32.
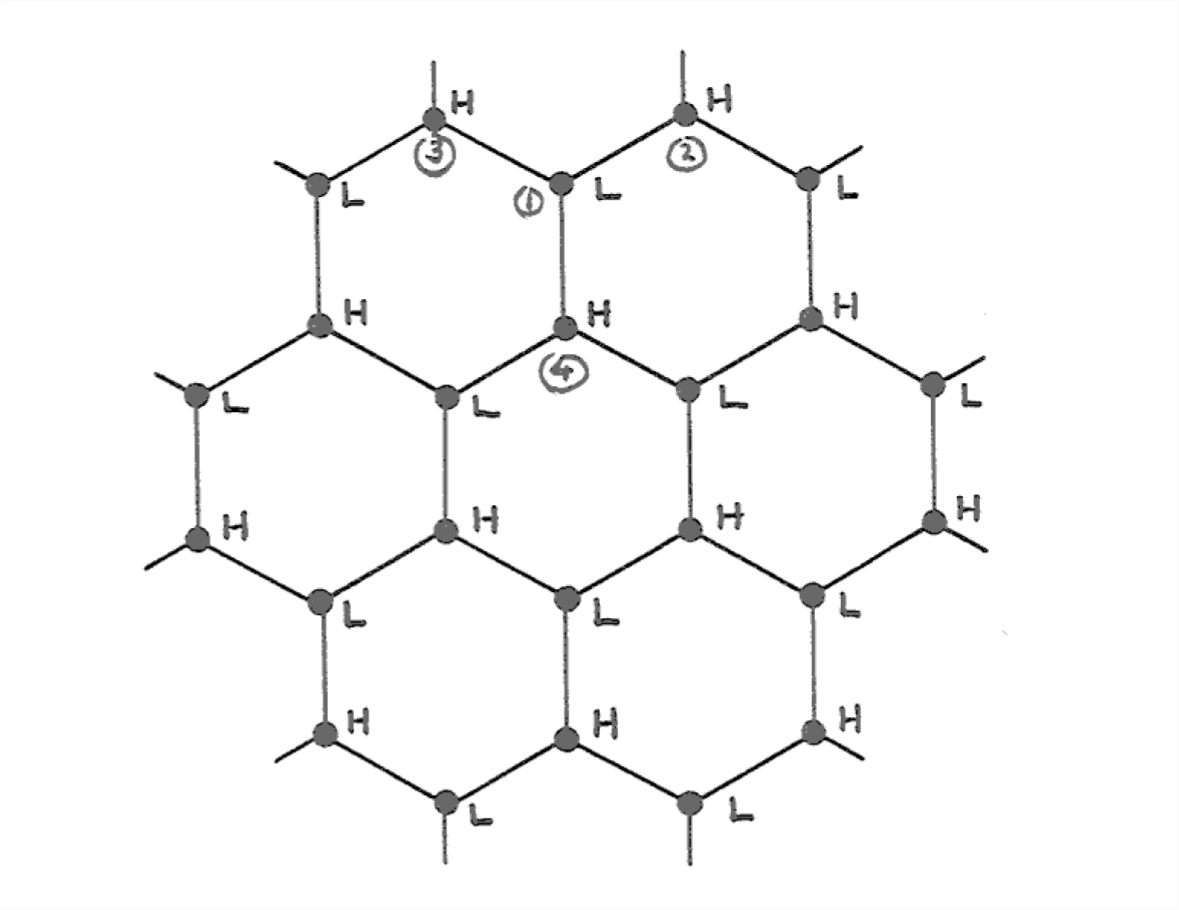
Entonces la estructura de hielo es una de simetría hexagonal, con grandes columnas de espacio vacío en el centro de los hexágonos. Una vista desde el lado (Figura 1- 33) sugiere (pero no muestra demasiado bien en la figura) túneles abiertos que también corren normales al eje hexagonal. El eje de simetría hexagonal se llama eje c, y el plano paralelo a las hojas frunciadas se llama plano basal.
Lo que llama la atención de esta estructura de hielo hexagonalmente simétrica es su apertura. Si el enlace de hidrógeno no sucediera, y las moléculas de agua estuvieran muy empaquetadas, cada una estaría rodeada por doce vecinos más cercanos en lugar de cuatro, y la estructura del hielo sería mucho más densa de lo que realmente es. Esta es la razón fundamental por la que la fase sólida, el hielo, es menos densa que la fase líquida. (Esa pequeña declaración aparentemente simple tiene profundas implicaciones para el agua en la Tierra.) Sólo un puñado de otras sustancias, germanio y silicio entre ellas, muestran este comportamiento.
1.4.4 Agua Líquida
Dije en una sección anterior que el estado líquido es complicado y relativamente poco comprendido. Esto es aún más cierto para el agua, por la existencia de esos insólitos enlaces de hidrógeno. Aquí me concentraré en algunas de las propiedades inusuales del agua líquida y haré algunos comentarios cualitativos sobre cómo podrían explicarse.
En primer lugar, piense en la densidad del agua en función de la temperatura y la presión. La dependencia de la presión de la densidad no está fuera de lo común: el agua tiene cierta compresibilidad pequeña, no fuera de línea con otros líquidos. Pero el comportamiento de la temperatura es asombroso (Figura 1-34): a presión constante la densidad del agua líquida en realidad aumenta al aumentar la temperatura de 0°C a aproximadamente 4°C y luego disminuye lentamente al aumentar la temperatura por encima de esa temperatura mágica de 4°C.
Tenga en cuenta también que la densidad aumenta en la transición de hielo a agua líquida al fundirse a presiones ambiente, de aproximadamente 0.92 g/cm3 a 1.00 g/cm3. Cuando la mayoría de los sólidos se funden a su fase líquida, la estructura se abre un poco, ya que el orden molecular disminuye y las moléculas se vuelven parcialmente libres para vagar en relación con sus vecinos más cercanos. Pero lo contrario es cierto para el agua: el empaquetamiento de las moléculas en el agua líquida es en realidad mayor que en el hielo.
La mejor manera de explicar el comportamiento de la densidad del agua con la temperatura es postular que el derretimiento del hielo implica la rotura de algunos de los enlaces de hidrógeno, de manera que se produce un colapso parcial al empaque más cercano. Los modelos del estado de agua líquida tienden a suponer que hay regiones estructurales transitorias y locales similares a hielo con enlaces de hidrógeno completos (llamados, expresivamente, “racimos parpadeantes”), y otras regiones transitorias y locales en las que las moléculas de agua están más estrechamente empaquetadas. A medida que aumenta la temperatura del líquido, un porcentaje mayor y mayor de las moléculas se encuentran en un estado de empaquetamiento cerrado, lo que lleva al asombroso aumento de la densidad de 0°C a 4°C.

Contrarrestando la tendencia a romper los enlaces de hidrógeno está la tendencia normal al aumento general de la distancia de separación de todas las moléculas en el agregado debido al aumento en la agitación térmica de las moléculas a medida que aumenta la temperatura. A temperaturas superiores a 4°C, este efecto de expansión contrarresta más que el efecto de condensación debido a la ruptura de los enlaces de hidrógeno.
Otra característica sobresaliente del agua líquida es su extremadamente alto calor de vaporización, alrededor de 540 cal/g, esto es casi un orden de magnitud mayor de lo que podría esperarse para líquidos normales del mismo peso molecular. ¿Por qué tan alto? Nuevamente se puede invocar el porcentaje progresivamente menor de enlaces de hidrógeno por unidad de masa de agua. Se necesita energía para romper los enlaces de hidrógeno, y eso es lo que se manifiesta como calor adicional de vaporización, además de la contribución habitual que implica la separación de moléculas del líquido de la interfaz líquido-vapor, donde son sostenidas por las fuerzas atractivas de las moléculas subyacentes.
La capacidad calorífica específica del agua líquida es extremadamente alta, por la misma razón: a medida que se agrega calor al agua líquida, no sólo va hacia el aumento de la energía térmica de las vibraciones de las moléculas de agua; también tiene que ir hacia romper cada vez más los enlaces de hidrógeno restantes, lo que toma energía.
Por último, cabe señalar que muchas propiedades importantes del agua líquida no están fuera de lo común. Propiedades que implican transporte molecular, como el coeficiente de viscosidad y el coeficiente de difusión están en línea con lo que se esperaría de un líquido normal.
1.4.5 Equilibrio de Fase en Agua
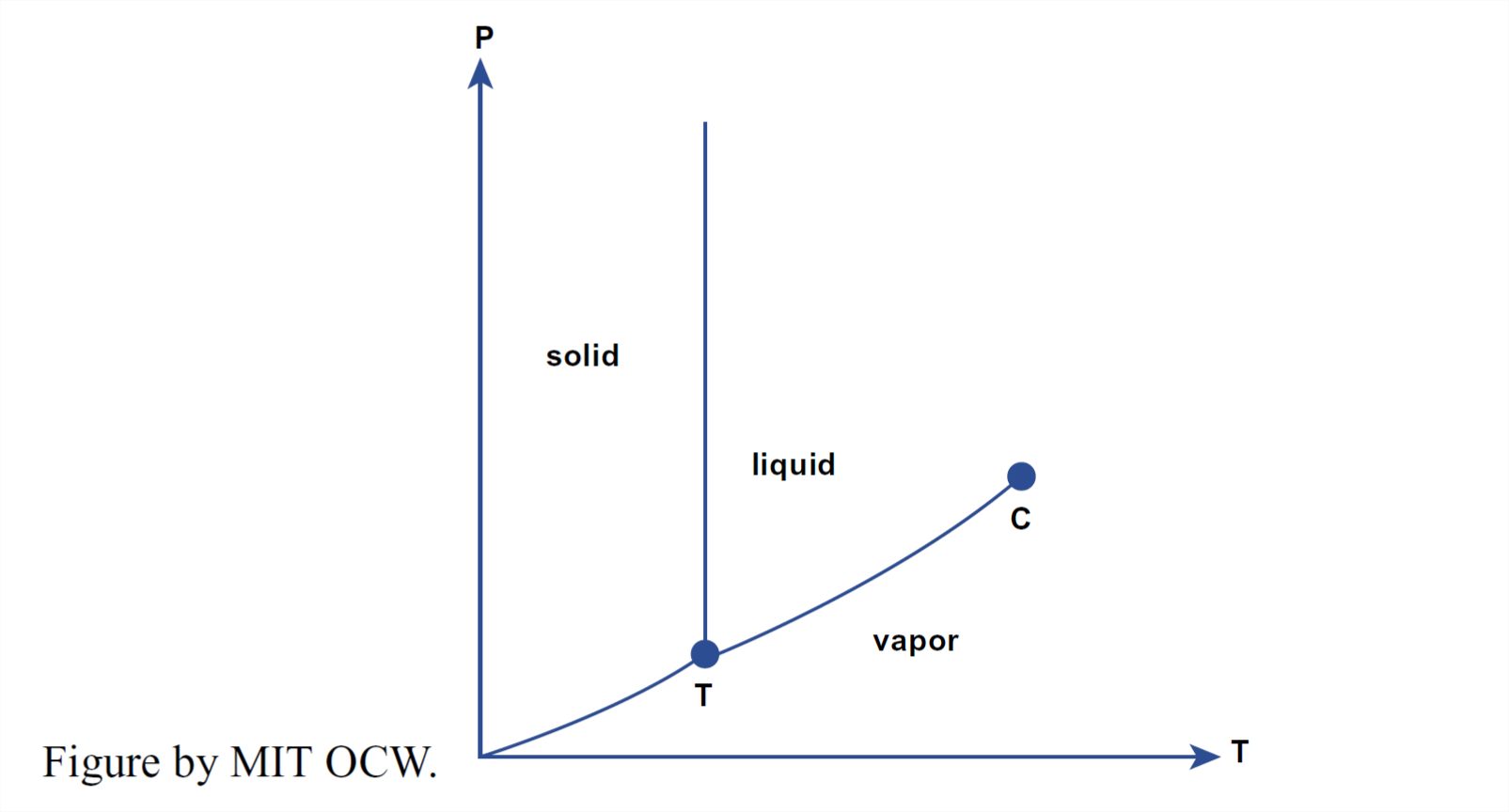
Ahora que hemos estudiado la estructura del agua sólida y líquida, es el momento de observar el equilibrio entre la fase sólida, la fase líquida y la fase vapor. La mejor manera de hacerlo es mediante un diagrama de fases, que muestra los rangos de presión P y temperatura T característicos de cada fase y los conjuntos de presiones y temperaturas para los cuales dos (o incluso las tres) fases pueden coexistir entre sí en equilibrio. La Figura 1-35 muestra dicho diagrama para el agua, pero solo para presiones muy bajas, mucho menores que las atmosféricas. La Figura 1-36 es una versión simplificada de “caricatura” de la Figura 1-35.
¿Cuáles son las características importantes del diagrama de fases en las Figuras 1-35 y 1-36? Tenga en cuenta primero que hacia abajo cerca de la esquina inferior izquierda hay un discreto punto triple entre las fases de vapor, líquido y sólido. En ese conjunto particular de valores de T y P (a una temperatura de aproximadamente 0.1°C y una presión de aproximadamente 4.6 mm Hg, o aproximadamente 6 x 10-3 atmósferas), las tres fases pueden coexistir en equilibrio, cada una con un valor diferente de densidad.
Otra cosa interesante del diagrama P - T en las Figuras 1-35 y 1-36 es el estrechamiento y eventual terminación del cilindro de equilibrio vapor-agua a medida que los límites de fase se unen en lo que se llama el punto crítico. Esto significa que la distinción entre las densidades de líquido y vapor, que es grande a las conocidas temperaturas y presiones de la superficie terrestre, disminuye con el aumento de la temperatura y el aumento de la presión y finalmente desaparece en el punto triple. A temperaturas y presiones aún mayores, el agua existe en una sola fase fluida, bastante densa, sin distinción entre el estado vapor y el estado líquido. (Esto no es relevante para este curso, pero no pude resistirme a incluirlo, porque es muy fascinante, para los nerds de la ciencia como yo, de todos modos).
Con referencia a las Figuras 1-35 y 1-36, se puede observar que es posible convertir el agua líquida en vapor de agua continuamente, sin el catastrófico cambio de fase que implica cruzar el límite directamente por la ruta más corta. Esto se podría hacer cambiando las condiciones P — T por una ruta de rotonda como la que se muestra en la Figura 1-37. A lo largo de esa ruta, todas las propiedades del agua varían continuamente de la fase líquida a la fase de vapor.


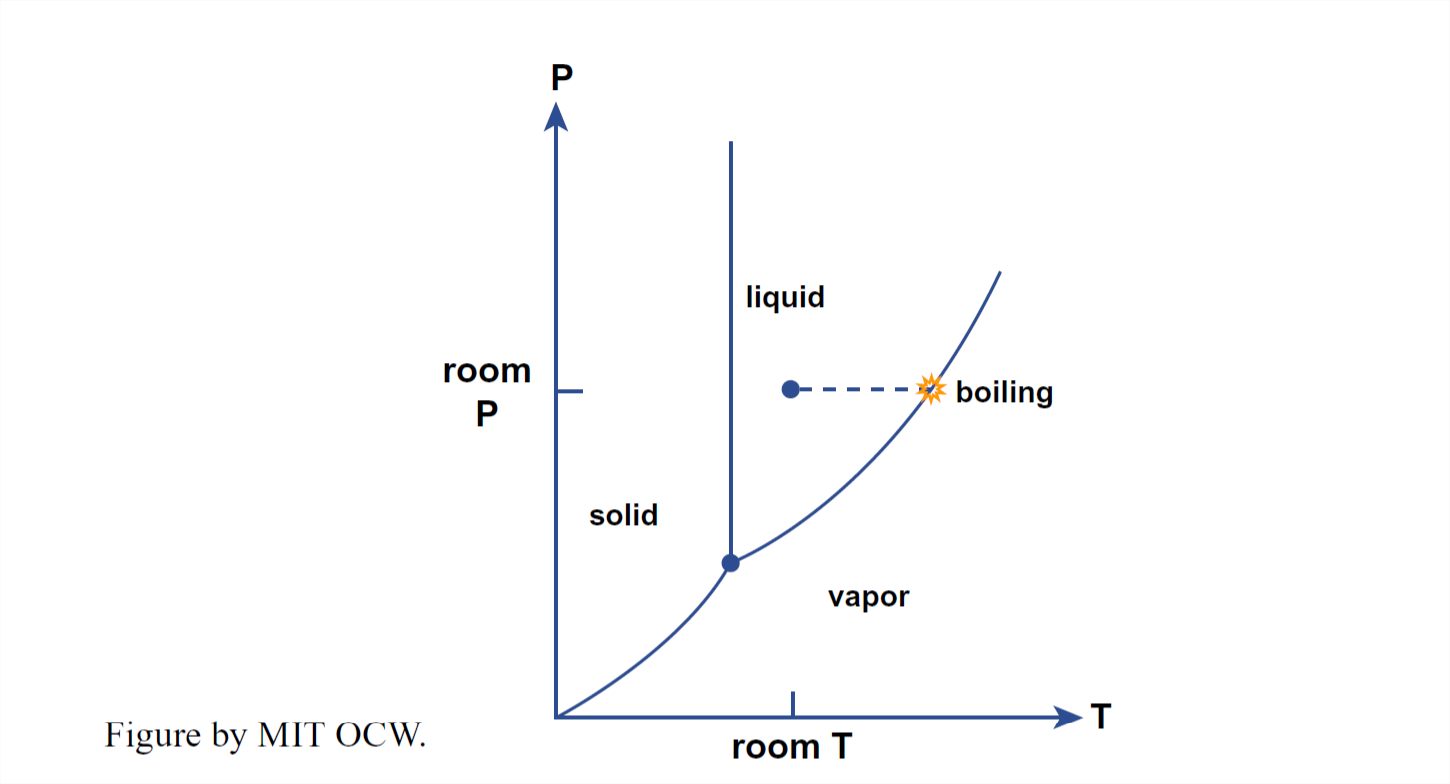
Cuando hierves agua, estás convirtiendo el agua líquida en vapor de agua. Ese proceso se puede mostrar de manera muy simple en el diagrama P — T para agua (Figura 1- 38). Se inicia con agua a temperatura ambiente a presión atmosférica (Punto A en la Figura 1-38). A medida que calienta el agua, ésta sigue un camino en el diagrama P — T horizontalmente hacia la derecha, hasta que alcanza el límite de la fase líquido-vapor, después de lo cual hierve. Luego, el agua permanece a la temperatura de ebullición hasta que se agote toda el agua líquida.
También se puede dar cuenta muy bien de la formación de rocío y escarcha mediante el uso del diagrama P — T. En ese caso, sin embargo, hay que pensar más detenidamente sobre qué usar para la presión. La atmósfera consiste en varios gases, que en conjunto dan cuenta de la presión atmosférica, en virtud de su peso en la columna de aire que recubre la localidad dada. Las contribuciones de cada gas a la presión total se llama su presión parcial.
El vapor de agua en la atmósfera varía en concentración desde considerablemente menos del uno por ciento, en el aire más frío y seco, hasta más del cuatro por ciento, en el aire más cálido y húmedo. En el diagrama P — T de la Figura 1-39, comience con un pozo de punto (Punto A) a la derecha del límite de fase líquido-vapor, a una temperatura por encima de la congelación. En una noche despejada, a medida que la superficie del suelo se enfría, por pérdida de calor por radiación al espacio exterior, el vapor de agua toma un camino horizontalmente hacia la izquierda en el diagrama P — T. Cuando alcanza el límite de la fase líquido-vapor, se condensa como rocío en las superficies frías.
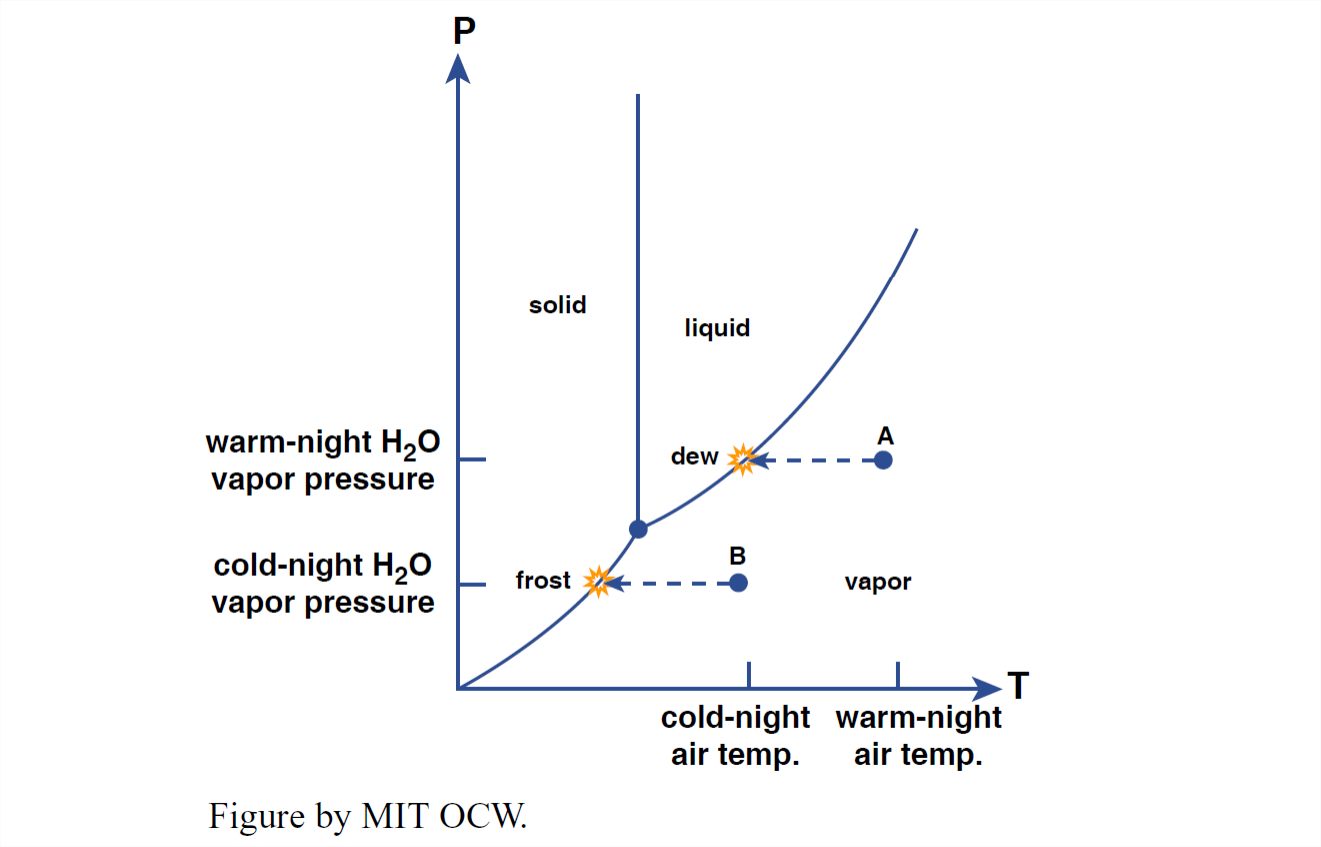
Se puede hacer lo mismo para la formación de heladas, comenzando a una temperatura por debajo del punto de congelación. Entonces el camino conduce horizontalmente a la izquierda, desde, digamos, el Punto B de la Figura 1-39, para alcanzar el límite hielo-vapor, momento en el que crecen pequeños cristales de hielo en las superficies frías, alimentados directamente del vapor de agua en el aire. (De esto se puede concluir que las heladas no son solo rocío congelado—aunque el rocío mismo puede congelarse, ya que la temperatura del aire disminuye durante la noche).
1.4.6 La Química del Agua
Las moléculas de agua en el agua líquida tienen una ligera tendencia a disociarse en iones H+ e iones OH-. Los iones H+ se llaman (¡naturalmente!) iones hidrógeno. Básicamente son solo protones. (En realidad, tienden a hidratarse por la unión a una molécula de agua, dando la fórmula H3O+, pero convencionalmente se escriben como, y se tratan como, solo iones H+). Los iones OH- se llaman iones hidroxilo.
Esta disociación de las moléculas de agua en iones hidrógeno e iones hidroxilo se expresa mediante la siguiente reacción química simple, con la que probablemente todos estén familiarizados:
H2OH+ +OH-
Ten en cuenta que, al igual que con todas esas reacciones químicas, las moléculas de agua se están disociando todo el tiempo en iones hidrógeno e iones hidroxilo, mientras que al mismo tiempo los iones hidrógeno y los iones hidroxilo se están recombinando para formar moléculas de agua.
El equilibrio entre disociación y recombinación es tal que sólo una proporción muy pequeña de las moléculas de agua, en un momento dado, se disocian.
En el agua pura que está contenida en un recipiente completamente insoluble y que no está en contacto con ningún gas, la proporción de moléculas de agua que se disocian en un momento dado es una de cada 107, una proporción muy pequeña. Además, los números de iones hidrógeno e iones hidroxilo son iguales, simplemente porque la disociación de una molécula de agua produce un ion H+ y un ion OH-. Se dice que las concentraciones tanto de los iones H+ como de los iones OH- son 10-7. (Pero cuidado: aquí estoy siendo algo superficial porque no les estoy diciendo las unidades de las concentraciones. Eso requeriría mucha más explicación de lo que permite este curso.)
Si, ahora, permitimos que algunos iones H+ del exterior se agreguen al agua, de alguna manera, habrá una disminución correspondiente y uno por uno en el número de iones OH-. Por el contrario, si permitimos que se agreguen algunos iones OH- al agua, de alguna manera, habrá una disminución correspondiente y uno por uno en el número de iones H+. Eso lleva a la idea de una escala de concentración de iones H +. Esa escala se llama escala de pH.
Todos ustedes probablemente hayan oído hablar del pH de las soluciones acuosas y sepan que de alguna manera está conectado con la acidez del agua. El pH de una solución acuosa se define como el negativo del logaritmo a base diez de la concentración de iones hidrógeno en la solución acuosa. (Para aquellos de ustedes que no están familiarizados con el concepto de logaritmos, todo lo que hay que tener en cuenta que el logaritmo de base diez del número 107 es 7 y que el logaritmo de base diez del número 10-7 es -7). Por lo que el pH del agua pura, en la que, como se discutió anteriormente, la concentración de iones hidrógeno es de 10-7, es de 7. Las soluciones acuosas con mayores concentraciones de iones hidrógeno tienen valores de pH más pequeños y se dice que son ácidas; las soluciones acuosas con concentraciones menores de iones hidrógeno tienen valores de pH mayores y se dice que son alcalinas.

