8.4: Primera Ley de la Termodinámica
( \newcommand{\kernel}{\mathrm{null}\,}\)
La idea de conservación de energía se introdujo en la Sec. 1.3. La mayoría de las discusiones sobre termodinámica también comienzan con la misma idea. La primera ley de la termodinámica es una declaración de conservación de energía. La energía se puede almacenar en la polarización material de un condensador, el potencial químico de una batería y en muchas otras formas. Las personas que estudian termodinámica y transferencia de calor, sin embargo, a menudo hacen algunas suposiciones drásticas. Clasifican todos los procesos de conversión de energía como transferencia de calor u otros donde el componente principal de este último es el trabajo mecánico. Al inicio de los cursos introductorios de termodinámica, se ignoran todas las formas de energía además de la transferencia de calor y el trabajo mecánico. La carga de un condensador, la descarga de una batería y todos los demás procesos de conversión de energía se agrupan con el trabajo mecánico al escribir la primera ley de la termodinámica. La primera ley de la termodinámica se escribe típicamente como
(change in int. energy) = (heat in) − (work and other forms).
ΔU=Q−W
Cada término de la Ecuación\ ref {8.4.2} tiene las unidades de julios. El símboloQ representa la energía suministrada al sistema por calentamiento y−W, con el símbolo menos, representa el trabajo mecánico en el sistema así como todas las demás formas de energía en el sistema. La cantidadΔU representa el cambio en la energía interna del sistema. En un sistema cerrado se conserva la energía total. En un sistema cerrado, la energía se almacena en el sistema (por ejemplo, como energía potencial u otra forma de energía interna), se transfiere dentro o fuera como calor, o se transfiere dentro o fuera como otra forma como el trabajo mecánico [109, p. 51].
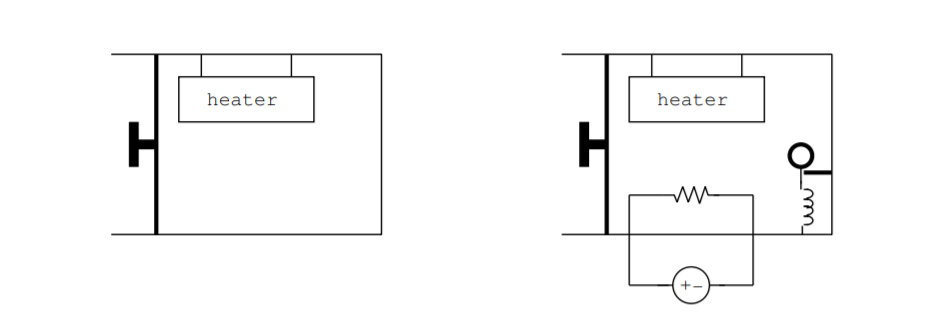
Como ejemplo, considere el sistema cerrado que se muestra en la parte izquierda de la Fig. 8.4.1compuesto por un cilindro con un pistón y un calentador. Supongamos que el cilindro contiene un volumen fijo de gas en su interior. Supongamos que el calentador se usa para transferir 100 J de energía al pistón en una hora mientras el pistón se ve obligado a permanecer en una posición fija. Pasada la hora, la energía interna del gas será 100 J mayor que antes. De nuevo supongamos que el calentador se utiliza para transferir 100 J de energía al gas, pero esta vez supongamos que se permite que el pistón se mueva expandiendo así el volumen de gas. Pasada la hora, la energía interna del gas será la energía original del gas, más los 100 J suministrados por el calentador, y menos un factor debido al trabajo mecánico realizado por el pistón.
La primera ley de la termodinámica dice dos cosas. Primero, se conserva la energía. En segundo lugar, la energía puede almacenarse, convertirse en trabajo mecánico o convertirse en calor. Sabemos que la energía también se puede convertir a otras formas, como la energía eléctrica o electromagnética. Si bien las clases introductorias de termodinámica no suelen hacerlo, podemos agregar otros dispositivos al pistón como se muestra en la parte derecha de la Fig. 8.4.1. Podemos incluir una batería y poner una resistencia en su interior para convertir la energía química en energía eléctrica, y la resistencia puede calentar el aire en el pistón. Podemos poner una masa y un resorte en el pistón y convertir la energía potencial de un resorte comprimido en energía cinética quitando un clip que sujeta el resorte comprimido. En un sistema cerrado cuando se consideran todos los procesos de conversión de energía, la energía debe ser conservada.


