4.4: Lluvia ácida y ozono (I)
- Page ID
- 82284
La lluvia ácida es un grave problema ambiental en todo el mundo, que afecta particularmente a Asia, Europa y grandes partes de Estados Unidos y Canadá. Los contaminantes ácidos como SO 2 y NO x son emitidos al ambiente por la combustión de combustibles fósiles.
La mayor parte del azufre en cualquier combustible se combina con el oxígeno y forma SO 2 en la cámara de combustión. Este SO 2 cuando se emite a la atmósfera se oxida lentamente a SO 3. SO 3 es fácilmente soluble en agua en las nubes y forma H 2 SO 4 (ácido sulfúrico).
\[ \ce{ S + O2 -> SO2 + \dfrac{1}{2}O2 \, (in \, the \, atmosphere) } \nonumber\]
\[ \ce{ SO2 + \dfrac{1}{2} O2 \, (in \, the \, atmosphere) -> SO3 + H2O } \nonumber\]
\[ \ce{ SO3 + H2O -> H2SO4 \, (sulfuric \, acid) } \nonumber\]
La mayor parte del NO x que se emite es en forma de NO. Este NO se oxida en la atmósfera a NO 2. El NO 2 es soluble en agua y forma HNO 3 (ácido nítrico).
\[ \ce{ NO + \dfrac{1}{2} O2 \, (in \, the \, atmosphere) -> NO2 + H2O } \nonumber\]
\[ \ce{ NO2 + H2O -> HNO3 \, (nitric \, acid) } \nonumber\]
Deposición ácida
La luz solar aumenta la tasa de la mayoría de las reacciones de SO 2 y NO. El resultado es una solución suave de ácido sulfúrico y ácido nítrico. “Lluvia ácida" es un término amplio que se usa para describir varias formas en que los ácidos caen de la atmósfera. Un término más preciso es la deposición ácida, que tiene dos partes: húmeda y seca.
- Deposición húmeda - se refiere a lluvia ácida, niebla y nieve. A medida que esta agua ácida fluye sobre y a través del suelo, afecta a una variedad de plantas y animales. La fuerza de los efectos depende de muchos factores, entre ellos:
- la acidez del agua;
- la química y la capacidad amortiguadora de los suelos involucrados;
- los tipos de peces, árboles y otros seres vivos que dependen del agua.
- Deposición seca - se refiere a gases ácidos y partículas. Alrededor de la mitad de la acidez en la atmósfera cae de nuevo a la tierra a través de la deposición seca.
- Las partículas ácidas y los gases son soplados por el viento sobre edificios, automóviles, casas y árboles.
- Los gases y partículas depositados en seco también pueden ser lavados de árboles y otras superficies por tormentas de lluvia. Cuando eso sucede, el agua de escorrentía agrega esos ácidos a la lluvia ácida, haciendo que la combinación sea más ácida que la lluvia que cae sola
Proceso de Deposición de Ácido
Los vientos predominantes soplan los compuestos que causan la deposición de ácido húmedo y seco a través de las fronteras estatales y nacionales, y a veces más de cientos de millas. El video entra en más detalles sobre el proceso de deposición ácida.
Escala de pH
La lluvia ácida se mide usando una escala de pH.
El pH es una medida de la concentración de iones hidrógeno, que se mide como un logaritmo negativo. En otras palabras, los ácidos producen iones hidrógeno y los álcalis producen iones hidroxilo, por lo que el pH es el poder de una solución para producir iones de hidrógeno [H+].
La escala de pH oscila entre 0 y 14 e indica qué tan ácida o básica es una sustancia.
- Un pH de 7 es neutro.
- Un pH menor a 7 es ácido.
- Un pH mayor a 7 es básico.
Cuanto menor sea el pH de una sustancia, más ácida es. Cada valor de pH completo por debajo de 7 (el punto neutro) es diez veces más ácido que el siguiente valor más alto.
- Por ejemplo, un pH de 4 es diez veces más ácido que un pH de 5 y 100 veces (10 veces 10) más ácido que un pH de 6.
Cuanto mayor sea el pH de una sustancia, más básica o alcalina es.
- Cada valor de pH completo por encima de 7 es diez veces más alcalino (otra forma de decir básico) que el siguiente valor entero inferior.
- Por ejemplo, un pH de 10 es diez veces más alcalino que un pH de 9.
La Figura 4.4.1 da una visión de la escala de pH.
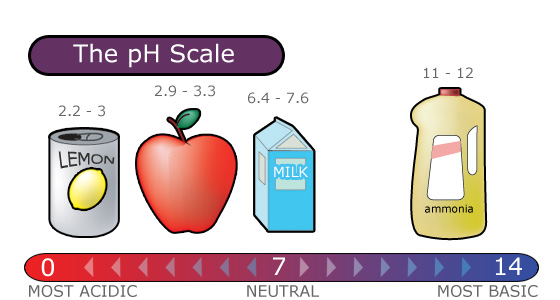
Figura 4.4.1. Escala de pH
Efectos de la Lluvia Acida
Visión general
El agua pura tiene un pH de 7.0. La lluvia normal es ligeramente ácida porque el dióxido de carbono se disuelve en ella, por lo que tiene un pH de aproximadamente 5.5. A partir del año 2000, la lluvia más ácida que cae en EU tiene un pH de aproximadamente 4.3.
A continuación se muestra un video de demostración que replica el efecto de la lluvia ácida en la vida vegetal. En el video, los frijoles se colocan en: a) agua, b) agua ligeramente ácida y c) agua ácida, y su crecimiento se observa en un periodo de tres días.
Efectos de la lluvia ácida en los bosques y la vida acuática
Bosques
La lluvia ácida no suele matar directamente a los árboles. En cambio, es más probable que debilite los árboles al:
- dañando sus hojas;
- limitar los nutrientes disponibles para ellos;
- exponiéndolos a sustancias tóxicas liberadas lentamente del suelo.
Muy a menudo, la lesión o muerte de árboles es el resultado de estos efectos de la lluvia ácida en combinación con una o más amenazas adicionales.
Vida Acuática
La lluvia ácida provoca la acidificación de lagos y arroyos y contribuye al daño de los árboles a altas elevaciones (por ejemplo, abetos rojos por encima de los 2,000 pies) y muchos suelos forestales sensibles. Se identificó que varias regiones de Estados Unidos contenían muchas de las aguas superficiales sensibles a la acidificación, como se muestra en la Figura 4.4.2. Entre ellos se encuentran los siguientes:
- Adirondacks y montañas Catskill en el estado de Nueva York;
- Altiplano Medio de los Apalaches a lo largo de la costa este;
- Medio Oeste Superior;
- Zonas montañosas del oeste de Estados Unidos.
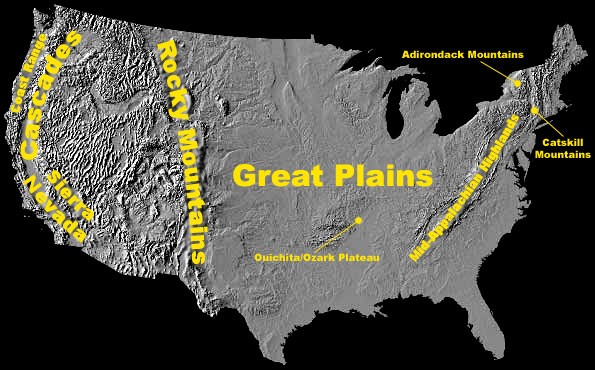
Figura 4.4.2. Mapa de Estados Unidos con áreas de alta elevación
Algunos tipos de plantas y animales pueden manejar aguas ácidas. Otros, sin embargo, son sensibles a los ácidos y se perderán a medida que disminuya el pH. La Figura 4.4.3 muestra los niveles de pH que los peces, mariscos e insectos pueden tolerar.
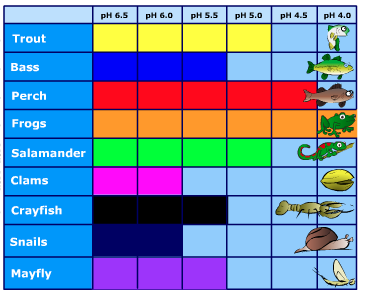
Figura 4.4.3. Tolerancias de pH de diversos organismos
Efectos de la lluvia ácida en los materiales, la visibilidad y la salud humana
Materiales
La lluvia ácida y la deposición seca de partículas ácidas contribuyen a la corrosión de los metales (como el bronce) y al deterioro de la pintura y la piedra (como el mármol y la piedra caliza). Estos efectos reducen seriamente el valor para la sociedad de edificios, puentes, objetos culturales (como estatuas, monumentos y lápidas) y automóviles. La Figura 4.4.4 muestra un ejemplo de una estatua afectada por la lluvia ácida.

Figura 4.4.4. Erosión por lluvia ácida a una estatua
Visibilidad
Los sulfatos y nitratos que se forman en la atmósfera a partir de las emisiones de dióxido de azufre (SO 2) y óxidos de nitrógeno (NO x) contribuyen al deterioro de la visibilidad, lo que significa que no podemos ver tan lejos o tan claramente a través del aire.
Este de EE.
Las partículas de sulfato representan del 50 al 70 por ciento de la reducción de visibilidad en la parte oriental de Estados Unidos, afectando nuestro disfrute de parques nacionales, como el Shenandoah y las Grandes Montañas Humeantes.
A través del Programa de Lluvia Ácida, se completarán las reducciones de SO 2 para mejorar el alcance visual en los parques nacionales ubicados en el este de Estados Unidos, como las Grandes Montañas Humeantes, que se muestran en la Figura 4.4.5. Con base en un estudio del valor que los visitantes del parque nacional otorgan a la visibilidad, se espera que estas reducciones valgan más de mil millones de dólares anuales para el año 2010.

Figura 4.4.5. Grandes Montañas Humeantes
Oeste de EE.
En la parte occidental de Estados Unidos, los nitratos y el carbono también juegan un papel importante, pero los sulfatos han sido implicados como una fuente importante de deterioro de la visibilidad en muchos de los parques nacionales de la meseta del río Colorado, incluyendo el Gran Cañón (mostrado en la Figura 4.4.6), Canyonlands y Bryce Canyon.

Figura 4.4.6. Gran Cañón
Salud Humana
La lluvia ácida se ve, siente y sabe igual que la lluvia limpia. El daño a las personas por la lluvia ácida no es directo. Caminar bajo lluvia ácida, o incluso nadar en un lago ácido, no es más peligroso que caminar o nadar en agua limpia. Sin embargo, los contaminantes que causan la lluvia ácida también dañan la salud humana.
- Efectos del Dióxido de Azufre (SO 2): Estos gases interactúan en la atmósfera para formar partículas finas de sulfato y nitrato que pueden ser transportadas largas distancias por los vientos e inhaladas profundamente en los pulmones de las personas. Las partículas finas también pueden penetrar en interiores. Muchos estudios científicos han identificado una relación entre los niveles elevados de partículas finas y el aumento de la enfermedad y la muerte prematura por trastornos cardíacos y pulmonares, como el asma y la bronquitis.
- Efectos del Óxido de Nitrógeno (NO x): También se espera que la disminución de las emisiones de óxido de nitrógeno tenga un impacto beneficioso en la salud humana al reducir los óxidos de nitrógeno disponibles para reaccionar con compuestos orgánicos volátiles y formar ozono. Los impactos del ozono en la salud humana incluyen una serie de riesgos de morbilidad y mortalidad asociados con la inflamación pulmonar, incluyendo asma y enfisema.
Protección del Medio Ambiente de la Lluvia Ácida
Puede hacer lo siguiente para proteger el medio ambiente de la lluvia ácida:
- Apaga las luces, las computadoras y otros electrodomésticos cuando no los estés usando.
- Use electrodomésticos energéticamente eficientes: iluminación, aires acondicionados, calentadores, refrigeradores, lavadoras, etc.
- Solo usa electrodomésticos cuando los necesites.
- Mantén tu termostato a 68°F en invierno y 72°F en verano. Puedes volverlo aún más bajo en el invierno y más alto en el verano cuando estás fuera de casa.
- Aísla tu casa lo mejor que puedas.
- Compartir coche, usar el transporte público, o mejor aún, caminar o andar en bicicleta siempre que sea posible.
- Compre vehículos con bajas emisiones de NO x y mantenga bien todos los vehículos.


