16: Contaminación atmosférica gaseosa
- Page ID
- 82549
Objetivos de aprendizaje
Después de completar este capítulo, podrás
- Describir las principales fuentes de emisión de contaminantes atmosféricos asociados al azufre, nitrógeno e hidrocarburos.
- Explicar la diferencia entre contaminantes primarios y secundarios.
- Contraste los problemas ambientales asociados al ozono estratosférico y troposférico.
- Examinar la importancia de los contaminantes del aire para los ecosistemas y para la salud humana.
- Describa las lecciones que se pueden aprender de la contaminación natural en Smoking Hills.
- Describir los patrones de contaminación y daño ecológico cerca de fuentes puntuales de contaminación atmosférica.
Introducción
Los contaminantes gaseosos del aire se emiten desde diversas fuentes naturales, como volcanes e incendios forestales. Sin embargo, las emisiones antropogénicas de algunos gases pueden ser mayores que las naturales, y están aumentando debido al crecimiento poblacional y a la industrialización.
En la antigüedad, no había mucha contaminación. Sin embargo, incluso entonces habrían ocurrido problemas locales. Por ejemplo, los fuegos de leña ahumada utilizados para cocinar y el calor probablemente habrían provocado que se produjera aire de mala calidad dentro de viviendas mal ventiladas. Los cultivos de caza a menudo usaban fuego para conducir animales de caza y mejorar el forraje local, y esas quemaduras habrían resultado en grandes emisiones de partículas de carbono (hollín), dióxido de carbono y otros gases que habrían deteriorado temporalmente la calidad del aire. En general, sin embargo, estos efectos fueron relativamente menores.
Por supuesto, a medida que las personas se volvieron más numerosas e industrializadas, la contaminación del aire se convirtió cada vez más en un problema mucho mayor. Cuando comenzó la Revolución Industrial (alrededor de 1750), el carbón se convirtió rápidamente en el principal combustible utilizado para generar calor y energía para las máquinas, y eso resultó en una contaminación del aire cada vez más peor. El uso generalizado del carbón provocó una grave contaminación por dióxido de azufre (SO 2) y hollín en los pueblos y ciudades industriales de Europa y América. Desde 1900, la floreciente industrialización y las nuevas tecnologías como las centrales eléctricas y los automóviles han incrementado aún más las emisiones de contaminantes.
La contaminación del aire puede ser especialmente grave en situaciones en las que la atmósfera más baja es estable y tranquila. Estas condiciones suelen ocurrir bajo un fenómeno atmosférico llamado inversión, en el que una capa de aire frío queda atrapada debajo de una capa más alta de aire más cálido (el patrón más habitual es que la temperatura se enfríe al aumentar la altitud). Una inversión atmosférica es una condición relativamente estable que impide que el aire contaminado a nivel del suelo se mezcle con aire más limpio desde altitudes más altas (ver En Detalle 16.1). Si una inversión atmosférica va acompañada de niebla, la contaminación se conoce como smog (palabra derivada de “humo” y “niebla”). Tan recientemente como la década de 1950, los llamados ocasionales “smogs asesinos” ricos en SO 2 y hollín causaron la muerte de miles de personas urbanas, y muchos más sufrieron dificultad respiratoria (la contaminación rica en SO 2 también se llama reducir el smog). Los smogs asesinos más famosos ocurrieron en Londres, Glasgow, algunos otros centros industriales de Europa, y cerca de Pittsburgh en Estados Unidos (estos se describen más adelante).
Una vez que los científicos reconocieron los graves daños que estaba causando la contaminación del aire, los gobiernos comenzaron a aprobar leyes para disminuir las emisiones. El control de la contaminación se volvió particularmente vigoroso después de que los investigadores médicos descubrieron evidencia clara de los vínculos entre la calidad del aire y las enfermedades humanas Se prestó especial atención a la contaminación del aire en ambientes urbanos, donde los smogs asesinos fueron los más frecuentes. Por lo general, los gobiernos respondían con importantes acciones de control, como las siguientes:
- cambiar del carbón, que es un combustible fósil relativamente “sucio”, a otros “más limpios” como el gas natural o el petróleo, o a tecnologías de energía alternativa como la energía nuclear y la hidroelectricidad
- construir chimeneas altas para esparcir las emisiones en un área mucho más amplia para que las exposiciones a nivel del suelo se vuelvan menos comunes y menos intensas; esta táctica es la “solución de dilución a la contaminación”
- centralizar la producción de energía en grandes centrales eléctricas para reemplazar gran parte de la quema relativamente sucia e ineficiente de carbón en las chimeneas y hornos domésticos, permitiendo así un mejor control de las emisiones
- tratar los gases residuales para eliminar parte de su contenido contaminante, reduciendo así las emisiones a la atmósfera
Debido a estas útiles acciones regulatorias, la importancia de reducir el smogs se hizo mucho menor en muchos países. Sin embargo, el llamado smog oxidante se ha convertido en causas más importantes de daño en muchas regiones. El smog oxidante se desarrolla en la atmósfera a través de complejas reacciones fotoquímicas en las que los hidrocarburos y los óxidos de nitrógeno se transforman en ozono (O 3) y otros gases. El ozono y otros gases oxidantes dañan la vegetación e irritan el sistema respiratorio y los ojos de las personas. El smog oxidante se desarrolla bajo condiciones soleadas si los hidrocarburos y los óxidos de nitrógeno están presentes por las emisiones automotrices e industriales, y especialmente si la presencia de una inversión atmosférica reduce la dispersión de la masa de aire contaminada.
En este capítulo, examinamos los contaminantes gaseosos más importantes. Se describen sus fuentes de emisión, transformaciones químicas y toxicidad, y se utilizan estudios de casos canadienses para demostrar los daños ecológicos que pueden ser causados.
En Detalle 16.1. Normalmente, la temperatura de la atmósfera disminuye con el aumento de la altitud. Bajo ciertas condiciones, sin embargo, una capa de aire relativamente frío puede quedar atrapada bajo una capa de aire más cálido, fenómeno conocido como inversión atmosférica (o inversión de temperatura; ver Figura).
Figura 16.1. Normalmente, la temperatura del aire disminuye con el aumento de la altitud (línea roja), pero durante una inversión atmosférica, una capa de aire más frío a nivel del suelo queda atrapada debajo del aire más cálido (líneas azules).
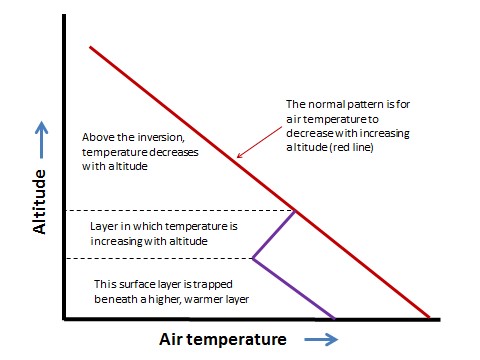
Una inversión atmosférica puede desarrollarse en una noche clara y sin nubes. En tales condiciones, la superficie del suelo se enfría rápidamente ya que irradia calor que fue absorbido durante el día. Esto puede resultar en una capa de aire frío que se produce debajo de una capa más alta de aire más cálido. El terreno montañoso es particularmente vulnerable al desarrollo de inversiones atmosféricas porque el aire frío relativamente denso puede fluir hacia abajo desde las cimas de las colinas y acumularse en valles. A veces, durante el verano, las condiciones atmosféricas estables pueden desarrollarse a mayor altitud, tapando una masa de aire que aún se mezcla a nivel del suelo.
Una inversión atmosférica puede ser bastante estable. Hasta que se dispersa por vientos vigorosos, puede atrapar y acumular contaminantes del aire que se emiten durante el evento de inversión. Los episodios severos de contaminación del aire pueden ocurrir cuando se desarrollan inversiones estables y se mantienen durante varios días.
Algunos lugares desarrollan regularmente inversiones menos persistentes, como Los Ángeles, la Ciudad de México y el Gran Vancouver. En estos lugares, las inversiones se desarrollan por la mañana pero suelen dispersarse durante la tarde. Mientras tanto, sin embargo, los contaminantes oxidantes del aire como el ozono pueden acumularse en un smog fotoquímico.
Gases Azufre
Emisiones y Transformaciones
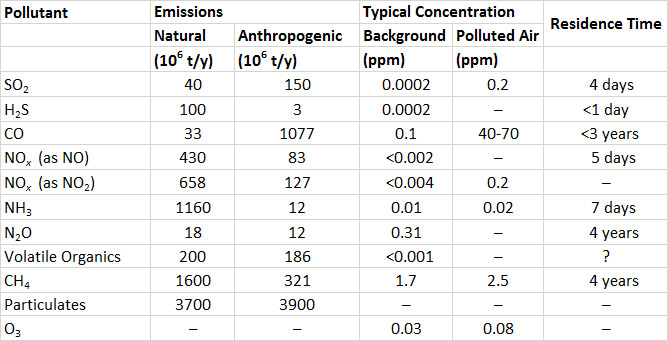
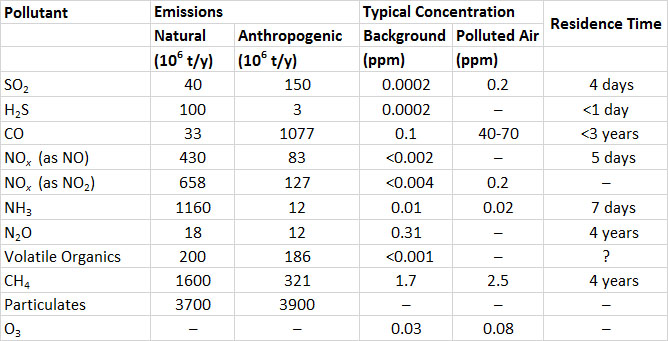
El dióxido de azufre (SO 2) es uno de los contaminantes atmosféricos gaseosos más importantes. SO 2 es un gas incoloro pero penetrante. Los humanos pueden detectar su sabor amargo a una concentración de sólo 0.3-1 ppm (partes por millón; para SO 2, 1 ppm = 2.6 mg/m 3). El sulfuro de hidrógeno (H 2 S), otro gas sulfuroso, puede detectarse como un olor asqueroso, que recuerda a huevos podridos, a concentraciones inferiores a 1 ppb (partes por mil millones; para H 2 S, 1 ppm = 1.4 mg/m 3) (a menos que se indique otra cosa, datos específicos citados en este y otros capítulos en esta sección sobre daños ambientales son de Freedman, 1995).
Después de que se emiten a la atmósfera, SO 2 y H 2 S se oxidan a otros compuestos, y finalmente forman sulfato (SO 4 2—; ver En Detalle 16.2). Debido a que el ion sulfato lleva cargas negativas, es un anión (esto se refiere a cualquier ion, átomo o molécula con una carga negativa). Debido a que H 2 S se oxida rápidamente a SO 2, su tiempo de residencia atmosférica es inferior a un día (este es el tiempo para completar la desaparición de una cantidad inicial). El SO 2 se oxida más lentamente, a una velocidad de < 1-5% por hora, dependiendo de la luz solar, la humedad, oxidantes fuertes como el ozono, y la presencia de partículas que contienen metal que pueden actuar como catalizadores. Un tiempo de residencia típico de SO 2 en la atmósfera es de aproximadamente cuatro días. En consecuencia, el SO 2 puede dispersarse a gran distancia desde su punto de emisión antes de que se oxide o se deposite en una superficie terrestre o acuática. Este tipo de dispersión se conoce como transporte de largo alcance de la contaminación del aire (LRTAP).
El sulfato atmosférico, formado por la oxidación de SO 2 o H 2 S, puede combinarse con iones cargados positivamente (cationes) para formar diversos compuestos. La mayor parte del sulfato atmosférico se presenta como partículas diminutas, especialmente sulfato de amonio ((NH 4) 2 SO 4). Este es el componente más destacado, junto con el nitrato de amonio (NH 4 NO 3), de la neblina de partículas finas que a menudo perjudica la visibilidad en las ciudades. La neblina también ocurre en algunas zonas rurales donde los contaminantes han sido importados por LRTAP de fuentes de emisión en otros lugares Otros cationes que se combinan con sulfato incluyen calcio (Ca 2+), magnesio (Mg 2+) y sodio (Na +). A menudo, sin embargo, no hay suficientes de estos cationes para equilibrar todas las cargas negativas del sulfato (SO 4 2—) presentes. En tales condiciones, los iones hidrógeno (H +) sirven para equilibrar algunas de las cargas negativas, dando como resultado un aerosol que contiene ácido sulfúrico (H 2 SO 4), el componente más importante de la precipitación ácida (ver Capítulo 19).
Emisiones de gases de azufre
Los volcanes son fuentes naturales de emisión de gases de azufre. En promedio, los volcanes emiten alrededor de 12 millones de toneladas de gases de azufre al año, de los cuales el 90% es SO 2 y el 10% es H 2 S. Sin embargo, la enorme erupción del Monte Pinatubo en 1991 en Filipinas emitió 7-10 millones de toneladas de SO 2 (expresado como el contenido de azufre, o SO 2 -S). La erupción mucho más pequeña del Monte St. Helens en el estado de Washington en 1980 ventiló alrededor de 0.2 millones de toneladas de SO 2-S. Las emisiones naturales de SO 2 también ocurren durante los incendios forestales.
Las emisiones antropogénicas globales de SO 2 son de aproximadamente 150 millones de toneladas anuales, o 3.8 veces las liberaciones naturales (Cuadro 16.1). La combustión de combustibles fósiles representa aproximadamente la mitad de las emisiones antropogénicas. El carbón y el petróleo contienen compuestos minerales de azufre, como la pirita (FeS 2), así como compuestos orgánicos de azufre. Cuando se queman estos combustibles, el azufre se oxida a SO 2 gaseoso, el cual puede ser ventilado a la atmósfera. Los carbones duros extraídos en el este de América del Norte contienen 1-12% de azufre, los carbones más blandos de las regiones occidentales tienen < 0.3-1.5%, el petróleo crudo tiene 0.8-1.0% los fuelóleos residuales como el búnker -C tienen 0.3-0.4%, y los combustibles para motores como el diesel y la gasolina tienen 0.04-0.05%. Otras fuentes importantes de emisiones de SO 2 son los procesos de fabricación (23% de las emisiones globales), la fundición de minerales metálicos (7%) y la quema de hábitats naturales durante las conversiones agrícolas (la mayor parte del resto).
Las emisiones antropogénicas de SO 2 han aumentado enormemente desde el inicio de la Revolución Industrial. Las emisiones en 1860 fueron de aproximadamente 5 millones de toneladas, en comparación con alrededor de 150 millones de toneladas en 2000. Desde entonces, la mayoría de los países más ricos han invertido fuertemente en tecnologías de aire limpio para centrales eléctricas y otros usuarios industriales de carbón y petróleo con el fin de reducir las emisiones de SO 2 dañino a la atmósfera. Las acciones de aire limpio incluyen las siguientes:
- la instalación de tecnologías para capturar SO 2 a partir de gases residuales de postcombustión (esto se conoce como desulfuración o lavado de gases de combustión)
- la eliminación de parte del contenido de azufre de los combustibles (conocido como desulfuración de combustible o lavado de carbón)
- la instalación de dispositivos de control de partículas (como precipitadores electrostáticos) para reducir en gran medida las emisiones de partículas (aunque esto tiene poco efecto sobre las emisiones de SO 2)
- cambiar a combustibles bajos o sin azufre, como el gas natural, o a tecnologías de energía sin azufre como la hidroelectricidad y la energía nuclear (conocidas como conmutación de combustible)
- conservación de energía para reducir la demanda general de combustible y las emisiones asociadas de contaminantes
- construir chimeneas más altas para dispersar las emisiones de SO 2 más ampliamente, lo que ayuda a disminuir la contaminación local a nivel del suelo
Sin embargo, las emisiones globales futuras están obligadas a aumentar. China, la India y otros países de rápida industrialización abastecen gran parte de sus crecientes necesidades energéticas quemando carbón y combustibles derivados del petróleo. En China, el carbón es la principal fuente de energía industrial, representando el 68% del suministro de energía (en 2013; Cuadro 13.9). Debido a la creciente industrialización, las emisiones de SO 2 en China aumentaron de 10 millones de toneladas en 1980 a 34 millones de toneladas en 2000, un aumento de 3.4 veces en solo 20 años.
Las cantidades de emisiones de SO 2 difieren mucho entre las naciones, dependiendo de su población, su tipo de industrialización y los combustibles que utilizan en su mayoría. Por ejemplo, las emisiones canadienses de SO 2 son aproximadamente 22% de las de Estados Unidos (Cuadro 16.2). No obstante, la población de Canadá es sólo alrededor del 11% la de Estados Unidos (Capítulo 10). Por lo tanto, las emisiones per cápita de SO 2 son aproximadamente el doble en Canadá que en Estados Unidos.
Alrededor del 66% de las emisiones canadienses de SO 2 provienen de grandes fuentes industriales, particularmente de fundiciones de metales, mientras que 24% son de “combustión de combustible”, que en su mayoría son centrales eléctricas de combustibles fósiles. En comparación, 84% de las emisiones de Estados Unidos provienen de centrales eléctricas y 10% de fuentes industriales. La mayor parte de esta diferencia se debe a dos factores: una proporción relativamente grande de la generación de electricidad en Canadá proviene de tecnologías nucleares e hidroeléctricas, que no emiten SO 2, y la fundición de metales es una industria importante en Canadá.
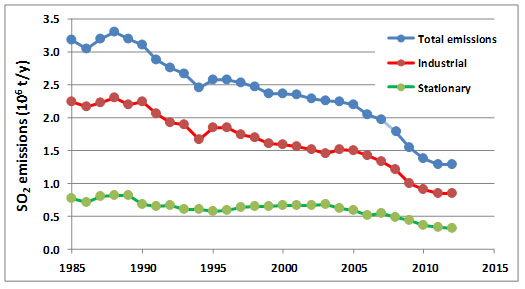
Debido a los daños a la salud humana y al medio ambiente asociados con el SO 2 y otros contaminantes del aire, la mayoría de los países desarrollados han actuado para reducir sus emisiones. En Canadá, las emisiones de SO2 se redujeron en aproximadamente 41% entre 1985 y 2012 (Figura 16.1), en comparación con una reducción de 32% en Estados Unidos. En ambos países las reducciones se lograron por varios métodos:
- cambiar a combustibles bajos o sin azufre para algunos usos importantes, especialmente para la generación de electricidad
- eliminar el azufre de algunos combustibles antes de la combustión, principalmente mediante lavado de carbón
- reducir las demandas de energía mediante la conservación
- instalar depuradores para eliminar SO 2 de los gases residuales de postcombustión antes de que sean ventilados a la atmósfera
Sin embargo, como se muestra en la Figura 16.1, las reducciones de emisiones de fuentes industriales (especialmente fundiciones de metales) y fuentes estacionarias (principalmente centrales eléctricas alimentadas con carbón) han sido especialmente importantes. Las grandes reducciones del SO 2 que se han logrado en América del Norte durante las últimas décadas costaron muchos miles de millones de dólares lograrlas, y deberían considerarse como una importante “historia de éxito” del control de la contaminación.
A diferencia del SO 2, las emisiones globales de gases sulfurados provienen principalmente de fuentes naturales (Cuadro 16.1). Las fuentes más grandes son H 2 S emitido por sedimentos anóxicos en aguas marinas poco profundas y continentales, y sulfuro de dimetilo ((CH 3) 2 S) producido por el fitoplancton y desgasificado de aguas oceánicas. La emisión natural de H 2 S es de aproximadamente 100 millones de toneladas anuales, y sulfuro de dimetilo, de 15 millones de toneladas anuales (ambas expresadas como equivalente de azufre, o como toneladas de S). Las emisiones antropogénicas de H 2 S son de aproximadamente 3 millones de toneladas anuales, y en su mayoría provienen de industrias químicas, plantas de tratamiento de aguas residuales y estiércol de ganado.
La emisión global de todos los gases que contienen azufre equivale a casi 300 millones de toneladas de azufre al año. Alrededor de la mitad de la emisión global proviene de fuentes antropogénicas.
El aire limpio normalmente contiene menos de 0.2 ppb de SO 2 o H 2 S. Las concentraciones de SO 2 y H 2 S en el aire contaminado por las emisiones son muy variables. Normalmente son de aproximadamente 0.2 ppm en atmósferas urbanas pero pueden superar los 3 ppm cerca de grandes fuentes de emisión.
Toxicidad de los Gases
Las concentraciones de H 2 S en el ambiente rara vez son lo suficientemente altas como para ser tóxicas para las plantas. Sin embargo, las emisiones accidentales de las plantas de gas agrio (donde H 2 S se elimina del gas natural) pueden causar daños a la vegetación local. En contraste, las concentraciones de SO 2 en las ciudades y cerca de fuentes industriales suelen ser lo suficientemente altas como para lesionar plantas silvestres y cultivadas. Cerca de ciertas fundiciones de metales, la vegetación ha sido severamente dañada, como examinamos más adelante.
Una exposición a 0.7 ppm SO 2 por una hora dará como resultado lesiones agudas a la mayoría de las especies de plantas, al igual que 0.2 ppm en un período de ocho horas. Es importante señalar, sin embargo, que ciertas especies son extremadamente sensibles a las exposiciones de SO 2 (son hipersensibles) y pueden sufrir lesiones agudas en concentraciones inferiores a las recién señaladas.
Además, las plantas a menudo exhibirán una reducción en el rendimiento cuando se exponen a concentraciones de SO 2 que son inferiores a las requeridas para causar una lesión aguda. Este tipo de respuesta, que ocurre sin síntomas de daño tisular agudo, se conoce como “lesión oculta”. Las lesiones ocultas a la vegetación silvestre y agrícola se miden encerrando las plantas en cámaras experimentales y exponiéndolas al aire que contenga niveles ambientales de SO 2, o al que haya sido filtrado a través de carbón vegetal para eliminar ese gas. Si la productividad es mayor en el aire filtrado, se deduce que el SO 2 ambiental estaba causando una lesión oculta. Los estudios de pastos han encontrado que la exposición a concentraciones de SO 2 con un promedio de solo 0.04 ppm causaría lesiones ocultas como reducciones del rendimiento.
La guía canadiense de calidad del aire para SO 2 ambiente en la atmósfera es un máximo de 450 µg/m 3 (0.17 ppm) en una exposición de una hora (Cuadro 16.3). Esta guía se basa en la concentración que causa lesiones foliares agudas (foliares) en la mayoría de las plantas agrícolas. Aunque las regiones que cumplan con esta directriz no mostrarían mucho daño agudo a la vegetación, las especies relativamente sensibles podrían verse afectadas por lesiones ocultas, posiblemente resultando en pérdidas significativas de rendimiento.
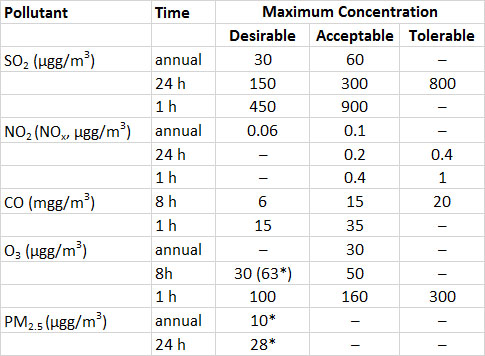
Los humanos y la mayoría de los otros animales son mucho menos sensibles al SO 2 que las plantas. Las pautas para las exposiciones permisibles de personas al SO 2 y otros gases potencialmente tóxicos acomodan el hecho de que, en términos de dosis recibidas, las exposiciones a más largo plazo a bajas concentraciones pueden ser tan importantes como las exposiciones agudas más altas.
Las pautas para las exposiciones ocupacionales a contaminantes del aire son frecuentemente mayores que las de las exposiciones ambientales. En Norteamérica, se recomienda que las exposiciones ocupacionales al SO 2 no sean superiores a 2 ppm (5.2 mg/m 3) a largo plazo, y no superiores a 5 ppm (13 mg/m 3) para exposiciones más cortas. Sin embargo, algunas personas son relativamente sensibles al SO 2, y concentraciones inferiores a 1 ppm (2.6 mg/m 3) pueden hacer que sufran asma u otras angustias relacionadas con el deterioro de la función pulmonar. Además, algunos estudios han sugerido que las exposiciones a largo plazo de grandes poblaciones humanas a aerosoles particulados de sulfato (que finalmente se derivan del SO 2 gaseoso) en las ciudades pueden dar lugar a pequeños aumentos en la incidencia de enfermedades respiratorias y circulatorias, muy probablemente en personas hipersensibles.
En Detalle 16.2. Química de la contaminación del
aire Los contaminantes del aire se emiten como productos químicos particulares, que luego pueden transformarse en otros compuestos a través de reacciones que ocurren en la atmósfera. A continuación se presentan varios ejemplos.
Oxidación de
SO 2 SO 2 + OH → HO•SO 2 (1)
HO•SO 2 + O 2 → HO 2 + SO 3 (2)
SO 3 + H 2 O → H 2 SO 4 (3)
H 2 SO 4 → 2H + + SO 4 2- (en solución acuosa) (4)
Tenga en cuenta que el SO 4 2— producido es importante como constituyente de la lluvia ácida y como sulfato de amonio particulado ((NH 4) 2 SO 4), que son contaminantes importantes.
Oxidación de
NO NO + HO 2 → NO 2 + OH (5)
NO 2 + OH → HNO 3 (6)
HNO 3 → H + + NO 3 — (en solución acuosa) (7)
De manera similar, el NO 3 — producido es importante en lluvia ácida y como nitrato amónico particulado (NH 4 NO 3).
Formación y Destrucción de la estratosfera O3
O 2 + radiación UV → O + O (8) O + O → O 2 (9)
O + O 2 → O 3 (10)
O 3 + radiación UV → O 2 + O (11)
La reacción 11 es un ultravioleta fotodisociación de O 3. El ozono también puede ser consumido por reacciones con NO, NO 2, N 2 O, y con iones o moléculas simples de cloro (especialmente ClO), bromo y flúor. Estas reacciones son demasiado complejas para describirlas aquí.
Formación y Destrucción de Nivel Terrestre
O 3 O + O 2 → O 3 (10)
NO 2 + Radiación UV → NO + O (12)
NO + O 3 → NO 2 + O 2 (13)
NO + RO 2 → NO 2 + RO (14)
La formación de O 3 (reacción 10) requiere O atómico, formado por la fotodisociación de NO 2 (reacción 12). El ozono se puede consumir por reacción con NO (un gas emitido), que regenera NO 2 (reacción 13). El O 3 atmosférico puede, sin embargo, acumularse si otras reacciones (como la reacción 14) convierten NO en NO 2, porque éstas operan en competencia con la reacción 13 para NO. (La especie RO 2 incluye diversos químicos conocidos como radicales peroxi, formados por la degradación de moléculas orgánicas por reacción con radicales hidroxilo, seguido de la adición de O 2 molecular. RO es la forma químicamente reducida de RO 2.)
Gases Nitrógeno
Emisiones y Transformaciones
Los más importantes de los gases que contienen nitrógeno son el óxido nítrico (NO), el dióxido de nitrógeno (NO 2), el óxido nitroso (N 2 O) y el amoníaco (NH 3). NO y NO 2 a menudo se consideran juntos como un complejo, referido como NO x.
El amoníaco (NH 3), un gas incoloro, se emite principalmente desde los humedales, donde se produce durante la descomposición anaeróbica de la biomasa muerta. Las emisiones naturales de NH 3 son de aproximadamente 1.2 mil millones de toneladas anuales (Cuadro 16.1). Las fuentes de emisiones antropogénicas incluyen la combustión de combustibles fósiles (4 millones de toneladas al año) y la cría de animales (0.2 millones de toneladas por año). El tiempo de residencia del NH 3 en la atmósfera es de aproximadamente siete días (el NH 3 finalmente se oxida a nitrato).
El óxido nitroso (N 2 O) es un gas incoloro, no tóxico que produce una leve euforia cuando se inhala. Este gas también se conoce como “gas de la risa” y se utiliza como anestésico leve en medicina, y a veces como droga recreativa. Debido a que el N 2 O es un compuesto bastante poco reactivo, tiene un largo tiempo de residencia en la atmósfera de aproximadamente cuatro años. La mayoría de las emisiones de N 2 O están asociadas con la desnitrificación microbiana en suelo y agua. Estos equivalen a unos 18 millones de toneladas anuales, mientras que las emisiones industriales son de 12 millones de toneladas anuales. El suelo agrícola fertilizado con nitrato puede tener altas tasas de emisión de N 2 O, y se cree que las prácticas agrícolas modernas han aumentado las emisiones globales en aproximadamente 40%.
El óxido nítrico (NO) es un gas incoloro e inodoro, mientras que el dióxido de nitrógeno es rojizo, penetrante e irritante para las membranas respiratorias y oculares. Las emisiones naturales de NO x son alrededor de 430 millones de toneladas anuales (expresadas como NO; las mismas emisiones expresadas como NO 2 son 658 millones de toneladas anuales). Las emisiones naturales más importantes de NO x se deben a la desnitrificación bacteriana del nitrato en el suelo, la fijación del gas nitrógeno atmosférico (N 2) por rayos y la oxidación del nitrógeno de la biomasa durante los incendios (ver Capítulo 5).
Las emisiones antropogénicas de NO x, alrededor de 83 millones de toneladas anuales (expresadas como NO), resultan principalmente de la combustión de combustibles fósiles, especialmente en automóviles y centrales eléctricas (Cuadro 16.1). Estas emisiones son en su mayoría NO, que se oxida secundariamente a NO 2 por reacciones en la atmósfera. En última instancia, la mayoría de los NO atmosféricos x gases se oxidan a nitrato (NO 3 —), un ion que es importante en la acidificación de las precipitaciones y los ecosistemas (Capítulo 19).
Toxicidad de los Gases
Es raro que las concentraciones de NH 3 o NO x gases sean lo suficientemente altas como para dañar la vegetación. El daño ambiental asociado al NO x se centra en las reacciones fotoquímicas por las que se produce el ozono, un gas mucho más tóxico (ver abajo), y también la acidificación de las precipitaciones y los ecosistemas.
Las concentraciones ambientales de NH 3 y NO x rara vez son lo suficientemente altas como para molestar a los humanos. Los lineamientos para exposiciones a largo plazo en un entorno ocupacional son 25 ppm (34 mg/m 3) para NO y 5 ppm (10 mg/m 3) para NO 2. Las pautas ocupacionales para exposiciones a corto plazo son 35 ppm (47 mg/m 3) y 5 ppm (10 mg/m 3), respectivamente. Las exposiciones ocupacionales intensas a NO x pueden causar alteración de la función pulmonar en humanos.
Gases y Vapores Orgánicos
Emisiones y Transformaciones
Los hidrocarburos son un grupo diverso de químicos cuyas estructuras moleculares contienen diversas combinaciones de átomos de hidrógeno y carbono. El hidrocarburo más simple es el metano (CH 4), un gas. Los hidrocarburos más grandes con mayor peso y estructura más compleja pueden ocurrir como vapores, líquidos o sólidos (Capítulo 22). Otros compuestos orgánicos volátiles (COV) pueden contener oxígeno, nitrógeno y otros elementos ligeros además de carbono e hidrógeno, e incluyen alcoholes, aldehídos y fenoles.
La concentración de fondo de metano en la atmósfera es de aproximadamente 1.7 ppm (1 ppm = 0.65 mg/m 3), mientras que todos los demás hidrocarburos y orgánicos volátiles juntos suman menos de 1 ppb (Cuadro 16.1; las conversiones a mg/m 3 son variables dependiendo del peso molecular). La mayoría de las emisiones de CH 4 son naturales y están asociadas con la fermentación de materia orgánica por microbios en humedales anaerobios. Cantidades menores son desgasificadas de depósitos de combustibles fósiles, durante incendios forestales, y de eructos y animales rumiantes flatulentos (como vacas y ovejas) y termitas, que producen CH 4 a medida que digieren sus alimentos vegetales. Las emisiones naturales globales de CH 4 son de aproximadamente 1.6 mil millones de toneladas por año, y las emisiones naturales 0.3 mil millones de toneladas por año.
Los hidrocarburos atmosféricos distintos de CH 4 se denominan hidrocarburos no metanos. Las emisiones naturales de estos y muchos orgánicos ocurren principalmente como gases y vapores que se evaporan de la vegetación viva, junto con cantidades menores que salen de gas de los depósitos de combustibles fósiles. Las mayores emisiones de los bosques suelen ocurrir durante los días calurosos y soleados. Las emisiones naturales de hidrocarburos no metanos son de aproximadamente 200 millones de toneladas anuales, en comparación con las emisiones antropogénicas de 186 millones de toneladas anuales (Cuadro 16.1). Las fuentes antropogénicas más importantes son el combustible no quemado emitido por vehículos y aeronaves, las liberaciones durante la minería y refinación de combustibles fósiles y la evaporación de solventes.
Toxicidad de gases y vapores orgánicos
Los gases y vapores orgánicos pueden ser tóxicos, pero las concentraciones atmosféricas rara vez son lo suficientemente altas como para dañar la vegetación o los animales. La importancia ambiental de estos gases y vapores radica principalmente en su papel en las reacciones fotoquímicas que producen ozono tóxico. Además, el CH4 es un importante gas de efecto invernadero que afecta el calentamiento global (Capítulo 17). En algunos lugares de trabajo, sin embargo, orgánicos relativamente tóxicos como el benceno y el formaldehído pueden ser contaminantes importantes.
Ozono
Hay dos temas ambientales diferentes relacionados con el ozono: (1) O 3 en la estratosfera y (2) O 3 en la troposfera (ozono a nivel del suelo). Las altas concentraciones de ozono están presentes de forma natural en la capa atmosférica superior conocida como la estratosfera, que comienza a unos 8-17 km sobre la superficie de la Tierra, dependiendo de la latitud y la estación del año. La estratosfera O 3 no causa daños y no es contaminante del aire. Más bien, al absorber la radiación ultravioleta solar, la estratosférica 3 ayuda a proteger a los organismos en la superficie del planeta de muchos efectos dañinos de la exposición a esta parte dañina del espectro electromagnético. En contraste, el O3 en la atmósfera inferior (la troposfera) es un contaminante importante del aire que daña la vegetación, los materiales y la salud humana. El ozono se elimina de la atmósfera por interacciones con otros gases, vapores orgánicos y superficies terrestres y acuáticas (incluida la vegetación).
Ozono a Nivel del
El ozono a nivel del suelo (O 3) es el más dañino de los llamados contaminantes fotoquímicos del aire. Menos importantes son el nitrato de peroxiacetilo (PAN), el peróxido de hidrógeno (H 2 O 2) y otros gases oxidantes. El smog oxidante es rico en O 3 y los otros gases oxidantes. Estos químicos son contaminantes secundarios, lo que significa que en realidad no se emiten a la atmósfera (al igual que los contaminantes primarios como SO 2 y NO x). En cambio, se sintetizan dentro de la atmósfera mediante reacciones fotoquímicas (reacciones químicas que requieren luz, especialmente longitudes de onda ultravioleta). Estos proceden a velocidades más rápidas y resultan en una acumulación de oxidantes si NO x e hidrocarburos están presentes en altas concentraciones, una condición que normalmente se debe a las emisiones antropogénicas.
Algunas regiones tienden a desarrollar una débil inversión atmosférica por la mañana. Debido a que una inversión es relativamente estable y resiste la mezcla de aire más limpio desde arriba o más allá, esta condición fomenta el desarrollo de smog oxidante durante la mañana y temprano en la tarde. Más tarde en el día, la inversión suele ser rota por vientos más fuertes, y la contaminación del aire se dispersa. Tales inversiones y su smog rico en ozono son fenómenos comunes alrededor de la cuenca de Los Ángeles, la Ciudad de México, Vancouver y otros lugares.
Las concentraciones de O 3 a nivel del suelo varían mucho entre las diferentes regiones de América del Norte. Las concentraciones promedio en el suroeste de Estados Unidos son relativamente altas, alrededor de 100 ppb (1 ppb = 2 µg/m 3), y generalmente oscilan entre 40 y 60 ppb en otras regiones de Estados Unidos y en el sur de Canadá.
Canadá, Estados Unidos y otros países han desarrollado estándares de calidad del aire para O 3. Estos pretenden reflejar concentraciones que evitarían daños severos a la vegetación agrícola y silvestre. Durante algún tiempo, el estándar americano O 3 fue de 80 ppb (160 µg/m 3) (para una exposición promedio de una hora), pero en 1979 ésta se relajó a 120 ppb (240 µg/m 3). Las autoridades hicieron el cambio debido a que el estándar original de 80 ppb se excedía frecuentemente en grandes regiones y por lo tanto era esencialmente inaplicable. De hecho, incluso el criterio de 120 ppb se suele superar en algunas regiones, particularmente en el suroeste de Estados Unidos.
La cuenca de Los Ángeles sufre una contaminación atmosférica fotoquímica especialmente intensa. Las concentraciones de O 3 pueden superar las 500 ppb (promedio de una hora), y normalmente superan las 100 ppb por más de 15 días durante el verano. Las concentraciones máximas de O 3 son menores en otras ciudades de Norteamérica, alcanzando típicamente hasta 150-250 ppb (promedio de una hora). Estas concentraciones están bien dentro del rango en el que O 3 puede causar lesiones agudas a las plantas, razón por la cual el O 3 es un contaminante del aire tan importante. Las emisiones de precursores de ozono (NO x e hidrocarburos) ocurren principalmente en las ciudades, pero se producen daños ecológicos extensos cuando las masas de aire contaminadas son transportadas a zonas rurales dominadas por vegetación agrícola o natural.
En Canadá, las regiones que más a menudo experimentan contaminación por ozono son el valle inferior de Fraser en el suroeste de Columbia Británica, el corredor Windsor-Quebec City y el sur de Marítimos (Environment Canada, 1999). El valle inferior de Fraser, una tierra baja costera delimitada por montañas al este, a menudo tiene inversiones atmosféricas y recibe grandes emisiones de precursores de ozono desde el área metropolitana de Vancouver hacia el oeste. Algunos lugares en el valle inferior de Fraser tienen concentraciones máximas de O3 de aproximadamente 100 ppb.
El corredor Windsor—Quebec City también tiene emisiones locales asociadas a personas e industrias (alrededor del 60% de la población canadiense vive en la región), pero esta zona también recibe ozono y sus precursores en masas de aire que soplan de regiones altamente pobladas de Estados Unidos. Muchos lugares del corredor tienen concentraciones de O3 de 110-160 ppb, y se han medido valores de hasta 190 ppb.
La región marítima del sur se ve afectada principalmente por masas de aire ricas en ozono que ingresan desde partes industriales del sur de Ontario, Quebec y el noreste de Estados Unidos. Algunos lugares en el sur de New Brunswick y el oeste de Nueva Escocia tienen concentraciones de O 3 de hasta 90-110 ppb.
Toxicidad del ozono
Los humanos y algunos animales son sensibles al O 3, que puede irritar y dañar las membranas de los ojos y del sistema respiratorio y provocar una pérdida del funcionamiento pulmonar. La pauta para la exposición a largo plazo a O 3 en un entorno ocupacional es de 100 ppb (196 µg/m 3), y es de 300 ppb (589 µg/m 3) para exposiciones a corto plazo. Sin embargo, las personas sensibles pueden verse afectadas por síntomas relacionados con O 3 en concentraciones más bajas. La exposición a O 3 puede provocar ataques asmáticos y puede exacerbar la bronquitis y el enfisema.
El ozono causa importantes daños a las plantas silvestres y agrícolas en áreas extendidas. Las lesiones foliares suelen ser distintivas del O 3, y disminuyen la capacidad fotosintética de las plantas y con ello reducen su productividad. Las lesiones agudas son causadas a la mayoría de las especies por exposiciones de dos a cuatro horas a 200-300 ppb O 3, mientras que las exposiciones a largo plazo de solo 40-100 ppb pueden causar lesiones ocultas (y rendimiento reducido). Sin embargo, muchas especies son más sensibles y sufren lesiones agudas y ocultas a concentraciones más bajas. Algunas variedades de tabaco (tabaco Nicotiana), por ejemplo, pueden sufrir lesiones foliares agudas por una exposición de dos a tres horas a solo 50-60 ppb, y espinacas (Spinacea oleracea), de una a dos horas a 60-80 ppb. Las especies sensibles de coníferas pueden sufrir lesiones agudas por exposiciones a 80 ppb O 3 a lo largo de 12 horas.
Los investigadores han cultivado plantas agrícolas en cámaras experimentales que recibieron aire ambiente, o aire filtrado a través de carbón vegetal, lo que elimina cualquier O 3. Estos estudios han sido útiles para definir el grado de daño causado a los cultivos agrícolas por la exposición al ambiente O 3. Una serie de experimentos de campo demostró que los rendimientos de los cultivos se redujeron en todas las regiones de Estados Unidos. El peor daño ocurrió en el suroeste, donde las condiciones soleadas y las grandes emisiones de NO x e hidrocarburos resultan en concentraciones especialmente altas de O 3. Ese estudio estimó que los daños en los cultivos por el O 3 equivalían al 2— 4% del rendimiento agrícola total en Estados Unidos, con pérdidas económicas equivalentes a más de 5 mil millones de dólares anuales. Debido a que el daño a la vegetación relacionado con el O 3 ocurre en extensas áreas de América del Norte, es con mucho el contaminante del aire más importante en la agricultura. El ozono es probablemente también el principal contaminante del aire que causa daños a los bosques y otros ecosistemas naturales.
Ozono estratosférico
En contraste con el ozono a nivel del suelo, el ozono en la estratosfera protege la vida en la Tierra de los efectos dañinos de la radiación solar ultravioleta (UV). Esta es la razón por la que el hecho de que el ozono estratosférico esté siendo destruido por las emisiones antropogénicas de ciertos gases es motivo de alarma.
El ozono se produce en la estratosfera mediante reacciones fotoquímicas naturales. Implican la absorción de la radiación UV solar por las moléculas de oxígeno (O 2), lo que crea átomos de oxígeno altamente reactivos (O) que se unen con otras moléculas de O 2 para formar O 3 (ver En Detalle 16.2). Estas reacciones proceden relativamente rápido en la estratosfera debido a que la radiación UV de alta energía es abundante allí. Como resultado, las concentraciones de O 3 son típicamente de 200-300 ppb en la estratosfera, aproximadamente 10 veces mayores que en la troposfera ambiental.
La estratosfera O 3 brinda un servicio ambiental crítico. Absorbe de manera eficiente la mayor parte de la radiación UV de alta energía entrante, que puede ser extremadamente dañina para los organismos. En particular, el ADN es un fuerte absorbente de UV y puede ser dañado por esta radiación. Esto puede aumentar el riesgo de desarrollar cánceres de piel, incluido el melanoma, una neoplasia maligna a menudo mortal. Otros riesgos para la salud de la exposición a los rayos UV incluyen el desarrollo de cataratas en los ojos y la supresión del sistema inmunológico. La radiación UV también daña las plantas, en parte porque la clorofila (el pigmento fotosintético clave) se degrada por la absorción UV, lo que puede conducir a disminuciones en la productividad. La cubierta cerosa de la cutícula del follaje también está dañada por la radiación UV.
El O 3 estratosférico puede ser destruido por diversos procesos, incluyendo reacciones con los gases traza NO x y N 2 O y con iones reactivos de bromo, cloro y flúor. Debido a las emisiones antropogénicas, las concentraciones de algunos de estos productos químicos que consumen O 3 han ido en aumento en la estratosfera, provocando preocupaciones sobre el agotamiento del O 3 estratosférico. Se cree ampliamente que las emisiones de clorofluorocarbonos (CFC), particularmente los gases industriales conocidos como freones, han sido especialmente importantes en este sentido. Debido a que los CFC son extremadamente poco reactivos en la troposfera, eventualmente migran hasta la estratosfera, donde son bombardeados con radiación UV y lentamente se degradan (fotodisocian) para liberar cloro libre. El cloro reacciona eficientemente con el O 3 y destruye.
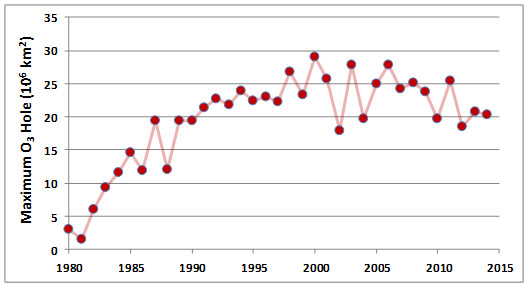
Las reacciones destructoras de O 3 proceden de manera más efectiva en condiciones extremadamente frías y estancadas en la estratosfera, como las que ocurren por encima de latitudes polares al final de los inviernos antárticos y árticos. Estos empobrecimientos de O 3 enfocados en el polo dan como resultado el desarrollo de los llamados agujeros de ozono durante la primavera temprana. Estos fenómenos se han observado regularmente desde principios de la década de 1980. Los agujeros O 3 sobre la Antártida son particularmente extensos y típicamente implican disminuciones de la concentración de O 3 de 30-50% durante la primavera. Los depleciones menores de O 3 ocurren por encima del Ártico, incluido el norte de Canadá. Las áreas afectadas en el hemisferio norte son mucho más pequeñas que sus contrapartes en la Antártida.
Los tamaños de los agujeros de ozono en la Antártida varían de un año a otro, pero ha habido una tendencia de fuertes aumentos desde 1980, cuando se comenzaron a recolectar los primeros datos precisos (Figura 16.3). Aunque las pérdidas estacionales de O 3 solo ocurren sobre regiones polares, latitudes más bajas también se ven afectadas cuando el aire empobrecido en O 3 se dispersa durante la ruptura de los agujeros. Esto reduce temporalmente las concentraciones estratosféricas de O 3 en todo el hemisferio, aunque no casi en el mismo grado que ocurre en los propios agujeros.
Cuestiones Ambientales 16.1. El Protocolo de Montreal — Un Éxito de la Acción Regulatoria
Poco después de que se reconociera ampliamente que las emisiones de clorofluorocarbonos (CFC) y otros productos químicos estaban degradando la capa de ozono estratosférico, los gobiernos mundiales tomaron medidas para hacer frente al problema. En 1987, el Programa de las Naciones Unidas para el Medio Ambiente (PNUMA) organizó una reunión internacional en Montreal, donde intensas negociaciones llevaron a un tratado llamado El Protocolo de Montreal relativo a las sustancias que agotan la capa de ozono. El Protocolo de Montreal es un acuerdo internacional que comprometió a todas las partes (naciones signatarias) a un cronograma para la eliminación gradual de la producción y uso de CFC y otras sustancias conocidas por ser perjudiciales para la capa de ozono. El tratado requería que las naciones signatarias congelaran su producción y consumo de CFC en los niveles de 1986 para 1989, y reducirlos aún más al 50% de los niveles de 1986 para 1998.
En un principio, los gobiernos de muchos países se mostraron reacios a ratificar el protocolo porque no querían imponer estrictos controles a la fabricación y uso de los productos químicos que consideraban necesarios para el funcionamiento de sus economías. Esto fue particularmente cierto para las naciones de la Comunidad Europea, la ex Unión Soviética y Japón. Sin embargo, Canadá, Estados Unidos, Noruega y Suecia abogaron enérgicamente por medidas de control, y lograron convencer a las naciones reacias de que eliminaran gradualmente su uso de sustancias que agotan el ozono. El Protocolo de Montreal entró en vigor el 1 de enero de 1989, y luego fue ratificado por 40 países, que representaron alrededor del 82% del uso global de CFC.
El Protocolo de Montreal fue posteriormente mejorado por una serie de enmiendas para eliminar el uso de halones para 1994; de CFC, metilcloroformo, HBFC (hidrobromofluorocarbonos) y tetracloruro de carbono para 1996; de bromuro de metilo para 2010; y de HCFC (hidroclorofluorocarbonos) para 2030. El protocolo enmendado fue ratificado por muchos países adicionales, entre ellos China e India, naciones enormes que no habían participado en las negociaciones iniciales. Para 2009, 197 países eran partes en el Protocolo de Montreal, lo que lo convirtió en el primer tratado de este tipo en lograr la aprobación universal. Las enmiendas también establecieron el Fondo Multilateral del Protocolo de Montreal para brindar apoyo financiero para ayudar a los países en desarrollo a ser rápidamente menos dependientes de los productos químicos que agotan el ozono.
El Protocolo de Montreal y sus modificaciones posteriores han sido calificadas de “historia de éxito” en el control regulatorio de la contaminación. Muchos países desarrollados (incluido Canadá) aceleraron y superaron sus objetivos de reducción originales, y los países menos desarrollados se han comprometido a no permitir el uso de sustancias que agotan el ozono en sus economías. Este éxito se logró debido a lo siguiente:
- Hubo reconocimiento internacional de una clara amenaza para el medio ambiente global
- La amenaza estaba asociada con sustancias particulares que podían controlarse fácilmente, ya que se fabricaban en pocos lugares y se utilizaban con fines relativamente discretos
- Se desarrollaron rápidamente sustitutos económicamente aceptables para reemplazar los usos de sustancias que agotan el ozono
En resumen, información rigurosa, instituciones internacionales y nacionales eficaces, espíritu de cooperación, liderazgo efectivo de líderes inspirados y disponibilidad de tecnologías alternativas combinadas para salvar las diferencias políticas en favor de la búsqueda de un interés ambiental compartido. Es por ello que el Protocolo de Montreal y su implementación son una historia de éxito de acción regulatoria ambiental.
Contaminación del aire y salud
Un caso extraordinario de una emisión natural de gas que causó muertes humanas implicó la liberación de un gran volumen de CO 2 de un lago en Camerún, África Occidental. El lago Nyos es un lago volcánico de 200 metros de profundidad en el que las aguas profundas están naturalmente sobresaturadas con CO 2, similar al agua de soda embotellada. Una noche de 1986, una gran cantidad de sedimentos aparentemente se desplomó en el lago empinado, lo que provocó que parte de su agua del fondo se agitara a la superficie. El agua desgasificó su contenido de CO 2 como una masa de aire densa, que luego fluyó hacia áreas bajas en el paisaje circundante. El aire rico en CO 2 asfixió a cerca de 1,700 personas dormidas y 3,500 ganado a 25 km del lago, además de animales salvajes sin contar. El CO 2 atmosférico es capaz de causar toxicidad severa a concentraciones superiores al 8-10%; su nivel “normal” es de aproximadamente 0.04%. Las plantas son mucho menos vulnerables a la toxicidad del CO 2, por lo que no se dañó la vegetación por este raro y sorprendente evento natural.
Las emisiones antropogénicas de otros contaminantes gaseosos en ocasiones han provocado aumentos en la mortalidad humana y en las enfermedades. Algunas personas, especialmente aquellas con enfermedades respiratorias o cardíacas crónicas, son especialmente vulnerables a los efectos de la contaminación del aire. Las exposiciones de las personas a gases tóxicos pueden ocurrir dentro de varios contextos, entre ellos los siguientes.
- El ambiente ambiente: La atmósfera urbana suele contener concentraciones relativamente altas de sustancias químicas potencialmente tóxicas. Esto es cierto en general, pero la calidad del aire es especialmente mala durante los eventos de smog, a menudo causados por una mala dispersión durante una inversión atmosférica. En consecuencia, la gente de la ciudad que vive su vida normal está habitualmente expuesta a concentraciones más altas de contaminantes del aire que las que viven en entornos rurales más limpios.
- El ambiente de trabajo: Muchas personas están expuestas a altas concentraciones de contaminantes como consecuencia de su ocupación. Por supuesto, las exposiciones específicas dependen del trabajo: los trabajadores de las fundiciones de metales pueden estar expuestos al dióxido de azufre y partículas metálicas, la mecánica automotriz puede verse afectada por los humos de escape que contienen monóxido de carbono e hidrocarburos, y los trabajadores de laboratorio pueden inhalar diversos solventes orgánicos.
- El ambiente interior: Los edificios suelen estar contaminados por gases y humos. Por ejemplo, los calefactores, hornos y chimeneas que queman leña, queroseno o fuelóleo pueden emitir monóxido de carbono al ambiente interior. Todas las combustiones a alta temperatura emiten óxido nítrico, y muchos materiales sintéticos y telas ventilan formaldehído y otros vapores orgánicos. Estos productos químicos pueden acumularse si el aire interior no se intercambia frecuentemente con aire exterior más limpio.
- Humo de tabaco: El fumar tabaco es una fuente líder de contaminación del aire fácilmente evitable. El tabaquismo es también la causa más importante de enfermedades prevenibles, especialmente el cáncer de pulmón y enfermedades cardíacas (ver Capítulo 15). Las personas inhalan una gran variedad de gases y humos tóxicos cuando fuman tabaco (y también marihuana). Además, los no fumadores están expuestos indirectamente a menores concentraciones de esos químicos debido a los persistentes residuos de “humo de segunda mano” que pueden ocurrir en las atmósferas interiores.
Todas estas exposiciones a contaminantes atmosféricos tienen implicaciones importantes para la salud humana. No obstante, la contaminación del medio ambiente urbano es el foco de los siguientes párrafos.
Desde el inicio de la Revolución Industrial en Europa Occidental a mediados del siglo XVIII, las personas que viven en ciudades y trabajan en ciertos tipos de fábricas han estado expuestas a altas concentraciones de contaminantes atmosféricos. Especialmente importantes han sido el dióxido de azufre, hollín y otras emisiones asociadas a la combustión de carbón y otros combustibles fósiles. Las exposiciones más severas a contaminantes en ambientes urbanos se produjeron típicamente durante inversiones atmosféricas prolongadas, que impiden la dispersión de las emisiones y dan como resultado smogs ricos en SO 2 y partículas.
El carbón se ha utilizado durante mucho tiempo en muchos lugares para calentar hogares y otros edificios. Las emisiones asociadas han sido consideradas como un problema en ciudades y pueblos de Europa desde al menos 1500. Con el inicio de la Revolución Industrial, que inicialmente utilizó el carbón como su principal fuente de energía, la contaminación del aire empeoró notablemente. El primer vínculo convincente entre la contaminación del aire y un aumento sustancial en la tasa de mortalidad de una población humana expuesta se hizo en 1909, en relación con un smog nocivo durante una inversión en Glasgow, Escocia, cuando se pudieron haber causado alrededor de mil muertes.
El “smog asesino” más infame en Norteamérica ocurrió en 1948 en Donora, Pensilvania. Una inversión y niebla persistieron en el Valle de Donora durante cuatro días, pero las emisiones de varias fábricas continuaron, resultando en una acumulación de altas concentraciones de SO 2 y partículas en la atmósfera. El smog resultó en un aumento de la mortalidad en la población local (20 muertes en una población de sólo 14 100). Un 43% adicional de la población enfermó, 10% severamente así. Los síntomas más comunes fueron irritación de ojos y vías respiratorias, a veces acompañada de tos, dolor de cabeza y vómitos.
El smog asesino más notorio del mundo afligió a Londres, Inglaterra, en 1952, cuando una extensa inversión y niebla se estabilizaron sobre el sur de Inglaterra. En Londres, las emisiones de contaminantes, principalmente de la combustión del carbón, transformaron la “niebla blanca” natural en una “niebla negra” venenosa. La visibilidad era terrible: la gente perdió el rumbo mientras caminaba o conducía, incluso se caía de muelles hacia el río Támesis, y los aviones se perdieron mientras intentaban tomar un taxi en el aeropuerto. El smog duró cuatro días, pero le siguieron otros 14 días con una tasa de mortalidad superior a la habitual. En general, se atribuyeron alrededor de 3,900 muertes a este episodio de contaminación nociva. La mayoría de las personas afectadas eran ancianos o muy jóvenes, o tenían enfermedades respiratorias o cardíacas preexistentes.
Hasta principios de la década de 1960, los episodios severos de contaminación del aire urbano eran comunes en las ciudades de América del Norte y Europa Occidental. La mayoría de los smogs fueron causados por la quema generalizada de carbón en chimeneas y hornos en hogares, servicios eléctricos y fábricas. El aire urbano de mala calidad afectó la salud de las personas y los animales y también dañó la vegetación. En muchas ciudades, solo podrían crecer ciertos tipos de plantas que pueden tolerar la contaminación del aire. Ejemplos de árboles tolerantes a la contaminación que se cultivan comúnmente en las zonas urbanas de Canadá incluyen el arce noruego (Acer platanoides), el arce plateado (A. saccharinum), el tilo (Tilia europaea), el árbol del cielo (Ailanthus altissima) y el ginkgo (Ginkgo biloba).
Para hacer frente a los problemas de este tipo de smog, los gobiernos introdujeron legislación que ha requerido grandes reducciones en las emisiones de contaminantes atmosféricos, particularmente en las ciudades. En Canadá, por ejemplo, la promulgación de diversas leyes federales, provinciales y municipales relacionadas con las emisiones atmosféricas ha mejorado sustancialmente la calidad del aire urbano. La calidad del aire se ha mejorado de manera similar bajo la legislación promulgada en los Estados Unidos, Gran Bretaña y otros países más ricos desde la década de 1960.
Por supuesto, los smogs asesinos fueron eventos particularmente severos de contaminación del aire. Más típicamente, la atmósfera urbana está contaminada por concentraciones mucho más pequeñas de SO 2, NO x, O 3, compuestos orgánicos volátiles y partículas. Muchos estudios han investigado los efectos de las exposiciones crónicas a esas exposiciones más bajas a contaminantes del aire en la salud humana. Los resultados de algunos estudios sugieren que la calidad del aire urbano moderno está suficientemente degradada para causar daños crónicos a la salud humana, especialmente al aumentar la incidencia de enfermedades pulmonares, asma e irritación ocular. Sin embargo, otros estudios no han encontrado que este sea el caso. En todo caso, se han tomado acciones efectivas en Canadá y otras naciones relativamente ricas. Episodios visiblemente amenazantes, incluso letales, de contaminación del aire como los descritos anteriormente ya no ocurren en esos países, aunque podrían regresar si se relajaban los estándares de control.
Desafortunadamente, en las ciudades de países con economías de rápido crecimiento, como Brasil, China, India, Indonesia y México, el crecimiento industrial y urbano mal regulado está dando como resultado terribles descensos en la calidad del aire. Aunque aún no están bien estudiadas en términos de enfermedades humanas, estas parecen ser tragedias modernas de contaminación del aire urbano.
Enfoque Canadiense 16.1. El smog en las ciudades canadienses El
smog es un problema grave en muchas ciudades y también en algunas zonas rurales debido al LRTAP de las zonas urbanas. El smog se caracteriza típicamente como una mezcla nociva de contaminantes visibles como una neblina de color amarillo parduzco o blanco grisáceo. Los componentes clave son los siguientes:
- O 3 gas, junto con SO 2 y NO x
- vapores orgánicos
- partículas finas (< 10 µm de diámetro), incluidas gotas ácidas de H 2 SO 4 y HNO 3, partículas de NH 4 NO 3 y (NH 4) 2 SO 4, y orgánicos de gases de escape de diesel y otras fuentes de combustión
El smog es ampliamente considerado como una de las principales causas de daño ambiental, ya que causa toxicidad a la vegetación y deteriora las superficies de los edificios y otros materiales. También se sabe que el smog causa enfermedades e incomodidad en muchas personas. Los ancianos y los niños son especialmente vulnerables, al igual que las personas con enfermedades cardíacas o pulmonares existentes (particularmente asma, bronquitis y enfisema). Incluso los adultos sanos, sin embargo, pueden verse afectados en días con smog severo. Las principales causas de toxicidad son el ozono, otros gases y las partículas más finas (<2.5 µm), que pueden penetrar en las cavidades pulmonares más pequeñas (conocidas como alvéolos) y causar irritación y otros problemas.
Sin embargo, los datos que muestran una asociación de smog y enfermedades humanas son epidemiológicos, es decir, implican descubrir relaciones estadísticas entre las concentraciones de contaminantes atmosféricos y la prevalencia de ciertas enfermedades. En el sur de Ontario, por ejemplo, existe un incremento predecible en los ingresos hospitalarios de personas que padecen padecimientos respiratorios en momentos en que las concentraciones de partículas de ozono y/o sulfato son altas. Aunque rara vez es posible vincular una enfermedad específica en una persona en particular con una exposición a la contaminación del aire, estimaciones estadísticas de la Asociación Médica de Ontario sugirieron que el smog es responsable anualmente de alrededor de 9.500 muertes prematuras y 7.800 millones de dólares en costos relacionados con la salud en Ontario (OMA, 2015).
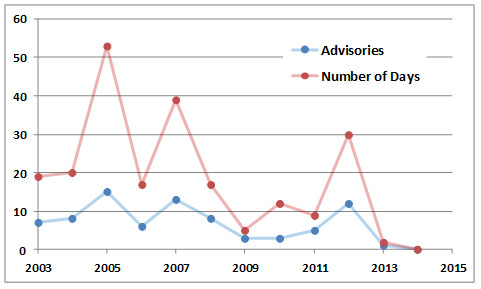
Debido a la importancia del smog como estresante de los canadienses urbanos, los gobiernos han iniciado programas para monitorear los contaminantes del aire y predecir sus concentraciones para que se puedan emitir “alertas de smog” al público. Environment Canada, en asociación con los gobiernos provinciales y municipales, emite habitualmente asesorías en ciudades propensas al smog, generalmente el día antes de que se prevea un alto nivel de ozono. De igual manera, algunas provincias y municipios han desarrollado índices de calidad del aire para brindar asesoría diaria. La intención es alentar a las personas e industrias a tomar acciones para reducir la contaminación del aire y evitar la exposición innecesaria al permanecer dentro de los edificios y al no hacer ejercicio al aire libre que implique la respiración profunda.
En 2005, Ontario experimentó su peor verano de smog, con 53 días entre junio y septiembre teniendo el aire tan contaminado por el ozono y otros químicos que se consideró un peligro para la salud. El smog fue causado por las emisiones de los muchos vehículos y otras fuentes en esa región bien poblada, aunado a un clima más caluroso y soleado de lo normal (esas condiciones favorecen la formación fotoquímica de ozono), así como LRTAP de otras regiones. Parece que este tipo de smog amenazante para la salud está bien establecido en regiones extensas y altamente pobladas del sur de Ontario y en otras partes de Canadá.
Figura 16.4. Historia de las asesorías de smog en Ontario. Fuente: Datos del Ministerio del Medio Ambiente de Ontario (2014).
Estudios de Caso de Daño Ecológico
En esta sección se examinan dos estudios de caso de daños ecológicos causados por la contaminación del aire. El primer ejemplo describe la contaminación del aire “natural” en Smoking Hills, una localidad remota en el Ártico. El segundo examina los efectos ecológicos de las emisiones de grandes fundiciones cerca de Sudbury, Ontario.
Las colinas humeantes
Las Colinas de Fumar se encuentran en los Territorios del Noroeste en la costa del Mar de Beaufort. En diversos lugares a lo largo de la costa y ríos cercanos, las costuras de esquisto bituminoso ocurren como estratos expuestos en lugares empinados donde se está produciendo erosión. El esquisto contiene azufre piritico, que se oxida a sulfato cuando se expone al oxígeno atmosférico a través de la erosión de los acantilados. La oxidación produce calor (la reacción es exotérmica), que bajo condiciones aislantes puede aumentar la temperatura lo suficiente como para encender espontáneamente los materiales bituminosos. Estos arden y liberan SO 2, que fumiga la tundra cercana. El primer avistamiento registrado de Smoking Hills fue en 1826 por John Richardson, un explorador. Sin embargo, las quemaduras fueron conocidas desde hace mucho tiempo por los inuit locales y probablemente tengan miles de años de antigüedad.

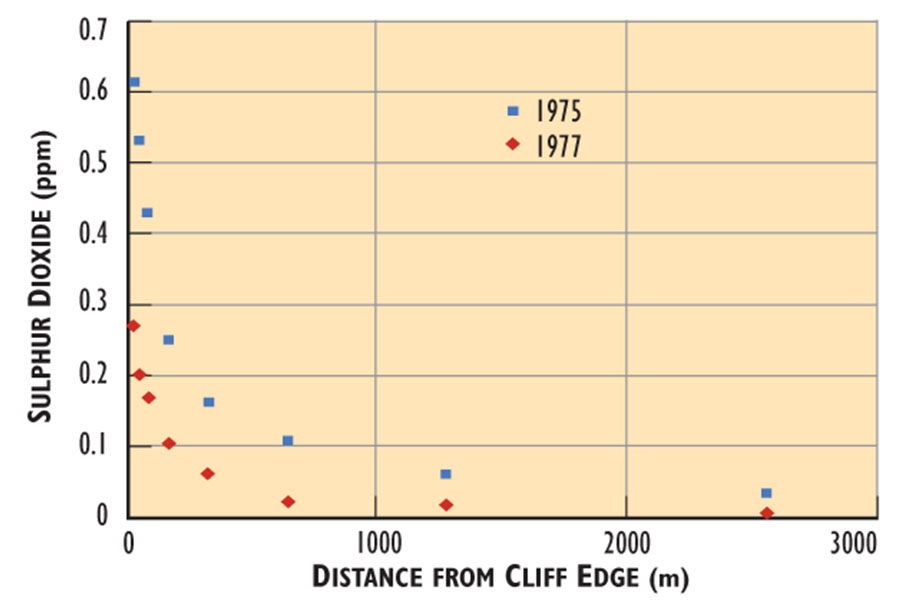
Los vientos en Smoking Hills suelen soplar los penachos cargados de SO 2 (masas de aire) tierra adentro a nivel del suelo, de tal manera que fumigan la tundra. La contaminación es más intensa al borde del acantilado, donde las plumas comienzan a extenderse tierra adentro. Las concentraciones de SO 2 en el borde del acantilado son tan altas como 2 ppm, y luego disminuyen rápidamente tierra adentro de una manera más o menos exponencial (Figura 16.3). Este gradiente de contaminación del aire se produce debido a que los gases se diluyen progresivamente en la atmósfera ambiente al aumentar la distancia desde los puntos de emisión.
La contaminación por SO 2 ha acidificado severamente el suelo. Las condiciones ácidas en estanques de agua dulce alcanzan pH 2 o menos, en comparación con pH 8 o más fuera del área de fumigación (ver En Detalle 19.1 para una explicación del pH como medida de acidez). La acidificación extrema provoca que los metales se disuelvan a partir de minerales en el suelo y sedimentos acuáticos (Cuadro 16.4). Las altas concentraciones de metales solubilizados son tóxicas para los organismos terrestres y acuáticos. Además, el sulfato se presenta en altas concentraciones tanto en suelo como en agua. Esto es principalmente el resultado de la deposición seca de SO 2 de la atmósfera y su posterior oxidación a SO 4 2— dentro del ecosistema (ver Capítulo 19).
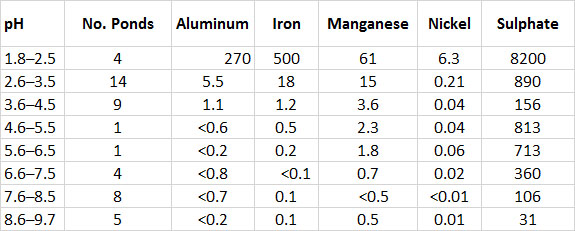
La alta concentración de SO 2 en el aire y la acidez y los metales solubles en el suelo y el agua dan como resultado que los hábitats fumigados sean altamente tóxicos para la mayoría de las plantas, animales y microorganismos. Cerca del borde del mar en áreas fumigadas, donde la contaminación es más intensa, no crece nada de vegetación —hay degradación ecológica total. Más tierra adentro, la contaminación se vuelve menos severa y algunas plantas tolerantes a la contaminación pueden crecer. Los más notables son el ajenjo ártico (Artemisia tilesii), el pasto polargrass (Arctagrostis latifolia), un liquen (Cladonia bellidiflora) y un musgo (Pohlia nutans). Estas pocas plantas tolerantes han reemplazado a las muchas especies de tundra no contaminada, que incluye sauce ártico (Salix arctica), avens de montaña (Dryas integrifolia) y más de 70 otras (Freedman et al., 1990).
Las especies tolerantes a la contaminación también se encuentran en estanques ácidos en Smoking Hills. Incluso los estanques más ácidos, que tienen un pH tan bajo como 1.8, soportan al menos seis especies de algas. Estos son extremadamente tolerantes a la acidez y a los metales disueltos y no se encuentran en cuerpos de agua no ácidos. A diferencia de los estanques ácidos, los estanques no contaminados son alcalinos, con pH superior a 8, y soportan comunidades ricas de algas de más de 90 especies. Algunos invertebrados tolerantes a los ácidos también se presentan en estanques ácidos (pero solo a pH superior a 2.8), incluyendo un crustáceo (Brachionus urceolaris) y un insecto (Chironomus riparius). La fauna invertebrada de estanques no ácidos es mucho más rica en especies y más productiva (Havas y Hutchinson, 1983).

La lección más importante que se puede aprender de Smoking Hills es que la contaminación “natural” puede causar daños ecológicos que son tan intensos como los asociados a las emisiones antropogénicas. Claramente, el SO 2 puede dañar los ecosistemas independientemente de la fuente de la contaminación. Además, la contaminación natural en Smoking Hills ha estresado a los ecosistemas durante mucho tiempo —al menos miles de años— y los efectos ecológicos probablemente hayan alcanzado una condición de estado estacionario. El estudio de Smoking Hills proporciona cierta comprensión de los efectos a largo plazo de la contaminación atmosférica severa:
- provoca que se produzca una simplificación de la biodiversidad y los ecosistemas
- la productividad y el ciclo de nutrientes están deteriorados
- se desarrollan comunidades inusuales de especies tolerantes a la contaminación
Fundiciones de metal cerca de Sudbury
En 1883, mientras volaba a través del lecho rocoso durante la construcción del Canadian Pacific Railroad, un trabajador con cierto conocimiento de prospección descubrió un rico cuerpo de mineral metálico en las cercanías de Sudbury, Ontario. Los principales metales en el mineral son el níquel y el cobre. Sin embargo, de las minas también se producen valiosas cantidades de hierro, cobalto, oro, plata y otros metales, al igual que el azufre y el selenio.
Uno de los complejos industriales más grandes del mundo se ha desarrollado para extraer y procesar los ricos cuerpos de mineral cerca de Sudbury. Las instalaciones han incluido minas subterráneas, una mina a cielo abierto, molinos de procesamiento de minerales con áreas de eliminación de relaves, fundiciones, refinerías de metal, plantas de ácido sulfúrico y varias otras instalaciones. Las actividades industriales alrededor de Sudbury proporcionan una base económica clave para una población regional de más de 160 mil personas.
Los metales en el mineral de Sudbury se presentan como minerales de sulfuro, lo que significa que se combinan con azufre en compuestos como sulfuro de níquel y sulfuro de hierro. En consecuencia, un paso importante en el procesamiento del mineral es asar el material a alta temperatura en presencia de oxígeno, lo que convierte los sulfuros en SO 2 gaseoso. El tostado aumenta la concentración de metales valiosos en el material residual, que luego pueden fundirse y refinarse en metales puros (ver Figura 13.1).
El tostado y la fundición a gran escala en el área de Sudbury han resultado en enormes emisiones de SO 2 y partículas que contienen metal a la atmósfera, lo que ha causado una contaminación severa y daños ecológicos. Hasta 1928, el tostado se realizaba en enormes fosas abiertas conocidas como camas asadas, que consistían en una capa de madera de cordel cosechada localmente sobre un montón de mineral de sulfuro. La madera se encendió y el calor encendió los sulfuros metálicos, liberando energía térmica adicional debido a que la oxidación es una reacción exotérmica. El lecho tostado se calentaba lo suficiente como para soportar una combustión autosostenida del mineral, que se quemaría y ardía durante varios meses, después de lo cual las reacciones se apagaron con agua. Cuando los concentrados de níquel y cobre se enfriaron, fueron recolectados y enviados a una refinería para su posterior procesamiento.
Como es evidente en las imágenes adjuntas, este proceso de tostado crudo resultó en una intensa fumigación a nivel del suelo del paisaje con SO 2 tóxico, neblina ácida y partículas metálicas. La contaminación devastó ecosistemas cerca de los parterres. La denudación de hábitats terrestres resultó en una erosión masiva del suelo de las laderas, dejando al descubierto el lecho rocoso, el cual quedó deshuesado y ennegrecido por la reacción con los humos sulfurosos.


Los 30 parterres asados que operaban en la región de Sudbury emitieron alrededor de 270 mil toneladas anuales de SO 2 más cantidades enormes pero indocumentadas de partículas metálicas. Estas primeras emisiones a nivel del suelo causaron el peor daño ecológico en el área de Sudbury.
En 1928, el gobierno de Ontario prohibió cualquier uso posterior de camas asadas. Todo el tostado se realizó en fundiciones ubicadas en Coniston, Copper Cliff y Falconbridge, todas en las cercanías de Sudbury. Una fundición es una instalación enorme que contiene cámaras de tostado dentro de un edificio. La mayoría de sus emisiones de gases residuales y partículas se ventilan a la atmósfera a través de una chimenea, lo que permite que los contaminantes se dispersen y reduce en gran medida la severidad de la contaminación local a nivel del suelo.
La fundición más grande se construyó en Copper Cliff en 1929. Inicialmente tenía una sola estaca de humo, con otras dos agregadas en 1936. En 1972, las tres pilas fueron reemplazadas por una sola “superpila” de 381 m (en ese momento, la chimenea más alta del mundo, pero ahora la segunda más alta). Al mismo tiempo, se cerró la fundición Coniston y su producción pasó a Copper Cliff. La fundición Falconbridge, con chimeneas de 93 m y 140 m, es propiedad de otra empresa. La puesta en marcha de la superpila en 1972 permitió que los contaminantes fueran ventilados a la atmósfera lo suficientemente alto como para hacer que las fumigaciones a nivel del suelo fueran eventos poco frecuentes. Esto resultó en una gran mejora de la calidad del aire en el área de Sudbury. Las chimeneas altas facilitan la dispersión y mezcla de las emisiones en el aire ambiente. Esto a veces se conoce como la “solución de dilución a la contaminación”.
Debido a que el superstack es tan alto, sus emisiones están bien dispersas en la atmósfera regional. Poco del SO2 ventilado se deposita localmente, hecho que se refleja en la relativamente buena calidad del aire en la región desde 1972. De hecho, estudios han indicado que solo alrededor del 1% de las emisiones de SO 2 se depositan dentro de los 40 km de la superpila. Esto significa que el 99% del SO 2 se exporta a mayor distancia, lo que evita daños locales pero contribuye a la acidificación de la precipitación sobre una gran región (ver Capítulo 19). El penacho de la superpila se puede detectar químicamente a distancias de 150 km o más de distancia.
Las emisiones de contaminantes también se han reducido por otros métodos. Los dispositivos como los precipitadores electrostáticos se utilizan para recuperar los polvos que contienen metal de los gases de combustión de la fundición, mientras que las emisiones de SO 2 se han reducido instalando depuradores húmedos, construyendo plantas de ácido sulfúrico y construyendo una instalación para separar los sulfuros de hierro de los minerales más valiosos de níquel y cobre.
Las emisiones de SO 2 en el área de Sudbury alcanzaron su punto máximo durante 1960-1972, cuando las descargas de las tres fundiciones promediaron alrededor de 2.25 millones de toneladas por año. En ese momento, Sudbury era la fuente más grande del mundo de emisiones antropogénicas de SO 2, responsable de alrededor del 4% de las emisiones mundiales. Las emisiones de SO 2 de las fundiciones han disminuido mucho desde ese momento, a aproximadamente 0.14 x 10 6 t/a durante 2006-2013 (Figura 16.4; Environment Canada, 2014). Las disminuciones se deben principalmente a las costosas inversiones en tecnologías de reducción de la contaminación, incluyendo equipos para la desulfuración de gases de combustión. Aunque muy disminuidas, las emisiones de SO 2 siguen siendo grandes.
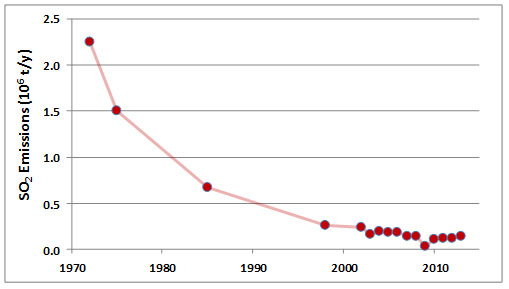
La calidad del aire post-superstack en la región de Sudbury representa una gran mejora con respecto al pasado sulfuroso. Las fumigaciones tóxicas con SO 2, nieblas ácidas y partículas metálicas fueron mucho más frecuentes e intensas cuando se usaban camas asadas, así como antes de 1972, cuando las fundiciones tenían pilas más cortas y poca tecnología de reducción de la contaminación. Casi todo lo peor de los daños ecológicos en la región se debió a las emisiones anteriores de contaminantes. Otros disturbios se sumaron a ese daño, sin embargo, incluyendo la tala clara de bosques para proporcionar combustible a lechos asados y el inicio de incendios forestales por prospectores y por chispas de motores ferroviarios impulsados por vapor. Las emisiones modernas de SO 2 y otros contaminantes en la región de Sudbury, aunque todavía son grandes, están bien dispersas y solo con poca frecuencia causan daños biológicos agudos. De hecho, se ha producido una recuperación ecológica sustancial desde que se encargó el superstack en 1972.
Grandes áreas de tierra y agua superficial en la región de Sudbury fueron severamente dañadas por la contaminación de los lechos asados y las fundiciones. Las fundiciones son grandes, fuentes puntuales de emisiones, por lo que la severidad del daño ecológico disminuyó rápidamente al aumentar la distancia. A lo largo de los años, los ecologistas han documentado daños a la vegetación en la zona. En 1970, alrededor de 100 km 2 de tierra alrededor de las fundiciones se caracterizó como “severamente estéril” y otros 360 km 2 tenían vegetación “empobrecida”, incluida la falta de coníferas en el bosque (Watson y Richardson, 1972). El pino blanco (Pinus strobus), un árbol económicamente importante, es sensible a la contaminación del aire y mostró lesiones diagnósticas SO 2 -en un área de aproximadamente 6,400 km 2.

La contaminación fue especialmente dañina alrededor de Copper Cliff, la ubicación de la fundición más grande. Los hábitats más degradados ocurren a varios kilómetros de esta instalación y casi no soportan bosques. Los cerros y laderas de esta zona están extensamente denudados de vegetación, su suelo está erosionado y el lecho rocoso expuesto se ha ennegrecido por la reacción con fumigaciones ácidas. Solo unas pocas especies de plantas que han evolucionado poblaciones tolerantes a la contaminación crecen en esta área, incluyendo varias especies de pastos, otras plantas herbáceas y plantas atrofiadas del tamaño de arbustos de algunos árboles (véase también el Capítulo 18).
La intensidad del estrés relacionado con la contaminación disminuye rápidamente a mayores distancias de las fundiciones (hay un gradiente espacial), y el daño a la vegetación es correspondientemente menos intenso. A unos 3-8 km de la fundición Copper Cliff, sobreviven restos de bosque donde la topografía local proporcionó cierto grado de resguardo de la contaminación. Sin embargo, las cimas denudadas y ennegrecidas siguen siendo comunes en esta zona vegetada patchily. Los árboles en los rodales remanentes están atrofiados, con muchas ramas muertas y otras lesiones. Los árboles incluyen especies relativamente tolerantes a la contaminación como arce rojo (Acer rubium), abedul blanco (Betula papyrifera), encino rojo (Quercus rubra), álamo tembloroso (Populus tremuloides) y álamo temblón de dientes grandes (P. grandidentata). La cobertura forestal más allá de los 8 km es casi continua, pero la biomasa y biodiversidad de las rodales están empobrecidas. Más allá de 20-30 km de las fundiciones, los bosques son poco afectados por la contaminación y se producen rodales mixtos de coníferas y árboles de frondosas, como es típico de la región (Freedman y Hutchinson, 1980).
Los lagos cercanos a las fundiciones de Sudbury también fueron severamente degradados por la contaminación atmosférica. Más de 7 mil cuerpos de agua en la región fueron acidificados por la deposición de SO 2 y contienen concentraciones elevadas de níquel tóxico, cobre y otros metales. Los cuerpos de agua contaminados contienen comunidades pobres en especies de algas tolerantes, plantas y zooplancton. Carecen de pescado, principalmente por su acidez.
Sin embargo, grandes mejoras en la calidad del aire a nivel del suelo desde la construcción del superstack en 1972 han resultado en dramáticas recuperaciones ecológicas en el área de Sudbury. Donde se recolectó suelo erosionado en cuencas húmedas, se desarrollaron prados húmedos. Estos están dominados por el pasto de pelo (Deschampsia caespitosa), cuyas poblaciones locales son genéticamente tolerantes al níquel y cobre tóxicos en el suelo (ver Capítulo 18). Otras plantas también se han beneficiado de la reducción de la contaminación del aire, aunque su recuperación aún se ve obstaculizada por la toxicidad residual del suelo asociada a la acidificación y los metales.
Los lagos también se están recuperando en la región. En un conjunto de 44 lagos que fueron monitoreados desde 1981, incluyendo 28 que estaban altamente acidificados (a pH 5.0 o menos), solo 6 fueron ese ácido en 2004 y 14 se habían recuperado a pH 6.0, nivel que soportaría la mayor parte de la biota acuática típica de la región (Keller et al., 2007). Las concentraciones de metales relacionados con la fundición, como el cobre y el níquel, también son mucho menores, aunque aún elevadas en comparación con las condiciones de fondo. En 1972, el pH de Baby Lake era de 4.0-4.2, y estaba casi desprovisto de algas y no tenía invertebrados ni peces (Havas et al., 1995). Sin embargo, para 1985 se había recuperado a pH 6.8 y para 1995 a pH 7.2, y los metales también disminuyeron en concentración. Esas mejoras en la calidad del agua permitieron que el lago fuera colonizado por una diversidad de fitoplancton, plantas acuáticas, invertebrados e incluso peces pequeños.
Desde principios de la década de 1970, la recuperación ecológica de algunas áreas degradadas ha sido asistida por diversas prácticas de manejo. El más importante de estos ha sido el encalado del suelo para reducir la acidez y con ello aliviar la toxicidad asociada a los metales. También han sido importantes la siembra de pastos y otras plantas que se sabe que son tolerantes a las condiciones tóxicas, la adición de fertilizantes y la siembra de plántulas de árboles. Los esfuerzos similares en lagos han consistido en encalar para reducir su acidez y toxicidad metálica, lo que ha promovido la recuperación de la biota. Estos esfuerzos de recuperación, junto con la regeneración natural que se ha producido debido a la gran disminución de la contaminación desde que se construyó el superstack, han ayudado a mejorar en gran medida los hábitats degradados en la región de Sudbury.
El caso de Sudbury es quizás el ejemplo más documentado del mundo de daños ecológicos causados por gases tóxicos y metales emitidos por fundiciones. Sin embargo, hay ejemplos adicionales de este tipo de daños alrededor de otras fundiciones en Canadá, que afectan a áreas más pequeñas, como las fundiciones de Flin Flon, MB, Rouyn-Noranda, QC, Trail, BC y Yellowknife, NT.
Todas estas fundiciones son grandes fuentes puntuales de emisiones de contaminantes a la atmósfera. Todos desarrollaron gradientes espaciales pronunciados en la intensidad de la contaminación, los cuales disminuyeron exponencialmente al aumentar la distancia desde la fuente de emisiones hasta alcanzar la condición ambiente. Los patrones de daño ecológico rastrean estos gradientes espaciales de estrés tóxico.
Conclusiones
Los contaminantes gaseosos del aire, como el dióxido de azufre y el óxido nítrico, se emiten desde una variedad de fuentes, que van desde grandes centrales eléctricas y fundiciones hasta automóviles individuales y hornos domésticos. En contraste, los contaminantes secundarios como el ozono no se emiten sino que se forman en la atmósfera por reacciones fotoquímicas que involucran la luz solar y los óxidos emitidos de nitrógeno e hidrocarburos. Si sus concentraciones son lo suficientemente altas, los contaminantes gaseosos (a menudo en combinación con partículas) pueden ser un riesgo para la salud humana y pueden causar graves daños ecológicos. Debido a que estos riesgos son ahora bien conocidos, muchos gobiernos han tomado medidas para reducir las emisiones de los contaminantes atmosféricos más importantes. Esto es particularmente el caso de países relativamente desarrollados, como Canadá. Si bien las emisiones de contaminantes atmosféricos en los países ricos siguen siendo grandes, generalmente se están estabilizando o incluso disminuyendo. Sin embargo, en economías de rápido crecimiento, como China e India, la industrialización apresurada y mal controlada está resultando en un rápido empeoramiento de la contaminación del aire.
Preguntas para revisión
- Comparar las emisiones naturales y antropogénicas de compuestos de azufre y nitrógeno. ¿Por qué las fuentes de emisión varían entre regiones y países?
- ¿Por qué las altas concentraciones de ozono en la atmósfera inferior se consideran un problema ambiental? ¿Por qué esto difiere de la estratosfera, donde muy poco ozono es un problema?
- ¿Explicar son las diferencias entre los contaminantes atmosféricos primarios y secundarios? Dar ejemplos de cada uno.
- ¿Por qué ha disminuido tanto la contaminación del aire en la región de Sudbury y cuáles han sido las respuestas ecológicas a esta mejora ambiental?
Preguntas para Discusión
- Compare, en términos generales, los patrones de daño ecológico causado por la contaminación “natural” en Smoking Hills con los causados por fundiciones cercanas a Sudbury. ¿Por qué es útil estudiar los efectos ecológicos de la contaminación natural?
- Las tecnologías de aire limpio existentes podrían utilizarse para reducir en gran medida las emisiones de contaminantes atmosféricos en todas partes. Considerando los daños que los contaminantes causan a la salud humana, los ecosistemas y otros valores, ¿por qué estas tecnologías no se utilizan más extensamente? Considerar factores asociados a la economía, la política, la incertidumbre científica sobre los daños por contaminación y los beneficios de tener un aire más limpio. Contraste la falta de acción con los éxitos alcanzados en el control de las emisiones de sustancias que agotan el ozono a través del Protocolo de Montreal.
- La investigación epidemiológica (estadística) sugiere que la salud humana puede verse afectada por los niveles ambientales de contaminantes del aire en áreas urbanas, particularmente a través del aumento de la incidencia de enfermedades respiratorias, como el asma. Sin embargo, los datos estadísticos son bastante débiles, y sólo una proporción relativamente pequeña de la población urbana parece estar afectada. ¿Cuáles son algunos temas que los tomadores de decisiones deben considerar al deliberar sobre controles adicionales sobre la liberación de contaminantes atmosféricos en áreas urbanas?
- Como la mayoría de las otras fundiciones construidas durante el siglo XX, las de Sudbury causaron daños evidentes a los ecosistemas y a la salud humana. ¿Por qué esas grandes instalaciones industriales no fueron clausuradas o mejor controladas por los gobiernos del día? Hoy en día, se están construyendo nuevas fundiciones en Canadá y en otros países. ¿Hay riesgos de que esas instalaciones industriales repitan los errores del pasado?
Explorando problemas
- Se le ha pedido que evalúe los posibles efectos ecológicos de construir una nueva fundición de metal en una región que ahora es desierto. La fundición emitirá dióxido de azufre a la atmósfera. Con base en lo que sabe sobre los daños por contaminación en Smoking Hills, alrededor de Sudbury y en otras fundiciones, ¿cuáles serían las consideraciones más importantes para incorporar en la evaluación de impacto ambiental? Centrarse en los efectos potenciales en los ecosistemas terrestres y acuáticos.
Referencias citadas y lecturas adicionales
Anderson, S.O. y K.M. Sarma. 2005. Proteger la capa de ozono: La historia de las Naciones Unidas. Earthscan Publications, Londres, Reino Unido.
Ayres, J. y R.L. Maynard. 2006. Contaminación del Aire y Salud. World Scientific Publishing Company.
Barker, J.R. y D.T. Tingey. 1992. Efectos de la contaminación del aire en la biodiversidad. Van Nostrand Reinhold, Nueva York, NY.
Brimblecombe, P. 1996. Composición del Aire y Química. 2a ed. Cambridge University Press, Cambridge, Reino Unido.
Brimblecombe, P. 2005. Los efectos de la contaminación del aire en el entorno construido. Imperial College Press, Londres, Reino Unido.
Consejo Canadiense de Ministros del Medio Ambiente (CCME). 2014. Lineamientos Canadienses de Calidad Ambiental. CCME. Winnipeg, MB. http://www.ccme.ca/en/resources/canadian_environmental_quality_guidelines/index.html Consultado enero, 2015.
Medio Ambiente Canadá. 1999. Ozono a nivel del suelo: Ocurrencia y transporte en el este de Norteamérica Hackensack, Nueva Jersey.
Medio Ambiente Canadá. 2013. Estándares canadienses de calidad del aire ambiente. http://www.ec.gc.ca/default.asp?lang=En&n=56D4043B-1&news=A4B2C28A-2DFB-4BF4-8777-ADF29B4360BD Consultado en enero de 2015.
Medio Ambiente Canadá. 2014. Inventario Nacional de Liberación de Contaminantes y Resúmenes y Tendencias de Emisiones Contaminantes del Aire. Medio Ambiente Canadá, Ottawa, ON. http://www.ec.gc.ca/inrp-npri/default.asp?lang=en&n=0EC58C98-1#Emission_Summaries Consultado en enero de 2015.
Agencia de Protección Ambiental (EE.UU.). 2014. Tendencias Aéreas. US EPA, Research Triangle Park, NC. www.epa.gov/airtrends/ Consultado enero, 2014.
Freedman, B. 1995. Ecología Ambiental. 2a ed. Prensa Académica, San Diego, CA. Freedman, B. y T.C. Hutchinson. 1980. Efectos a largo plazo de la contaminación por fundición en Sudbury, Ontario, en la composición de la comunidad forestal. Revista Canadiense de Botánica, 58:2123-2140.
Freedman, B., V. Zobens, y T.C. Hutchinson. 1990. La intensa contaminación natural afecta la vegetación de la tundra ártica en Smoking Hills, Canadá. Ecología, 71:492-503.
Gizyn, W. 1980. La química y el impacto ambiental de los incendios de esquisto bituminoso en las colinas humeantes, NWT. M.Sc. Tesis, Universidad de Toronto, Toronto, ON.
Gunn, J.M. (ed.). 1995. Restauración y recuperación de una región industrial: avances en la restauración del paisaje dañado por la fundición cerca de Sudbury, Canadá. Springer, Nueva York, NY.
Havas, M. y T.C. Hutchinson. 1983. The Smoking Hills: Acidificación natural de un ecosistema acuático. Naturaleza, 301:23-—27.
Havas, M., D.G. Woodfine, P. Lutz, K. Yung, H.H. MacIsaac, y T.C. Hutchinson. 1995. Recuperación biológica de dos lagos previamente acidificados y contaminados con metales cerca de Sudbury Ontario, Canadá. Contaminación del Agua, Aire y Suelo, 85:791-796.
Hemond, H.F. y E.J. Fechner. 2014. Destino Químico y Transporte en el Medio Ambiente. 3ª ed. Prensa Académica, San Diego, CA.
Hester, R.E. y R.M. Harrison. 1998. Contaminación del Aire y Salud. Royal Society of Chemistry, Cambridge, Reino Unido.
Holgate, S.T., J.M. Samet, R.L. Maynard, y H.S. Koren (eds.). 1999. Contaminación del Aire y Salud. Prensa Académica, San Diego, CA.
Keller, W., N.D. Yan, J.M. Gunn, y J. Heneberry. 2007. Recuperación de lagos acidificados: Lecciones de Sudbury, Ontario, Canadá. Contaminación del Agua, Aire y Suelo: Foco, 7:317-322. Maynard, R.L. y P. Brimblecombe (eds.). 2001. La atmósfera urbana y sus efectos. World Scientific Publishing Company, Hackensack, NJ.
Servicio Meteorológico Nacional (EE.UU.). 2015. Condiciones Meteorológicas y Ozono en la Stratosfera Polar. NWS, Washington, DC. Accedido enero, 2015. www.cpc.ncep.noaa.gov/products/stratosphere/polar/polar.shtml
Agencia de Evaluación Ambiental de los Países Bajos (NEAA). 2015. Base de Datos de Emisiones para Investigación Ambiental Global (EDGAR). NEAA. La Haya, Países Bajos. http://themasites.pbl.nl/tridion/en/themasites/edgar/emission_data/edgar_32ft2000/index-2.html Consultado enero, 2015.
Asociación Médica de Ontario (OMA). 2015. Humo/Contaminación del Aire. Recursos. OMA, Toronto, ON. https://web.archive.org/web/20160914204453/https://www.oma.org/HealthPromotion/Smog/Pages/default.aspx.
Ontario Ministerio de Medio Ambiente y Cambio Climático. 2014. Resumen de Asesorías de Smog. OMECC, Toronto, ON. http://www.airqualityontario.com/press/smog_advisories.php Consultado en enero de 2015.
Parson. E. 2003. Proteger la Capa de Ozono: Ciencia y Estrategia. Oxford University Press, Oxford, Reino Unido.
Pepper, I.L., C.P. Gerba, y M.L. Brusseau (eds.). 2006. Ciencia de la Contaminación, 2a ed. Prensa Académica, San Diego, CA.
Roberts, T.M. 1984. Efectos de los contaminantes atmosféricos en la agricultura y la silvicultura. Ambiente Atmosférico, 18:629-652.
Seinfeld, J.H. y S.H. Pandis. 2006. Química y Física Atmosféricas: de la contaminación atmosférica al cambio climático, 2a ed. Wiley-Interscience, Nueva York, NY.
Shriner, D.S. 1990. Respuestas de la vegetación a la deposición atmosférica y a la contaminación atmosférica. En Deposición Ácida: Estado de la Ciencia y la Tecnología. Vol. III. Efectos Terrestres, Materiales, Salud y Visibilidad. Superintendente de Documentos, Oficina de Imprenta del Gobierno de Estados Unidos, Washington, DC.
Vallero, D. 2014. Fundamentos de la Contaminación del Aire, 5ta ed. Prensa Académica, San Diego. Wark, K. Jr., C.F. Warner, y W.T. Davis. 1998. Contaminación del aire: su origen y control. 3a ed. Addison-Wesley, Menlo Park, CA.
Watson, W.Y. y D.H. Richardson. 1972. Apreciar el potencial de una tierra devastada. Crónica Forestal, 48:312-315.
Winterhalder, E.K. 1978. Una perspectiva histórica de la minería y recuperación en Sudbury. Actas, 3ª Reunión Anual, Asociación Canadiense de Recuperación de Tierras. Guelph, ON.
Wise, W. 2001. Smog asesino: el peor desastre de contaminación del aire del mundo. Gremio de autores, Nueva York, NY.


