18: Elementos Tóxicos
- Page ID
- 82559
Objetivos de aprendizaje
Después de completar este capítulo, usted será capaz de:
- Describir la distribución ubicua de los elementos en el ambiente y explicar este fenómeno en términos de la diferencia entre contaminación y contaminación.
- Describir casos de contaminación natural por elementos tóxicos y explicar cómo proporcionan una visión de los efectos de la contaminación antropogénica.
- Describir casos de contaminación antropogénica por metales y describir los daños ecológicos resultantes.
Introducción
Todos los metales naturales y otros elementos son ubicuos (se encuentran en todas partes) en concentraciones al menos traza en el suelo, el agua, el aire y los organismos. Siempre y cuando los límites de detección de la química analítica disponible sean lo suficientemente bajos, esta contaminación universal siempre se puede demostrar.
Los organismos requieren algunos de los oligoelementos como micronutrientes esenciales, incluyendo cobre, hierro, molibdeno, zinc y en algunos casos aluminio, níquel y selenio. Bajo ciertas condiciones, sin embargo, estos mismos elementos pueden acumularse a altas concentraciones en los organismos y causar daños ecológicos (ver En Detalle 18.1). Los oligoelementos que se asocian con mayor frecuencia con la toxicidad ambiental son los metales pesados cadmio, cromo, cobalto, cobre, hierro, plomo, mercurio, níquel, plata, estaño y zinc, así como los elementos más ligeros aluminio, arsénico y selenio.
Algunos casos de contaminación elemental son de origen natural. Esto generalmente implica que los minerales ricos en metales se exponen en la superficie y causan cambios ecológicos locales. Sin embargo, las actividades humanas han provocado ejemplos adicionales de contaminación por elementos tóxicos, particularmente en las proximidades de fuentes industriales como las fundiciones. Además, las emisiones de mercurio y plomo de centrales eléctricas y automóviles han provocado una contaminación generalizada de ambientes remotos, aunque aún no es seguro que esto esté causando daños ecológicos.
Hay casos de personas que han sido envenenadas por exposición a elementos tóxicos en su entorno. Algunos historiadores creen que el declive del Imperio Romano puede haberse acelerado por la neurotoxicidad causada por la intoxicación crónica por plomo. Los romanos tuvieron una exposición significativa al plomo porque almacenaban bebidas ácidas (como el vino) en alfarería tratada con pigmentos y esmaltes que contenían plomo. Además, su tubería de agua estaba hecha de plomo (la palabra “plomería” se basa en la palabra latina para plomo — plumbum). En la Gran Bretaña del siglo XIX, muchas personas que fabricaban sombreros de copa de fieltro desarrollaron daño neurológico debido a su exposición a compuestos de mercurio utilizados para dar un acabado brillante a los sombreros, de ahí el personaje de Lewis Carroll en Alicia en el país de las maravillas, el “Sombrerero Loco” y la expresión “loco como sombrerero”.
Más recientemente, miles de personas sufrieron intoxicación por mercurio durante la década de 1960 luego de que comieron grano que había sido tratado con fungicida mercúrico. En un caso desastroso en Irak en 1971, más de 6 mil 500 personas fueron envenenadas (unas 500 murieron) cuando comieron alimentos preparados a partir de granos tratados con mercurio. El grano había sido donado por un programa de ayuda extranjera y estaba destinado únicamente a la siembra. Si bien los sacos de grano estaban etiquetados para indicar que las semillas eran venenosas, muchas de las víctimas eran analfabetas o no entendían o ignoraban las implicaciones del mensaje. Casi al mismo tiempo, envenenamientos similares ocurrieron cuando la gente comía granos tratados con mercurio en Guatemala, Irán y Pakistán. Para evitar estos problemas hoy en día, el grano de semilla tratado con fungicida suele teñirse de rojo, lo que advierte a las personas que no lo utilicen como alimento.
Mercurio también causó miles de casos de envenenamiento en Minamata, Japón. Una fábrica allí había descargado mercurio elemental en la bahía de Minamata. En esa forma el mercurio no es muy venenoso, pero los microbios del sedimento transformaron el metal en metilmercurio, el cual es extremadamente tóxico y se bioacumula en organismos con preferencia al agua de su ambiente acuático. El metilmercurio se biomagnificó aún más la red alimentaria y causó una intoxicación extensa de aves devoradoras de peces, gatos domésticos y personas (ver En detalle 18,1 y Global Focus 18.1). En este capítulo, examinamos la contaminación natural y antropogénica con elementos tóxicos y las consecuencias ecológicas resultantes.
En Detalle 18.1: Bioacumulación y Biomagnificación
Ciertos metales o sus compuestos orgánicos, como el metilmercurio, tienden a presentarse en concentraciones mucho mayores en los organismos que en el ambiente, no vivo. Este fenómeno se conoce como bioacumulación (también llamada bioconcentración). Tendencias similares se muestran en los hidrocarburos clorados, como el DDT, los PCB y las dioxinas (ver Capítulo 21). La bioacumulación ocurre porque ciertas sustancias tienen una fuerte afinidad por los organismos y por lo tanto se concentran dentro de ellas en preferencia a su entorno no vivo. Muchos de estos químicos se disuelven en fluidos y tejidos biológicos, como los lípidos (grasa), en preferencia al agua ambiente o el suelo.
Otro fenómeno, conocido como biomagnificación (o aumento de la red alimenticia), es la tendencia de los depredadores superiores a tener las concentraciones más altas de estos químicos. Los organismos son altamente eficientes para asimilar metilmercurio y organocloros de sus alimentos. Por lo tanto, estos químicos se almacenan en organismos, en lugar de ser excretados. Esto significa que los depredadores en la parte superior de la red alimentaria desarrollan las concentraciones más altas (residuos) de estos químicos. Por lo general, la bioacumulación y el aumento de la red alimentaria progresan con la edad, por lo que los individuos más antiguos de cualquier población son los más contaminados.
Concentración y Disponibilidad
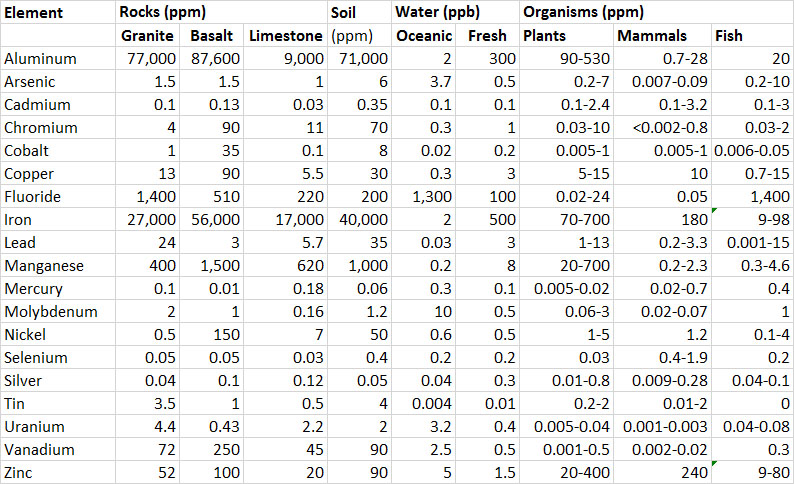
Todos los elementos naturales están presentes en al menos concentraciones traza en todas las muestras de agua, suelo y rocas, aire y organismos. El término concentración de fondo se refiere a una presencia que no está significativamente influenciada por emisiones antropogénicas ni exposiciones naturales inusuales. La concentración de fondo en suelo y rocas suele ser mucho mayor que en el agua, y también generalmente mayor que en los tejidos de los organismos (Cuadro 18.1).
Sin embargo, los elementos que se disuelven en el agua a menudo ocurren en formas químicas (como los iones) que son absorbidos con relativa facilidad por los organismos. Por esta razón, incluso una concentración acuosa traza puede ser tóxica. En contraste, las concentraciones mucho más altas que comúnmente ocurren en el suelo y las rocas son en su mayoría insolubles, y por lo tanto no son particularmente biodisponibles. Los científicos determinan la concentración total de metales en un componente del ambiente (como suelo, sedimento o roca) digiriendo una muestra en una mezcla caliente de ácido fuerte. En contraste, la concentración “disponible” se determina a partir de un extracto acuoso (agua) de una muestra. En general, la concentración disponible de elementos tóxicos en el suelo es mucho menor que las concentraciones totales (generalmente menos del 1% del valor total), y también es mucho más relevante para la toxicidad potencial.
La mayoría de los elementos se encuentran solo en concentraciones traza en el ambiente (Cuadro 18.1). En contraste, el aluminio y el hierro son constituyentes prominentes de rocas y suelo, con concentraciones típicamente alrededor de 8% y 3-4%, respectivamente. Sin embargo, casi todo el aluminio y hierro en el suelo y las rocas se presenta como minerales insolubles que no están fácilmente disponibles para ser absorbidos por los organismos. Por ejemplo, prácticamente todo el aluminio en el suelo se presenta como silicato insoluble y minerales arcillosos. Aunque el aluminio en estas formas comprende aproximadamente 8% de la masa del suelo, no está disponible para ser absorbido por las plantas y por lo tanto no es tóxico. Sin embargo, concentraciones mucho más pequeñas de aluminio, típicamente solo unas pocas partes por millón (ppm), se encuentran como iones, ya sea unidos a materia orgánica y superficies arcillosas o disueltos libremente en el agua del suelo. Las formas iónicas del aluminio están fácilmente disponibles para su absorción biológica y pueden causar toxicidad a especies que son sensibles a este metal.
Concentraciones mucho más altas de aluminio soluble disponible ocurren en ambientes fuertemente ácidos, especialmente cuando el pH es menor de aproximadamente 5.5. (De hecho, casi todos los metales son mucho más solubles en condiciones ácidas). La solubilidad del aluminio también es mayor en ambientes fuertemente alcalinos, con pH superior a aproximadamente 8. Además, diferentes especies iónicas de aluminio ocurren a diferentes niveles de pH:
- Al 3+ es dominante en ambientes fuertemente ácidos con un pH inferior a aproximadamente 5.0
- AloH 2+ y Al (OH) 2 + son importantes en condiciones menos ácidas de pH 4.5—5.5
- Al (OH) 3 de pH 5.2—9.0
- y AlOH 4 — en ambientes alcalinos con pH superior a 8.5.
La toxicidad del aluminio es un problema común para los organismos que viven en ambientes altamente ácidos o alcalinos. Esto se debe a las influencias combinadas de mayor solubilidad y la presencia de iones relativamente tóxicos bajo esas condiciones.
Toxicidad
La toxicidad de elementos y otras sustancias químicas está relacionada con dos factores: (1) la exposición (dosis) y (2) la vulnerabilidad de un organismo a la sustancia en particular. La dosis recibida está influenciada por la concentración disponible en el ambiente y el periodo de exposición. Por lo tanto, una exposición a largo plazo a solo un minuto de concentración disponible puede causar toxicidad, especialmente si el elemento es capaz de bioacumularse y luego biomagnificarse en la red alimenticia hasta que supere un umbral de tolerancia biológica.
Los organismos varían mucho en su tolerancia a las exposiciones a elementos tóxicos (y a todos los demás venenos). En consecuencia, una exposición intensa a un químico potencialmente tóxico puede resultar en que algunas especies sean envenenadas, mientras que las tolerantes pueden no dañarse e incluso pueden beneficiarse de la desaparición de especies sensibles en su comunidad. Además, generalmente existe variación de base genética para la tolerancia dentro de una especie. Esto puede conducir a la evolución de poblaciones (conocidas como ecotipos) que son relativamente tolerantes a las exposiciones tóxicas (examinamos este tema en la siguiente sección).
El mecanismo más común de intoxicación por elementos tóxicos es el daño a un sistema enzimático. (Los organismos tienen una enorme diversidad de enzimas, que son proteínas que catalizan reacciones bioquímicas específicas y son críticas para un metabolismo saludable). El envenenamiento ocurre porque los iones metálicos se unen a enzimas específicas, lo que cambia su forma y da como resultado una pérdida de su función catalítica única. Los elementos tóxicos también pueden causar envenenamiento por la unión a ADN o ARN, interrumpiendo así la transcripción y traducción, los procesos por los cuales se utiliza la información genética para producir proteínas específicas (incluyendo enzimas; ver En Detalle 6.1). Los metales tóxicos también pueden alterar la replicación del ADN y por lo tanto la división celular.
Los síntomas típicos de intoxicación aguda causada por elementos tóxicos en las plantas incluyen patrones anormales de crecimiento, disminución de la productividad, alteración de la reproducción, aparición de enfermedades y, en última instancia, muerte. Los síntomas de toxicidad crónica son más difíciles de detectar y pueden incluir una “lesión oculta” como una disminución en la productividad que ocurre sin signos de daño agudo. Los animales pueden mostrar una variedad de síntomas asociados con la alteración enzimática, a menudo incluyendo neurotoxicidad y deterioro del funcionamiento de los riñones, hígado y otros órganos.
Contaminación Natural
La contaminación natural localizada a veces ocurre cuando los minerales ricos en metales están presentes en la superficie y son prominentes en la química del suelo, las aguas superficiales y la vegetación. Estas condiciones a menudo se pueden identificar por una forma distintiva de crecimiento atrofiado de la vegetación, y a veces por la presencia de especies de plantas indicadoras particulares. En combinación con análisis químicos, estos indicadores biológicos pueden ser utilizados para explorar depósitos ricos en metales, una técnica conocida como prospección biogeoquímica.
En algunos casos, la contaminación natural por metales puede ser bastante intensa. Por ejemplo, en un sitio de la isla de Baffin se encontró suelo que contenía hasta 3% de plomo más zinc. En otro caso, la turba que filtraba un manantial de agua subterránea rica en metales en New Brunswick acumuló tanto como 10% de cobre. Las altas concentraciones de metales en el suelo también se reflejan en la química de las plantas, especialmente en ciertas especies hiperacumuladoras genéticamente adaptadas que pueden ocurrir en hábitats ricos en metales. Por ejemplo, se han medido concentraciones de níquel de hasta 10% en plantas del género Alyssum que crecen en Rusia, y hasta 25% en el látex de color azul de Sebertia acuminata de Nueva Caledonia en el Pacífico Sur. Estas plantas hiperacumuladoras crecen en sitios naturalmente contaminados por metales.
Suelo Serpentino y Vegetación
Algunos casos bien estudiados de contaminación natural involucran suelos influenciados por minerales serpentinos, que son ricos en níquel, cromo y cobalto y están asociados con depósitos de asbesto. El suelo que contiene minerales serpentinos es tóxico para las plantas no adaptadas debido a las altas concentraciones de estos metales, en combinación con un desequilibrio de los nutrientes calcio y magnesio. El suelo serpentino generalmente contiene varios miles de partes por millón de níquel, pero puede tener hasta 25 mil ppm (o 2.5%) de este metal.
La vegetación natural en los sitios serpentinos a menudo se atrofia de manera distintiva. Extensas “balsas” serpentinas ocurren en el este de Quebec y el oeste de Terranova. Esos hábitats sustentan ecosistemas similares a la tundra en un paisaje que de otra manera está cubierto por bosques boreales.
En algunos lugares, las áreas serpentinas dan soporte a especies de plantas que solo se presentan en ese tipo de hábitat, una distribución estrecha que los ecologistas denominan endémicas. En otros casos, las especies extendidas han evolucionado poblaciones localmente adaptadas que pueden hacer frente a las tensiones tóxicas y nutricionales del suelo serpentino, a estos se les conoce como ecotipos. En sitios no serpentinos, los endémicos y ecotipos específicamente adaptados se eliminan rápidamente por la competencia con plantas que son mejores competidoras en hábitats menos estresantes.
Los sitios serpentinos en el norte de California soportan una vegetación relativamente antigua, debido a que el área no estaba glaciada. Estos hábitats contienen al menos 215 especies endémicas o subespecies de plantas. Algunos de los endémicos ocurren solo en sitios serpentinos particulares en California y en ningún otro lugar del mundo. En contraste, los baldíos serpentinos en el este de Canadá son relativamente jóvenes, siendo liberados de la glaciación hace apenas unos 10 mil años o menos. En consecuencia, no ha pasado el tiempo suficiente para permitir que muchos endémicos serpentinos o ecotipos evolucionen.

Suelo Selenífero y Vegetación
Las regiones semiáridas en diversas partes del mundo suelen tener áreas con suelo que contiene altas concentraciones de selenio. Estos hábitats seleníferos pueden soportar plantas que hiperacumulan selenio, como especies del género Astragalus (locoweeds). Alrededor de 25 especies norteamericanas de Astragalus son hiperacumuladores de selenio. Pueden contener hasta 1.5% de selenio en sus tejidos, almacenándolo en bioquímicos únicos similares a los aminoácidos, como la selenometionina. La especie Astragalus también emite dimetil seleniuro y dimetil diselenuro a la atmósfera, dándoles un olor distintivo y desagradable. El ganado que se alimenta de estas plantas es envenenado por un síndrome tóxico conocido como enfermedad alcalina o escalonamientos ciegos.
Mercurio en Ambientes Acuáticos
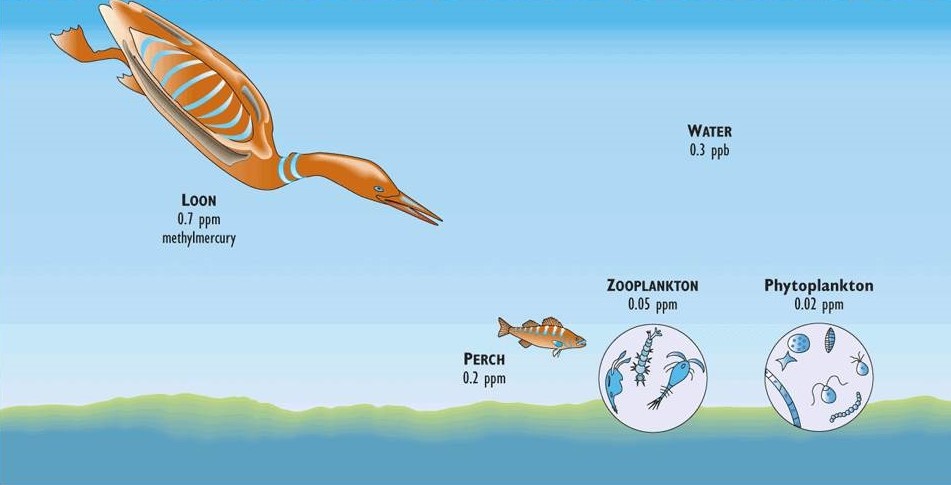
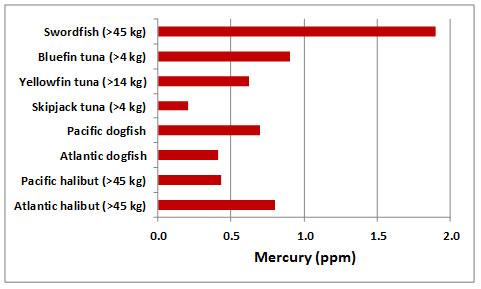
Incluso en hábitats oceánicos remotos, el mercurio a menudo se acumula en altas concentraciones (como metilmercurio, CH 3 Hg) en peces, aves y mamíferos marinos. En aguas marinas frente al este y oeste de Canadá, los peces grandes pueden tener concentraciones de mercurio en su carne que exceden el límite considerado aceptable para el consumo humano (más de 0.5 ppm de mercurio sobre una base de peso fresco; Figura 18.1). El análisis de especímenes antiguos de peces y aves marinas en museos ha revelado niveles de contaminación por mercurio similares a los de las muestras modernas, lo que sugiere que el fenómeno puede ser natural. La contaminación de animales marinos representa una biomagnificación sustancial del agua de mar ambiental, la cual tiene una concentración traza de mercurio de menos de 0.1 ppb.
La biomagnificación se produce por la acumulación progresiva de mercurio en la red trófica. Las algas inicialmente absorben mercurio del agua (como metilmercurio), y el zooplancton acumula residuos aún más grandes a medida que pastan sobre las algas. Los peces devoradores de zooplancton acumulan cantidades aún mayores, pero los residuos más grandes se encuentran en depredadores superiores de larga vida, como peces grandes y mamíferos marinos (ver En Detalle 18.1).
Dentro de cualquier especie particular de peces, los individuos más grandes (y mayores) generalmente tienen concentraciones de mercurio más altas que los más pequeños (y más jóvenes). Un estudio de pez espada capturado en el este de Canadá encontró que los animales que pesaban más de 45 kg tenían una concentración promedio de mercurio de 1.1 ppm, mientras que los que pesaban 23-45 kg tuvieron 0.86 ppm, y los menores de 23 kg tuvieron 0.55 ppm (Armstrong, 1979). Parece que los residuos de mercurio se vuelven más intensos a medida que los animales envejecen y crecen.
Las altas concentraciones de mercurio también ocurren en mamíferos marinos y aves que se alimentan de peces, que son los principales depredadores en su ecosistema. Estudios de focas arpa adultas (Phoca groenlandica) en el este de Canadá encontraron una concentración promedio de mercurio de 0.34 ppm en músculo y 5.1 ppm en el hígado (Armstrong, 1979). También se presentan altos residuos de mercurio en aves marinas del Atlántico Norte, con un promedio de 7 ppm en plumas de skua norteña (Catharacta skua), 5 ppm en frailecillo (Fratercula arctica) y 1-2 ppm en fulmar (Fulmarus glacialis), kittiwake (Rissa tridactyla), pico de navaja (Alca torda) y murre común (Uria aalge) ( Thompson et al., 1991).
También se ha observado contaminación por mercurio de peces en muchos lagos remotos. Por ejemplo, alrededor de tres cuartas partes de los 1,700 lagos monitoreados en Ontario tienen peces con mercurio que superan las 0.5 ppm de peso fresco en su carne. En un lago remoto en el norte de Manitoba, la concentración promedio de mercurio en el músculo de 53 lucios norteños (Esox lucius) fue de 2 ppm de peso fresco y un animal tenía 5 ppm (McKay, 1985). En general, los peces de agua dulce que son los principales depredadores tienen los mayores residuos de mercurio, y los individuos más grandes o mayores son los más contaminados.
Los gobiernos federales, provinciales y territoriales de Canadá emiten advertencias sobre el consumo de peces tomados de lagos y ríos particulares donde se sabe que los residuos de mercurio son un problema; las advertencias también pueden tener información sobre otros contaminantes, como PCB y dioxinas. En Ontario, por ejemplo, se monitorean más de 2,200 cuerpos de agua para este propósito (MOEE, 2014). Los avisos le dicen a la gente cuántos peces de especies y tamaños particulares pueden comer. El umbral general es de 0.61 ppm, pero es tan bajo como 0.26 ppm para mujeres embarazadas y niños, y no se debe consumir pescado con más de 1.84 ppm. Alrededor de un tercio de las recomendaciones dadas para los peces deportivos tomados de los lagos de Ontario dan como resultado algún nivel de restricción de consumo. En Suecia, alrededor de la mitad de los lagos tienen algunos peces con mercurio que superan el límite de asesoramiento de salud (0.5 ppm), y cientos de lagos han sido incluidos en la lista negra porque sus peces se consideran no aptos para el consumo humano.
No se conocen con certeza las causas de la contaminación por mercurio de los lagos. Parece probable que el fenómeno pueda ser natural en regiones alejadas de fuentes de emisión. Sin embargo, el mercurio antropogénico está contribuyendo al problema más cercano a las grandes fuentes de emisiones, como las estaciones generadoras de carbón, los incineradores municipales y las fundiciones. Por ejemplo, Harp Lake en Ontario se encuentra relativamente cerca de fuentes municipales e industriales de emisiones. Los estudios encontraron que la deposición atmosférica representó el 57% del aporte de mercurio a ese lago, lo que sugiere una influencia antropogénica significativa (Mierle, 1990).
La discusión anterior sobre el mercurio en los lagos se refiere a las múltiples situaciones en las que no hay insumos antropogénicos directos del metal. Sin embargo, hay casos bien conocidos de contaminación causada directamente por liberaciones industriales. Por ejemplo, las descargas de las fábricas de cloro-álcali y acetaldehído y algunas fábricas de pulpa más antiguas han causado contaminación local por mercurio, resultando en altos residuos de metilmercurio en peces y otros animales. El caso de Minamata Bay, Japón, involucró una planta de acetaldehído (Global Focus 18.1). Un caso menos grave en Canadá, que afectó partes de los ríos Inglés y Wabigoon en el noroeste de Ontario, involucró una fábrica de pulpa.
La bioacumulación significativa de mercurio también ocurre cuando se desarrollan reservorios hidroeléctricos (ver Capítulo 20). Las inundaciones lixivian el mercurio natural del suelo en el embalse, donde las bacterias del sedimento pobre en oxígeno lo transforman en metilmercurio que es biomagnificado por los peces. Este proceso ocurre más rápidamente en lagos ácidos porque esa condición favorece la producción de metilmercurio en el sedimento, en comparación con el menor dimetilmercurio disponible en cuerpos de agua no ácidos.
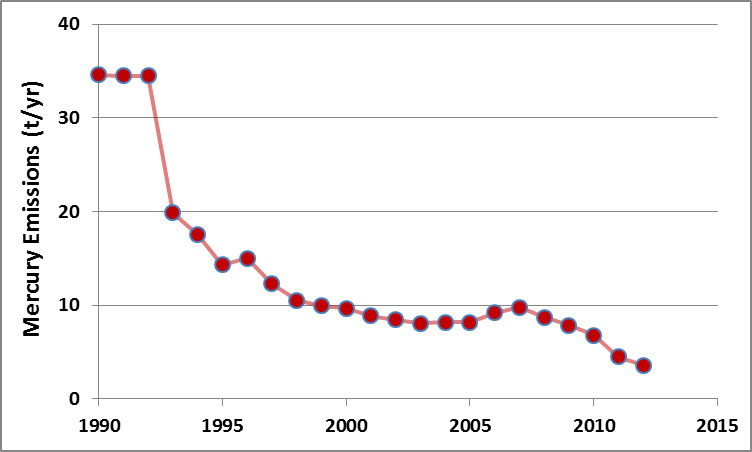
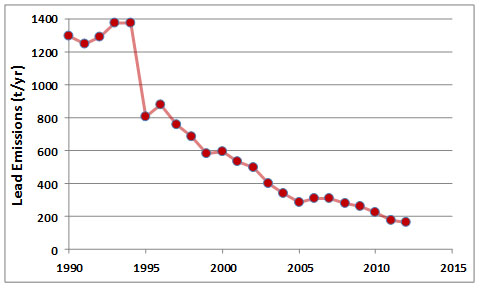
Si bien existe cierta controversia sobre la importancia relativa de las fuentes naturales y antropogénicas de mercurio para los lagos remotos, es tranquilizador saber que las emisiones globales se han reducido considerablemente en las últimas décadas (Figura 18.3). Esto ocurrió debido a la mejora de los controles de emisiones en las instalaciones industriales, incluyendo el cierre de varias fundiciones de metales y centrales eléctricas de carbón.
Enfoque Global 18.1: Mercurio en la Bahía de Minamata
Minamata es una ciudad de Japón donde las emisiones industriales de una fábrica provocaron un famoso ejemplo de contaminación tóxica, a partir de la década de 1950. La fábrica produjo acetaldehído, que se utiliza para fabricar plásticos. El proceso industrial utilizó mercurio inorgánico como catalizador, y entre 1932 y 1968, alrededor de 25 toneladas del metal se vertieron en la bahía de Minamata con descargas de aguas residuales. Las bacterias en el sedimento anaeróbico transformaron el mercurio en metilmercurio, el cual se biomagnificó en peces hasta residir hasta 20 ppm. Los peces fueron consumidos por aves depredadoras, causando toxicidad y fracaso reproductivo. Los peces y mariscos también fueron cosechados y consumidos por personas que vivían alrededor de la bahía, que tiene una economía pesquera tradicional de larga data. Esto provocó un episodio de toxicidad que se conoció como “Enfermedad de Minamata”.
Tomó varios años para que el complejo de síntomas causados por la intoxicación por metilmercurio fuera reconocido como en última instancia debido a las emisiones de la fábrica de acetaldehído. Inicialmente, a mediados de la década de 1950, los médicos notaron que las personas mostraban un síndrome neurológico novedoso y extraño, caracterizado por una degeneración progresiva del sistema nervioso. Los síntomas se intensificaron desde entumecimiento en las extremidades de las extremidades, hasta dificultad para hablar, pérdida de visión periférica, convulsiones, inconsciencia y, en última instancia, la muerte de muchas víctimas. También hubo un síndrome congénito causado por la toxicidad a los fetos por metilmercurio pasado a través de la barrera placentaria. Los niños afectados padecían deformidad, retraso mental y alteración del control motor. Al mismo tiempo, los gatos alimentados con peces fueron asesinados por una enfermedad neurológica, al igual que las aves devoradoras de peces.
Pronto se hizo evidente que la enfermedad estaba siendo causada por comer pescado cosechado de la bahía de Minamata. Si bien los desechos industriales que se vierten a la bahía fueron uno de los primeros sospechosos, inicialmente no se hizo mucho para reducir las descargas o para evitar que las personas comieran mariscos capturados en la zona contaminada. Entonces, en 1959, científicos de la Universidad de Kumamoto concluyeron que un compuesto organo-mercurial era la causa del síndrome tóxico. Poco después, se dio cuenta de que su origen era mercurio inorgánico de origen industrial que estaba siendo naturalmente metilado en la bahía. La empresa que causó la contaminación cuestionó estas conclusiones, aunque comenzó a pagar indemnizaciones a algunas de las personas más gravemente afectadas (pero sólo si se firmó una liberación que absolvió a la empresa de responsabilidad y eliminó la posibilidad de futuras demandas; además, muchas personas afectadas se les denegó la indemnización). A pesar de la intensa controversia, la compañía continuó liberando mercurio al medio acuático hasta 1968, cuando un cambio en la tecnología lo eliminó del proceso de fabricación.
En última instancia, alrededor de 2,200 personas fueron diagnosticadas oficialmente con la Enfermedad de Minamata como resultado de la exposición al metilmercurio en mariscos cosechados de la bahía. De estos, alrededor de 100 murieron por su envenenamiento. Además, al menos 12 mil personas pueden haber sufrido formas más leves de la enfermedad pero no fueron diagnosticadas oficialmente. En 1973, un tribunal determinó que la compañía química se había comportado de manera negligente y que era responsable de los daños. A muchas personas que padecían enfermedad causada por mercurio se les otorgó una indemnización, aunque las cantidades pagadas se disputaron por ser insuficientes y muchas personas no recibieron nada. La conclusión, sin embargo, es que las personas murieron de intoxicación evitable por metilmercurio, y muchos sobrevivientes experimentaron terribles discapacidades físicas y mentales.
Se pueden aprender lecciones importantes de esta catástrofe ambiental. Una es que las consecuencias imprevistas pueden resultar de actividades humanas que se consideran ambientalmente seguras. En el caso Minamata, se consideró que el vertimiento de aguas residuales que contienen mercurio inorgánico no causaría daños graves al medio marino. En su momento, no se sabía que las bacterias en los sedimentos sean capaces de transformar el mercurio en metilmercurio bio-aumentador y tóxico. Además, aun cuando se reconoció que esto estaba sucediendo, y que las personas y la vida silvestre estaban siendo envenenadas, los intereses empresariales y las autoridades reguladoras y políticas no actuaron de manera decisiva para garantizar que las personas ya no estuvieran expuestas a la amenaza tóxica. Esta negligencia agravó mucho el problema.
En cualquier caso, el trágico caso de la bahía de Minamata ha mejorado nuestra comprensión de las consecuencias de descargar mercurio en un ambiente acuático. Sin embargo, la lección más amplia sobre las consecuencias no deseadas de actividades económicas poco consideradas aún no está firmemente consagrada en nuestros sistemas de planeación y regulación.
Fuentes Antropogénicas
Los procesos industriales utilizados para extraer, procesar y usar metales pueden resultar en la contaminación del aire, el agua y la tierra (consulte la Figura 13.1).
Residuos Mineros
Las áreas cercanas a sitios mineros pueden verse gravemente dañadas por el vertido de desechos de excavación ricos en metales (rocas cuya concentración de metal no es lo suficientemente alta como para considerarse mineral comercial). Debido a que estos materiales pueden ser tóxicos, el desarrollo de la vegetación puede restringirse a comunidades sucesionales tempranas, como pastizales dispersos. En algunos casos, la toxicidad del suelo es lo suficientemente grave como para que pocas plantas logren establecerse incluso después de cientos de años. Esto se puede ver en los desechos de minas de trabajos de plomo romanos de 2000 años en Inglaterra y Gales.
Los ecologistas que estudian sitios británicos contaminados por desechos mineros han encontrado que estos hábitats a menudo apoyan ecotipos de plantas que son genéticamente tolerantes a los metales que están presentes. Los ecotipos adaptados localmente pueden crecer en suelos contaminados con metales, donde las plantas no tolerantes son eliminadas por el estrés tóxico. Por el contrario, los ecotipos tolerantes son competidores pobres en ambientes no contaminados, por lo que son raros en hábitats no afectados por la toxicidad de los metales.
La investigación sobre ecotipos tolerantes a metales ha proporcionado información sobre el proceso de evolución (Capítulo 6). Los individuos tolerantes a metales ocurren en poblaciones que crecen en sitios no contaminados, pero son raros. Sin embargo, la frecuencia de genotipos tolerantes aumenta rápidamente después de que se produce la contaminación por metales. En lugares con límites agudos entre suelos contaminados y no contaminados, una población tolerante puede mantenerse a una distancia de solo unos pocos metros. Esto es posible porque la intensa toxicidad del suelo contaminado favorece fuertemente la supervivencia y reproducción de individuos tolerantes. Tal cambio a nivel poblacional en caracteres de base genética, que ocurre en respuesta a un agente de selección natural (en este caso, contaminación metálica), es una demostración de evolución (más específicamente, microevolución).
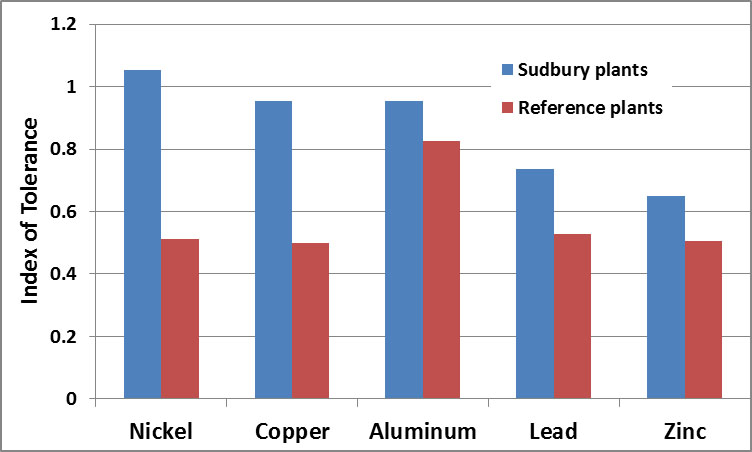
Se han estudiado ecotipos tolerantes a metales cerca de Sudbury, donde la contaminación por níquel y cobre ha sido causada por las emisiones de fundiciones y camas asadas (ver Capítulo 16). Las comunidades vegetales de sitios contaminados están dominadas por ecotipos tolerantes a metales de varias gramíneas, particularmente Agrostis gigantea y Deschampsia caespitosa. Los prados de estos pastos se desarrollaron poco después de que el extremadamente alto “superstack” fuera comisionado en 1972. Debido a que dispersó ampliamente las emisiones, el superstack redujo en gran medida la contaminación SO 2 a nivel del suelo Sin embargo, el suelo de la zona se mantuvo ácido y contaminado con metales. Los ecotipos locales de estas gramíneas pueden tolerar estrés tóxico por acidez y metales, pero son intolerantes al SO 2, razón por la cual los pastizales no se desarrollaron hasta después de que el superstack comenzara a operar.
Se ha estudiado la tolerancia al metal del pasto Deschampsia caespitosa. Las plantas se cultivaron en soluciones que contenían los metales de interés, y se compararon con los controles (Figura 18.3). Los datos muestran que la población de Sudbury es tolerante al níquel y al cobre, los cuales se presentan en su suelo nativo a concentraciones de aproximadamente 400 ppm, en comparación con 20 ppm en sitios de referencia no contaminados. La población de Sudbury también es más tolerante al aluminio. Esto es una respuesta a la mayor solubilidad y toxicidad del aluminio en suelos ácidos cercanos a las fundiciones (que tuvieron un pH de 3.5-3.9, comparado con pH 6.8-7.2 en sitios de referencia).
Relaves que contienen metal
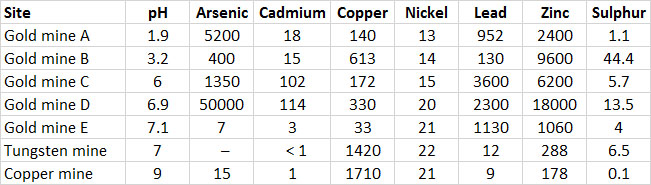
Una vez que se extrae el mineral, se muele hasta obtener un polvo fino en un proceso llamado molienda. Luego, el polvo se separa en una valiosa fracción rica en metales, que se tuesta y se funde, además de grandes cantidades de relaves de desecho. En la mayoría de los casos, los relaves se vierten en un área baja contenida, que cuando está llena se cubre con vegetación como medida de estabilización. Si bien los relaves son un producto de desecho, aún contienen altas concentraciones de metales, y eso puede dificultar el establecimiento de vegetación después de llenar un basurero. Además, si los minerales sulfurados están presentes, la acidez se genera cuando se oxidan por las bacterias, y eso empeora la toxicidad. Los análisis químicos de relaves de varias minas canadienses se muestran en el Cuadro 18.2. Los relaves contienen altas concentraciones de diversos metales, dependiendo del mineral que se esté procesando. Los relaves ácidos son especialmente tóxicos, porque los metales son mucho más solubles y biodisponibles en condiciones ácidas.
Los reguladores canadienses requieren que las áreas de eliminación de relaves se cubran con vegetación una vez que estén llenas de desechos o después de que cierre su mina asociada. Esto se hace porque los vertederos de relaves tienen una estética deficiente y pueden ser fuentes de polvo del viento. Estos problemas ambientales pueden mitigarse sustancialmente si un vertedero de relaves abandonado se cubre con una cubierta estable de vegetación. Además, si sus presas y bermas asociadas no son estructuralmente sólidas y se ven violadas por altos flujos de agua durante el clima severamente lluvioso, las áreas de eliminación de relaves pueden ser una fuente de contaminación masiva del agua.
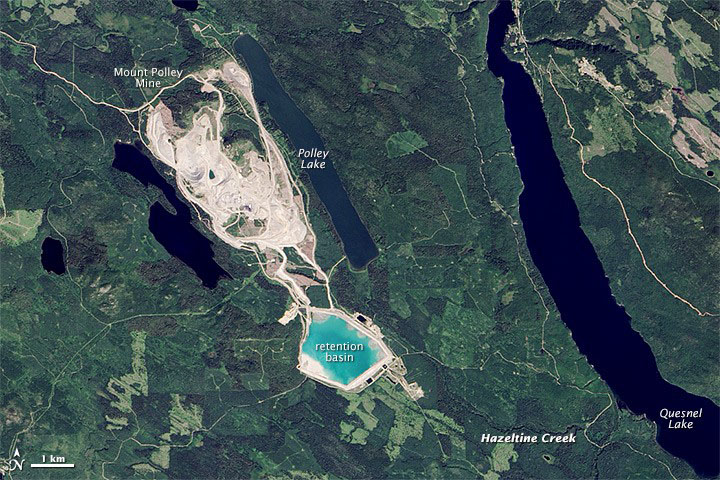
Uno de esos desastres ocurrió en 2014 en la región Cariboo, en el centro de Columbia Británica, cuando se produjo una brecha accidental en el área de disposición de relaves de una mina de cobre- oro en Mount Polley. El derrame masivo involucró alrededor de 10 millones de metros cúbicos de agua y 4.5 millones de metros cúbicos de lodo (una mezcla fluida de partículas de relaves y agua) (Allen y Voiland, 2014). El gran flujo de limpieza erosionó bancos y árboles arrancados de raíz y gran parte del volumen finalmente se depositó en el cercano lago Polley, cuya superficie se elevó 1.5 metros. Parte del flujo continuó luego a través de Hazeltine Creek hacia el lago Quesnel mucho más grande, que había sido famoso como un cuerpo de agua profundo y prístino. Al final del día de la brecha, el estanque de relaves de 4 km2 estaba casi vacío. En este caso, la causa de la brecha parece haber sido el llenado excesivo de un área de eliminación de relaves poco diseñada.

Si un área llenada de desechos debe tener una cobertura estable de vegetación establecida en la parte superior, su contenido debe ser tratado para reducir la toxicidad. Si los relaves son ácidos, se necesita un tratamiento de encalado para elevar el pH a un nivel neutro y así reducir la disponibilidad de metales. El fertilizante también se puede usar para aliviar la deficiencia de nutrientes y agregar materia orgánica para mejorar la estructura del suelo y la capacidad de retención de agua, y luego se siembran las plantas. En ocasiones, se utilizan técnicas novedosas, como el uso de ecotipos tolerantes a ácidos o metales en la mezcla de siembra. Si los relaves son extremadamente tóxicos o generadores de ácido, es posible que tengan que cubrirse con una sobrecarga disponible localmente, como la labranza glacial, que luego se vegeta. Canadian Focus 18.1 describe la recuperación de áreas de eliminación de relaves en las cercanías de Sudbury.

Canadian Focus 18.1: Reclamación de relaves en el acantilado de cobre
Una gran fundición en Copper Cliff, cerca de Sudbury, es atendida por un molino que produce grandes cantidades de relaves (54 mil toneladas por día en el momento en que se escribió el estudio de caso de Peters (1984)). Los relaves se mezclan con agua y se canalizan como una suspensión para ser desechados en cuencas naturales cuya capacidad se incrementa por la construcción de diques de tierra. En 2005, los vertederos de relaves cubrieron alrededor de 3,025 ha, de las cuales 1,425 han sido estabilizadas por una cobertura de vegetación perenne. La vegetación evita que el polvo fino sople a la atmósfera y mejora la estética y la calidad ambiental. Las áreas de relaves re-vegetadas tienen un estanque central, el cual está rodeado de pastizales gradualmente inclinados.
Los relaves son un material finamente molido, compuesto principalmente por minerales que no son particularmente tóxicos. Sin embargo, los relaves contienen piritas que se oxidan cuando se exponen al oxígeno atmosférico, y generan acidez tan baja como pH 3.7. Estas condiciones extremadamente ácidas dan como resultado que los metales estén disponibles para la absorción de la planta, lo que aumenta enormemente la toxicidad de los relaves. Los metales disponibles en la planta se analizaron mediante la extracción de relaves con ácido acético, y se encontraron niveles muy altos de metales disponibles, con níquel hasta 87 ppm, cobre 81 ppm y hierro 440 ppm.
Los procedimientos de recuperación dan como resultado que se establezca un pastizal estable, que luego es invadido por arbustos nativos, árboles y otras plantas. Los métodos incluyen los siguientes:
- aplicación de 900 kg/ha de piedra caliza (CaCo 3), lo que eleva el pH de los relaves a 4.5-5.5 y reduce la disponibilidad de metales
- varias aplicaciones de fertilizantes durante las etapas iniciales de establecimiento de pastizales, siendo especialmente importante el nitrógeno
- aplicación de un mantillo orgánico para mejorar las características de retención de agua y aireación de los relaves superficiales
- siembra con una mezcla de pastos de larga vida y legumbres, así como centeno anual (Secale cereale), lo que proporciona un cultivo de nodriza de corta duración que ayuda a mitigar el microclima estresante para las plántulas tiernas de las hierbas y legumbres perennes
A medida que la vegetación se establece y se desarrolla en las áreas de eliminación de relaves recuperadas, algunos animales comienzan a usar el hábitat. Las aves que se reproducen en el hábitat herboso y su estanque central incluyen ánade real y patos negros (Anas platyrhynchos y A. rubripes), cernícalo americano (Falco sparverius), ciervo asesino (Charadrius vociferus) y gorrión de sabana (Passerculus sandwichensis). Se han observado al menos 90 especies de aves que utilizan el vertedero de relaves recuperadas y su estanque durante la migración.
Fundiciones
Una fundición es una gran instalación industrial donde se tuesta el mineral. Esto se hace para oxidar minerales sulfurados, un proceso que da como resultado grandes cantidades de desechos SO 2 y partículas metálicas. En la mayoría de los casos actuales, las tecnologías de control de contaminación se utilizan para recuperar gran parte del SO 2 y las partículas antes de que los gases de combustión sean ventilados a la atmósfera. En el pasado, sin embargo, esos desechos se emitían al medio ambiente, provocando una intensa contaminación y daños ecológicos. Tan recientemente como hace varias décadas esta era una práctica común, y todavía lo es para algunas fundiciones más antiguas. Las fundiciones más nuevas funcionan de manera mucho más limpia.
Una fundición es una fuente puntual de estrés tóxico para los ecosistemas circundantes. Las emisiones pueden resultar en gradientes espaciales bien definidos tanto de contaminación como de sus daños ecológicos resultantes, que disminuyen con el aumento de la distancia. Los estudios de daños cerca de fundiciones indican las siguientes generalizaciones:
- Cerca de la fuente puntual, la contaminación por SO 2 atmosférico y los metales en el suelo es más severa
- La intensidad de la contaminación disminuye rápidamente (más o menos exponencialmente) al aumentar la distancia desde la fundición.
- El daño a la vegetación varía con la intensidad del estrés tóxico e incluye disminuciones en la biomasa, productividad y diversidad de especies, con solo unas pocas especies de bajo crecimiento que ocurren en los hábitats más contaminados
- Los procesos ecológicos como el ciclo de nutrientes y la descomposición se ven alterados por metales tóxicos, gases y acidez
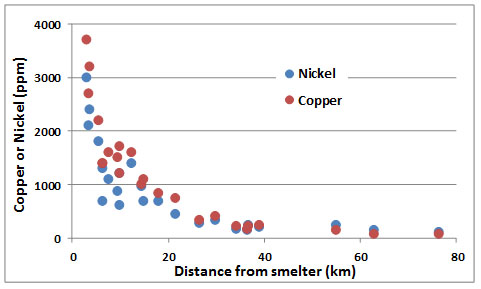
El patrón de contaminación por metales alrededor de una fuente puntual puede ser ilustrado por la fundición Copper Cliff cerca de Sudbury. La Figura 18.4 muestra que las concentraciones de metales en el ambiente disminuyen rápidamente al aumentar la distancia desde esa fundición. Estos datos se refieren específicamente al suelo del bosque, pero se observan observaciones similares en suelo, vegetación, agua de lago y otros componentes del ecosistema.
Como examinamos en el Capítulo 16, el SO 2 también ha sido un contaminante importante en el área de Sudbury. En consecuencia, es difícil determinar el papel específico de los metales tóxicos en la causa de daños ecológicos. Una forma de investigar la influencia de los metales es cultivar plantas en suelo contaminado en un invernadero, donde el SO 2 no está presente. Estos experimentos de bioensayos han demostrado que el suelo recolectado cerca de las fundiciones es tóxico, principalmente por sus altas concentraciones de metales. En un grado sustancial, la toxicidad persiste incluso después de que la acidez del suelo se neutraliza agregando cal.
No todas las fundiciones emiten tanto SO 2 como metales. El daño ecológico que resulta de aquellos que emiten únicamente partículas metálicas ha sido en consecuencia causado por la contaminación metálica. Una fundidora bien estudiada, en Gusum, Suecia, opera desde 1661 (Tyler, 1984). El zinc es un contaminante importante allí, alcanzando concentraciones tan altas como 2% (20 mil ppm) en materia orgánica superficial cerca de la fuente puntual, en comparación con menos de 200 ppm a más de 6 km de distancia. La contaminación por cobre es similar, alcanzando 1.7% dentro de 0.3 km, en comparación con 20 ppm más allá de 6 km. La contaminación por zinc y cobre ha causado daños ecológicos locales. Los pinos y abedules han muerto o declinado cerca de la fuente, y se han dañado plantas de sotobosque, musgos, líquenes e invertebrados que habitan en el suelo. Las tasas de descomposición y ciclo de nutrientes también se ven afectadas en los sitios más contaminados. Algunas plantas, sin embargo, son tolerantes a la contaminación por metales en Gusum. Incluyen el pasto Deschampsia flexuosa y el musgo Pohlia nutans, que les va relativamente bien en sitios que son tóxicos para otras plantas.
Uso de Pesticidas Inorgánicos
Hasta la década de 1970, los químicos inorgánicos eran ampliamente utilizados como pesticidas en la agricultura (véase también el Capítulo 22). Esto fue especialmente cierto en huertos frutales, donde se utilizaron pesticidas a base de arseniato de plomo, arseniato de calcio, sulfato de cobre y compuestos relacionados para controlar enfermedades fúngicas y plagas de artrópodos. Estos compuestos ahora han sido desplazados en gran medida por pesticidas orgánicos sintéticos.
Sin embargo, hasta mediados de la década de 1970, las tasas anuales de aspersión de plomo en los huertos de Ontario fueron tan altas como 8.7 kg/ha, mientras que los tratamientos con arsénico alcanzaron 2.7 kg/ha, zinc 7.5 kg/ha y cobre 3.0 kg/ha (Frank et al., 1976). Las tasas de aspersión dependieron del cultivo que se cultivaba, la plaga que se manejaba y el pesticida utilizado, pero en algunos casos todos estos elementos tóxicos se aplicaron en los mismos huertos.
Residuos de estos químicos acumulados en el suelo de huertos tratados. Estudios de huertos de manzanos encontraron residuos tan altos como 890 ppm de plomo y 126 ppm de arsénico en suelo superficial, comparados con niveles de fondo de <25 ppm de plomo y <10 ppm de arsénico (Figura 18.5). Las acumulaciones fueron causadas por hasta 70 años de fumigación de arseniato de plomo como insecticida, en su mayoría contra la polilla de la manzana (Laspeyresia pomonella), plaga que causa manzanas “lombrisas”.
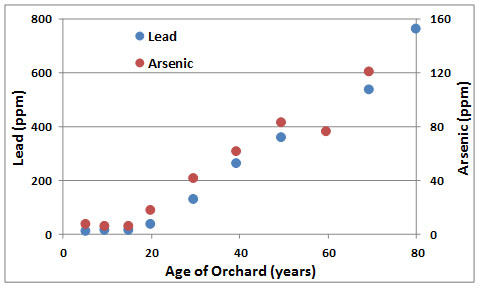
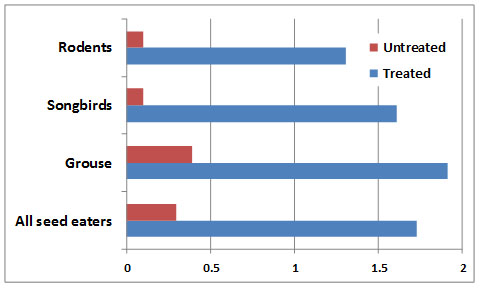
El suelo agrícola también puede contaminarse con el uso de fungicidas que contienen mercurio, especialmente aquellos que protegen las plántulas recién germinadas de una infección fúngica conocida como humedecimiento. Este patógeno ataca a las plántulas en la interfaz suelo-aire y hace que la planta debilitada se caiga y muera. Los pesticidas que contienen mercurio también se utilizan para controlar enfermedades del césped en campos de golf putting greens. Se han medido residuos de mercurio que van de 24-120 ppm en el suelo de putting greens en Ontario, mientras que en Nueva Escocia se encontraron hasta 9 ppm. La siembra de semillas recubiertas con fungicida mercúrico ha ocasionado envenenamiento de animales silvestres que consumieron el grano plantado o comieron herbívoros que lo hicieron. Los compuestos alquil-mercurio como el metilmercurio son especialmente peligrosos a este respecto porque esta forma es extremadamente tóxica y fácilmente asimilada por los animales a partir de sus alimentos. La Figura 18.6 muestra la contaminación por mercurio de la fauna silvestre que come semillas en regiones de Alberta donde se utilizó semilla tratada, en comparación con áreas donde no se produjo esa exposición. El uso de estos fungicidas fue común hasta principios de la década de 1970.
Figura 18.7. Mercurio en Animales Alimentados de Semilla Tratada. Los roedores y aves que comían semillas fueron expuestos al fungicida alquil-mercurio al alimentarse de semillas tratadas en áreas agrícolas de Alberta. También se presentan datos para un área donde no se utilizó semilla tratada con mercurio (etiquetada como no tratada). Los datos son datos promedio para hígado y están en ppm de peso seco. Fuente: Datos de Fimreite et al. (1970).
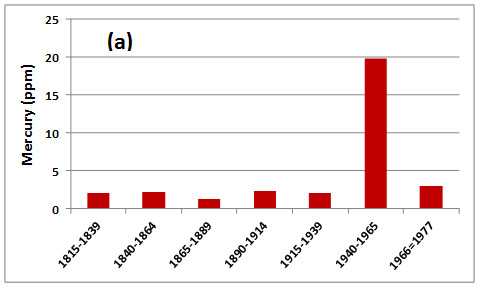
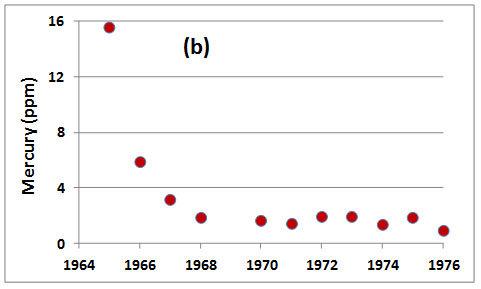
A partir de finales de la década de 1960, la mayoría de los países desarrollados prohibieron el uso de fungicidas alquil-mercurio como apósitos para semillas. Esta prohibición resultó del reconocimiento de problemas ecológicos asociados con el uso de estos químicos, especialmente el envenenamiento de animales salvajes. Suecia, por ejemplo, prohibió el uso de estos plaguicidas en 1966, al tiempo que aprobó el uso de compuestos alcoxil-alquil-mercurio, que son mucho menos tóxicos, como sustitutos. Esta acción condujo rápidamente a una disminución de la contaminación por mercurio de la fauna silvestre, como las aves depredadoras (Figura 18.7). Canadá tomó medidas similares, aunque varios años después.
Figura 18.8. Contaminación por mercurio de halcones suecos. a) Mercurio en plumas de azores (Accipiter gentilis), durante diversos periodos de tiempo; b) Mercurio en plumas de aguiluchos de pantano (Circus aeruginosus). Obsérvese el gran incremento en la contaminación causado por el uso de fungicidas alquil-mercurio y la rápida disminución que siguió a la prohibición de estos químicos en 1966. Fuente: Datos de Johnels et al. (1979).
Como se señaló en la introducción a este capítulo, los humanos también han sido envenenados al comer inadvertidamente grano de semilla tratado con mercurio.
Aves y Plomo
Millones de aves han sufrido envenenamiento por plomo en Norteamérica cada año debido a que comían perdigones de escopeta gastados. La mayor parte del disparo gastado se asoció con la caza. En Canadá, por ejemplo, alrededor de 2000 toneladas de perdigones de plomo fueron utilizadas por los cazadores cada año a principios de la década de 1990. Aunque más localizado, el tiro al plato también fue un problema debido a la gran cantidad de disparos depositados, hasta toneladas de plomo cada año.
Después de ser ingerido por un ave devorador de semillas, el tiro de plomo puede ser retenido en la molleja, un avance muscular del estómago. El grano duro normalmente se retiene en la molleja y se usa para moler semillas con recubrimiento duro, ayudando en su digestión. Desafortunadamente, los perdigones de escopeta son similares en tamaño y peso al grano que muchas aves seleccionan para este propósito. El disparo se erosiona en la molleja, y los trozos son tragados y disueltos por el líquido ácido del estómago. Luego, el plomo se absorbe en el torrente sanguíneo, lo que le permite envenenar el sistema nervioso del ave, lo que lleva a la muerte.
Las aves acuáticas han sido especialmente afectadas, con 2-3 millones de individuos, o 2-3% de la población norteamericana, muriendo cada año por envenenamiento por inyección de plomo a principios de la década de 1990. La retención de solo uno o dos pellets en su molleja puede envenenar a un pato, provocando una pérdida de 30-50% de su peso corporal, toxicidad neurológica y, en última instancia, la muerte. Por lo general, alrededor del 10% de las aves acuáticas encuestadas en Norteamérica tenían uno o más perdigones de escopeta en su molleja. Se sabe que las aves acuáticas más grandes, como los cisnes, retienen pesos de pesca de plomo en su molleja. Los plomos de plomo o tiro fueron citados como la causa del 20-50% de la mortalidad de cisnes trompetistas (Cygnus buccinator) en el oeste de América del Norte. También se sabe que los plomos de plomo envenenan cisnes de tundra (C. columbianus) que invernan en el este de Estados Unidos, cisnes mudos (C. olor) en Europa y somorros (Gavia immer) en Canadá y Estados Unidos. En Canadá, alrededor de 500 t/a de plomos y jigs de pesca con plomo se perdieron a principios de la década de 1990.
Un síndrome relacionado, causado por la ingestión de disparos de plomo y balas, aflige a las aves que capturan cadáveres muertos. Aunque los números no están bien documentados, se sabe que esta intoxicación mata a buitres, águilas y otras aves carroñeras. El cóndor de California (Gymnogyps californianus), en peligro crítico, ha sido relativamente bien estudiado: alrededor del 60% de sus muertes conocidas en estado salvaje entre 1980 y 1986 fueron causadas por la toxicidad de las balas ingeridas en carroña. Debido al envenenamiento generalizado de las aves por tiro de plomo, los reguladores ahora han restringido su uso. El tiro de plomo está prohibido en la mayor parte de Estados Unidos. En Canadá, el uso de perdigones no tóxicos ha sido requerido en todas las áreas de humedales desde 1997 y en todas las demás áreas de caza desde 1999. El uso de perdigones de plomo para la caza está siendo reemplazado principalmente por perdigones de acero, y en menor grado por perdigones de bismuto. El uso restringido del disparo de plomo ha causado cierta polémica porque muchos cazadores creen que los tipos de disparos alternativos podrían causar más muertes paralizantes. Sin embargo, las pruebas de campo han demostrado que este efecto es marginal, siempre y cuando las cualidades balísticas inferiores de las alternativas sean compensadas disparando a distancias más cercanas o utilizando un tamaño mayor de disparo.
Emisiones de plomo en los automóviles
El plomo emitido por los automóviles ha contribuido a una contaminación general de los ambientes urbanos. A partir de 1923, pero particularmente después de 1945, se agregó tetraetil plomo a la gasolina como un compuesto llamado “antidetonante”. El plomo aumenta la eficiencia mecánica y la economía de gasolina, mientras disminuye el desgaste del motor. En 1975, alrededor del 95% de la gasolina utilizada en Norteamérica fue plomada a concentraciones tan altas como 770 ppm. En 1987, solo 35% de la gasolina estaba plomada, y el máximo permitido entonces fue de 290 mg/L; la disminución del uso de plomo entre 1975 y 1987 se debió principalmente al mayor uso de convertidores catalíticos para reducir las emisiones de otros contaminantes automotrices, especialmente monóxido de carbono e hidrocarburos. Los automóviles equipados con un convertidor catalítico solo pueden usar gasolina sin plomo, debido a que los catalizadores, generalmente platino, se vuelven inactivos por el plomo. El creciente uso de combustibles sin plomo resultó en una disminución de 93% en las partículas de plomo en el aire de las ciudades canadienses entre 1977 y 1989.
Después de 1990, se prohibió el uso de gasolina con plomo en Canadá y Estados Unidos (las únicas excepciones fueron los combustibles bajos en plomo [hasta 30 ppm] para su uso en algunos vehículos agrícolas, motores marinos y camiones grandes). En consecuencia, las emisiones de plomo de los automóviles en Canadá disminuyeron de aproximadamente 9,500 t en 1978 a menos de 100 t/a desde 1995. Sin embargo, muchos otros países, particularmente en el mundo menos desarrollado, continúan permitiendo el uso de combustibles con plomo.
Casi todo el plomo en la gasolina se emite como partículas a través del tubo de escape del vehículo. Las partículas más grandes se asientan cerca de la calzada. Esto da como resultado la acumulación de un gradiente bien definido de contaminación por plomo, cuya intensidad está relacionada con el volumen de tráfico. Este patrón de contaminación vial se ilustra en la Figura 18.8 (este estudio se realizó antes de la prohibición de los combustibles con plomo). Las partículas de plomo más finas se dispersan más ampliamente en la atmósfera y contribuyen a la contaminación general que ocurre en las ciudades. No es sorprendente que los estudios hayan demostrado algunos efectos del plomo en la vida silvestre urbana. Por ejemplo, las palomas (Columba livia) que viven en ciudades pueden tener residuos significativos de plomo y pueden presentar síntomas de intoxicación aguda.
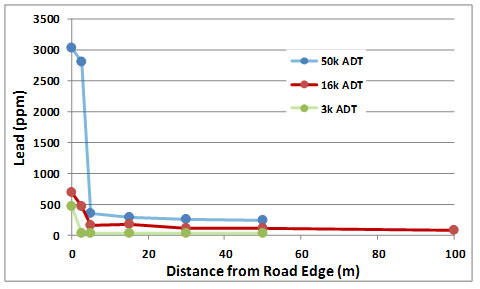
En general, se han producido grandes reducciones en las emisiones de plomo en Canadá, y también en otros países desarrollados (Figura 18.9). Esta mejora en las condiciones ambientales se ha producido debido a la prohibición de la gasolina con plomo así como a la mejora de los controles de emisiones en las fundiciones y otras instalaciones industriales.
Figura 18.10. Emisiones de plomo en Canadá. La disminución especialmente grande en 1995 se debió a la prohibición de la gasolina con plomo, y gran parte de la continua reducción se debió a mejoras en las prácticas industriales. Fuente: Datos de Environment Canada (2015).
Conclusiones
Todos los elementos naturales están presentes en al menos un nivel traza de contaminación en todos los componentes del ambiente, en el aire, el agua, el suelo y los organismos. En ocasiones su concentración es naturalmente elevada, como ocurre cuando un cuerpo mineral está presente en la superficie del suelo. Sin embargo, cada vez más las actividades antropogénicas son responsables de grandes emisiones de elementos tóxicos al medio ambiente, y en algunos casos esto ha ocasionado graves daños a los ecosistemas y toxicidad para las personas. Los peores casos de contaminación involucran prácticas industriales que ya no están permitidas en Canadá u otros países ricos, como las emisiones incontroladas de metales de las fundiciones, el vertido de mercurio a ambientes acuáticos, el uso de gasolina con plomo y el uso de perdigones de plomo para la caza. Sin embargo, la contaminación por elementos tóxicos sigue siendo un problema importante. El daño sigue siendo causado a los ecosistemas y organismos por las liberaciones de plomo, mercurio y otros elementos tóxicos. Esto es cierto en todas las partes del mundo, aunque la contaminación por elementos tóxicos en los países más pobres está mucho menos controlada que en los más ricos.
Preguntas para revisión
- ¿Cómo podemos identificar niveles normales (o de referencia), contaminación y contaminación por metales y otros elementos dado que estas sustancias son ubicuas en el ambiente?
- ¿Cuáles son las fuentes importantes de emisiones de metales para el medio ambiente?
- ¿Cuál es la diferencia entre las concentraciones totales y las disponibles de metales?
- Describir el patrón espacial de contaminación metálica alrededor de una fuente puntual de emisiones grandes, como una fundición.
Preguntas para Discusión
- ¿Cree que es probable que se produzcan daños ambientales similares al cercano a Sudbury si se construye una nueva fundición para procesar el mineral extraído en el yacimiento de mineral en Voisey Bay, Labrador? (Obsérvese que los minerales en ambos casos son similares —contienen minerales sulfurados de níquel y cobre.)
- Se han obtenido importantes beneficios ambientales al prohibir el uso de gasolina con plomo en Canadá. ¿Por qué hubo largas demoras en tomar acciones igualmente vigorosas contra el uso del tiro de plomo en la caza y tiro al plato y pesos de plomo en la pesca?
- Elija un elemento que se examinó en este capítulo e investigue sus beneficios, toxicidad, efectos sobre el medio ambiente, control y mitigación.
- Explicar los principios de bioacumulación y biomagnificación utilizando el caso del metilmercurio en ecosistemas acuáticos. ¿Por qué cree que estos fenómenos fueron “sorpresas” imprevistas para los científicos ambientales?
Explorando problemas
- Supongamos que Canadá y Estados Unidos están negociando un tratado para regir sus emisiones de mercurio al medio ambiente. Eres asesor científico del equipo canadiense. Algunos miembros del equipo quieren presionar por una política de “cero emisiones”, creyendo que ninguna emisión de mercurio al medio ambiente es aceptable. Piden tu consejo en este tema. ¿Qué tipo de información sobre la toxicidad del mercurio, para los humanos y para los ecosistemas silvestres se necesita para dar al equipo un asesoramiento objetivo sobre la política propuesta de cero emisiones? Además, ¿es físicamente posible tener cero emisiones?
Referencias citadas y lecturas adicionales
- Allen, S.E., A.W. Garrison, y G.W. Lutero III. 1998. Metales en Aguas Superficiales. Ann Arbor Press, Chelsea, MI.
- Allen, J. y A. Voiland. 2014. Infracción de presa en la mina Mount Polley en Columbia Británica. NASA (Tierra Visible). http://visibleearth.nasa.gov/view.php?id=84202 Recuperado enero, 2015.
- Alloway, B.J. (ed.). 2012. Metales Pesados en Suelos: Metales Traza y Metaloides en Suelos y su Biodisponibilidad. 3a ed. Springer, Nueva York, NY.
- Armstrong, F.A.J. 1979. Mercurio en el medio acuático. Pp. 84-100 en: Efectos del Mercurio en el Medio Ambiente Canadiense. NRCC No. 16739, Consejo Nacional de Investigaciones de Canadá, Ottawa, ON.
- Bowen, H.J.M. 1979. Química Ambiental de los Elementos. Academic Press, Nueva York, NY.
- Bradshaw, A.D. y M.J. Chadwick. 1981. La Restauración de la Tierra. Blackwell, Oxford, Reino Unido. Cox, R.M. y T.C. Hutchinson. 1979. Cotolerancias metálicas en el pasto Deschampsia caespitosa. Naturaleza, 279:231-233.
- Dale, J.M. y B. Freedman. 1982. Contaminación por plomo y zinc de suelos y vegetación en carretera en Halifax, Nueva Escocia. Actas del Instituto de Ciencia de Nueva Escocia, 32:327-336. http://hdl.handle.net/10222/14063
- Medio Ambiente Canadá. 2015. Inventario Nacional de Liberación de Contaminantes. https://www.ec.gc.ca/inrp-npri/default.asp?lang=En&n=4A577BB9-1
- Fimreite, N., R.W. Feif, y J.A. Keith. 1970. Contaminación por mercurio de comedores de semillas de praderas canadienses y sus depredadores aviares. Naturalista Canadiense de Campo, 84:269-276.
- Foulkes, E.C. (ed.). 1990. Efectos Biológicos de los Metales Pesados. CRC Press, Boca Ratón, FL.
- Frank, R., S.E. Braun, K. Ishida, y P. Suda. 1976. Residuos persistentes de plaguicidas orgánicos e inorgánicos en suelos de huertos y viñedos del sur de Ontario. Revista Canadiense de Ciencia del Suelo, 56:463-484.
- Freedman, B. 1995. Ecología Ambiental. 2a ed. Prensa Académica, San Diego, CA.
- Freedman, B. y T.C. Hutchinson. 1980. Insumos contaminantes de la atmósfera y acumulaciones en suelos y vegetación cerca de una fundición de níquel-cobre en Sudbury, Ontario, Canadá. Revista Canadiense de Botánica, 58:108-132.
- Gilmour, C.C. y E.A. Henry. 1991. Metilación de mercurio en sistemas acuáticos afectados por deposición ácida. Contaminación Ambiental, 71:131-169.
- Gunn, J.M. (ed.). 1995. Restauración y recuperación de una región industrial: avances en la restauración del paisaje dañado por la fundición cerca de Sudbury, Canadá. Springer, Nueva York, NY.
- Harada, M. 2001. La enfermedad de Minamata y la contaminación por mercurio del globo. Red de Información Ambiental para Asia y el Pacífico. http://www.einap.org/envdis/Minamata.html
- Johnels, A., G. Tyler, y T. Westermark. 1979. Una historia de niveles de mercurio en la fauna sueca. Ambio, 8:160-168.
- Kruckeberg, A.R. 1984. Serpentina de California: Flora, Vegetación, Geología, Suelos y Problemas de Manejo. Prensa de la Universidad de California, Los Ángeles, CA.
- Kuja, A.L. 1980. Revegetación de relaves de minas utilizando especies nativas de sitios perturbados en el norte de Canadá. M.Sc. Tesis, Departamento de Botánica, Universidad de Toronto, Toronto, ON.
- McKay, C. 1985. Contaminación de Peces de Agua Dulce en Aguas Canadienses. División de Riesgos Químicos, Departamento de Pesca y Océanos, Ottawa, ON.
- Mierle, G. 1990. Insumos acuosos de mercurio a lagos Precámbricos Shield en Ontario. Contaminación Ambiental y Química, 9:843-851.
- Agencia Nacional de Aeronáutica y del Espacio. 2014. Brecha de presa en la mina Mount Polley en Columbia Británica, 17 de agosto de 2014. Observatorio de la Tierra de la NASA. earthobservatory.nasa.gov/iotd/view. php`id=84202&src=ve
- Ontario Ministerio de Medio Ambiente y Energía (MOEE). 2014. Comer pescado deportivo de Ontario (2013-14). MOEE, Toronto, EN. https://web.archive.org/web/20141009013225/http://www.ontario.ca/environment-and-energy/guide-eating-ontario-sport-fish
- Peters, T.H. 1984. Rehabilitación de relaves mineras: un caso de reconstrucción completa de ecosistemas y revegetación de tierras estresadas industrialmente en el área de Sudbury, Ontario, Canadá. Pp. 403-421 En: Efectos de Contaminantes a Nivel Ecosistémico. (P.J. Sheehan, D.R. Miller, y P. Bourdeau, eds.), Wiley, Nueva York, NY.
- Ripley, E.A., R.E. Redmann, y A.A. Crowder. 1996. Efectos Ambientales de la Minería. Prensa de St. Lucie, Delray Beach, FL.
- Salomons, W., U. Förstner, y P. Mader (eds.). 1995. Metales Pesados: Problemas y Soluciones. Springer, Nueva York, NY.
- Sanderson, G.C. y F.C. Bellrose. 1986. Intoxicación por Plomo en aves Acuáticas. Publicación Especial 4, Sociedad de Historia Natural de Illinois, Urbana, IL.
- Sarkar, B. (ed.). 2002. Metales Pesados en el Medio Ambiente. Marcel Dekker, Nueva York, NY. Scheuhammer, A.M. y S.L. Norris. 1996. La ecotoxicología de los pesos de tiro de plomo y pesca con plomo. Ecotoxicología, 5:279-295.
- Spitz, K. y J. Trudinger. 2008. La minería y el medio ambiente: del mineral al metal. CRC Press, Boca Ratón, FL.
- Spry, D.J. y J.G. Weiner. 1991. Biodisponibilidad de metales y toxicidad en peces en lagos de baja alcalinidad: Una revisión crítica. Contaminación Ambiental, 71:243-304.
- Thompson, D.R., K.C. Hamer, y R.W. Furness. 1991. Acumulación de mercurio en grandes skúas (Catharacta skua) de edad y sexo conocidos, y su efecto sobre la reproducción y supervivencia. Revista de Ecología Aplicada, 28:672-684.
- Tyler, G. 1984. El impacto de la contaminación por metales pesados en los bosques: Un estudio de caso de Gusum, Suecia. Ambio, 13:18-24.
- Wiemeyer, S.N., J.M. Scott, M.P. Anderson, P.H. Bloom, y C.J. Stafford. 1988. Contaminantes ambientales en cóndores de California. Diario de Manejo de Vida Silvestre, 52:238-247.
- Wang, L.K., J.P. Chen, Y.-T. Hung, y N.K. Shammas. 2009. Metales Pesados en el Medio Ambiente. CRC Press, Boca Ratón, FL.
- Wong, M.H.W. y A.D. Bradshaw. 2003. Restauración y manejo de terrenos abandonados: enfoques modernos. World Scientific Publishers, Londres, Reino Unido.


