9.1: La presión de gas
- Page ID
- 1868
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)habilidades para desarrollar
- Definir las propiedades de la presión.
- Definir y convertir entre las unidades de medidas de presión.
- Describir el funcionamiento de herramientas comunes para medir.
- Calcular la presión de los datos del manómetro
La atmósfera de la tierra ejerce una presión, al igual que cualquier otro gas. Aunque normalmente no nos damos cuenta de la presión atmosférica, somos sensibles a los cambios de presión—por ejemplo, cuando escuchamos el "pop" durante el despegue y el aterrizaje al volar, o cuando buceas bajo del agua. La presión del gas es causada por la fuerza ejercida por las moléculas de gas que chocan con las superficies de los objetos (Figura \(\PageIndex{1}\)). Aunque la fuerza de cada colisión es muy pequeña, cualquier superficie de área apreciable tiene una gran cantidad de colisiones en poco tiempo, lo que puede resultar en una alta presión. De hecho, la presión de aire normal es lo suficientemente fuerte como para aplastar un recipiente de metal cuando no se equilibra con la misma presión desde el interior del recipiente.
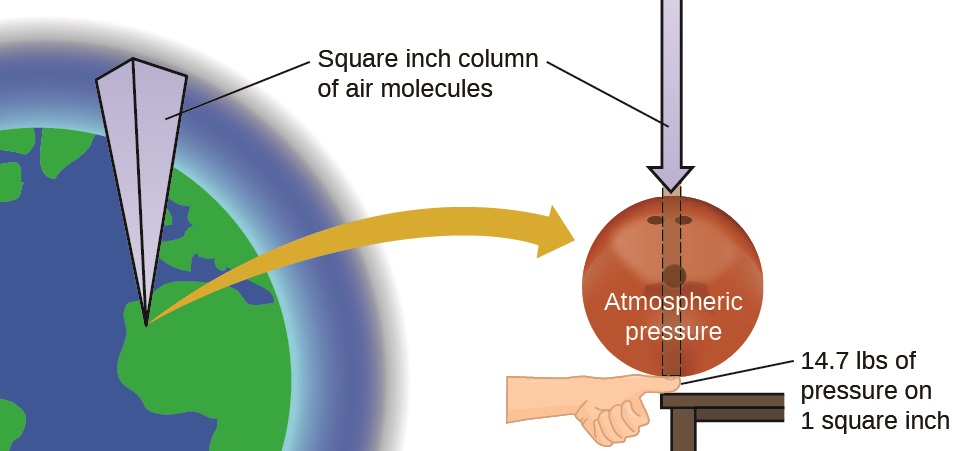
La presión atmosférica es causada por el peso de la columna de moléculas de aire en la atmósfera sobre un objeto, como el carro cisterna. Al nivel del mar, esta presión es más o menos igual a la de un elefante africano adulto sobre un tapete o una bola de boliche típica que descansa sobre su uña. Estas pueden parecer grandes cantidades, y lo son, pero la vida en la Tierra ha evolucionado bajo tanta presión atmosférica. Si realmente tiene una bola de boliche en su uña, la presión suele ser suficiente y la sensación es desagradable.

Se muestra una ilustración dramática de la presión atmosférica en este breve video, que muestra a un camión cisterna implosionando cuando su presión interna disminuye.
La presión se define como la fuerza ejercida sobre un área determinada:
\[P=\dfrac{F}{A} \label{9.2.1}\]
Como la presión es directamente proporcional a la fuerza e inversamente proporcional al área (Ecuación \ref{9.2.1}), la presión se puede aumentar por aumentando la cantidad de fuerza o disminuyendo el área sobre la que se aplica. En consecuencia, la presión se puede disminuir por disminuyendo la fuerza o aumentando el área.
Apliquemos la definición de presión (Ecuación \ref{9.2.1}) para determinar qué sería más probable a caerse a través del hielo delgado en la Figura 1 (\PageIndex{2}\). —¿el elefante o el patinador artístico?

Un gran elefante africano puede pesar 7 toneladas, apoyado en cuatro pies, cada uno con un diámetro de aproximadamente 1.5 pies (área de huella de 250 in2), por lo que la presión ejercida por cada pie es de aproximadamente 14 lb/in2:
\[\mathrm{pressure\: per\: elephant\: foot=14,000\dfrac{lb}{elephant}×\dfrac{1\: elephant}{4\: feet}×\dfrac{1\: foot}{250\:in^2}=14\:lb/in^2} \label{9.2.2}\]
El patinador pesa aproximadamente 120 libras, apoyado en dos patines, cada uno con un área de aproximadamente 2 in2, por lo que la presión ejercida por cada paleta es aproximadamente 30 lb/in2:
\[\mathrm{pressure\: per\: skate\: blade=120\dfrac{lb}{skater}×\dfrac{1\: skater}{2\: blades}×\dfrac{1\: blade}{2\:in^2}=30\:lb/in^2} \label{9.2.3}\]
Aunque el elefante es más de cien veces pesado que el patinador, ejerce menos de la mitad de la presión y, por lo tanto, es menos probable que caiga a través del hielo delgado. Por otro lado, si la patinadora se quita los patines y se para con los pies descalzos (o calzado normal) sobre el hielo, el área más grande sobre la cual se aplica su peso reduce en gran medida la presión ejercida:
La unidad de presión SI es el pascal (Pa), con 1 Pa = 1 N/m2, donde N es el newton, una unidad de fuerza definida como 1 kg m/s2. Un pascal es una pequeña presión; en muchos casos, es más conveniente usar unidades de kilopascal (1 kPa = 1000 Pa) o barra (1 barra = 100,000 Pa). A veces, en los Estados Unidos, la presión se mide en libras de fuerza sobre un área de una pulgada cuadrada (libras por pulgada cuadrada (psi), por ejemplo, en las llantas de los automóviles. La presión también se puede medir usando la unidad de atmósfera (atm), que originalmente representaba la presión del aire promedio al nivel del mar en la latitud aproximada de París (45°). La Tabla \(\PageIndex{1}\) nos da información sobre estas y algunas otras unidades comunes para mediciones de presión.
| El nombre de la unidad y la abreviatura | La definición o relación con otra unidad | Comentario |
|---|---|---|
| pascal (Pa) | 1 Pa = 1 N/m2 | unidad recomendada de IUPAC |
| kilopascal (kPa) | 1 kPa = 1000 Pa | |
| libras por pulgada cuadrada (psi) | la presión del aire al nivel del mar es ~14.7 psi | |
| atmósfera (atm) | 1 atm = 101,325 Pa | la presión del aire al nivel del mar es ~1 atm |
| bar (bar, or b) | 1 bar = 100,000 Pa (exactamente) | comúnmente usado en la meteorología |
| milibar (mbar, or mb) | 1000 mbar = 1 bar | |
| pulgadas de mercurio (en Hg) | 1 in. Hg = 3386 Pa | usado por la industria de la aviación, también algunos informes meteorológicos |
| torr | \(\mathrm{1\: torr=\dfrac{1}{760}\:atm}\) | lleva el nombre de Evangelista Torricelli, inventora del barómetro |
| milímetros de mercurio (mm Hg) | 1 mm Hg ~1 torr |
Ejemplo \(\PageIndex{1}\): CONVERSIÓN DE Las UNIDADES DE la PRESIÓN
El Servicio Meteorológico Nacional de los Estados Unidos informa sobre la presión en ambas pulgadas de Hg y milibares. Convierta una presión de 29.2 pulgadas Hg a:
- torr
- atm
- kPa
- mbar
Solución
Este es un problema de conversión de unidades. Las relaciones entre las distintas unidades de presión se dan en la Tabla 9.2.1.
- \(\mathrm{29.2\cancel{in\: Hg}×\dfrac{25.4\cancel{mm}}{1\cancel{in}} ×\dfrac{1\: torr}{1\cancel{mm\: Hg}} =742\: torr}\)
- \(\mathrm{742\cancel{torr}×\dfrac{1\: atm}{760\cancel{torr}}=0.976\: atm}\)
- \(\mathrm{742\cancel{torr}×\dfrac{101.325\: kPa}{760\cancel{torr}}=98.9\: kPa}\)
- \(\mathrm{98.9\cancel{kPa}×\dfrac{1000\cancel{Pa}}{1\cancel{kPa}} \times \dfrac{1\cancel{bar}}{100,000\cancel{Pa}} \times\dfrac{1000\: mbar}{1\cancel{bar}}=989\: mbar}\)
Ejercicio \(\PageIndex{1}\)
Una presión barométrica típica en Kansas City es de 740 torr. ¿Cuál es esta presión en atmósferas, en milímetros de mercurio, en kilopascales y en bares?
- Respuesta
-
0.974 atm; 740 mm Hg; 98.7 kPa; 0.987 bar
Podemos medir la presión atmosférica, la fuerza ejercida por la atmósfera sobre la superficie de la tierra, con un barómetro (Figura \(\PageIndex{3}\)). Un barómetro es un tubo de vidrio que se cierra en un extremo, se llena con un líquido no volátil como el mercurio y luego se invierte y se sumerge en un recipiente con ese líquido. La atmósfera ejerce presión sobre el líquido fuera del tubo, la columna de líquido ejerce presión dentro del tubo, y la presión en la superficie del líquido es la misma dentro y fuera del tubo. La altura del líquido en el tubo es, por lo tanto, proporcional a la presión ejercida por la atmósfera.
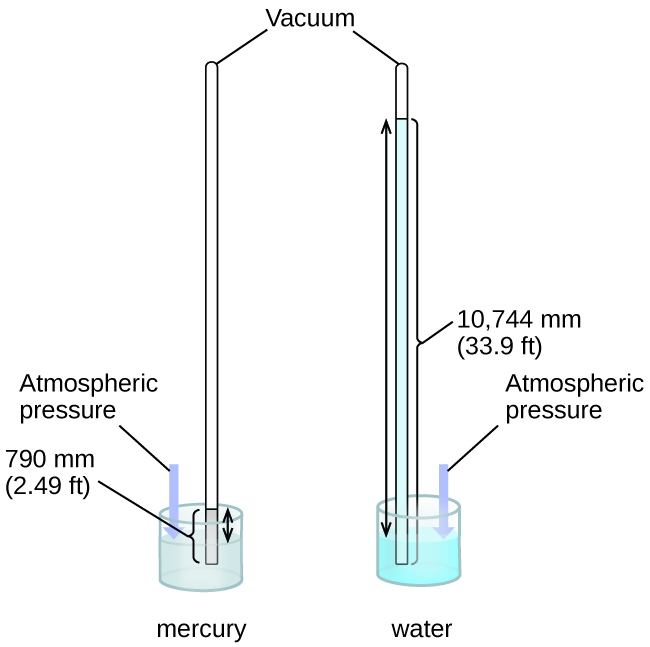
Si el líquido es el agua, la presión atmosférica normal soportará una columna de agua de más de 10 metros de altura, lo cual es bastante inconveniente para hacer (y leer) un barómetro. Debido a que el mercurio (Hg) es aproximadamente 13.6 veces más denso que el agua, un barómetro de mercurio solo necesita ser \(\dfrac{1}{13.6}\) tan alto como un barómetro de agua, un tamaño más adecuado. La presión atmosférica estándar de 1 atm al nivel del mar (101,325 Pa) corresponde a una columna de mercurio que tiene aproximadamente 760 mm (29.92 pulgadas) de altura. Originalmente, el torr estaba destinado a ser una unidad igual a un milímetro de mercurio, pero ya no corresponde exactamente. La presión ejercida por un fluido debido a la gravedad se conoce como la presión hidrostática, p:
donde
- \(h\) es la altura del fluido
- \(ρ\) es la densidad del fluido y
- \(g\) es la aceleración debida a la gravedad.
Ejemplo \(\PageIndex{2}\): CÁLCULO DE LA PRESIÓN BAROMÉTRICA
Muestre el cálculo que apoya la afirmación de que la presión atmosférica cerca del nivel del mar corresponde a la presión ejercida por una columna de mercurio que tiene aproximadamente 760 mm de altura. La densidad del mercurio = \(13.6 \,g/cm^3\).
Solución
La presión hidrostática viene dada por la ecuación \ref{9.2.5}, con \(h = 760\,mm\), \(ρ = 13.6\, g/cm^3\) y \(g = 9.81 \,m/s^2\). Al conectar estos valores en la ecuación \ref{9.2.5} y hacer las conversiones de unidades necesarias, obtendremos el valor que buscamos. (Nota: esperamos encontrar una presión de ~101,325 Pa:)
\[\mathrm{101,325\:\mathit{N}/m^2=101,325\:\dfrac{kg·m/s^2}{m^2}=101,325\:\dfrac{kg}{m·s^2}}\]
\[\begin {align*}
p&\mathrm{=\left(760\: mm×\dfrac{1\: m}{1000\: mm}\right)×\left(\dfrac{13.6\: g}{1\:cm^3}×\dfrac{1\: kg}{1000\: g}×\dfrac{( 100\: cm )^3}{( 1\: m )^3}\right)×\left(\dfrac{9.81\: m}{1\:s^2}\right)}\\
&\mathrm{=(0.760\: m)(13,600\:kg/m^3)(9.81\:m/s^2)=1.01 \times 10^5\:kg/ms^2=1.01×10^5\mathit{N}/m^2} \\ & \mathrm{=1.01×10^5\:Pa} \end {align*}\]
Ejercicio \(\PageIndex{2}\)
Calcule la altura de una columna de agua a 25°C que corresponde a la presión atmosférica normal. La densidad del agua a esta temperatura es 1.0 g/cm3.
- Respuesta
-
10.3 m
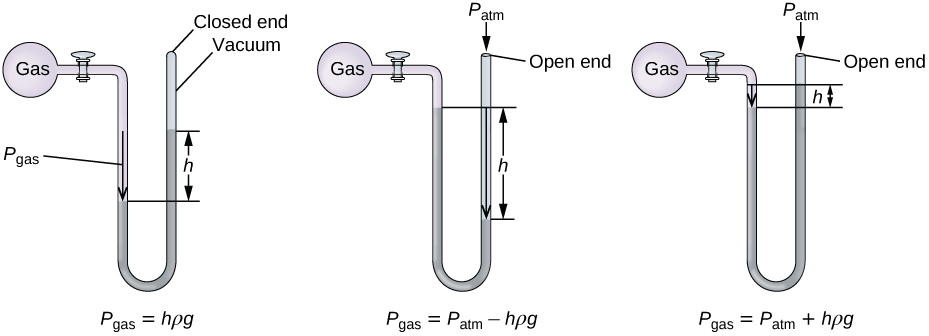
Un manómetro es un dispositivo similar a un barómetro que se puede usar para medir la presión de un gas atrapado en un recipiente. Un manómetro de extremo cerrado es un tubo en forma de U con un brazo cerrado, un brazo que se conecta al gas a medir y un líquido no volátil (generalmente el mercurio) en el medio. Al igual que con un barómetro, la distancia entre los niveles de líquido en los dos brazos del tubo (h en el diagrama) es proporcional a la presión del gas en el recipiente. Un manómetro de extremo abierto (Figura \(\PageIndex{3}\)) es lo mismo que un manómetro de extremo cerrado, pero uno de sus brazos está abierto a la atmósfera. En este caso, la distancia entre los niveles de líquido corresponde a la diferencia de presión entre el gas en el recipiente y la atmósfera.
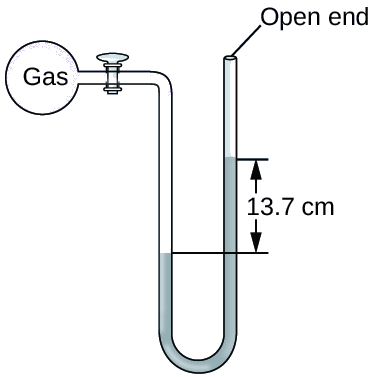
Ejemplo \(\PageIndex{3}\): CÁLCULO DE la PRESIÓN MEDIANTE UN MANÓMETRO ABIERTO
La presión de una muestra de gas se mide al nivel del mar con un manómetro abierto de Hg (mercurio), como se muestra a continuación. Determine la presión del gas en:
- mm Hg
- atm
- kPa
Solución
La presión del gas es igual a la presión hidrostática debido a una columna de mercurio de 13.7 cm de altura más la presión de la atmósfera al nivel del mar. (La presión en la línea horizontal inferior es igual en ambos lados del tubo. La presión de la izquierda se debe al gas y la presión de la derecha se debe a 13.7 cm de Hg más la presión atmosférica).
- En mm Hg, esto es: 137 mm Hg + 760 mm Hg = 897 mm Hg
- \(\mathrm{897\cancel{mm Hg}×\dfrac{1\: atm}{760\cancel{mm Hg}}=1.18\: atm}\)
- \(\mathrm{1.18\cancel{atm}×\dfrac{101.325\: kPa}{1\cancel{atm}}=1.20×10^2\:kPa}\)
Ejercicio \(\PageIndex{3}\)
La presión de una muestra de gas se mide al nivel del mar con un manómetro de Hg de extremo abierto, como se muestra a continuación. Determine la presión del gas en:
- mm Hg
- atm
- kPa
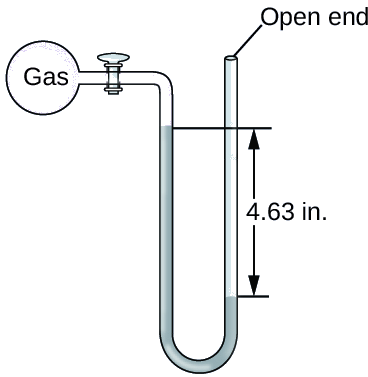
Respuesta a
-
642 mm Hg
- Respuesta b
-
0.845 atm
- Respuesta c
-
85.6 kPa
APLICACIÓN: MEDICIÓN DE LA PRESIÓN ARTERIAL
La presión arterial se mide usando un dispositivo llamado el esfigmomanómetro (sphygmos griego = "pulso"). Consiste de un manguito inflable para restringir el flujo sanguíneo, un manómetro para medir la presión y un método para determinar cuándo comienza el flujo sanguíneo y cuándo se impide (Figura \(\PageIndex{5}\)). Desde su invención en 1881, ha sido un dispositivo médico esencial. Hay muchos tipos de esfigmomanómetros: manuales que requieren un estetoscopio y son usados por profesionales médicos; los de mercurio, usados cuando se requiere la mayor precisión; los mecánicos menos precisos; y digitales que se pueden usar con poca capacitación pero que tienen limitaciones. Cuando se usa un esfigmomanómetro, el manguito se coloca alrededor de la parte superior del brazo y se infla hasta que el flujo sanguíneo esté completamente bloqueado, luego se libera lentamente. A medida que el corazón late, la sangre forzada a través de las arterias provoca un aumento de la presión. Este aumento de la presión a la que comienza el flujo sanguíneo es la presión sistólica, la presión máxima en el ciclo cardíaco. Cuando la presión del manguito es igual a la presión sistólica arterial, la sangre fluye más allá del manguito, creando sonidos audibles que se pueden escuchar con un estetoscopio. Esto es seguido por una disminución de la presión a medida que los ventrículos del corazón se preparan para otro latido. A medida que la presión del manguito continúa disminuyendo, eventualmente ya no se escucha el sonido; esta es la presión diastólica: la presión más baja (fase de reposo) en el ciclo cardíaco. Las unidades de presión arterial de un esfigmomanómetro están expresadas en milímetros de mercurio (mm Hg).

La meteorología, climatología y ciencia atmosférica
A lo largo de los siglos, la gente ha observado nubes, vientos y precipitaciones, tratando de discernir patrones y hacer predicciones: cuándo es mejor plantar y cosechar; si es seguro emprender un viaje por mar; y mucho más. Ahora enfrentamos desafíos complejos relacionados con el clima y la atmósfera que tendrán un gran impacto en nuestra civilización y el ecosistema. Varias disciplinas científicas diferentes usan principios químicos para ayudarnos a comprender mejor el clima, la atmósfera y el clima. Estos son la meteorología, la climatología y la ciencia atmosférica. La meteorología es el estudio de la atmósfera, los fenómenos y los efectos atmosféricos sobre el clima de la Tierra. Los meteorólogos buscan comprender y predecir el clima a corto plazo, lo que puede salvar vidas y beneficiar a la economía. Los pronósticos del tiempo (Figura \(\PageIndex{5}\)) son el resultado de miles de mediciones de presión de aire, temperatura y similares, que se compilan, modelan y analizan en centros meteorológicos de todo el mundo.
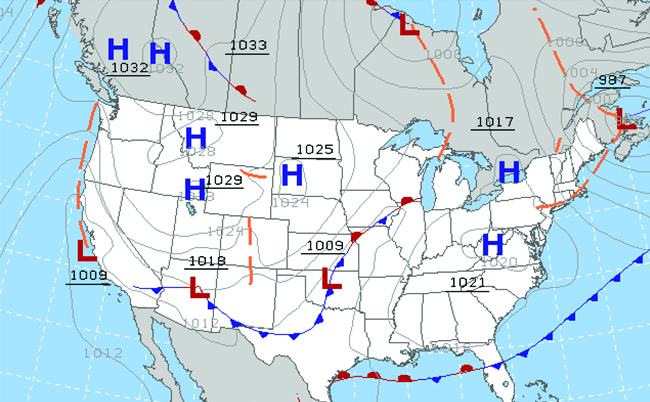
En términos de clima, los sistemas de baja presión ocurren cuando la presión atmosférica de la superficie de la tierra es más baja que el ambiente circundante: el aire húmedo se eleva y se condensa, produciendo nubes. El movimiento de la humedad y el aire dentro de varios frentes climáticos instiga la mayoría de los eventos climáticos.
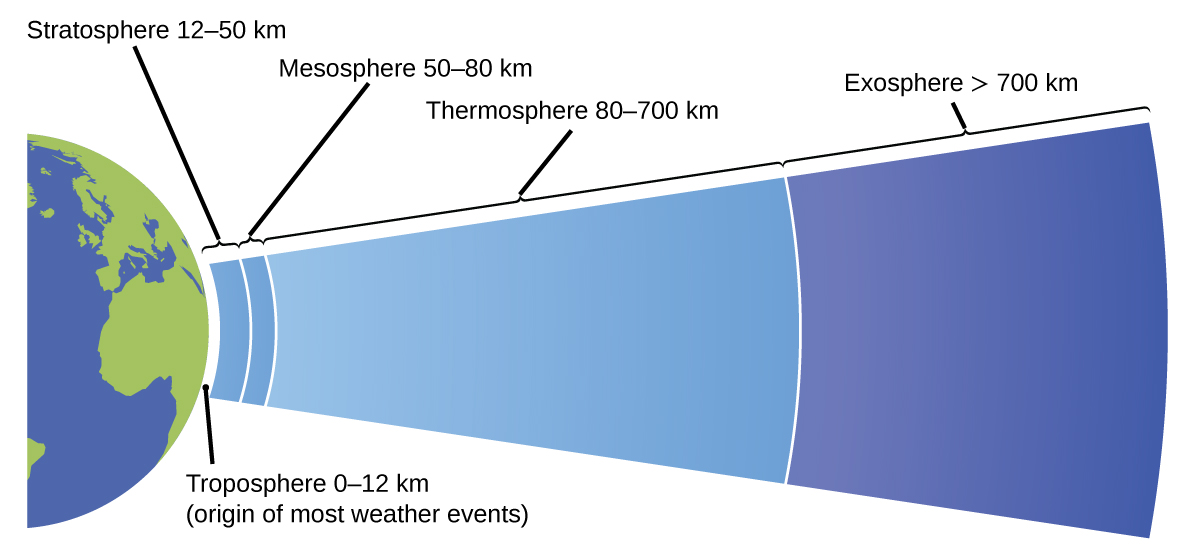
La atmósfera es la capa gaseosa que rodea un planeta. La atmósfera de la Tierra, que tiene aproximadamente 100–125 km de espesor, consta de aproximadamente 78.1% de nitrógeno y 21.0% de oxígeno, y se puede subdividir en las regiones que se muestran en la Figura \(\PageIndex{7}\): la exosfera (más alejada de la Tierra > 700 km sobre el nivel del mar), la termosfera (80–700 km), la mesosfera (50–80 km), la estratosfera (segundo nivel más bajo de nuestra atmósfera, 12–50 km sobre el nivel del mar) y la troposfera (hasta 12 km sobre el nivel del mar, aproximadamente el 80% de la atmósfera de la tierra en masa y la capa donde se originan la mayoría de los eventos climáticos). A medida que asciendes en la troposfera, la densidad del aire y la temperatura disminuyen.
La climatología es el estudio del clima, las condiciones climáticas promedio durante largos períodos de tiempo, usando los datos atmosféricos. Sin embargo, los climatólogos estudian los patrones y los efectos que ocurren durante décadas, siglos y milenios, en lugar de períodos de tiempo, días y semanas más cortos, como los meteorólogos. La ciencia atmosférica es un campo aún más amplio, que combina la meteorología, la climatología y otras disciplinas científicas que estudian la atmósfera.
Resumen
Los gases ejercen presión, que es la fuerza por unidad de área. La presión de un gas se puede expresar en la unidad SI de pascal o kilopascal, así como en muchas otras unidades, incluyendo el torr, la atmósfera y el bar. La presión atmosférica se mide con un barómetro; Se pueden medir otras presiones de gas usando uno de varios tipos de manómetros.
Ecuaciones Clave
- \(P=\dfrac{F}{A}\)
- p = hρg
Glosario
- atmósfera (atm)
- unidad de presión; 1 atm = 101,325 Pa
- bar
- (bar ob) unidad de presión; 1 barra = 100,000 Pa
- barómetro
- dispositivo utilizado para medir la presión atmosférica
- presión hidrostatica
- presión ejercida por un fluido debido a la gravedad
- manómetro
- dispositivo utilizado para medir la presión de un gas atrapado en un contenedor
- pascal (Pa)
- Unidad de presión SI; 1 Pa = 1 N / m2
- libras por pulgada cuadrada (psi)
- unidad de presión común en los EE. UU.
- presión
- fuerza ejercida por unidad de área
- torr
- unidad de presión; \ (\ mathrm {1 \: torr = \ dfrac {1} {760} \, atm} \)
Contribuyentes
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


