3.1: Compartimentos ambientales
- Page ID
- 70516
3.1.1. Introducción
Para comprender y predecir los efectos de los químicos en el medio ambiente necesitamos entender el comportamiento de los químicos en entornos específicos y en el ambiente en su conjunto. Para hacer frente a la diversidad de sistemas naturales, consideramos que consisten en compartimentos. Estas se definen como partes del entorno físico que se definen por un límite espacial que las distingue del resto del mundo, por ejemplo la atmósfera, el suelo, las aguas superficiales e incluso la biota. Estos ejemplos sugieren que tres fases: gas, líquido y sólido, son importantes pero los compartimentos pueden constar de diferentes fases. Por ejemplo, la atmósfera consiste en líquidos suspendidos (por ejemplo, niebla) y sólidos (por ejemplo, polvo) así como gases. Del mismo modo, los lagos contienen sólidos suspendidos y los suelos contienen espacio poroso gaseoso y lleno de agua. En modelos ambientales detallados, cada una de estas fases también puede ser considerada como un compartimento.
El comportamiento y destino de los químicos en el ambiente está determinado por las propiedades de los compartimentos ambientales y las características fisicoquímicas de los químicos. En conjunto, estas propiedades determinan cómo los químicos experimentan reacciones químicas y biológicas, como hidrólisis, fotólisis y biodegradación, y procesos de transferencia de fase como el intercambio aire-agua y la sorción.
En este capítulo, presentamos primero los compartimentos más importantes y sus propiedades y procesos más importantes que determinan el comportamiento de los contaminantes químicos: la atmósfera, la hidrosfera, el sedimento, el suelo, las aguas subterráneas y biota. Se discuten las emisiones de químicos al medio ambiente desde fuentes puntuales o fuentes difusas y las vías y procesos importantes que determinan el destino de los químicos. El enfoque de partición para los procesos de transferencia de fase se presenta con la sorción como ejemplo específico. También se discute el impacto de las propiedades fisicoquímicas en la partición.
Otros procesos ambientales importantes se discuten en secciones sobre especiación de metales, procesos que afectan la biodisponibilidad de metales y contaminantes orgánicos y la transformación y degradación de químicos orgánicos. Estas secciones también incluyen información sobre los métodos básicos para medir estos procesos.
Finalmente, los enfoques que se utilizan para modelar y predecir el destino ambiental de los químicos, y así la exposición de organismos a estos químicos se describen en la sección 3.8.
3.1.2. Atmósfera
Autores: Astrid Manders-Groot
Crítico: Kees van Gestel, John Parsons, Charles Chemel
Objetivos de Inclinación:
Deberías ser capaz de:
- describir la estructura de la atmósfera y mencionar sus principales componentes
- describir los procesos que determinan el tiempo de residencia y las distancias de transporte de los químicos en el aire
Palabras clave: atmósfera, distancia de transporte, tiempo de residencia
Composición y estructura vertical de la atmósfera
La atmósfera de la Tierra consta de varias capas que tienen interacción limitada. La troposfera es la parte más baja de la atmósfera y contiene el oxígeno que respiramos y la mayor parte del vapor de agua. Contiene en promedio 78% N 2, 20% O 2 y hasta 4% de vapor de agua. Los gases de efecto invernadero como CO 2 y CH 4 están presentes en 0.0038% y 0.0002%, respectivamente. Los contaminantes del aire como el ozono y el NO 2 tienen concentraciones que son incluso un factor 1,000-10.000 menores, pero ya son perjudiciales para la salud de humanos, animales y vegetación en estas concentraciones.
La troposfera tiene 6-8 km de altura cerca de los polos, unos 10 km en latitudes medias y unos 15 km en el ecuador. Tiene circulación propia y determina lo que experimentamos como clima, con temperatura, viento, nubes y precipitaciones. La parte más baja de la troposfera es la capa límite, la parte más cercana a la Tierra. Su altura está determinada por el calentamiento de la atmósfera por la superficie terrestre y las condiciones del viento y tiene un ciclo diario, determinado por la luz solar entrante. No es una capa completamente separada, pero el intercambio de contaminantes del aire como O3, NOx, SO2 y sustancias químicas xenobióticas entre la capa límite y las capas anteriores es generalmente ineficiente. Por lo tanto, también se le conoce como la capa de mezcla.
Por encima de la troposfera se encuentra la estratosfera, una capa que está menos fuertemente influenciada por el ciclo solar diario. Es muy seco y tiene su propia circulación, con algún intercambio con la troposfera. La estratosfera contiene la capa de ozono que protege la vida en la Tierra contra la radiación UV y se extiende a unos 50 km de altitud. Las capas que cubren los siguientes 50 km son la mesosfera y la termosfera, las cuales no son directamente relevantes para el transporte de los químicos considerados en este libro.
Propiedades de los contaminantes en el aire
Los contaminantes del aire incluyen una amplia gama de productos químicos, que van desde metales como el plomo y el mercurio hasta fibras de amianto, hidrocarburos policíclicos (PAH) y cloroformo. Estos contaminantes pueden ser emitidos a la atmósfera como un gas o como una partícula o gotita con tamaños de unos pocos nanómetros a decenas de micrómetros. Las partículas y gotitas se llaman aerosol o, dependiendo del método de medición, materia particulada. Esta última definición se utiliza en las regulaciones de calidad del aire. Tenga en cuenta que un solo aerosol puede estar compuesto por varios compuestos químicos. Una vez que un contaminante es liberado en la atmósfera, es transportado por difusión y advección por vientos horizontales y verticales y puede ser finalmente depositado en la superficie de la Tierra por lluvia (deposición húmeda), y pegándose a la superficie (deposición seca). Las partículas grandes pueden caer por sedimentación gravitacional, un proceso también llamado sedimentación. Los contaminantes del aire pueden interactuar entre sí o con otros productos químicos, partículas y agua por procesos físicos o químicos. Todos estos procesos se explicarán con más detalle a continuación. En la Figura 1 se presenta un resumen de las interacciones relevantes.

Es importante darse cuenta de que los contaminantes del aire pueden tener un impacto en la meteorología misma, al actuar como un gas de efecto invernadero, dispersando o absorbiendo la luz entrante cuando están en forma de aerosol, o estar involucrados en la formación de nubes. Este aspecto no se discutirá aquí.
La meteorología es relevante para todos los aspectos, desde la mezcla y el transporte hasta las velocidades de reacción dependientes de la temperatura o la luz y la absorción de agua. Dependiendo de las tasas de remoción, las especies pueden eliminarse con escalas de tiempo de segundos, como partículas de arena pesada, hasta décadas o más, como gases que contienen halógeno (Cl, Br), y transportarse en rangos de unos pocos metros para cruzar el globo varias veces. Las concentraciones de gases a menudo se expresan en proporciones de mezcla volumétricas (partes por mil millones, ppb) mientras que para la materia particulada la unidad correcta está en (micro) gramos por metro cúbico ya que no hay peso molecular asociado a ella. Para las partículas ultrafinas, las concentraciones se expresan como números de partículas por metro cúbico, para el asbesto, se utiliza el número de fibras por metro cúbico.
Procesos físicos y químicos que determinan las propiedades de los contaminantes del aire
Las propiedades de los contaminantes del aire, como la solubilidad en el agua, las eficiencias de adhesión a la superficie terrestre (agua, vegetación, suelo) y el tamaño de las partículas, son elementos clave que determinan la vida útil y las distancias de transporte. Estas propiedades pueden cambiar debido a la interacción con otros químicos y con la meteorología.
Los principales procesos físicos son:
- Condensación o evaporación con decrecimiento/aumento de la temperatura. Por lo tanto, un aerosol potencialmente tóxico puede estar cubierto por productos químicos semivolátiles como el sulfato de amonio, mientras que un gas puede condensarse en un aerosol y transportarse más como parte de este aerosol. Algunos contaminantes existen al mismo tiempo en aerosol y en fase gaseosa con su partición dependiendo de la temperatura del aire y la humedad relativa.
- Los gases pueden agruparse para formar partículas ultrafinas de unos pocos nanómetros (nucleación) que crecerán a tamaños más grandes.
- Las partículas pueden crecer por coagulación: partículas pequeñas que se mueven rápidamente chocan en partículas grandes de movimiento lento y permanecen unidas a ellas.
- Las partículas pueden absorber agua (higroscopicidad), lo que lleva a un diámetro mayor.
Las conversiones químicas incluyen:
- Reacciones químicas entre contaminantes en fase gaseosa y gas ambiente, que alteran las características de un contaminante del aire o pueden conducir a la formación de contaminantes (por ejemplo, el NO 2 es emitido directamente por la combustión, lo que lleva a la formación de ozono).
- Reacciones químicas entre aerosoles y gases, a menudo involucrando agua adherida al aerosol.
- Las gotas de nube o el agua adherida a los aerosoles tienen su propio papel en la química de la atmósfera, y los gases pueden difundirse en el agua.
- Algunos contaminantes pueden actuar como catalizador.
- Algunos contaminantes del aire pueden ser degradados por la luz (UV) (fotodegradación).
Los contaminantes se caracterizan por su composición química pero para los aerosoles también es relevante la distribución de tamaño de las partículas. Tenga en cuenta que la conservación de los átomos siempre se aplica, pero la distribución del tamaño de partícula y el número de partículas se pueden cambiar por procesos físicos. Esto debe tenerse en cuenta cuando las concentraciones se expresan en partículas por volumen en lugar de concentraciones másicas.
Transporte de contaminantes atmosféricos
Varios procesos determinan la mezcla y transporte de químicos en el aire:
- Difusión por el movimiento de las moléculas, o movimiento browniano de las partículas (caminata aleatoria).
- Difusión turbulenta: la mezcla debido a remolinos turbulentos (a pequeña escala) que tienen una naturaleza aleatoria, pero la fuerza de esta difusión está relacionada con la fricción en el flujo.
- Advección: el proceso de transporte con el flujo a gran escala (velocidad y dirección del viento).
- La mezcla o arrastre de diferentes masas de aire conduce a una mayor mezcla de contaminantes del aire en un volumen mayor. Este proceso es por ejemplo relevante cuando sale el sol, y el aire en la capa límite se calienta, se eleva y se mezcla con el aire en la capa sobre la capa límite.
Aunque los procesos de difusión y transporte son bien conocidos, no es tarea fácil resolver las ecuaciones que describen estos procesos. Para fuentes estacionarias de punto y línea bajo condiciones idealizadas, las descripciones analíticas se pueden derivar en términos de un penacho con perfil de concentración con una distribución gaussiana, pero para descripciones más realistas las ecuaciones deben resolverse numéricamente. Para un flujo complejo alrededor de un edificio, se requiere dinámica de fluidos computacional para una descripción precisa, para el transporte de largo alcance se debe usar un modelo de química-transporte.
Deposición húmeda
La deposición húmeda comprende los procesos de eliminación que involucran agua:
- Eliminación de partículas por o disolución de gases en gotitas de nubes. Estas gotas de nube pueden crecer a un tamaño más grande y llover, eliminando así los contaminantes del aire disueltos de la atmósfera (barrido dentro de la nube).
- Las partículas debajo de las nubes pueden ser capturadas por gotas de lluvia que caen (por debajo de las nubes).
- La deposición oculta ocurre cuando las nubes están en contacto con la superficie (áreas de montaña) y las gotas de nubes que contienen contaminantes del aire se adhieren a la superficie.
La deposición húmeda es un mecanismo de eliminación muy eficiente para ambos pequeños (1 <0.1 µm diameter) and large aerosols (diameter > µm). Los aerosoles higroscópicos pueden crecer en tamaño absorbiendo agua, o encogerse evaporando el agua en condiciones secas. Esto afecta su velocidad de deposición para deposición húmeda o seca.
Deposición en seco
La deposición seca está determinada en parte por las fuerzas gravitacionales sobre una partícula. Las partículas pesadas (≥ 5 µm) caen a la superficie de la Tierra en un proceso llamado sedimentación gravitacional o sedimentación. En la capa más baja de la atmósfera, los contaminantes del aire se pueden acercar lo suficiente a la superficie para pegarse a ella o ser absorbidos. En la capa límite turbulenta, los contaminantes del aire se acercan a la superficie por el movimiento turbulento de la atmósfera, hasta la capa laminar muy delgada (resistencia laminar, solo para gases) a través de la cual se difunden hacia la superficie. Los aerosoles o gases pueden adherirse a la superficie de la Tierra o ser absortos por la vegetación, pero también pueden rebotar. Varias vías tienen lugar en paralelo o en serie, similares a un circuito eléctrico con varias resistencias en paralelo y en serie. Por lo tanto, el enfoque de resistencia se utiliza a menudo para describir estos procesos.
La deposición sobre la nieve o el hielo es generalmente lenta, ya que la atmósfera por encima de ella a menudo se estratifica de manera estable con poca turbulencia (alta resistencia aerodinámica), la superficie sobre la que se deposita es relativamente pequeña (impactadores) y los aerosoles pueden incluso rebotar a una superficie helada (eficiencia de recolección de impactadores) a los que es difícil de adherir. Por otro lado, los bosques suelen mostrar altas velocidades de deposición ya que inducen una turbulencia más fuerte en la atmósfera más baja y tienen una gran superficie foliar que puede absorber gases por los estomas o proporcionar superficies adherentes para los aerosoles. Por lo tanto, las velocidades de deposición dependen del tipo de superficie, pero también de la estación, la estabilidad atmosférica (velocidad del viento, cobertura de nubes) y la capacidad de los estomas para absorber gases. Cuando la atmósfera es muy seca, por ejemplo, las plantas cierran sus estomas y esta vía se cierra temporalmente. Para las partículas, la velocidad de deposición en seco es más baja en tamaños de 0.1-1 µm.
Reemisión
Una vez que los contaminantes del aire se eliminan de la atmósfera, pueden formar parte de los compartimentos de suelo o agua que pueden actuar como reservorio. Esto en general sólo se toma en cuenta para un número limitado de productos químicos. El amoníaco o los contaminantes orgánicos persistentes pueden ser reemitidos del suelo por evaporación. El material polvoriento o los contaminantes adheridos al polvo pueden ser devueltos a la atmósfera por la acción del viento. Esto es relevante para áreas desnudas como tierras agrícolas en invierno, pero también para vehículos de paso que traen el polvo en una carretera por el flujo que inducen.
Modelado del destino atmosférico
Debido a los muchos procesos e interacciones relevantes, el destino de los contaminantes químicos en el aire tiene que ser determinado mediante modelos que cubran los procesos más importantes. Qué procesos deben cubrirse depende del estudio de caso: una buena descripción de una pluma de material tóxico durante un accidente, donde altas concentraciones, gradientes fuertes y escalas de tiempo cortas son importantes, requiere un enfoque diferente al de la pequeña liberación crónica de una fábrica. Dado que requeriría simulaciones numéricas demasiado pesadas para incluir todos los aspectos, hay que seleccionar los procesos relevantes a incluir. Los insumos clave para todos los modelos de transporte son las tasas de emisión y los insumos meteorológicos.
Cuando uno está interesado en concentraciones cercanas a una fuente específica, junto a la tasa de emisión es importante la altura efectiva de emisión, y los procesos que determinan la dispersión: velocidad del viento, estabilidad atmosférica. Las velocidades de reacción química y las velocidades de deposición deben incluirse cuando el horizonte temporal es largo o cuando las reacciones son rápidas o las velocidades de deposición son altas.
Cuando uno está interesado en concentraciones reales resultantes de liberaciones de múltiples fuentes y especies en una gran área de interés, como para un pronóstico de calidad del aire, los procesos de advección, deposición y conversiones químicas se vuelven más relevantes, y la meteorología de entrada necesita ser conocida en el área. Sin embargo, los gradientes agudos cercanos a las fuentes individuales ya no se resuelven. En particular, la lluvia puede ser un mecanismo de eliminación muy eficiente, eliminando la mayor parte del aerosol en una hora. La deposición en seco es más lenta, pero resulta en una vida útil de menos de una semana y distancias de transporte de menos de 1,000 km para la mayoría de los aerosoles. Para algunos compuestos gaseosos como los halógenos y la deposición de N 2 O apenas juega un papel y son químicamente inertes en la troposfera, lo que lleva a vidas muy largas.
Para evaluar el destino general a largo plazo de un nuevo químico que se lanzará al mercado, se tienen que determinar las concentraciones potenciales en el aire, el agua y el suelo. Idealmente, los modelos para aire, suelo y agua se utilizan juntos de manera consistente, incluyendo su interacción Para muchos contaminantes del aire, la vida útil atmosférica es corta pero determina dónde y en qué forma se depositan en las superficies del suelo y del agua, donde pueden acumularse. Esto significa que aunque una concentración en el aire sea relativamente baja a cierta distancia de una fuente, la deposición de un contaminante del aire a lo largo de un año aún puede ser significativa. La Figura 2 muestra un ejemplo de concentraciones modelizadas medias anuales y deposición total anual de un hipotético trazador pasivo (no reactivo) similar al holín que se libera a 1 kg/hora en un sitio ficticio en los Países Bajos. Las concentraciones medias anuales son pequeñas en comparación con las concentraciones ambientales de materia particulada, pero la huella de la deposición acumulada es mayor que la de la concentración media, ya que la superficie actúa como reservorio. Esto implica que la reemisión al aire puede ser relevante. Pueden pasar varios años para el suelo o el agua antes de que se alcance una concentración de equilibrio en estos compartimentos a partir de la entrada de deposición, ya que se aplican diferentes procesos y escalas de tiempo. Las cadenas montañosas son visibles en la deposición húmeda acumulada (Alpes, Pirineos), ya que son áreas con precipitaciones mejoradas.
Además del modelado espacialmente explícito, también existen modelos de caja que tienen la ventaja de que pueden hacer cálculos a largo plazo para una liberación continua de una especie, incluyendo la interacción entre los compartimentos aire, suelo y agua. Se pueden utilizar para determinar cuándo se alcanza una concentración de equilibrio dentro de un compartimento, pero estos modelos no pueden resolver gradientes de concentración horizontales dentro de un compartimento.
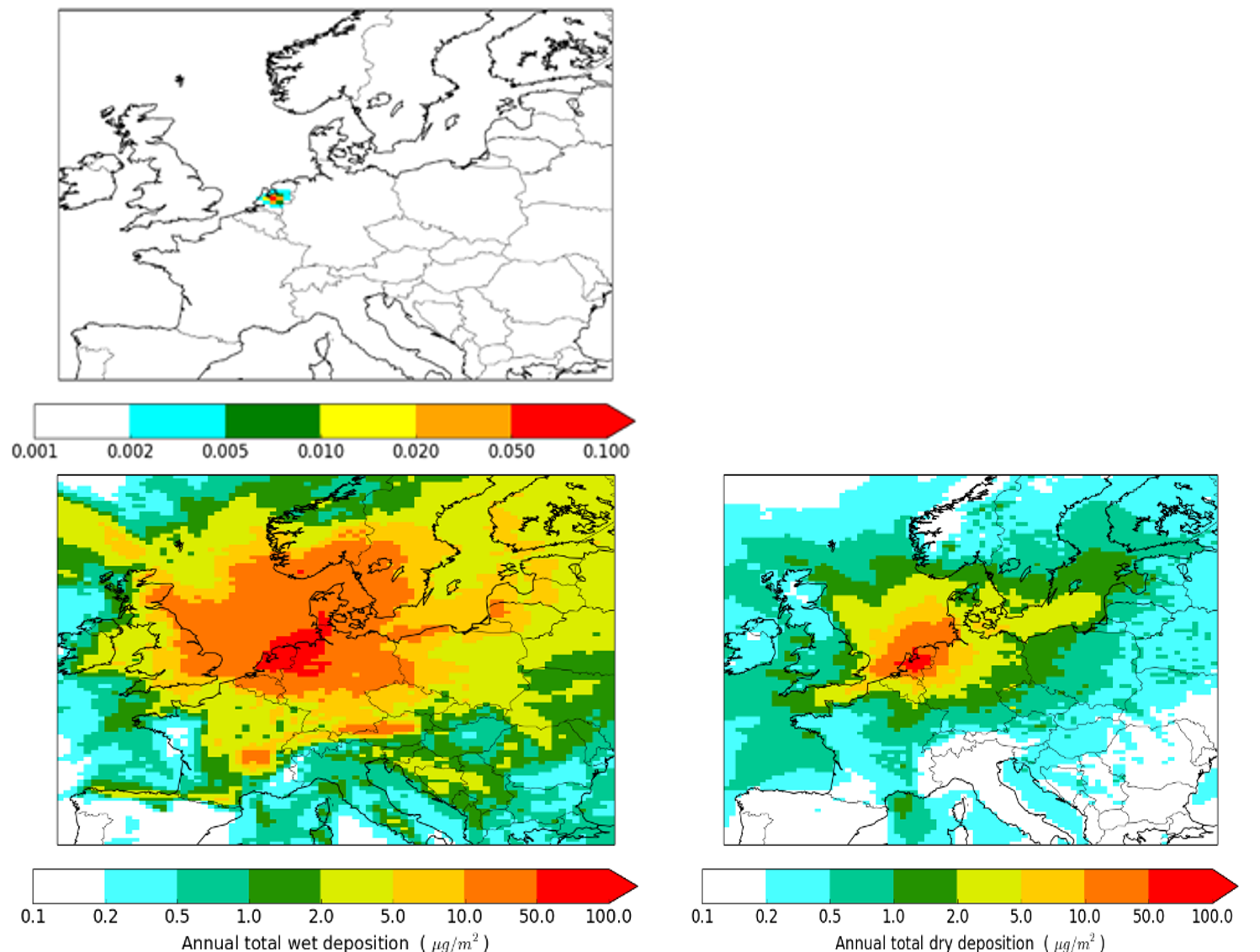
F igure 2. Liberación constante de un trazador pasivo de una fuente puntual en los Países Bajos. El panel superior muestra la concentración media anual, el panel inferior muestra la deposición húmeda y seca acumulada durante un año. Tenga en cuenta la escala de colores no lineal para cubrir el amplio rango de valores. Fuente: https://doi.org/10.3390/atmos8050084.
Conozca más
Legislación sobre calidad del aire, política y calidad del aire de la UE: http://ec.europa.eu/environment/air/index_en.htm
Contaminantes peligrosos del aire de Estados Unidos, incluyendo listas de tóxicos: https://www.epa.gov/haps
Enfoque de dispersión de penacho: http://courses.washington.edu/cewa567/Plumes.PDF
Modelos químico-transporte: www.narsto.org/sites/narsto-dev.ornl.gov/files/ch71.3mb.pdf
Seinfeld, J., Pandis, S.N. Química y Física Atmosféricas, de la contaminación del aire al cambio climático, Wiley, 2016, abarcando todos los aspectos.
John, A. C., Küpper, M., Manders-Groot, A. M., Debray, B., Lacome, J. M., Kuhlbusch, T. A. (2017). Emisiones y posible implicación ambiental de nanomateriales de ingeniería (ENM) en la atmósfera. Atmósfera, 8 (5), 84.
¿Qué procesos determinan la concentración de un contaminante en el aire muy cerca de su punto de emisión?
Cuando se liberan partículas finas (<1µm de diámetro) en los 100 m más bajos de la atmósfera, ¿hasta dónde serán transportadas? ¿Y qué procesos contribuyen a la eliminación de las partículas del aire?
Cuando se liberan gases en los 100 m más bajos de la atmósfera, ¿hasta dónde llegan?
3.1.3. Hidrosfera
Autores: John Parsons
Revisores: Steven Droge, Sean Comber
Objetivos de Inclinación:
Deberías ser capaz de:
- describir los componentes químicos más importantes y sus fuentes
- describir los procesos químicos más importantes en agua dulce y marina.
- estar familiarizado con los procesos que regulan el pH de las aguas superficiales.
Palabras clave: enlaces de hidrógeno, carbonatos, sales disueltas
Las propiedades e importancia del agua
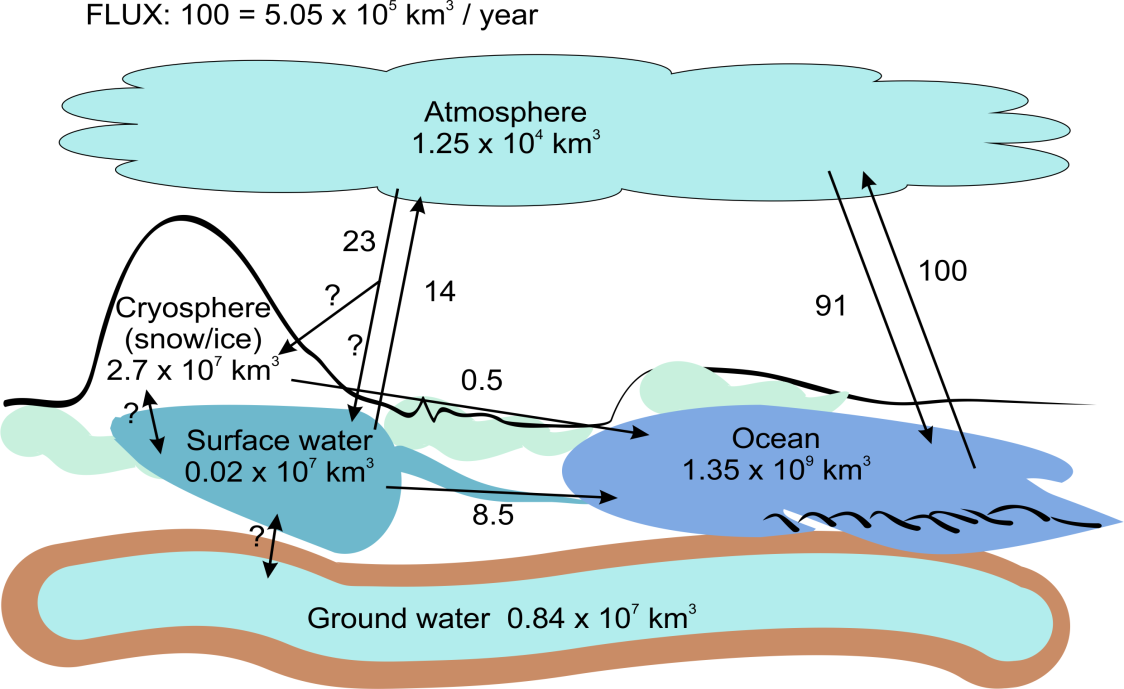
El agua cubre el 71% de la superficie terrestre y esta agua, junto con las menores cantidades presentes como gas en la atmósfera, como agua subterránea y como hielo se conoce colectivamente como la hidrosfera. El grueso de esta agua es agua salada en los océanos y mares con solo una pequeña parte del agua dulce estando presente como lagos y ríos (Figura 1).
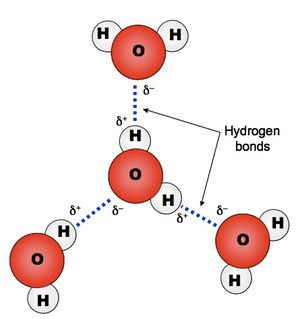
El agua es esencial para la vida y también juega un papel clave en muchos otros procesos químicos y físicos, como la meteorización de minerales y la formación del suelo y en la regulación del clima de la Tierra. Estos importantes papeles del agua derivan de su estructura como una molécula pequeña pero muy polar que surge de los enlaces polarizados hidrógeno-oxígeno (Figura 2). Como consecuencia, las moléculas de agua son fuertemente atraídas por los enlaces de hidrógeno, lo que le da puntos de fusión y ebullición relativamente altos, capacidad calorífica, tensión superficial, etc. La polaridad de la molécula de agua también hace que el agua sea un excelente solvente para una amplia variedad de químicos iónicos y polares pero un solvente pobre para grandes moléculas no polares.
El ambiente de agua dulce
Como se mencionó anteriormente, el agua dulce es sólo una proporción muy pequeña de la cantidad total de agua en el planeta y la mayor parte de esta está presente como hielo. Dado que esta agua está en contacto con la atmósfera y los suelos y lecho rocoso de la corteza terrestre, disuelve tanto los gases atmosféricos como el oxígeno y el dióxido de carbono y las sales y productos químicos orgánicos de la corteza. Si comparamos las composiciones relativas de cationes en la corteza terrestre y las principales especies disueltas (Cuadro 1) es claro que estas son muy diferentes. Esta diferencia refleja la importancia de la solubilidad de estos componentes. Para los químicos iónicos, esto depende tanto de su carga como de su tamaño (expresado como z/r 2, donde z es la carga y r el radio de un ion). Además de reflejar las propiedades de la corteza local, la composición de las sales también está influenciada por la precipitación y evaporación y la deposición de sal marina en las regiones costeras.
Cuadro 1. Comparación de la composición catiónica principal de la corteza continental superior promedio y el agua promedio del río. (*excepto aluminio y hierro de Broecker y Peng (1982))
|
Corteza continental superior (mg/kg) (Wedepohl 1995*) |
Agua de río (mg/kg) |
|
|
Al |
77.4 |
0.05 |
|
Fe |
30.9 |
0.04 |
|
Ca |
29.4 |
13.4 |
|
Na |
25.7 |
5.2 |
|
K |
28.6 |
1.3 |
|
Mg |
13.5 |
3.4 |
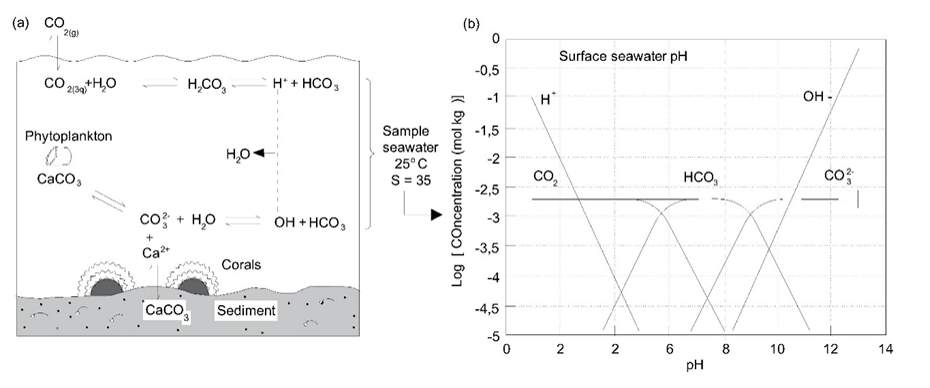
El pH de las aguas superficiales está determinado tanto por la disolución de los minerales carbonatados como del dióxido de carbono de la atmósfera. Estos componentes forman parte del conjunto de reacciones de equilibrio conocidas como sistema de carbonato (Figura 3).
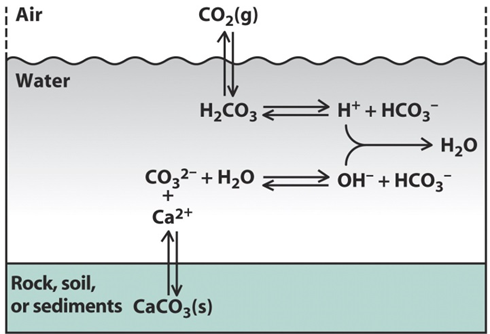
En equilibrio con la concentración atmosférica actual de CO 2 y el carbonato de calcio sólido, el pH de las aguas superficiales está entre 7 y 9 pero esto puede alcanzar valores más ácidos donde los suelos son pobres en carbonato de calcio (piedra caliza). Esto se ilustra por los valores de pH medidos en un río en el norte de Inglaterra, donde el agua ácida rica en carbono orgánico en la fuente se neutraliza gradualmente una vez que el río se encuentra con roca rocosa rica en piedra caliza (Figura 4).
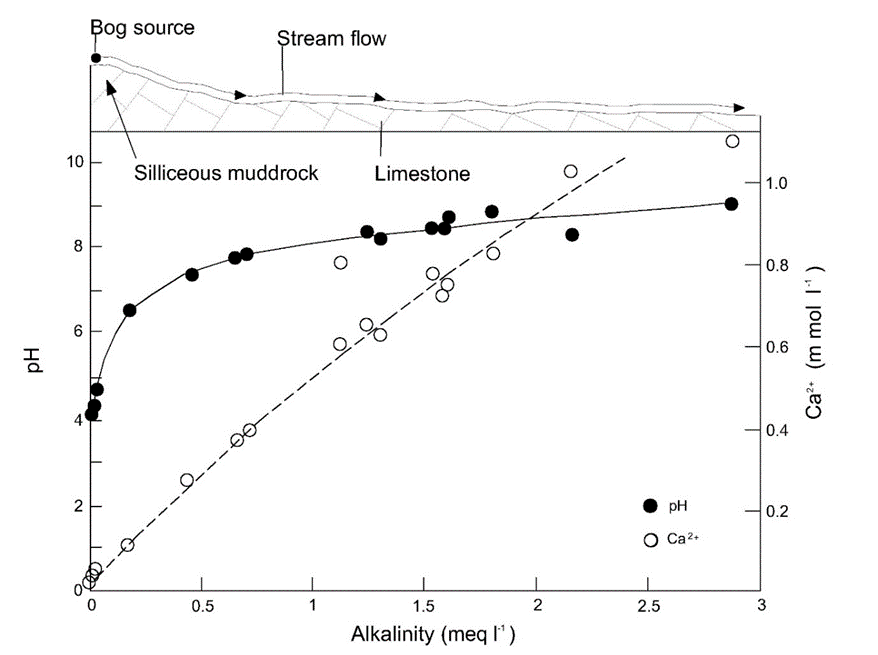
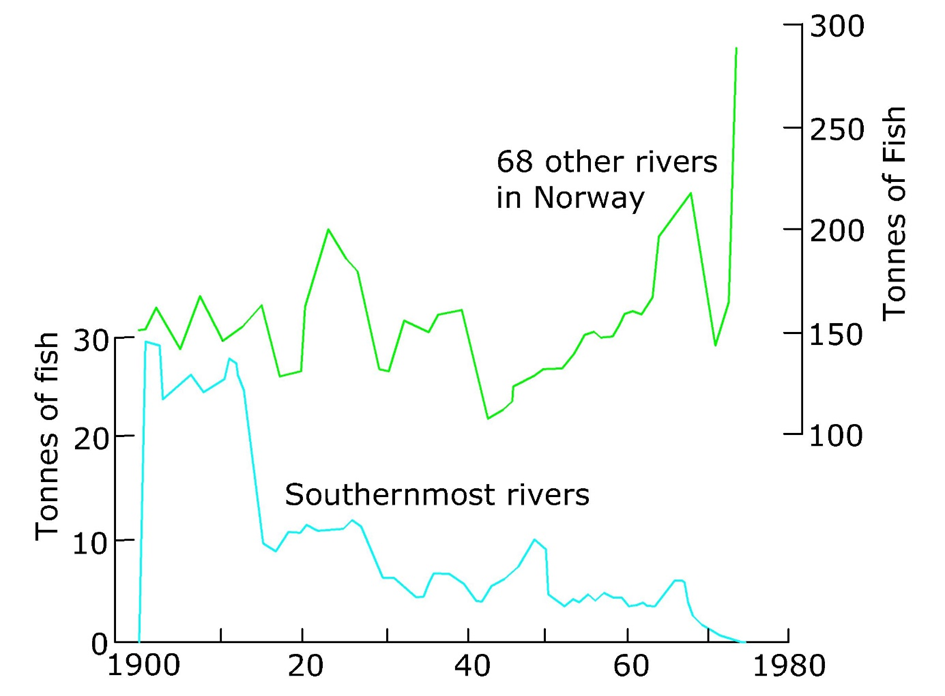
Además de estos procesos naturales, existen influencias humanas en el pH de las aguas superficiales, incluyendo la precipitación ácida resultante de la combustión de combustibles fósiles y los efluentes ácidos de las actividades mineras causadas por la oxidación y disolución de sulfuros minerales. Regiones como el sur de Escandinavia con suelos pobres en carbonato son particularmente vulnerables a la acidificación debido a estas influencias y esto se refleja, por ejemplo, en la reducción de las poblaciones de peces en estas regiones vulnerables (ver Figura 5). Más recientemente, la reducción de la quema de carbón y la disminución de la industria pesada está dando como resultado la recuperación de los valores de pH en las zonas altas de Europa.
El oxígeno disuelto es, por supuesto, esencial para la vida acuática y las concentraciones son en general adecuadas en cuerpos de agua bien mezclados. El oxígeno puede llegar a ser limitante en lagos profundos donde la estratificación térmica restringe el transporte de oxígeno a capas más profundas, o en cuerpos de agua con altas tasas de descomposición de materia orgánica. Esto puede resultar en condiciones anóxicas con impactos ecológicos significativos y en el comportamiento de los contaminantes químicos.
El medio marino
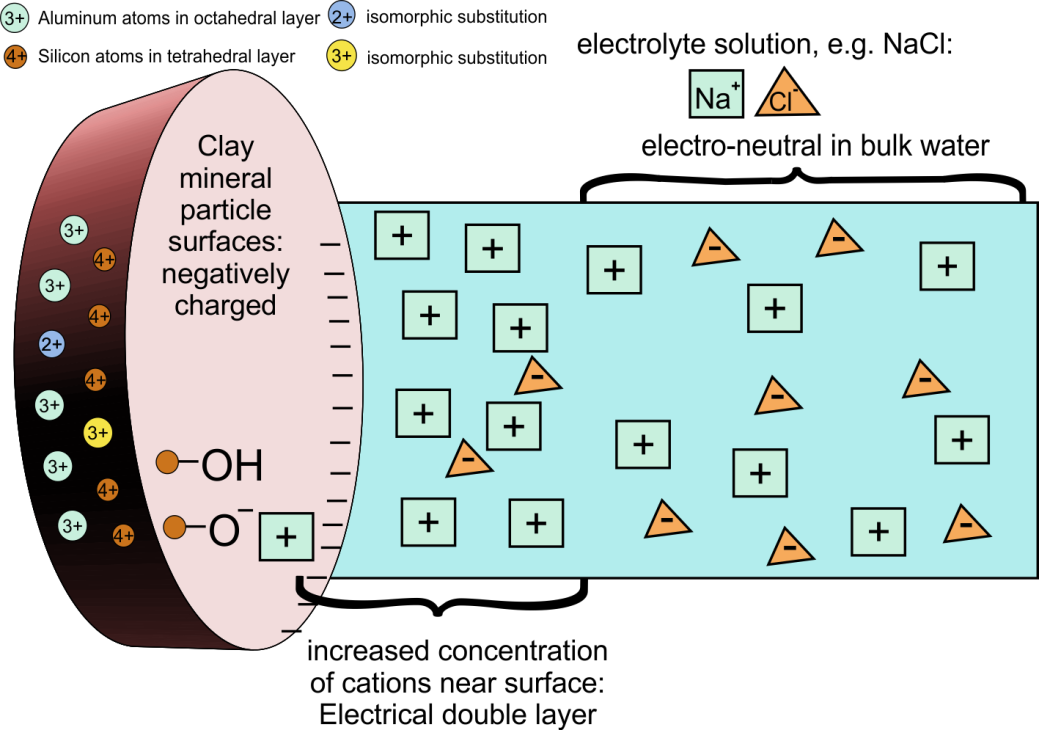
El agua dulce finalmente se traslada a mares y océanos donde las concentraciones de especies disueltas son mucho más altas que en el ambiente de agua dulce. Esto se debe en parte a los efectos de la evaporación del agua de los océanos pero también se debe a fuentes marinas específicas de algunos componentes disueltos. Los estuarios son las zonas de transición donde se mezclan agua dulce y agua de mar. Se trata de ambientes altamente productivos donde el aumento de la salinidad tiene un impacto importante en el comportamiento de muchos químicos, por ejemplo en la especiación de metales y la agregación de coloides como resultado de cationes que protegen el cambio negativo de la superficie de las partículas coloidales (Figura 6). El aumento de la salinidad también afecta a los químicos orgánicos, con químicos iónicos formando pares de iones, e incluso reduciendo la solubilidad de los compuestos orgánicos neutros (el llamado efecto de salinidad). Además de estos efectos químicos debido al aumento de la salinidad, la disminución de los caudales en los estuarios conduce a la deposición de partículas suspendidas.
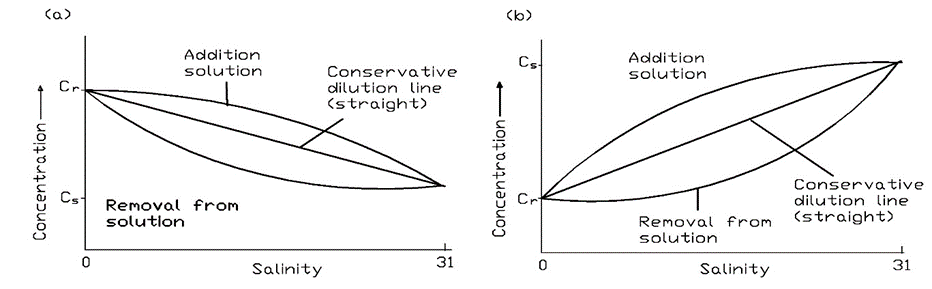
Dado que las concentraciones de contaminantes son en general menores en el medio marino que en el ambiente de agua dulce, las concentraciones en los estuarios disminuyen a medida que el agua dulce se diluye con agua de mar. Medir la salinidad en diferentes lugares de los estuarios es una manera conveniente de determinar la extensión de esta dilución. Los componentes que están presentes en mayores concentraciones en el agua de mar, por supuesto, mostrarán un incremento con la salinidad a menos que. Trazar la salinidad frente a las concentraciones de sustancias químicas en diferentes ubicaciones puede proporcionar información sobre si se comportan de manera conservadora (es decir, solo se someten a mezcla) o se eliminan mediante procesos como la degradación o la partición en la atmósfera o sedimentos. En la Figura 7 se muestran ejemplos de parcelas esperadas para químicos conservadores y aquellos que se eliminan en el estuario o tienen fuentes locales allí. Los modelos que describen el comportamiento de los químicos en estuarios se pueden utilizar con estos datos para derivar las tasas de eliminación o adición del químico en el sistema.
El océano abierto está suficientemente mezclado para que la composición de los principales constituyentes disueltos sea bastante constante, excepto en situaciones locales como resultado de la surgencia de aguas profundas ricas en nutrientes o la absorción biológica de nutrientes. En las regiones costeras las concentraciones de químicos y otros componentes originarios de fuentes terrestres también pueden ser localmente mayores. Los componentes principales en el agua de mar se enumeran en el Cuadro 2 con sus concentraciones típicas.
Cuadro 2. Mayor composición iónica de agua dulce y agua de mar.
|
Agua de mar (mmol/L) (Broecker y Peng, 1982) |
Agua de río (mmol/L) |
|
|
Na + |
470 |
0.23 |
|
Mg 2+ |
53 |
0.14 |
|
K + |
10 |
0.03 |
|
Ca 2 + |
10 |
0.33 |
|
HCO 3 - |
2 |
0.85 |
|
SO 4 2 - |
28 |
0.09 |
|
Cl - |
550 |
0.16 |
|
Si |
0.1 |
0.16 |
Estas concentraciones pueden ser mayores en cuerpos de agua que están parcial o totalmente aislados de los océanos y son impactados por pérdidas evaporativas de agua (por ejemplo, Mediterráneo, Báltico, Mar Negro). En casos extremos, las concentraciones de sales pueden exceder su producto de solubilidad, dando como resultado la precipitación de sales en depósitos evaporados.
Como es el caso en el agua dulce, los carbonatos juegan un papel importante en la regulación del pH del océano. El hecho de que los océanos estén sobresaturados en carbonato de calcio hace posible que una variedad de organismos tengan conchas de carbonato de calcio y otras estructuras. Los importantes procesos y equilibrios involucrados se ilustran en la Figura 8. Existe la preocupación de que uno de los efectos más importantes del aumento del dióxido de carbono atmosférico sea la disminución del pH del océano a valores que deriven en la desestabilización de estas estructuras carbonatadas.
Referencias
Andrews, J.E., Brimblecombe, P., Jicketts, T.D., Liss, P.S., Reid, B.J. (2004). Una introducción a la química ambiental, Blackwell Publishers, ISBN 0-632-05905-2.
Baird, C., Cann, M. (2012). Química Ambiental, Quinta Edición, W.H. Freeman and Company, ISBN 978-1429277044.
Berner, E.K., Berner, R.A. (1987). Ciclo global del agua: geoquímica y medio ambiente, Prentice-Hall.
Broecker, W.S., Peng, T.S. (1982). Trazadores en el mar, Lamont-Doherty Geol. Obs. Publ.
Henriksen, A., Lien, L., Rosseland, B.O., Traaen, T.S., Sevaldrud, I.S. (1989). Acidificación del lago en Noruega: estado actual y previsto de los peces. Ambio 18, 314-321
Wedepohl, K.H. (1995). La composición de la corteza continental, Geochimica Cosmochimica Acta 59, 1217-1232.
Las concentraciones de sales disueltas en ríos y lagos se determinan mediante tres procesos. Describir estos procesos y la composición característica de cuerpos de agua donde uno de estos procesos es dominante.
Además de los efectos bien conocidos sobre el clima global, también se espera que el aumento del CO 2 atmosférico tenga un impacto en el pH de los océanos. ¿Qué procesos son los encargados de determinar el pH de los océanos?
¿Cómo podría afectar estos procesos el aumento de CO 2 atmosférico?
¿Qué efectos podría tener el aumento de la acidez de los océanos en los organismos marinos?
3.1.4. Sedimento
En preparación
3.1.5. Suelo
Autor: Kees van Gestel
Revisores: John Parsons, Jose Alvarez Rogel
Objetivos de aprendizaje
Deberías ser capaz de
- describir los principales componentes de los cuales consisten los suelos
- describir cómo la composición del suelo influye en las propiedades que pueden afectar el destino de los productos químicos en el suelo
Palabras clave:
Distribución del tamaño de partícula, Porosidad, Minerales, Materia orgánica, Capacidad de intercambio catiónico, Capacidad de retención de agua
Introducción
El suelo es la capa superior del ambiente terrestre que sirve como hábitat para los organismos y medio para el crecimiento de las plantas. Además, también juega un papel importante en el almacenamiento y purificación del agua y ayuda a regular la atmósfera terrestre (por ejemplo, almacenamiento de carbono, flujos de gas,...).
Los suelos están compuestos por tres fases (Figura 1).
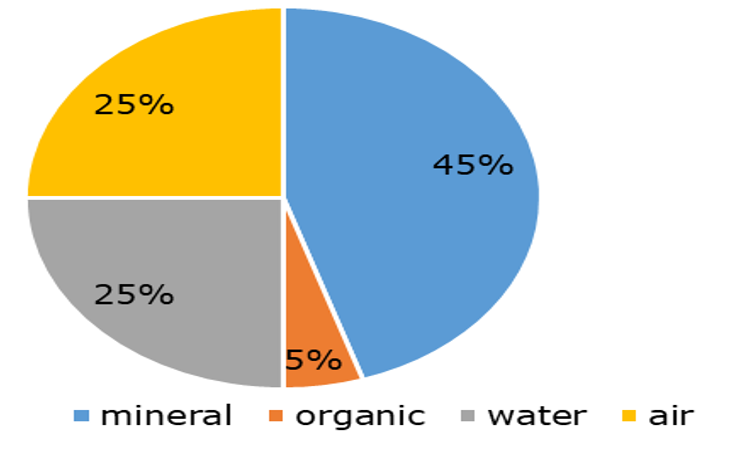
La fase sólida está formada por componentes minerales y orgánicos. Los componentes minerales aparecen en diferentes tamaños de partícula de partículas gruesas (arena), intermedias (limo) y finas (arcilla), cuya combinación determina la textura del suelo. Las partículas se pueden disponer para formar agregados porosos; los poros del suelo se llenan con aire y/o agua. La proporción de aire en los suelos depende del contenido de humedad del suelo. La composición de la fase sólida del suelo puede ser bastante variable.
La fase gaseosa tiene una composición similar a la del aire, pero debido a la respiración de las raíces de las plantas y a la actividad metabólica de los microorganismos del suelo, el contenido de O 2 generalmente es menor y el contenido de CO 2 es mayor. El intercambio de gases entre los poros del suelo y el aire atmosférico se realiza por difusión. La difusión avanza más rápido en suelo seco y mucho más lenta cuando los poros del suelo se llenan de agua.
La fase líquida del suelo, la solución del suelo o agua porosa, es una solución acuosa que contiene iones (principalmente Na +, K +, Ca 2 +, Cl -, NO 3 -, SO 4 2 -, HCO 3 -) de la disolución de una variedad de sales, y también contiene carbono orgánico disuelto (DOC, también denominado materia orgánica disuelta, DOM). La solución del suelo forma parte del ciclo hidrológico, que implica el ingreso de entre otros lluvia y riego, y la salida por absorción de agua por las plantas, evaporación y drenaje a las aguas subterráneas y superficiales. La solución del suelo actúa como portador para el transporte de químicos en el suelo, tanto para plantar raíces, microorganismos del suelo y animales del suelo como para aguas subterráneas y superficiales.
Sólidos del suelo
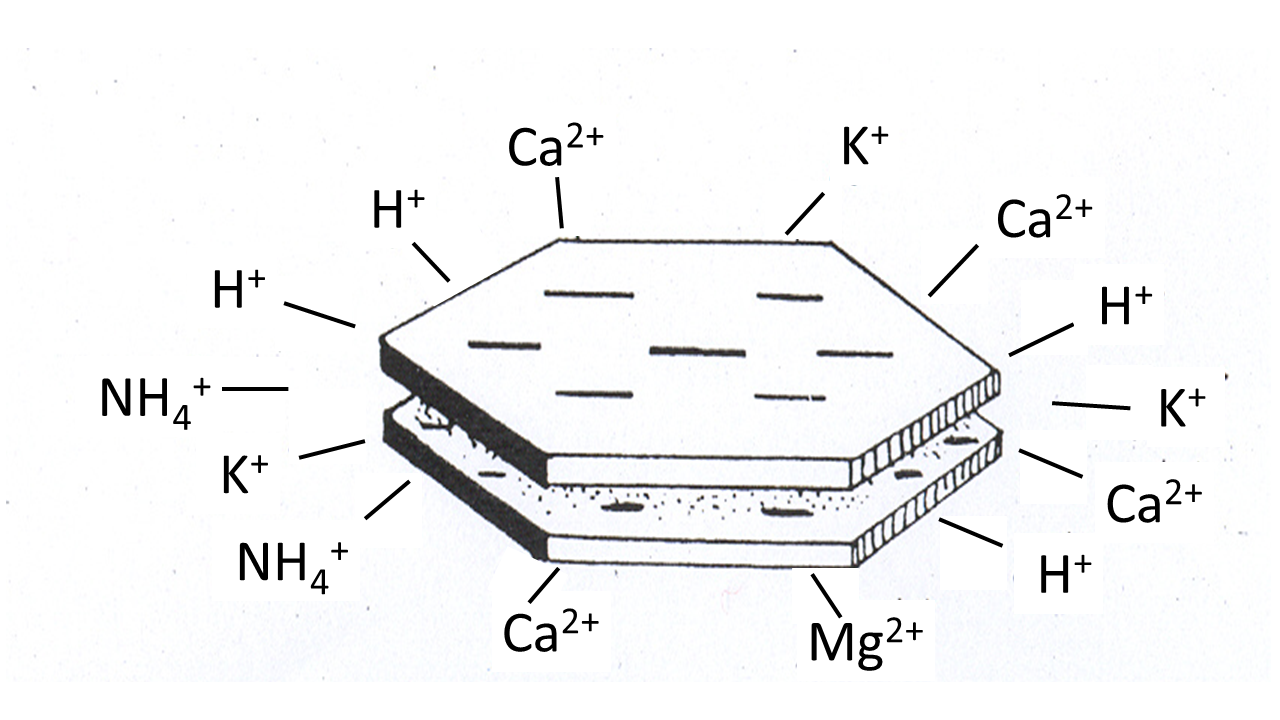
La fase sólida del suelo consiste en partículas minerales y orgánicas del suelo. Según su tamaño, las partículas minerales se dividen en arena (63-2000 µm), limo (2- 63 µm) y arcilla (<2 µm). Al aumentar el tamaño de partícula, la superficie específica disminuye, el tamaño de poro aumenta y la capacidad de retención de agua disminuye. La fracción de arena consiste principalmente en cuarzo (SiO 2) y no tiene ninguna propiedad de sorción debido a que los cristales de cuarzo son eléctricamente neutros. Los suelos arenosos tienen poros grandes, por lo que una baja capacidad para retener el agua. En suelos con una alta fracción de limo, los poros más pequeños están mejor representados, lo que da a estos suelos una mayor capacidad de retención de agua. Además, la fracción de limo no tiene propiedades adsorbentes. Las arcillas son silicatos de aluminio, celosías compuestas por tetraedros SiO 4 y octaedros de Al (OH) 6. Tras la formación de partículas de arcilla, se produjo una sustitución isomórfica, proceso en el que Si 4 + fue reemplazado por Al 3 +, y Al 3 + por Mg 2 +. Aunque tienen diámetros similares, estos elementos tienen diferentes valencias. Como consecuencia, las partículas de arcilla tienen una carga negativa, haciendo que los iones positivos se acumulen en su superficie. Esto incluye iones importantes para el crecimiento de las plantas, como NH 4 +, K +, Na + y Mg 2 +, pero también metales catiónicos (Figura 2). Muchos otros minerales tienen cargas dependientes del pH (positivas o negativas) que también son importantes en la unión de cationes y aniones.
Además de las partículas minerales, los suelos también contienen materia orgánica, que incluye todos los restos de plantas y animales muertos y sus productos de degradación. La biota viva no está incluida en la fracción de materia orgánica del suelo. La materia orgánica suele dividirse en: 1. humina, materia orgánica no disuelta asociada a partículas de arcilla y limo, 2. ácidos húmicos que tienen un alto grado de polimerización, y 3. ácidos fúlvicos que contienen más grupos ácidos fenólicos y carboxílicos. Los ácidos húmico y fúlvico son solubles en agua pero su solubilidad depende del pH. Por ejemplo, los ácidos húmicos son solubles a pH alcalino pero no a pH ácido. La disociación de los grupos fenólico y carboxílico le da a la materia orgánica también una carga negativa (Figura 3), cuya densidad aumenta al aumentar el pH del suelo. La materia orgánica del suelo actúa como reservorio de nitrógeno y otros elementos, proporciona sitio de adsorción para cationes y químicos orgánicos, y apoya la construcción de agregados de suelo y el desarrollo de la estructura del suelo.
La unión de cationes a los sitios cargados negativamente en las partículas del suelo es un proceso de intercambio. El grado de acumulación de cationes cerca de las partículas del suelo depende de su densidad de carga, la afinidad de los cationes a las superficies cargadas (que es mayor para los cationes bivalentes que para los monovalentes), la concentración de iones en solución (cuanto mayor sea la concentración de un catión en solución, mayor atracción a partículas de suelo), etc. Debido a su unión a partículas de suelo cargadas, los cationes están menos disponibles para la lixiviación y para la absorción por los organismos. La Capacidad de Intercambio Catiónico (CEC) se utiliza comúnmente como medida del número de sitios disponibles para la sorción de cationes. La CEC generalmente se expresa como cmol c/kg de suelo seco. Los suelos con CEC más altos tienen una mayor capacidad de unión a cationes, por lo que los metales catiónicos muestran una menor (bio) disponibilidad en suelos altos de CEC (ver la Sección sobre especiación metálica). La CEC depende del contenido y tipo de minerales arcillosos, teniendo la montmorillonita un CEC mayor que, por ejemplo, la caolinita, el contenido de materia orgánica y el pH del suelo. Además de la arcilla y la materia orgánica, también los óxidos e hidróxidos de aluminio y hierro pueden contribuir a la unión de cationes al suelo.
Agua del suelo
El transporte de agua a través de los poros del suelo se controla por gravedad y por gradientes de succión que son el resultado de la retención de agua por procesos capilares y osmóticos. La unión capilar del agua es más fuerte en los poros más pequeños, lo que explica por qué los suelos arcillosos tienen mayores capacidades de retención de agua que los suelos arenosos La unión osmótica del agua aumenta con el aumento de la fuerza iónica, y es especialmente alta cerca de las partículas cargadas del suelo como la arcilla y la materia orgánica donde los iones tienden a acumularse.
Cuanto más fuerte es el agua retenida por el suelo, menor es su disponibilidad para las plantas y otros organismos. La fuerza por la que se retiene el agua depende del contenido de humedad, debido a que 1. al disminuir el contenido de humedad la fuerza iónica de la solución del suelo y por lo tanto la unión osmótica aumenta, 2. cuando el contenido de humedad del suelo disminuye los poros más grandes del suelo se vaciarán primero, conduciendo a un aumento capilar retención del agua restante en poros más pequeños. Las curvas de retención de agua describen la resistencia con la que se retiene el agua en función del contenido total de agua y en dependencia de la composición del suelo. La Figura 4 muestra curvas de pF para tres tipos de suelo diferentes.
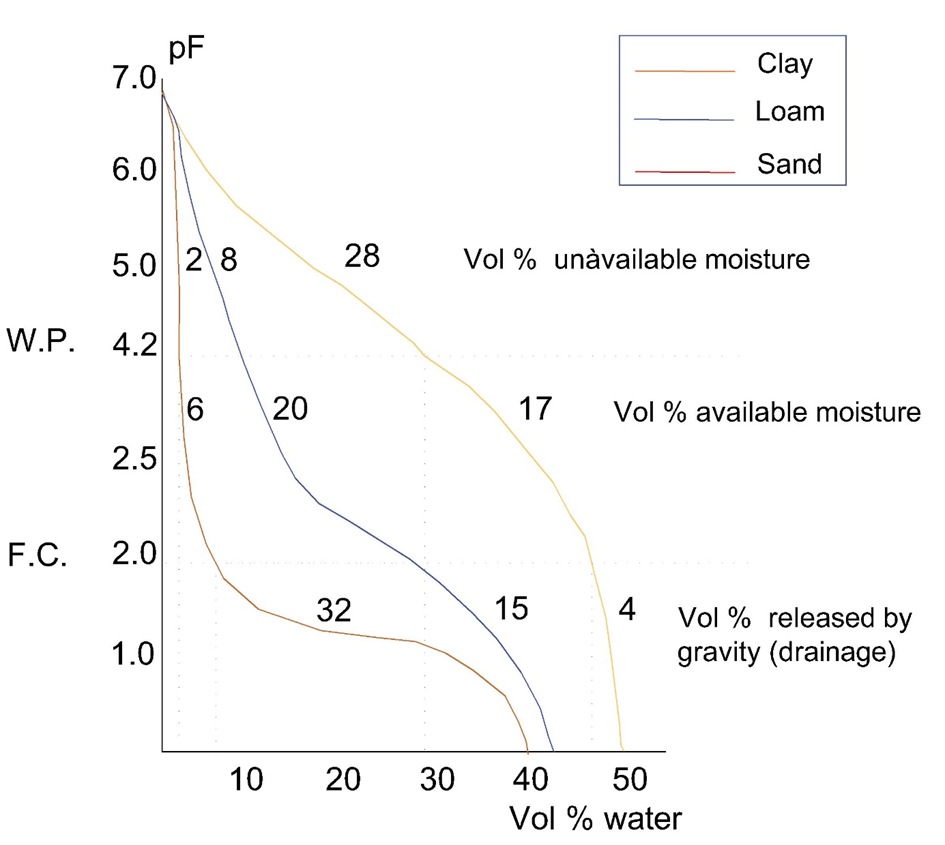
Un valor de pF de 2.2-2.5 corresponde con una fuerza de unión de 200 a 300 hPa. Esto se llama capacidad de campo; el agua está fácilmente disponible para la absorción de la planta. A pF 4.2 (15,000 hPa), el agua está fuertemente ligada al suelo y ya no está disponible para la absorción de la planta; esto se llama punto de marchitamiento. Para los organismos del suelo, no es importante el contenido total de agua de un suelo sino el contenido de agua disponible. Las curvas de retención de agua pueden ser importantes para describir la disponibilidad de agua en el suelo. Las pruebas de toxicidad con organismos del suelo se realizan típicamente al 40-60% de la capacidad de retención de agua (WHC) del suelo, lo que corresponde con la capacidad de campo.
Referencias/lectura adicional
Schulten, H.-R., Schnitzer, M. (1997). Estructura de modelo químico para materia orgánica del suelo y suelos. Ciencia del Suelo 162, 115-130.
Blume, H.-P., Brümmer, G.W., Fleige, H., Horn, R., Kandeler, E., Kögel-Knabner, I., Kretzschmar, R., Stahr, K., Wilke, B.-M. (2016). Scheffer/Schachtschabel Ciencia del suelo, Springer, ISBN 978-3-642-30941-0
¿Cuáles son los principales componentes de la fase sólida de un suelo?
Al considerar dos suelos diferentes, uno arenoso y otro arcilloso, ¿cuál tiene el mayor volumen de agua disponible cuando ambos suelos tienen el mismo contenido total de agua? Explique su respuesta.
¿Cuál es la importancia agrícola y ambiental de la capacidad de intercambio catiónico de los suelos?
Explicar el papel de los minerales arcillosos y la materia orgánica en la retención de metales catiónicos en los suelos.
¿Cuáles dos factores explican el hecho de que la disponibilidad de metales catiónicos aumenta con la disminución del pH del suelo?
3.1.6. Agua subterránea
(borrador)
Autor: Thilo Behrends
Revisor: Steven Droge, John Parsons
Objetivos de Inclinación:
Deberías ser capaz de:
- comprender la importancia de las reacciones redox para el destino de compuestos potencialmente tóxicos en aguas subterráneas y acuíferos.
- aplicar la ecuación de Nernst para evaluar la factibilidad de las reacciones redox.
Palabras clave: Acuífero, ecuación de Nernst, transferencia de electrones, potencial redox, medias reacciones
Introducción
Algunas definiciones conciben toda el agua debajo de la superficie terrestre como agua subterránea, mientras que otras restringen la definición al agua en la zona saturada. En la zona saturada los poros están completamente llenos de agua en contraste con la zona subsaturada en la que algunos poros se llenan de gas y la acción capilar son importantes para mover el agua. Las formaciones geológicas, que albergan aguas subterráneas en la zona saturada, pueden clasificarse como 'acuíferos', 'acuíferos' o 'acuíferos' dependiendo de su permeabilidad. En contraste con el acuitardo y el acuífero, que tienen una baja permeabilidad, un acuífero permite que el agua se mueva en tasas significativas en condiciones de campo ordinarias. Los acuíferos suelen tener una alta porosidad y los poros están bien conectados entre sí. Ejemplos de acuíferos incluyen capas sedimentarias de arena o grava, rocas carbonatadas, areniscas, rocas volcánicas y rocas ígneas fracturadas. La química redox discutida en este capítulo se centra en los acuíferos en formaciones sedimentarias.
Las aguas subterráneas son una fuente importante de agua potable y la calidad de las aguas subterráneas es, por lo tanto, de gran importancia para proteger la salud humana. Sin embargo, los acuíferos también representan un hábitat para bacterias e invertebrados acuáticos y, por lo tanto, también son objeto de estudios ecotoxicológicos. Además, el agua subterránea puede actuar como una vía de transporte que conecta diferentes compartimentos ambientales, por ejemplo, suelos con ríos u océanos. Por lo tanto, el agua subterránea juega un papel en la distribución de contaminantes en el ambiente.
Transporte de contaminantes en acuíferos
El movimiento de una sustancia química en el agua subterránea se controla mediante tres procesos: advección, dispersión y reacción. La advección es el transporte de un químico en forma disuelta junto con el flujo de agua subterránea. Cuando un químico se libera de una fuente puntual al agua subterránea con una dirección de flujo constante, se forma una pluma aguas abajo de la fuente. La dispersión de la sustancia química se debe a la dispersión. Hay dos razones para esta propagación: Primero, la difusión molecular provoca el transporte del químico independientemente de la advección; Segundo, las diferencias en las velocidades del agua subterránea a diferentes escalas provocan la mezcla del agua subterránea (dispersión mecánica) en la dirección del flujo del agua subterránea pero también perpendicular a ello. Varios procesos pueden retardar el transporte de productos químicos o pueden provocar su eliminación del sistema (por ejemplo, degradación). Para la movilidad de un químico, la distribución entre la fase sólida inmóvil y la fase líquida móvil es de importancia clave en las aguas subterráneas (ver capítulo 3.4). Existen varios procesos que pueden conducir a la degradación de un compuesto en los acuíferos. La actividad microbiana puede contribuir a la degradación de los productos químicos, pero también las reacciones abióticas pueden ser de importancia. Para algunos químicos, las reacciones redox son relevantes las cuales se discuten en la siguiente sección.
Reacciones redox en acuíferos
Muchos elementos son sensibles a la redox bajo condiciones ambientales. Esto significa que ocurren naturalmente en diferentes 'estados redox. Por ejemplo, la oxidación o reducción del carbono juega un papel fundamental en el metabolismo energético de los organismos vivos y el carbono ocurre en los estados de oxidación desde +IV en CO 2 (porque los dos átomos de oxígeno cuentan como -II ((porque el oxígeno es más electronegativo que el carbono)), y la molécula total debería balance) a -IV en CH 4 (porque cada átomo de H cuenta como +I ((porque el hidrógeno es menos electronegativo que el carbono)). También elementos potencialmente tóxicos, como el arsénico, se encuentran en la naturaleza en diferentes estados de oxidación. Los estados de oxidación importantes del arsénico son +V, (por ejemplo AsO 4 3 -, arseniato), + III (por ejemplo AsO 3 -3, arsenito), 0 (arsénico elemental o arsénico asociado con sulfuro como en FeAS, arsenopirita). El arsénico también puede tener estados de oxidación negativos cuando forma arseniuros como FeAs 2 (löllingita). La biodisponibilidad, toxicidad y movilidad de los elementos sensibles redox suelen depender fuertemente de su estado de oxidación. Por ejemplo, el arsenito tiende a ser más tóxico y más móvil que el arseniato. Por esta razón, evaluar el estado redox de elementos potencialmente tóxicos es un elemento importante en la evaluación del riesgo ambiental de las aguas subterráneas.
Los contaminantes orgánicos también pueden sufrir transformaciones redox. En la superficie terrestre, cuando el oxígeno está presente, la (foto-) oxidación es una vía de degradación importante para los contaminantes orgánicos. En ambientes subsuperficiales, cuando las concentraciones de oxígeno suelen ser muy bajas (condiciones anóxicas), la reducción puede desempeñar un papel importante en las vías de degradación. Por ejemplo, se ha investigado extensamente la deshalogenación reductora de hidrocarburos clorados o la reducción de compuestos nitroaromáticos. La reducción de estos compuestos puede ser mediada por microorganismos pero también pueden ocurrir abióticamente en superficies sólidas presentes en el subsuelo. En cualquier caso, la reducción de contaminantes orgánicos solo es posible cuando la reacción es termodinámicamente factible. Por esta razón es necesario conocer las condiciones redox en, por ejemplo, un acuífero.
Evaluación cuantitativa de las reacciones redox
Como su nombre indica, las reacciones redox combinan la oxidación de un constituyente en el sistema con la reducción de otro y, por lo tanto, implican transferencia de electrones. La oxidación del arsenito con oxígeno elemental a arseniato tiene la siguiente estequiometría:
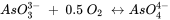
Es importante que las estequiometrías de las reacciones redox no solo estén equilibradas de carga y masa, sino también de electrones. Aquí, el arsénico libera dos electrones al pasar del estado de oxidación +III a +V (el arsenito se oxida a arseniato) mientras que un átomo de oxígeno toma los dos electrones y pasa del estado de oxidación 0 a -II (el oxígeno elemental se reduce). Para esta reacción se puede obtener una constante de equilibrio y en base a las actividades (o concentraciones) de los reactivos y productos disueltos se puede evaluar si la reacción está en equilibrio o en qué dirección la reacción es termodinámicamente favorable.
Cuando un sistema natural contiene varios constituyentes redox activos diferentes, se pueden formular y evaluar por separado un gran número de posibles reacciones redox. En esta situación es más conveniente formular y comparar medias reacciones. Por ejemplo, la oxidación del arsenito con oxígeno se puede dividir en las reacciones de arsénico y oxígeno.
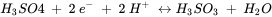
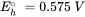
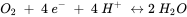
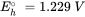
Las medias reacciones se formulan típicamente como reacciones de reducción (los electrones están en el lado izquierdo de la reacción). El E h o es el potencial redox estándar y representa el potencial eléctrico, el cual se mediría en una celda electroquímica estandarizada que contiene en un lado, H 3 AsO 4, H 3 AsO 3 y H +, todos con actividades de 1 mol l -1, y una solución que contiene 1 mol l -1 H + en equilibrio con H 2 gas con una presión de 1 bar, en el otro lado.
En ambientes naturales el pH no suele ser 0 y las actividades de arsenito y arseniato no son 1 mol l -1. El potencial redox, E h bajo estas condiciones se puede calcular usando la ecuación de Nernst:
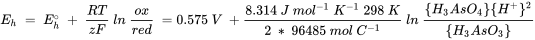
donde:
R es la constante de gas ideal (8.314 J mol -1 K -1),
T la temperatura en K,
z es el número de electrones que se transfieren en la reacción,
F la constante de Faraday (96485 mol C -1).
En la relación ox/rojo, 'buey' representa las actividades o presiones de los constituyentes en el lado derecho de la media reacción, por lo que el factor estequiométrico se convierte en el exponente correspondiente, mientras que 'rojo' representa el lado derecho de la media reacción.
Se pueden comparar los potenciales redox de diferentes medias reacciones:
- La media reacción con el mayor potencial redox proporciona el aceptor de electrones en la reacción redox termodinámicamente favorable,
- La media reacción con el menor potencial proporciona el donador de electrones.
En otras palabras, es termodinámicamente favorable que la media reacción con el alto potencial proceda de izquierda a derecha y la media reacción con el bajo potencial de derecha a izquierda.
Condiciones redox en acuíferos
Las condiciones redox en un acuífero dependen del inventario heredado de oxidantes y reductores durante la formación de la formación geológica y los procesos que han venido ocurriendo a lo largo de su historia. Los oxidantes y reductores pueden haber ingresado al acuífero por difusión o con el agua infiltrante y la reacción redox que progresa lentamente puede haber modificado el ensamblaje de oxidantes y reductores. En ausencia de catálisis (microbiana), las reacciones redox suelen tener una cinética muy lenta. Además, debido a la fotosíntesis, las reacciones redox no están en equilibrio en la superficie terrestre y en la parte superior del subsuelo subyacente. Como consecuencia, las condiciones redox en un acuífero generalmente no se pueden representar en un único potencial redox. Esto implica que los valores obtenidos para aguas subterráneas con mediciones electroquímicas, por ejemplo, mediciones potenciométricas usando electrodos redox, podrían no ser representativos de las condiciones redox en el acuífero. Además, las medias reacciones relevantes en el acuífero a menudo involucran sólidos (reacciones heterogéneas) con baja solubilidad, lo que implica que las concentraciones en solución (por ejemplo de Fe 3 +) son demasiado bajas para ser detectadas. Por lo tanto, evaluar las condiciones redox en ambientes subsuperficiales suele ser un desafío.
Las concentraciones de oxígeno en las aguas subterráneas suelen ser prácticamente nulas, ya que el oxígeno en el agua de lluvia infiltrante o que ingresa al subsuelo por difusión molecular a menudo se consume antes de que pueda llegar al acuífero. De ahí que las 'condiciones reductoras' prevalezcan típicamente en los acuíferos. El potencial redox medido en un sistema puede reflejar los aceptores de electrones dominantes además del oxígeno que están presentes en el sistema (Figura 1).
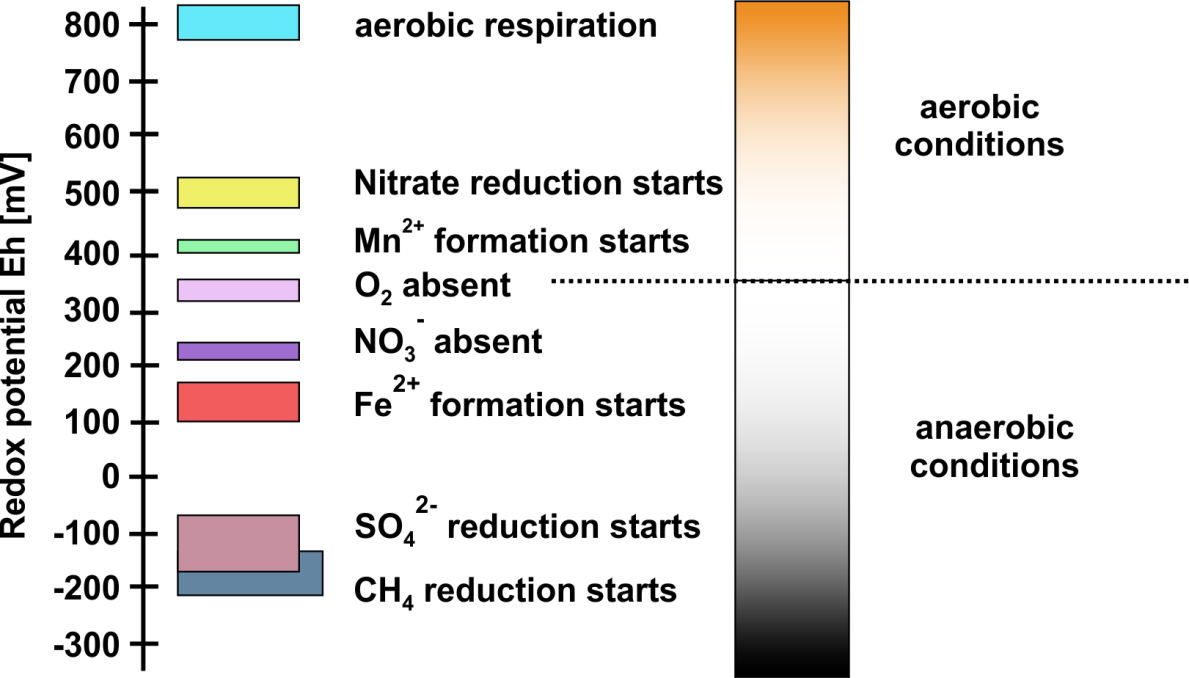
En sedimentos o rocas sedimentarias, las reacciones redox después de la deposición son impulsadas predominantemente por la oxidación de la materia orgánica, que ingresó al sedimento durante su deposición. Sin embargo, el acuífero también podría haber recibido materia orgánica disuelta a través del agua infiltrante. La oxidación de la materia orgánica está predominantemente mediada por microbios y predominantemente acoplada a la reducción del oxígeno elemental (si está presente). Sin embargo, cuando se agota el oxígeno elemental, lo que suele ser el caso, otros aceptores de electrones son utilizados por microorganismos. Los aceptores de electrones relevantes (ver Figura 1) en ambientes anóxicos incluyen:
- Nitrato (en forma disuelta),
- Mn (IV) (como superficie sólida),
- Mn (III) (como superficie sólida),
- Fe (III) (como superficie sólida),
- Sulfato (en forma disuelta).
El nitrato y el sulfato pueden estar presentes en forma disuelta mientras que Mn (IV), Mn (III), Fe (III) se presentan como sólidos con baja solubilidad. Los sólidos de óxido (hydr) de estos metales, como la goetita (FeOOH) o la manganita (MnOOH) son en su mayoría accesibles para la reducción microbiana, mientras que Mn (III) o Fe (III) en los silicatos solo pueden reducirse parcialmente o no están biodisponibles para la reducción. Cuando también estos aceptores de electrones se quedan cortos, se puede iniciar la metanogénesis.
Los microorganismos, que reducen sulfato, Mn o Fe (III), pueden utilizar los productos de organismos fermentativos. Estos organismos fermentativos producen ácidos grasos de cadena corta, como el acetato o el lactato, pero a menudo también liberan gas hidrógeno. Es decir, las concentraciones de hidrógeno en las aguas subterráneas reflejan un estado estacionario de producción y consumo de hidrógeno, y generalmente están limitadas por las tasas de producción. Como consecuencia, las concentraciones de hidrógeno en las aguas subterráneas suelen estar en el límite fisiológico del organismo consumidor. Las concentraciones son suficientes para permitir que el organismo conserve la energía de la oxidación del hidrógeno. Este límite aumenta según la secuencia de aceptores de electrones (Figura 1): reducción de nitrato < reducción de Mn < reducción de Fe < reducción de sulfato < metanogénesis cuando los compuestos correspondientes están presentes en cantidades o concentraciones relevantes. Por esta razón, las concentraciones de hidrógeno disuelto pueden ser un indicador útil para identificar la vía respiratoria anaeróbica dominante en un acuífero. Por ejemplo, se puede determinar si la reducción de sulfato está habilitada o si se ha establecido la metanogénesis. Las concentraciones de hidrógeno en el agua subterránea también pueden ser utilizadas directamente para evaluar si es factible la reducción microbiana de metales, metaloides, hidrocarburos clorados, compuestos nitroaromáticos u otros contaminantes orgánicos.
La reducción de los óxidos de Fe (III) (hidro) son sulfato conduce a la formación de Fe (II) y sulfuro, lo que a su vez, típicamente da como resultado la precipitación de sólidos ferrosos como FeCo 3 (siderita), FeS (mackinawite) o FeS 2 (pirita). Estos minerales que contienen Fe (II) a menudo juegan un papel importante en la reducción abiótica de contaminantes orgánicos o inorgánicos en los acuíferos. Cuando se conoce la composición del agua subterránea y el conjunto mineral, se puede utilizar la ecuación de Nernst para calcular el potencial redox de medias reacciones relevantes en el acuífero. Este potencial redox se puede utilizar entonces para evaluar si la reducción de compuestos potencialmente tóxicos es posible o no. Por ejemplo, la reacción media para la reducción de un hidróxido de hierro férrico amorfo acoplado a la precipitación de siderita viene dada por:

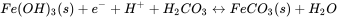
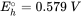
A pH y concentración de ácido carbónico dados, el potencial redox correspondiente se puede calcular usando la ecuación de Nernst. Este potencial redox puede compararse con el obtenido de la ecuación de Nernst para la dicloración reductora de tetracloroetileno (Cl 2 C=CCl 2)

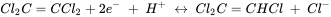
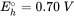
Con este enfoque se puede evaluar la factibilidad de reacciones redox que involucren compuestos potencialmente orgánicos e inorgánicos en acuíferos. Eso, sin embargo, no implica que las reacciones correspondientes también ocurran dentro de la escala de tiempo relevante. Para ello se tiene que conocer la cinética de la reacción y haber sido estudiada para muchas reacciones de potencial relevancia en sistemas acuíferos. Sin embargo, la cinética de las reacciones redox no son objeto de esta sección.
Referencias
Sparks, D. (2002). Química Ambiental del Suelo, Segunda Edición, Prensa Académica, Capítulos 5 y 8, ISBN 978-0126564464.
Esington, M.E. (2004). Química de suelos y aguas: un enfoque integrador, capítulos 7 y 9, CRC Press, ISBN 978-0849312588
¿Qué procesos controlan el movimiento de químicos en las aguas subterráneas? Definir cada uno de estos procesos.
Las reacciones redox de los contaminantes en las aguas subterráneas están controladas por el potencial redox. ¿Cuáles son los productos químicos y procesos más importantes que determinan el potencial redox?
¿Cómo se puede determinar el potencial redox en el acuífero? ¿Cuáles son las desventajas de estos métodos?
3.1.7. Biota
(borrador)
Autor: Steven Droge,
Revisor: Nico van der Brink, John Parsons
Objetivos de Inclinación:
Deberías ser capaz de:
- explicar el efecto de la composición celular y corporal sobre la toxicocinética de los compuestos
- describir el papel de la biota en el destino ambiental de los químicos
Palabras clave: composición celular, composición corporal, vías de exposición, absorción, distribución
Introducción
Al igual que el suelo, el agua y el aire, el tejido orgánico de los organismos vivos también puede considerarse como un compartimento del ecosistema donde los contaminantes químicos pueden acumularse o descomponerse. La concentración interna en organismos vivos proporciona información importante sobre la exposición química y finalmente determina el riesgo ambiental de contaminación, pero es importante comprender las características clave del tejido que influyen en la partición química en organismos. La acumulación química en el tejido de organismos vivos es una serie de procesos químicos y biológicos, brevemente basados en:
- absorción química (principalmente permeación de medios a granel sobre ciertas membranas hacia las células);
- distribución interna (por ejemplo, a través de flujos sanguíneos a través de órganos);
- metabolismo (por ejemplo, procesos de biotransformación en, por ejemplo, el hígado).
- excreción (por ejemplo, a través de orina y heces, pero también a través de agallas, sudor, leche o pelos)
Estos cuatro procesos son la base del modelado toxicocinético, y a menudo se resumen como Absorción, Distribución, Metabolismo y Excreción, o “ADME”. Estos procesos ADME pueden variar fuertemente para diferentes compuestos contaminantes debido a las propiedades de la estructura química. Estos procesos ADME también pueden variar fuertemente para diferentes organismos, debido a:
- las características fisiológicas (por ejemplo, tener agallas, pulmones o raíces, disponibilidad de mecanismos específicos de absorción química, presencia de enzimas metabólicas específicas, propiedades relacionadas con el tamaño como la tasa metabólica),
- la posición en el ambiente contaminado (aves voladoras o larvas de musgo que viven en sedimentos),
- la interacción con el ambiente contaminado (vivir en suelo o agua, elección de alimentos, etc.)
- el comportamiento en el ambiente contaminado (ser sésil o capaz de alejarse (temporalmente) de un lugar contaminado).
Más detalles de estos procesos toxicocinéticos se presentan en la sección 4.1 sobre Toxicocinética y bioacumulación. El módulo actual tiene como objetivo proporcionar un resumen de las características clave de los diferentes componentes tisulares que explican la distribución interna de los químicos (distribución), los diferentes tipos de contacto entre contaminantes y organismos (exposición-absorción), y los cambios temporales en la fisiología que pueden afectar exposición (por ejemplo, excreción, que incluye ejemplos como la liberación de COP por lactancia y el aumento de las concentraciones de POP durante la inanición). Antes de discutir cómo los químicos son absorbidos en la biota, es importante definir primero las propiedades químicas clave y la composición molecular del tejido que influyen en la forma en que los químicos son absorbidos del ambiente circundante y distribuidos por todo el organismo.
Absorción-distribución: Bloques de construcción de tejidos
Todos los organismos están compuestos por células, las cuales están compuestas por una membrana celular, rodeando la solución en gran parte acuosa llena de membranas orgánicas internas, estructuras proteicas y ADN/ARN. Organismos procariotas como bacterias, pero también algas, hongos y plantas tienen membranas reforzadas con paredes celulares para evitar fugas de agua por altas presiones osmóticas, y para proteger la membrana celular. La energía metabólica se almacena en moléculas grandes como ésteres grasos y azúcares. Sorprendentemente, para todas las especies de organismos vivos existentes, estos componentes tisulares son en su mayoría estructuras compuestas por bloques de construcción moleculares relativamente simples y repetitivos, con variaciones menores en las cadenas laterales. Ver ejemplos en la Figura 1. La composición de los órganos, como colección de células específicas, en términos del porcentaje de lípidos, proteínas e hidratos de carbono es importante para la toxicocinética general de los químicos en todo el organismo.
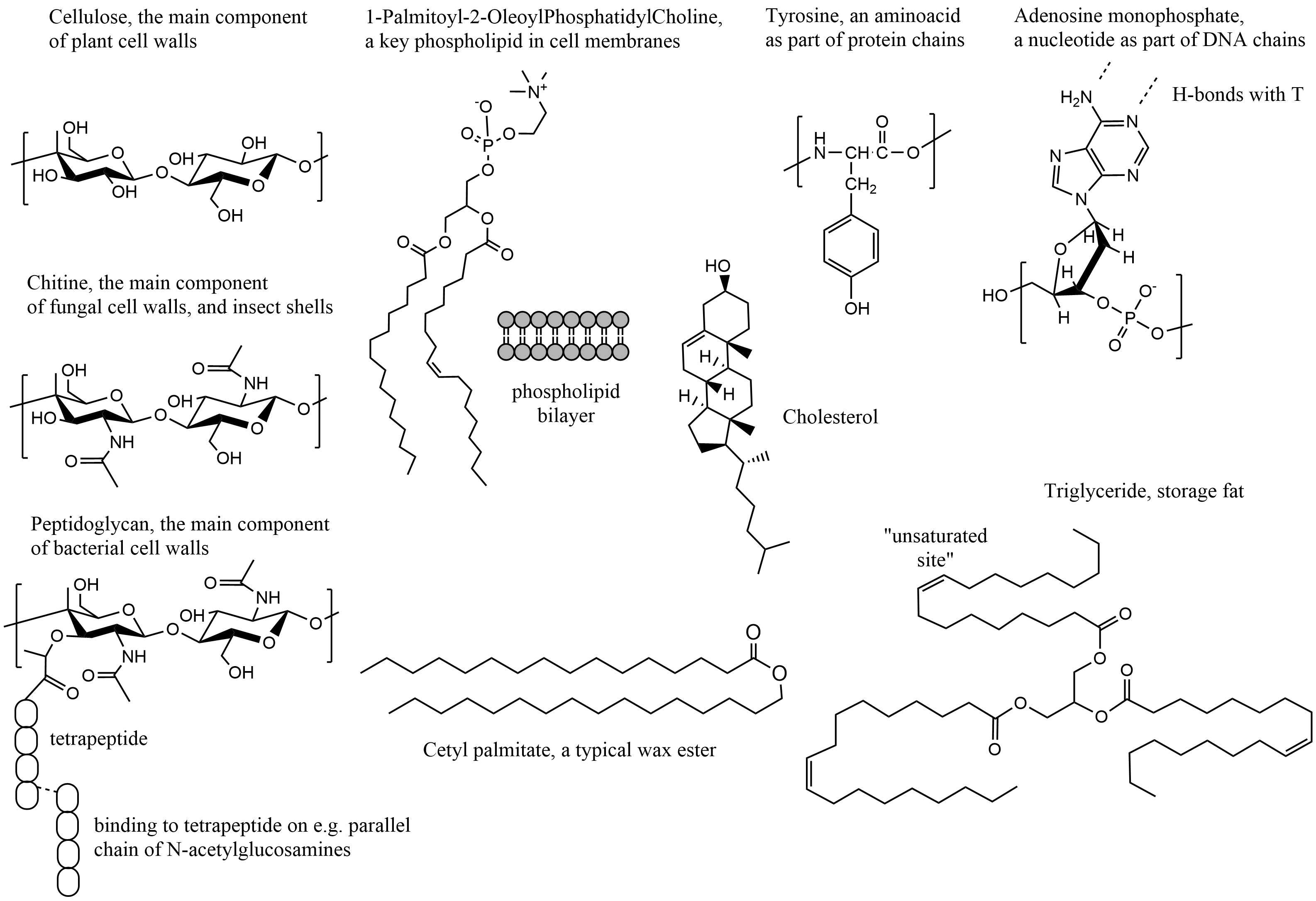
Las paredes celulares están hechas principalmente de polisacáridos altamente polares, por ejemplo:
- celulosa, un polímero de moléculas azucaradas, y quitina en hongos, que es altamente polar y por lo tanto permeable al agua.
- estructuras semicristalinas de peptidoglicano que rodean a las bacterias (90% del peso seco de bacterias Gram-positivas pero solo 10% de cepas Gram-negativas), un polímero mixto entre N-acetilglucosamina (quitina similar) y cortas que interconectan 4 o 5 cadenas de aminoácidos.
- lignina, una supraestructura polar (~ 30% de oxígeno) pero más hidrofóbica de moléculas fenólicas polimerizadas que recubren los principales vasos vegetales que transportan agua.
El grupo específico de algas de diatomeas tiene una pared celular compuesta por sílice biogénica (dióxido de silicio hidratado), típicamente como dos válvulas que se solapan entre sí rodeando la especie unicelular. Las diatomeas generan alrededor del 20 por ciento del oxígeno que se produce anualmente en el planeta, y aportan casi la mitad del material orgánico que se encuentra en los océanos. Con su estructura específica de pared celular, las diatomeas absorben más de 6.7 mil millones de toneladas métricas de silicio cada año de las aguas en las que viven, lo que crea enormes depósitos cuando mueren.
Las membranas celulares están compuestas principalmente por una bicapa de fosfolípidos, teniendo cada molécula de fosfolípido básicamente un grupo de cabeza polar e ionizado conectado a dos cadenas alquílicas largas (Figura 1 ejemplo con fosfolípido tipo POPC). Los lados externos de una bicapa de fosfolípidos son hidrófilos (amantes del agua), el interior es hidrófobo (temeroso del agua). Los iones (sales inorgánicas, nutrientes, metales, ácidos fuertes y biomoléculas ionizadas) no penetran fácilmente a través de dicha membrana pasivamente, y requieren proteínas de transporte específicas que puedan transportar y regular iones dentro y fuera del interior de la célula. Las moléculas de colesterol estabilizan la fluidez de las bicapas de membrana en células de la mayoría de los organismos, pero por ejemplo no en la mayoría de las bacterias Gram negativas. Los químicos neutros disueltos pueden difundirse pasivamente a través de bicapas de fosfolípidos dentro y fuera de las células
Las proteínas son cadenas de una variedad de aminoácidos, 21 de los cuales se sabe que están codificados genéticamente, y de los cuales los humanos solo pueden producir 12. Los otros nueve deben ser consumidos, y por lo tanto se denominan aminoácidos esenciales (codificados H, I, L, K, M, F, T, W, V). Las proteínas forman complejas estructuras tridimensionales que permiten que las reacciones enzimáticas ocurran de manera efectiva y repetida. Hay dos aminoácidos con cadenas laterales que llevan una carga positiva a pH neutro: Arginina (pKa 12) y Lisina (pKa 10.6), y dos aminoácidos con cadenas laterales que portan una carga negativa a pH neutro: Ácido aspártico (pKa 3.7) y ácido glutámico (pKa 4.1). Algunos aminoácidos llevan cadenas laterales hidrófobas típicas: entre otras Leucina y Fenilalanina. La cisteína tiene un resto tiol (SH) que puede formar fuertes interacciones de disulfuro conectivo con grupos laterales de cisteína espacialmente cercanos en la estructura 3D. La proteína albúmina de transporte sanguíneo clave, por ejemplo, contiene aproximadamente 98 aminoácidos aniónicos y 83 aminoácidos catiónicos, y aproximadamente 35 residuos de cisteína.
El ADN y otras cadenas codificantes genéticamente están compuestas por 4 nucleótidos diferentes que forman una doble hélice de dos cadenas opuestas, mantenidas unidas por enlaces de hidrógeno que conectan las bases complementarias: A y T (o A y U en el ARN), y G y C. El ADN puede estar densamente empaquetado alrededor de proteínas histonas, y es ya sea o parte del citoplasma celular (en especies procariotas) o separados dentro de una membrana (en especies eucariotas). El ADN no es una fase de acumulación crítica para los químicos, pero por supuesto es una estructura celular donde los contaminantes pueden impactar fuertemente en todo tipo de procesos celulares cuando reaccionan con componentes de ADN o afectan la organización estructural de otra manera.
La grasa de almacenamiento proporciona a muchos animales y frutos de las plantas una importante reserva de energía, pero también aísla a los animales de sangre caliente en climas fríos, lubrica las articulaciones para que se muevan suavemente y protege los órganos de golpes (por ejemplo, ojos y riñones). Las semillas y los frutos secos pueden contener hasta 65% (nueces) de componentes grasos, lo que por supuesto proporciona energía para el crecimiento inicial, pero a partir del cual también se puede prensar el aceite. La grasa de almacenamiento en la mayoría de los animales está presente en forma de triglicéridos, y como tal fases neutras y muy hidrófobas dentro del tejido. Los ésteres de ácidos grasos poliinsaturados como los ácidos grasos omega-6 y omega-3 son abundantes en los peces (ácido eicosapentaenoico (EPA) y ácido docosahexaenoico (DHA)) y en semillas y plantas (principalmente ácido alfa-linolénico (ALA), pero las algas también contienen EPA y DHA). La alta ingesta de algas por parte de los peces en redes alimenticias acuosas basadas en algas, da como resultado los altos niveles de EPA/DHA en muchas especies de peces, ya que en su mayoría no pueden hacerlo ellos mismos (https://www.pufachain.eu). Los humanos pueden producir algunos EPA y DHA a partir de ALA.
La composición promedio de los organismos vivos basada en los componentes clave del tejido lipídico, proteína y carbohidrato puede variar ampliamente, como se ilustra en la Tabla 1.
|
Organismo |
lípido % de d.w. |
proteína % de d.w. |
carbohidrato % de d.w. |
|---|---|---|---|
|
Hierba |
0.5-4 |
15-25 |
60-84 |
|
Fitoplancton |
20 |
50 |
30 |
|
Zooplancton |
15-35 |
60-70 |
10 |
|
Oyster |
12 |
55 |
33 |
|
Larvas de Midge |
10 |
70 |
20 |
|
gusanos cortadores del ejército (larvas de polilla) |
72% de cuerpo |
||
|
Filete de lucio |
3.7 |
96.3 |
0 |
|
Trucha de lago |
14.4 |
85 |
0 |
|
Anguila (cultivada por 1.5 años) |
65 |
~34 |
1 |
|
Carne de caza de venado |
10 |
90 |
0 |
Cuadro 2. Estimaciones sobre la composición de la estructura tisular de una mujer (BW= 60 kg, H = 163 cm, IMC = 22.6 kg/m 2), (tomadas de Goss et al., 2018). Los huesos no están incluidos.
|
Órgano |
Volumen total de órganos (mL) |
humedad contenido |
fosfolípido % de d.w. |
lípido de almacenamiento % de d.w. |
proteína % de d.w. |
|---|---|---|---|---|---|
|
Adiposo |
22076 |
26.5% |
0.3% |
93.6% |
6.1% |
|
Cerebro |
1311 |
80.8% |
35.4% |
22.6% |
42.1% |
|
Gut |
1223 |
81.8% |
9.9% |
22.0% |
68.1% |
|
Corazón |
343 |
77.3% |
19.1% |
17.7% |
63.2% |
|
Riñones |
427 |
82.4% |
16.5% |
5.9% |
77.7% |
|
Hígado |
1843 |
79.4% |
19.4% |
8.0% |
72.6% |
|
Pulmón |
1034 |
94.5% |
13.1% |
13.7% |
73.2% |
|
Músculo |
19114 |
83.7% |
2.6% |
2.5% |
95.0% |
|
Piel |
3516 |
71.1% |
2.6% |
22.9% |
74.5% |
|
Bazo |
231 |
83.5% |
5.6% |
2.4% |
92.0% |
|
Gónadas |
12 |
83.3% |
18.8% |
0.0% |
81.3% |
|
Sangre |
4800 |
83.0% |
2.5% |
2.4% |
95.1% |
|
total |
55929 |
60.2% |
1.7% |
71.0% |
27.3% |
Diferentes órganos en una sola especie también pueden diferir en gran medida en su composición, así como su contribución al cuerpo en general, como se muestra para un ser humano en la Tabla 2. La mayoría de los órganos tienen un contenido de humedad > 75%, pero en general el contenido de humedad es considerablemente menor, debido al bajo contenido de humedad de los huesos y el tejido adiposo. El tejido adiposo es, con mucho, el mayor repositorio de lípidos, pero compuesto principalmente por lípidos de almacenamiento, mientras que el cerebro también es particularmente rico en ambos lípidos, pero particularmente enriquecido en fosfolípidos de membranas celulares. Los músculos y la sangre contienen un contenido de proteínas relativamente alto.
Absorción-distribución: Propiedades químicas
La influencia de la estructura química en la acumulación de sustancias químicas en los compartimentos bióticos depende en gran medida de su biodisponibilidad, como se discute con más detalle en la sección 4.1 sobre Toxicocinética y bioacumulación, así como de las propiedades de unión básicas como los resultados de los químicos hidrofobicidad y volatilidad (sección 3.4 sobre Constantes de partición y partición) y estado de ionización (sección 2.2.6 sobre productos químicos orgánicos ionogénicos). En resumen, cuanto más no polar es la composición de un químico, más hidrófoba es, mayor es su afinidad por la partición de las fases disueltas (tanto externa como internamente) en fases tisulares poco hidratadas como la grasa de almacenamiento y las membranas celulares. Por esta razón, el principal problema con los contaminantes orgánicos clásicos como las dioxinas, DDT y PCB, suele ser su alta hidrofobicidad que resulta en una fuerte acumulación en el tejido. Tales químicos a menudo tardan mucho tiempo en excretarse del tejido si no se hacen menos hidrófobos a través de procesos de biotransformación. Esto conduce a la acumulación de la red alimentaria y a efectos tóxicos específicos agudos o crónicos a un determinado nivel de organismo (sección 4.1.6 sobre la transferencia de la cadena alimentaria). Las proteínas y los carbohidratos azucarados están compuestos principalmente por series extendidas de unidades polares y, por lo tanto, fuertemente hidratadas, y unen químicos hidrófobos en un grado mucho menor. Las proteínas pueden tener bolsas tridimensionales que podrían encajar tanto hidrófilas como sustancias químicas hidrófobas, y como tales actúan como proteínas de transporte en la sangre por todo el cuerpo (transportando ácidos grasos por ejemplo), basándose en la afinidad de unión específica. Muchos receptores basados en proteínas también se basan en una afinidad de unión específica, y en muchos casos esto implica (combinaciones de) interacciones polares y electrostáticas que también tienen un espacio de ajuste tridimensional óptimo. Los productos químicos volátiles están más abundantemente presentes en la fase gaseosa en lugar de disolverse, y están más fácilmente en contacto con la biota a través del intercambio de gases en las extensas superficies de pulmones de animales y hojas de plantas.
Para ser absorbidos en las células, o en los órganos, los químicos tienen que permear a través de las membranas. Para la mayoría de los contaminantes orgánicos, la difusión pasiva a través de bicapas de fosfolípidos tiene un óptimo a cierta hidrofobicidad. La alta acumulación en la membrana asegura la desorción en la solución celular adyacente. Se supone que los químicos ionizados tienen tasas de permeación pasiva que son despreciables o al menos órdenes de magnitud inferiores a las de los correspondientes productos químicos neutros. Por esta razón, se pueden mantener fácilmente todo tipo de gradientes moleculares intraextracelulares, por ejemplo para protones (H +) o sodio-potasio (Na + /K +). El movimiento de sustancias químicas muy polares e iónicas puede regularse estrechamente mediante proteínas de transporte que sobresalen de la bicapa de membrana. Las moléculas específicas se pueden excretar activamente de las células (por ejemplo, ciertos medicamentos) o reabsorberse (por ejemplo, en los riñones de vuelta al torrente sanguíneo). Esto nuevamente se basa en el ajuste tridimensional en el bolsillo de transporte y el movimiento paso a paso a través de la estructura de la proteína, y cuesta energía. Para ácidos y bases con una fracción muy pequeña de especies neutras a pH fisiológico, la permeación pasiva sobre las membranas aún puede estar dominada por las especies neutras.
Exposición: Contacto entre la biota y diversos compartimentos ambientales
Existen múltiples vías por las cuales los químicos pueden ingresar al tejido de la biota, por ejemplo a través de órganos respiratorios, a través de la digestión de alimentos contaminados, o por contacto dérmico. La mayoría de los animales necesitan tomar un flujo más o menos constante de oxígeno y agua, y periódicamente alimentos, para liberar nutrientes y energía de los alimentos. Por supuesto que también necesitan liberar CO 2 (y otros productos químicos) como desechos. Los químicos contaminantes son absorbidos junto con estos procesos básicos, y depende de las propiedades químicas y de la eficiencia de la vía de captación cuánto absorberá el organismo de estas diferentes vías de exposición.
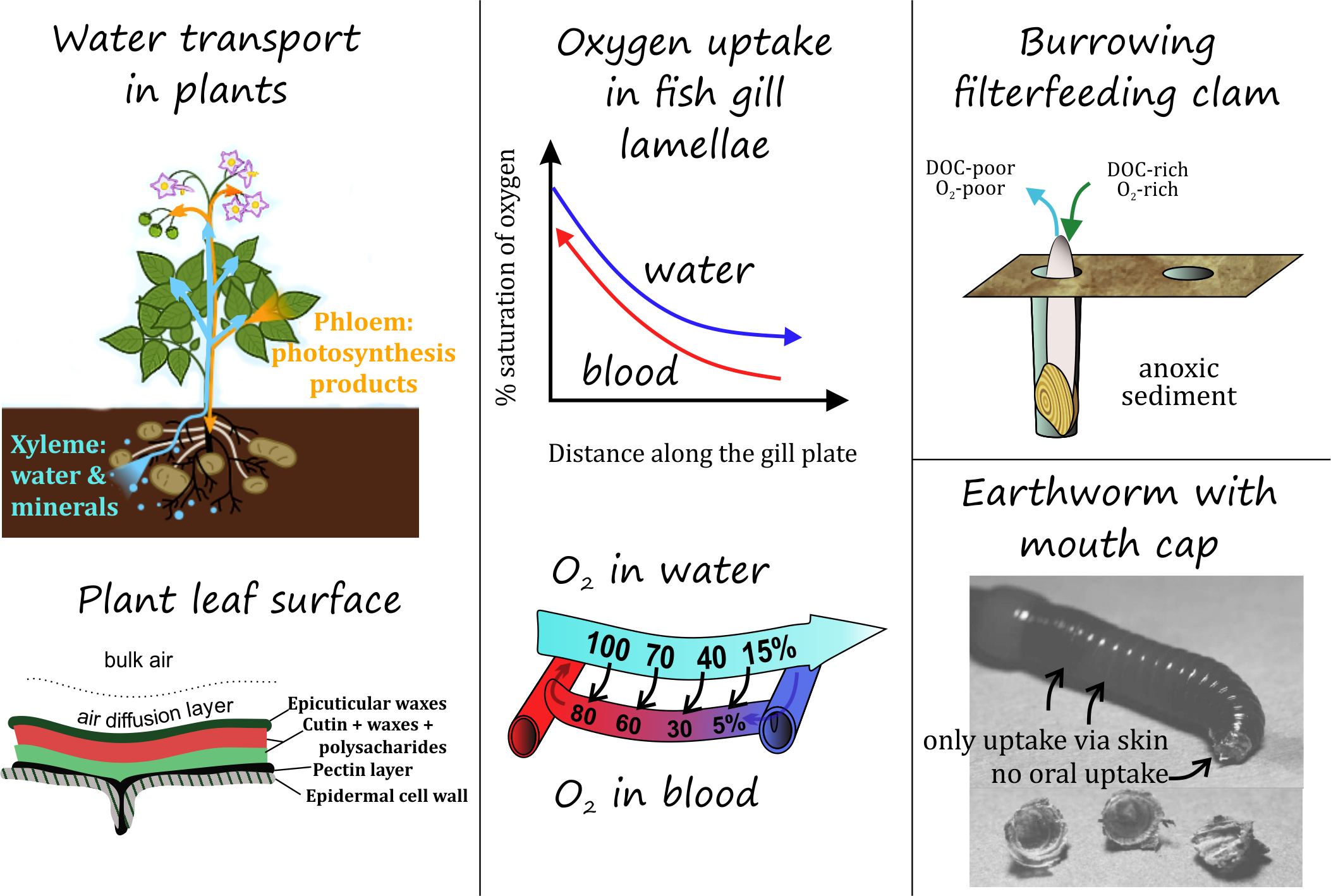
Las plantas necesitan mucha agua y durante el día la fotosíntesis necesitan CO 2, pero también requieren oxígeno durante la noche. Las altas densidades de algas pueden agotar los niveles de oxígeno en los sistemas acuáticos poco profundos durante la noche y reponer los niveles de oxígeno durante el día. El oxígeno es abundante en el aire (200,000 partes por millón en el aire), pero es considerablemente menos accesible en el agua (15 partes por millón en agua fría que fluye), y a menudo se agota por debajo de los primeros mm de sedimento. Para obtener suficiente oxígeno, agua y alimento, los organismos acuáticos tienen que pasar grandes volúmenes de agua a través de sus branquias. Los organismos que habitan en los sedimentos tienen hemoglobina para unirse al oxígeno, o bombean constantemente agua dulce superpuesta a través de madrigueras creadas en sedimentos, a menudo revestidas de moco. Por lo tanto, los organismos vivos están constantemente en contacto con contaminantes disueltos en agua, y los organismos que respiran aire se exponen fácilmente a contaminantes del aire Para simplificar el dominio de los organismos vivos como parte de este módulo sobre el compartimento biótico y cómo entran en contacto con sustancias químicas relevantes para la Toxicología Ambiental, pueden dividirse por ejemplo en:
- , que a menudo toman grandes cantidades de agua de su entorno a través de sus raíces, impulsadas por la evaporación del agua en las hojas y los flujos internos resultantes.
- organismos que respiran agua, que pasan grandes cantidades de agua a través de branquias o estructuras similares a branquias (túbulos u otras estructuras de piel delgada cerca de donde pasa el agua) con el fin de absorber suficiente oxígeno y reducir la acumulación de CO 2. Alimentadores filtrantes como ostras y mejillones, que pueblan enormes superficies como arrecifes o bancos, pueden volcar diariamente un enorme volumen de agua, y así permitir que los químicos disueltos entren en contacto cercano con las membranas externas.
- organismos que respiran el aire, que pueden intercambiar eficazmente grandes cantidades de sustancias químicas volátiles y gaseosas con el aire (oxígeno pero también compuestos orgánicos), pero típicamente toman productos químicos menos/no volátiles a través de los alimentos y requieren excreción activa y metabolismo para la emisión de menos/no volátiles productos químicos.
Plantas
Casi todas las plantas tienen raíces bajo tierra, una estructura robusta de tallo y ramas sobre el suelo, y hojas. Junto con el agua de poro del suelo, los químicos solubles se transportan fácilmente desde las raíces de la planta en la corriente de circulación interna a través de células de xilema, las cuales están revestidas con lignina impenetrable en agua (ver Figura 2). Los productos químicos moderadamente hidrófobos (K ow de 1-1000) se transportan rápidamente de las raíces a los brotes y las hojas, mientras que los químicos hidrófobos pueden retenerse fuertemente en las membranas y las paredes celulares y, en su mayoría, se acumulan en secciones de raíces, limitando el transporte a los tejidos vegetales Las raíces también pueden liberar activamente cantidades considerables de sustancias químicas para influir en los medios circundantes inmediatos de las raíces (rizosfera), por ejemplo, para estimular procesos microbianos o pH con el fin de liberar nutrientes. Estos 'exudados' de raíces de plantas pueden ser iones, pequeños ácidos, aminoácidos, esteroles, etc. Los químicos que ingresan a las plantas a través de las hojas, como pesticidas o contaminantes orgánicos semivolátiles, pueden redistribuirse a otras partes de la planta a través de las corrientes del floema.
El transporte a través del xilema hasta tejidos vegetales superiores se produce a través de fuerzas capilares y se ve potenciado por tres fenómenos pasivos:
- el alto contenido de azúcar en el floema causando presión osmótica para atraer agua de otras partes.
- la evaporación del agua crea tensión superficial en miles de células que extraen agua del suelo a través del sistema de xilema.
- la presión osmótica de las células radiculares en comparación con el agua de poro del suelo. La presión radicular es mayor por la mañana antes de que los estomas se abran y permitan que comience la transpiración.
Como resultado de las fuerzas capilares necesarias para elevar el agua contra la gravedad, y un cierto diámetro máximo de los vasos para hacerlo, existe una altura máxima posible de planta de 122-130 m (Koch et al., 2004) que se compara con los árboles de secuoyas (Sequoias) que alcanzan una altura máxima de 113 m.
La mayoría de las hojas están cubiertas con una capa cerosa, para evitar daños y evaporación del agua. Esta capa de cera puede tener un grosor de 0.3-4.6 µm (Moeckel et al., 2008). Los bosques grandes proporcionan enormes superficies hidrofóbicas a las que los productos químicos orgánicos semivolátiles (SVOC) pueden unirse fuera del aire, lo que influye en la distribución global de productos químicos como los PCB. El reparto de COVs en la vegetación de pastizales extendidos contamina la base de la cadena alimentaria, así como los sectores agrícolas y ganaderos utilizados por los humanos. La cadena alimentaria de pasta/maíz/leche-ganado/carne de vacuno representa la mayor parte de la exposición de fondo de la población europea y norteamericana a muchos COV persistentes. La tasa de absorción de sustancias químicas en las hojas a menudo también depende de la capa límite de aire que rodea las hojas, lo que limita la difusión en las superficies de las hojas. Por supuesto, todo tipo de factores como la velocidad del viento, la formación de dosel y el grosor de la cutícula también controlan el intercambio entre las hojas y la fase gaseosa (ver también la sección 3.1.2 sobre la Atmósfera). Las pequeñas aberturas o poros en la parte inferior de las hojas, llamados estomas, permiten además el intercambio de gases. En condiciones cálidas, los estomas pueden cerrarse para evitar la evaporación del agua, pero se necesita intercambio de gases en muchos tipos de plantas para permitir que el CO 2 sea metabolizado y la liberación de O 2 que se produzca. La capa cerosa en las hojas puede atrapar productos químicos orgánicos gaseosos. Muchas plantas, como los árboles coníferos, producen resinas para proporcionar una defensa efectiva contra insectos y enfermedades, y estas resinas liberan grandes cantidades y volátiles orgánicos estructuralmente muy diversos como los terpenos e isoprenos (Michelozzi, 1999). Estos volátiles producidos por plantas pueden incluso contribuir a la formación de ozono. Por lo tanto, las plantas acumulan productos químicos de su entorno, pero también liberan químicos al ambiente. Por lo tanto, también importa para la exposición de los organismos de pastoreo a ciertos tipos de contaminantes ya sea que coman raíces, brotes, hojas, semillas o frutos de plantas que viven en ambientes contaminados.
Organismos que utilizan oxígeno disuelto
Los movimientos 'branquiales' de los respiradores de agua crean un flujo constante de sustancias químicas disueltas en agua a granel a lo largo de las membranas celulares externas (o capas de moco que rodean las membranas celulares) de las branquias Un pez trucha arco iris de 1 kg ventila alrededor de 160 ml/min, por lo que 230 L/día (Consoer et al., 2014). La superficie total de las branquias en un pez depende del comportamiento y peso de la especie (los peces grandes activos requieren mucho oxígeno), y equivale a cerca de 1-6 cm 2 por g de peces (Palzenberger & Pohla, 1992). Para un pez de 1 kg de ~20 cm de longitud, el área branquial de ~1000 cm 2 se compara con una superficie externa del cuerpo de ~500 cm 2. Esto da como resultado una partición efectiva de los productos químicos entre el agua y las membranas celulares. Dentro de las branquias, las células están en estrecho contacto con el sistema sanguíneo del organismo, y la acumulación de concentraciones químicas en las células externas proporciona un intercambio efectivo con el torrente sanguíneo (u otros fluidos internos, Figura 2) que se arrastran a lo largo que redistribuyen los químicos a los órganos internos. Lo contrario ocurre igualmente: los químicos disueltos en el torrente sanguíneo provenientes de órganos también intercambiarán rápidamente con agua externa a granel si las concentraciones son menores.
Por supuesto, muchos contaminantes también pueden ingresar a los organismos que respiran agua a través de los alimentos, pero el intercambio de aguas branquiales es muy efectivo para controlar la distribución de productos químicos. La salinidad del agua juega un papel importante en la necesidad de los organismos que respiran agua para “beber” agua, y por lo tanto absorber contaminantes a través de esta ruta.
|
CAJA 1. Osmoregulación (nivel MSc) La mayoría de los animales vertebrados acuáticos son osmorreguladores: sus células contienen una concentración de solutos que es diferente al agua que los rodea. Los peces que viven en agua dulce suelen tener un nivel osmótico celular (300 millosmoles por litro, mOsm/l) que es más alto que el agua dulce a granel (~20-40 mOsm/l), por lo que mucha agua fluye pasivamente a través de las agallas (no a través de la piel) hacia el tejido de los peces. Por lo tanto, están constantemente absorbiendo agua (solo moléculas de agua) a través de las branquias, lo que necesita ser controlado, por ejemplo, diluyendo fuertemente la orina. También toman algo de agua en su tracto gastrointestinal (GIT). Los peces marinos tienen niveles osmóticos celulares similares a los peces de agua dulce, pero el agua salada (1000 mOsm/l) hace que el agua salga del tejido branquial a través de los revestimientos de las agallas de los peces por ósmosis, que necesita ser reabastecida por la ingesta activa de agua salada, y la excreción separada de las sales. La mayoría de los organismos invertebrados en los océanos tienen una concentración global interna de compuestos disueltos comparable al agua en la que viven, de manera que no sufren fuertes presiones osmóticas sobre sus tejidos blandos (osmoconformadores). |
Una sola ostra adulta puede limpiar unos 200 litros de agua al día (https://www.cbf.org/about-the-bay/mo...act-sheet.html). Los planes para repoblar el puerto de Nueva York con mil millones de ostras sobre sustratos artificiales pueden tener enormes impactos en la redistribución química. Un solo mejillón cebra de 2 cm (Dreissena polymorpha) que habita en el lago poco profundo IJsselmeer (6.05x10 12 L) en puede filtrar aproximadamente 1 L por día, y las altas densidades de estas y especies relacionadas en este lago de agua dulce pueden volcar el volumen del lago una o dos veces al mes (Reeders et al., 1989).
Incluso muchos organismos del suelo están constantemente en contacto con superficies húmedas del suelo, y el contacto entre el agua de los poros del suelo y las superficies externas (branquias/áreas de piel blanda) domina las rutas de intercambio químico para muchos productos químicos. Las lombrices de tierra, por ejemplo, no tienen pulmones e intercambian oxígeno a través de su piel. Las lombrices de tierra comen bacterias y hongos que crecen sobre materia orgánica muerta y en descomposición, y así actúan como principales descomponedores de materia orgánica y reciclaje de nutrientes. Las lombrices alteran drásticamente la estructura del suelo, el movimiento del agua, la dinámica de nutrientes y el crecimiento Se estima que las lombrices de tierra voltean los 15 cm superiores del suelo en diez a veinte años (LINK), por lo que también son capaces de mezclar la contaminación ligada a la superficie en una capa sustancial de suelo. En términos de biomasa, las lombrices dominan el mundo de los invertebrados del suelo, incluidos los artrópodos. Para comprender mejor la cantidad de contaminación que reciben las lombrices de tierra a través de los alimentos o a través de su piel, varios estudios han utilizado lombrices de tierra en pruebas de exposición con parte de los organismos que tienen sus partes de la boca selladas con pegamento quirúrgico (Vijver et al., 2003). Las tasas de absorción de los metales Cd, Cu y Pb en lombrices selladas y no selladas expuestas a dos suelos de campo contaminados fueron similares (Vijver et al., 2003), lo que indica la absorción principal a través de la piel de los gusanos. Las tasas de absorción, así como el nivel máximo de acumulación de varios contaminantes orgánicos de suelos contaminados artificialmente, también fueron comparables entre gusanos sellados y no sellados (Jager et al., 2003). La vía dérmica es, por lo tanto, una ruta de absorción muy importante para los químicos orgánicos también. La absorción dérmica por los organismos del suelo es generalmente del charco de sustancias químicas en el agua de los poros del suelo, de ahí que la distribución de sustancias químicas entre partículas sólidas y materiales orgánicos en el suelo y el agua de los poros del suelo es extremadamente importante para impulsar la absorción dérmica de sustancias químicas por las lombrices de tierra (Ver sección 3.4 Constantes de partición y partición, sección 3.5 sobre Especiación de metales y 3.6 sobre Disponibilidad y biodisponibilidad).
Organismos que respiran aire
Los organismos que respiran aire suelen consumir productos químicos menos/no volátiles a través de los alimentos y requieren excreción activa y metabolismo para la eliminación de estos químicos a través de, por ejemplo, heces y orina. Por lo general, se supone que la absorción dérmica es insignificante, mientras que la ingesta de productos químicos a través de partículas de aire puede ser relativamente alta, por ejemplo, de contaminantes presentes en el polvo doméstico o contaminantes en los aerosoles. La excreción a través de partículas de aire claramente no es una vía dominante. Los productos químicos en la matriz de alimentos dentro del tracto gastrointestinal a menudo primero necesitan disolverse completamente en los fluidos intestinales, antes de que puedan pasar las capas de moco y las membranas que recubren el tracto gastrointestinal y entrar en las corrientes sanguíneas para su redistribución. Sin embargo, la 'endocitosis' también puede resultar en la absorción de sustancias químicas (pequeñas) en partículas en las células al rodear primero completamente la partícula por la membrana, después de lo cual la membrana encapsulante brota dentro de la célula y forma una vesícula. A pesar de esta endocitosis, las fracciones químicas de contaminantes fuertemente absorbidos en partes no digeribles no siempre pueden ser absorbidas automáticamente de los alimentos. Los animales de pastoreo generalmente requieren conversión microbiana en su intestino para digerir material vegetal como la celulosa y la lignina en componentes químicos que pueden ser tomados como fuente de energía.
Muchas redes alimentarias acuáticas están estructuradas de tal manera que comienzan con plantas acuáticas que son consumidas por organismos que respiran agua, con animales marinos o aves que respiran aire en la parte superior de la cadena alimentaria. Estos depredadores superiores que respiran aire absorben contaminantes en gran parte a través de su dieta, pero carecen del intercambio efectivo sangre-membrana-agua a través de branquias. La partición sangre-membrana-aire en los pulmones es mucho menos efectiva en la eliminación de productos químicos a través de la partición pasiva. Por esta razón, muchos de los principales depredadores de las redes alimentarias tienen las concentraciones más altas de contaminantes. La distribución química en las redes alimenticias se discutirá con más detalle en la sección 4.1.6.
Referencias
Palzenberger & Pohla 1992, Reseñas en Biología y Pesca de Peces, 2, 187-216.
Jager, T.; Fleuren, R.H.L.J.; Hogendoorn, E.A.; de Korte, G. 2003. Elucidar las rutas de exposición de químicos orgánicos en la lombriz, Eisenia andrei (Oligochaeta). Medio ambiente. Sci. Technol. 37 (15), 3399-3404
Koch et al. 2004, Nature (428) 851-854.
Moeckel et al. 2008, Environ. Sci. Technol. 42, 100-105.
Michelozzi 1999, Roles defensivos de mezclas terpenoides en coníferas, Acta Botanica Gallica 146 (1), 73-84.
Consoer et al. 2014, Toxicología Acuática 156, 65-73.
Reeders et al. 1989, Freshwater Biology 22 (1), 133-141.
Vijver et al. 2003, Biología del Suelo y Bioquímica 35, 125-132.
Goss et al. 2018, Chemosphere 199, 174-181.
Explique si un pez magro de 1 kg probablemente contenga una menor concentración de contaminante hidrófobo como un pez graso de 1 kg capturado en el mismo lago.
Explicar cómo los bivalvos (almejas, músculos, ostras) pueden reducir la contaminación con un químico hidrófobo de un lago
En muchos países, los niveles de contaminación del agua se han reducido fuertemente en comparación con hace 30 años, pero muchos sedimentos siguen contaminados con contaminantes históricos que se unen fuertemente a las partículas de sedimentos. Explicar cómo la contaminación histórica en un sedimento puede ser puesta en suspensión por organismos bentónicos.
Discutir si las concentraciones internas de sustancias químicas muy hidrofóbicas en los peces grasos aumentan o disminuyen durante un período prolongado de inanición, por ejemplo, durante la migración hacia los criaderos. Tenga en cuenta que los químicos muy hidrófobos pueden tener vidas medias de eliminación de meses o incluso más largas.
Discutir si las concentraciones internas de sustancias químicas muy hidrofóbicas en organismos femeninos aumentan o disminuyen durante un ciclo de reproducción, por ejemplo, al generar descendencia y/o lactancia. Tenga en cuenta que los químicos muy hidrófobos pueden tener vidas medias de eliminación de meses o incluso más largas.


