1.2: Experimento cinético y métodos de separación
- Page ID
- 69464
2.1 Condiciones de transferencia de calor
Como es sabido, el experimento termoanalítico se lleva a cabo bajo condiciones de temperatura variable, con mayor frecuencia a una velocidad de calentamiento constante. De este modo, aparece un denominado gradiente de temperatura cuasi-estacionario en la muestra calentada por el fondo. La temperatura en cada punto de una muestra cilíndrica térmicamente inerte con radio R y altura H≤4R se describe mediante la siguiente ecuación:
\[T_{i}\left(r_{i}, t\right)=T_{0}+\beta t-\frac{\left(\beta R^{2}-r^{2}\right)}{4 a}\left[1+\frac{2 \lambda}{h R}-\frac{r^{2}}{R^{2}}\right] \label{2.1}\]
donde T i (r i, t) es la temperatura en el punto i de la muestra, T 0 es la temperatura de inicio del experimento, β es la tasa de cambio de temperatura dT/dt = constante, t es tiempo, R es el radio de la muestra cilíndrica, r i es el vector de radio de un punto de la muestra, a es la difusividad térmica,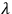 es la conductividad térmica y h es el coeficiente de emisión de calor en el sistema muestra-soporte. La ecuación\ ref {2.1}, que es una representación analítica de la solución a la ecuación de transferencia de calor bajo ciertos supuestos, muestra que se establece un denominado régimen de temperatura cuasi-estacionario en una muestra, correspondiente a un campo de temperatura parabólico en el sistema muestra-soporte idéntico a cualquier momento en el tiempo antes del inicio de los procesos térmicos. De ahí que el “campo de conversión” tenga la misma forma, es decir, cada punto de la muestra está en su propio estado diferente de uno vecino. Así, diferentes procesos pueden ocurrir en diferentes puntos de la muestra. En una reacción química acompañada de liberación o absorción de calor (reacciones exo y endotérmicas), el campo de temperatura puede cambiar significativamente y los gradientes de temperatura pueden ser tan grandes como varias decenas de kelvin. Para evitar esto, se deben crear condiciones bajo las cuales los gradientes de temperatura en el sistema de reacción no excedan el gradiente cuasi-estacionario dentro del error de determinación. Este requisito se cumple bajo condiciones de dilución térmica cuando el campo de temperatura y las condiciones de intercambio de calor son dictadas por las propiedades termofísicas del portamuestras. Esto ocurre al estudiar pequeñas cantidades de una sustancia cuando el portamuestras está compuesto por un metal con alta conductancia térmica y su peso excede significativamente el peso de la muestra. Bajo estas condiciones, se realiza un llamado régimen degenerado, y las condiciones de intercambio de calor tienen poco efecto en la cinética del proceso.
es la conductividad térmica y h es el coeficiente de emisión de calor en el sistema muestra-soporte. La ecuación\ ref {2.1}, que es una representación analítica de la solución a la ecuación de transferencia de calor bajo ciertos supuestos, muestra que se establece un denominado régimen de temperatura cuasi-estacionario en una muestra, correspondiente a un campo de temperatura parabólico en el sistema muestra-soporte idéntico a cualquier momento en el tiempo antes del inicio de los procesos térmicos. De ahí que el “campo de conversión” tenga la misma forma, es decir, cada punto de la muestra está en su propio estado diferente de uno vecino. Así, diferentes procesos pueden ocurrir en diferentes puntos de la muestra. En una reacción química acompañada de liberación o absorción de calor (reacciones exo y endotérmicas), el campo de temperatura puede cambiar significativamente y los gradientes de temperatura pueden ser tan grandes como varias decenas de kelvin. Para evitar esto, se deben crear condiciones bajo las cuales los gradientes de temperatura en el sistema de reacción no excedan el gradiente cuasi-estacionario dentro del error de determinación. Este requisito se cumple bajo condiciones de dilución térmica cuando el campo de temperatura y las condiciones de intercambio de calor son dictadas por las propiedades termofísicas del portamuestras. Esto ocurre al estudiar pequeñas cantidades de una sustancia cuando el portamuestras está compuesto por un metal con alta conductancia térmica y su peso excede significativamente el peso de la muestra. Bajo estas condiciones, se realiza un llamado régimen degenerado, y las condiciones de intercambio de calor tienen poco efecto en la cinética del proceso.
2.2 Condiciones de transferencia de masa
La descripción matemática de los eventos de transferencia masiva que acompañan a procesos heterogéneos está fuera del alcance de esta sección. Más bien, el objetivo es mostrar, a nivel cualitativo, cómo pueden ser afectados experimentalmente. Consideremos el proceso heterogéneo más simple descrito por la Ecuación 1.1.
En este proceso, se pueden discernir varios pasos de difusión posibles. Primero, se trata de la difusión de productos gaseosos a través de la interfaz entre la superficie sólida y el entorno. Esta etapa de transferencia de masa se puede controlar purgando el volumen de reacción con un gas inerte. En la Figura 2.1 se muestran los resultados del estudio de la deshidratación de CuSO 4·5H 2 O. La curva que refleja un proceso de tres etapas se obtuvo en condiciones de ambiente dinámico. El caudal de aire fue de 40 ml/min. La curva indica la pérdida de cinco moléculas de agua; el agua se elimina paso a paso, dos moléculas a la vez en la región 40—180°C y la quinta molécula se libera a 210—270°C.
La curva TG de un proceso de dos etapas pertenece al proceso en una atmósfera estática. La Figura 2.1 demuestra que el proceso en una atmósfera estática tiene otro mecanismo en comparación con el proceso en un crisol abierto en el flujo de aire. Se cree que los obstáculos de difusión que surgen en una atmósfera estática son responsables de un efecto significativo de la reacción posterior. Dado que la deshidratación de CuSO 4 ·5H 2 O es un proceso reversible, su cinética cambia notablemente. Si cambiar el caudal no cambia el caudal del proceso, este paso de transferencia de masa no tiene ningún efecto sobre la velocidad general.
Segundo, la transferencia de masa en el medio poroso del reactivo inicial es digna de consideración. La forma más sencilla de verificar la importancia de este paso es realizar una serie de experimentos con una muestra de diferente espesor en la misma superficie externa. Si el cambio en la altura de la capa no tiene ningún efecto sobre la velocidad del proceso, se puede considerar aproximadamente que la difusión en el reactivo poroso tiene poco efecto sobre el proceso en su conjunto.
La etapa de transferencia de masa en la capa del producto de reacción sólido es la más difícil de identificar. Una posible manera de revelar limitaciones de difusión en esta etapa es determinar cómo cambia la composición en diferentes partes del reactivo sólido a diversas profundidades. Sin embargo, este procedimiento es bastante laborioso y requiere el uso de métodos analíticos apropiados y una preparación especial de la muestra. Para determinar el papel de las limitaciones de difusión en la capa de producto, es una práctica común comparar la cinética de propagación de la interfaz medida a diferentes conversiones. Si existen obstáculos de difusión, los parámetros de Arrhenius disminuyen con un incremento en el grosor de la capa del producto. Si el coeficiente de temperatura de la velocidad de reacción E/R (en caso general es mejor usar E/R en lugar de E, porque E se mide en J/mol mientras que para los datos termoanalíticos de cualquier material o mezcla el uso de unidad “mol” no tiene sentido) permanece constante a diferentes conversiones, se puede afirmar que este tipo de difusión no es una etapa limitante de velocidad.
Así, los obstáculos de difusión pueden manifestarse en diferentes etapas del proceso en consideración y pueden depender tanto del diseño del equipo como de la naturaleza de las sustancias involucradas en el proceso.
Una conclusión que se puede extraer de lo anterior es que para mitigar un efecto notable de los procesos de transferencia de resultados experimentales, se deben utilizar pequeñas cantidades del reactivo inicial (unos miligramos) con porosidad mínima o menores velocidades de calentamiento. Además, es importante que la muestra se coloque sobre una superficie bastante grande y que se utilicen gases de purga a un caudal bastante alto.
2.3 Nucleación
Si nuestro experimento se lleva a cabo en condiciones tales que los fenómenos de transferencia no tienen ningún efecto sobre la forma de las curvas termoanalíticas, la reacción puede pensarse, a una primera aproximación, como un proceso cuasi-una etapa que representa las transformaciones químicas de la reacción 1.1. Sin embargo, los resultados experimentales dependen también de un cambio en la morfología del reactivo inicial, es decir, de la formación del producto de reacción, en primer lugar, en la superficie del reactivo. En este caso, la cinética de conversión está dominada por la nucleación de la nueva fase y el posterior crecimiento de sus núcleos. Para procesos heterogéneos, generalmente no somos conscientes de qué transformaciones atómicas o moleculares conducen a la nucleación de la fase producto, por lo que el proceso está representado por un conjunto de algunas transformaciones formalmente geométricas. La cinética no isotérmica tiene como objetivo encontrar las formas de funciones y sus parámetros describiendo estas transformaciones.
La nucleación está relacionada con la etapa química del proceso. Sin embargo, debido a la complejidad y diversidad de los procesos de nucleación, creemos que es necesario detenernos brevemente en este fenómeno, sin entrar en descripciones teóricas de los diferentes pasos de estos procesos. La consideración se centra en las manifestaciones de los procesos de nucleación en el experimento termoanalítico y en el diseño adecuado de este último.
En el caso de procesos topoquímicos heterogéneos, la interfaz entre el reactivo sólido inicial y el producto de reacción sólido se forma con mayor frecuencia a través de procesos de nucleación. La reacción puede comenzar simultáneamente sobre toda la superficie. Además, la nucleación puede ocurrir en sitios separados de la superficie, o por el mecanismo de cadena ramificada, u otro. Posibles mecanismos de estos procesos han sido bien documentados (ver, e.g., [1,4,5]). Aquí, no pretendemos entrar en detalles de todos los mecanismos posibles; consideraremos estos fenómenos con más detalle al describir el software NETZSCH.
Para realizar un experimento cinético y obtener resultados reproducibles, es necesario estandarizar la superficie del reactivo inicial y crear una cantidad definida de núcleos antes del experimento cinético. En el marco del estudio termoanalítico, solo podemos medir la conversión (determinación de la conversión o la velocidad de reacción global). Aquí, no consideramos el uso de otros métodos físicos para determinar el número de núcleos en la superficie del reactivo, por ejemplo, el conteo directo de núcleos bajo el microscopio. En el análisis térmico, el método más accesible y eficiente es la nucleación natural en condiciones estándar. En este método, previo al experimento cinético, se trata térmicamente una cantidad notable del reactivo inicial hasta una cierta conversión. Por regla general, la conversión asciende a varios por ciento. El método se basa en que las últimas etapas de nucleación tienen poco efecto en el desarrollo de la interfaz de reacción, ya que una gran parte de los centros potenciales ya han sido activados. La muestra así estandarizada se utiliza en todos los experimentos cinéticos, es decir, a diferentes velocidades de calentamiento.
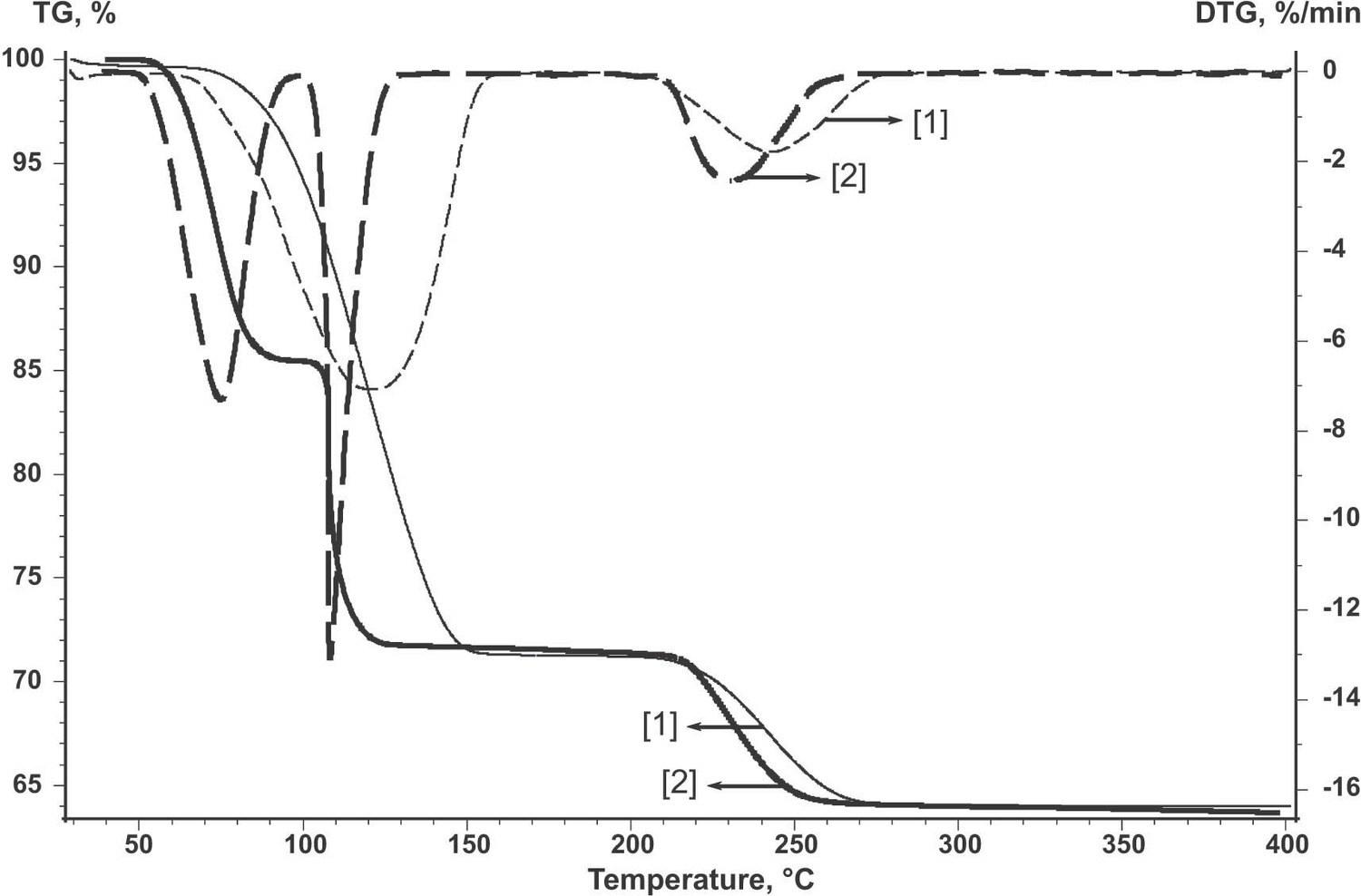
Usando la deshidratación CuSO 4 ·5H 2 O como ejemplo, consideremos cómo cambian las curvas termoanalíticas después de la nucleación natural en condiciones estándar en comparación con la muestra no estandarizada.
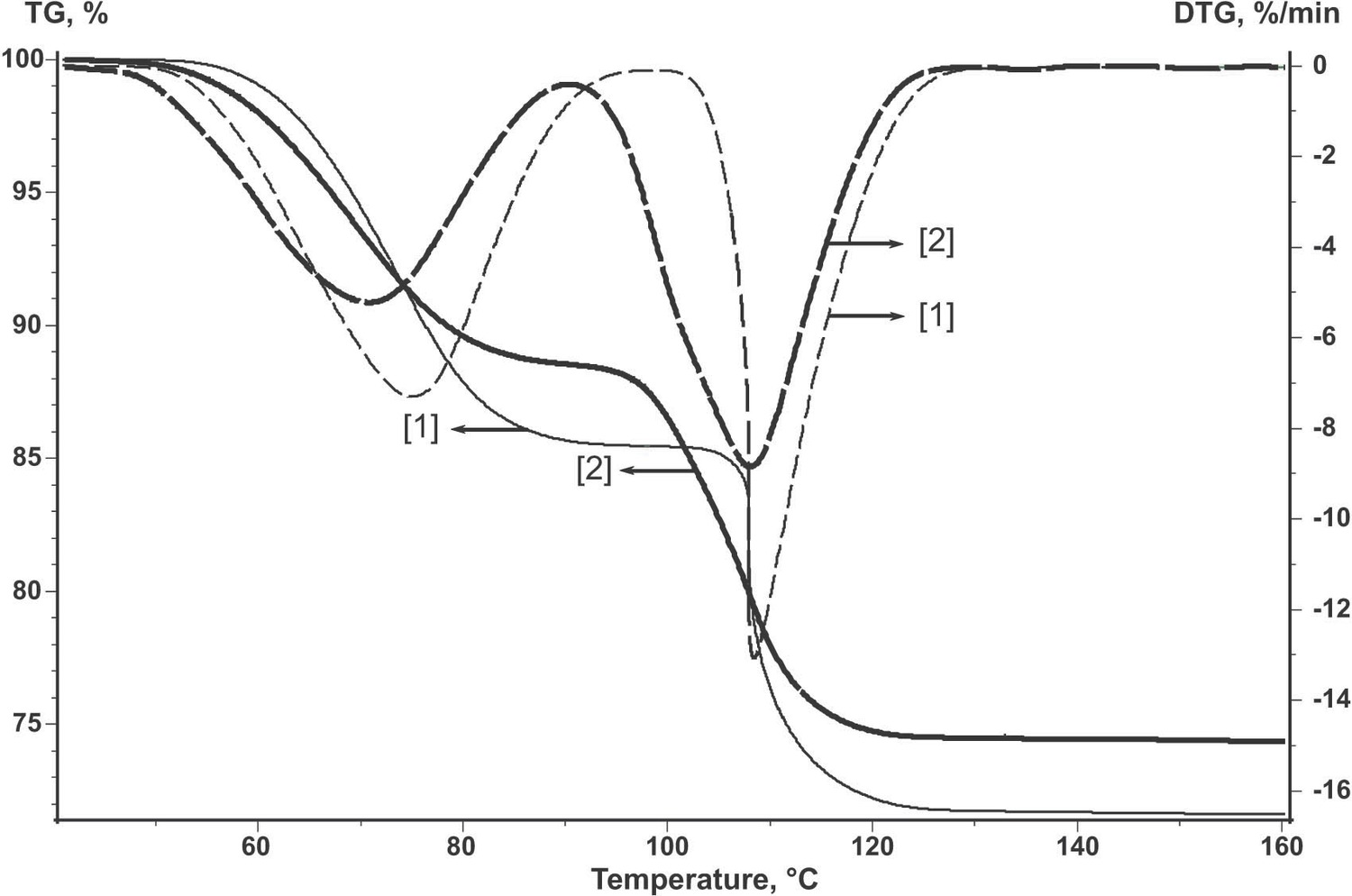
La Figura 2.2 muestra las curvas TG y tasa de pérdida de peso (DTG) para el sulfato de cobre pentahidratado inicial no tratado (curva 2) y para la muestra sometida a nucleación natural en condiciones estándar (curva 1). Para ello, el polvo del reactivo inicial se calentó a T = 70 °C hasta que se perdió 10% H 2 O. Como se observa, las formas de las curvas TG y DTG del reactivo tratado difieren de las del reactivo inicial. De ahí que la cinética de deshidratación cambie.
Por lo tanto, el uso de métodos cinéticos no isotérmicos requiere llevar a cabo un experimento especial que implica una serie de ejecuciones a diversas velocidades de calentamiento utilizando los métodos de separación de la etapa limitante de velocidad, y pequeñas cantidades del reactivo sólido, gases de purga, crisoles de tamaño apropiado, etc.


