1.4: Análisis cinético basado en datos de termogravimetría
- Page ID
- 69466
4.1 Deshidratación de Oxalato de Calcio Monohidrato
Consideremos la deshidratación como la reacción que se produce por el esquema
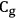 , es decir,
, es decir,
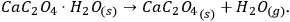
La Figura 4.1 muestra las curvas TG de la deshidratación de oxalato de calcio monohidratado.
La deshidratación de CaC 2 O 4 · H 2 O se estudió en una termomicrobalanza Netzsch TG 209 F 3 Tarso. El experimento se realizó a tres velocidades de calentamiento: 5, 7.5 y 10 K/min. Se tomaron tres medidas a cada velocidad de calentamiento, siendo idénticas otras condiciones. Se utilizaron crisoles de aluminio estándar sin tapas como soportes. El proceso se realizó en un flujo de aire seco a una velocidad de 200 ml/min. El reactivo inicial fue oxalato de calcio recién precipitado con un tamaño de partícula de 15—20 μm. Las porciones pesadas del reactivo fueron de 5—6 mg por cada velocidad de calentamiento.
4.2 Procedimiento Computacional. Solución de los Problemas Cinéticos Inversa y Directa. Proceso cuasi de una etapa
Como se desprende de la Figura 4.1, la deshidratación en el intervalo de temperatura dado puede considerarse una reacción de casi una etapa a todas las velocidades de calentamiento utilizadas. Los datos experimentales obtenidos en equipos NETZSCH se procesan con el software NETZSCH Proteus.
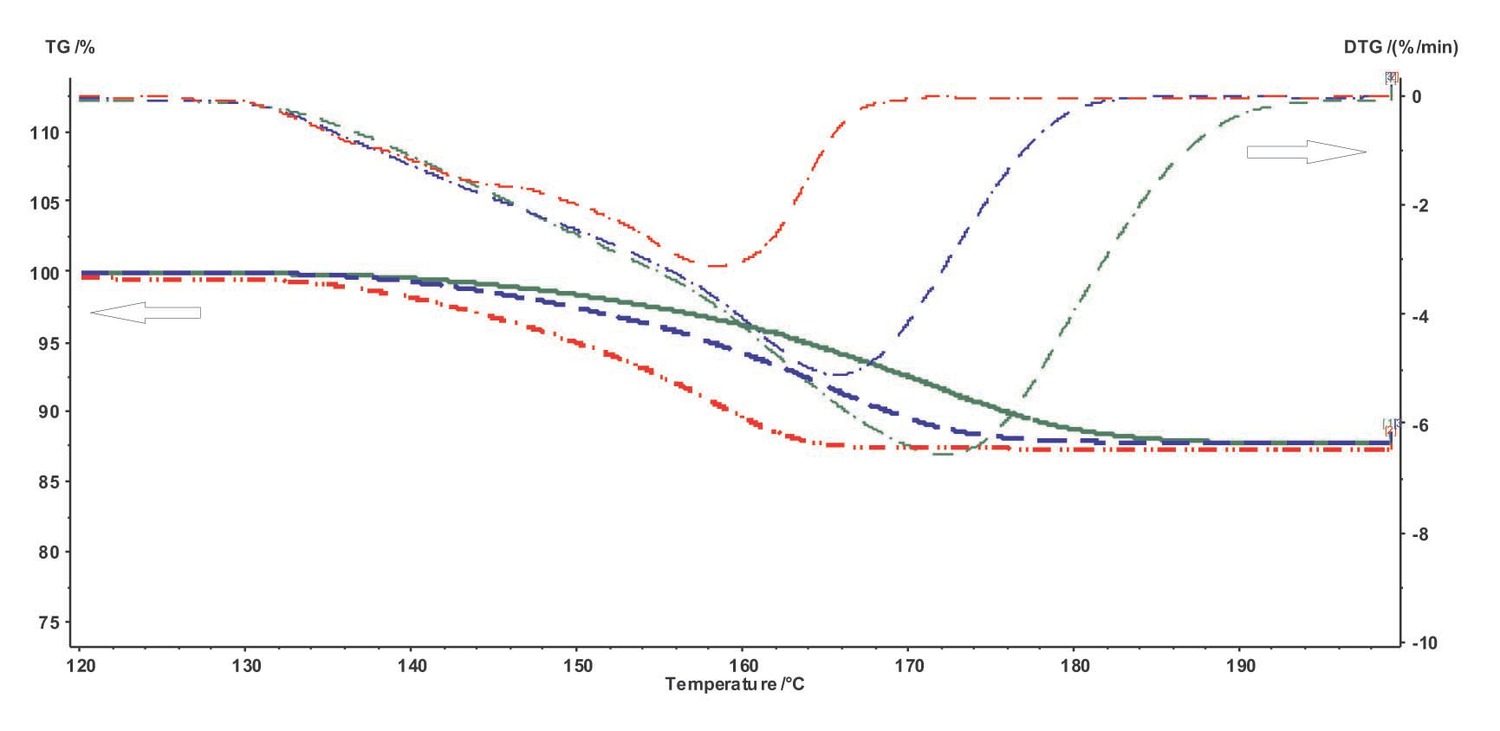
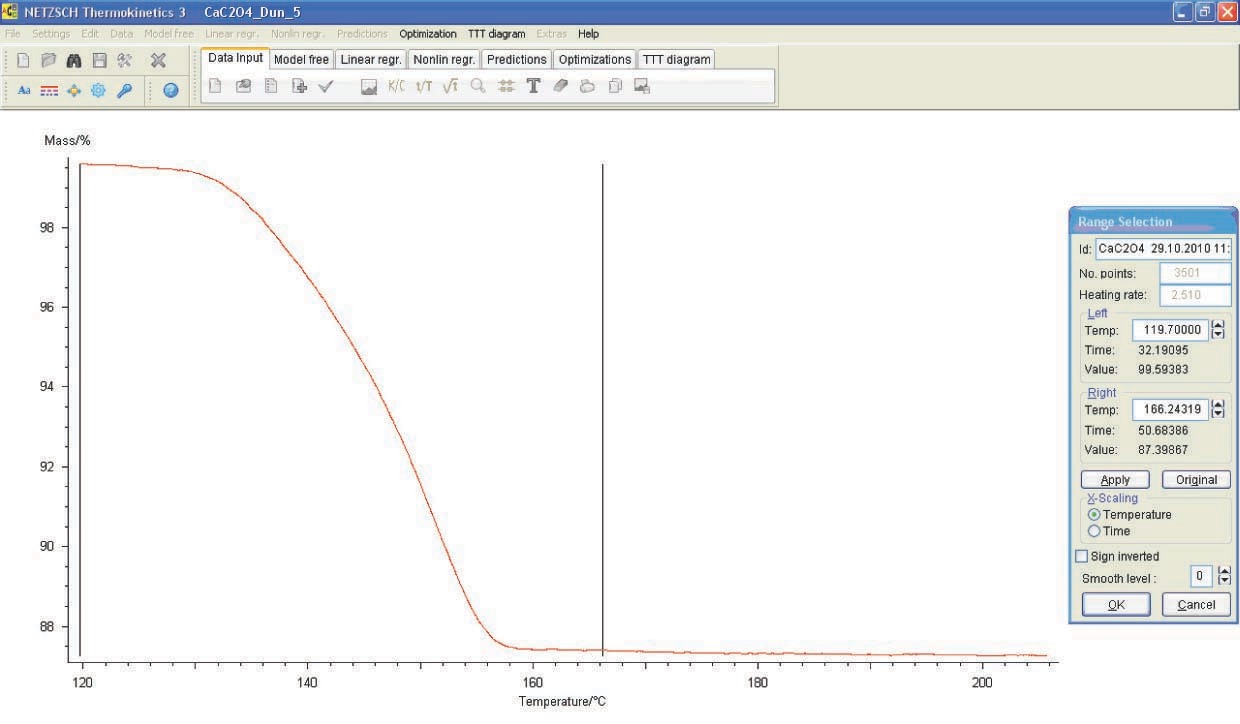
Para seguir trabajando con los datos experimentales utilizando el software NETZSCH Thermokinetics, es necesario exportar datos del programa Proteus en forma tabulada (señal medida en función de la temperatura o el tiempo) como un archivo ASCII. Para ello, el usuario deberá seleccionar la curva deseada y hacer clic en el botón Extras Exportar datos en la barra de herramientas de Proteus. El usuario deberá ingresar los límites inferior y superior del rango de datos a exportar. Para especificar correctamente los límites, se utiliza la derivada de la curva seleccionada. Los límites izquierdo y derecho se eligen en los rangos donde la derivada se convierte en cero (Figura 4.2).
Exportar datos en la barra de herramientas de Proteus. El usuario deberá ingresar los límites inferior y superior del rango de datos a exportar. Para especificar correctamente los límites, se utiliza la derivada de la curva seleccionada. Los límites izquierdo y derecho se eligen en los rangos donde la derivada se convierte en cero (Figura 4.2).
Recuerde que la derivada de la curva seleccionada se puede obtener haciendo clic en el icono correspondiente en la ventana del programa NETZSCH Proteus.
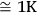 . Para el rango de temperatura seleccionado, se utilizan 100 puntos por cada curva. Cabe señalar que el uso de un incremento menor es físicamente irrazonable ya que el valor S refleja las propiedades del sistema en cuestión, pero no es la precisión de medición de temperatura proporcionada por un instrumento, que es un orden de menor magnitud. En este caso, se deben tomar en cuenta las características específicas del proceso.
. Para el rango de temperatura seleccionado, se utilizan 100 puntos por cada curva. Cabe señalar que el uso de un incremento menor es físicamente irrazonable ya que el valor S refleja las propiedades del sistema en cuestión, pero no es la precisión de medición de temperatura proporcionada por un instrumento, que es un orden de menor magnitud. En este caso, se deben tomar en cuenta las características específicas del proceso.
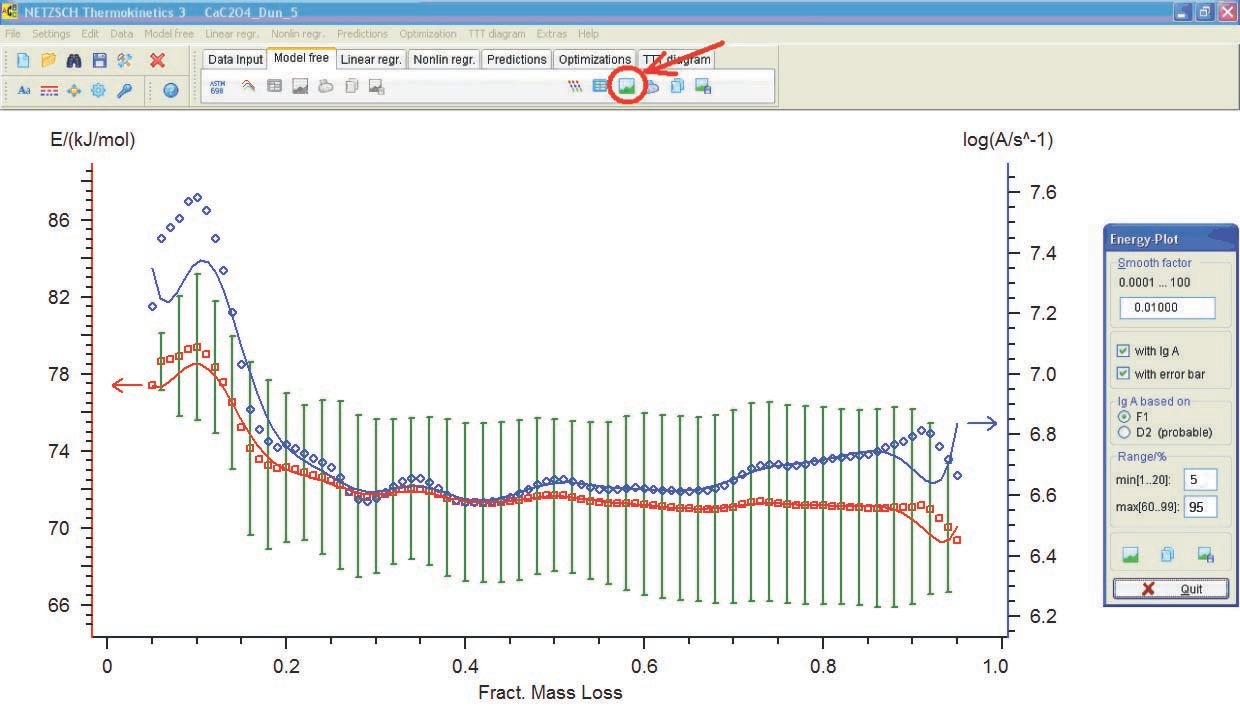
4.3 Análisis de resultados de cómputos
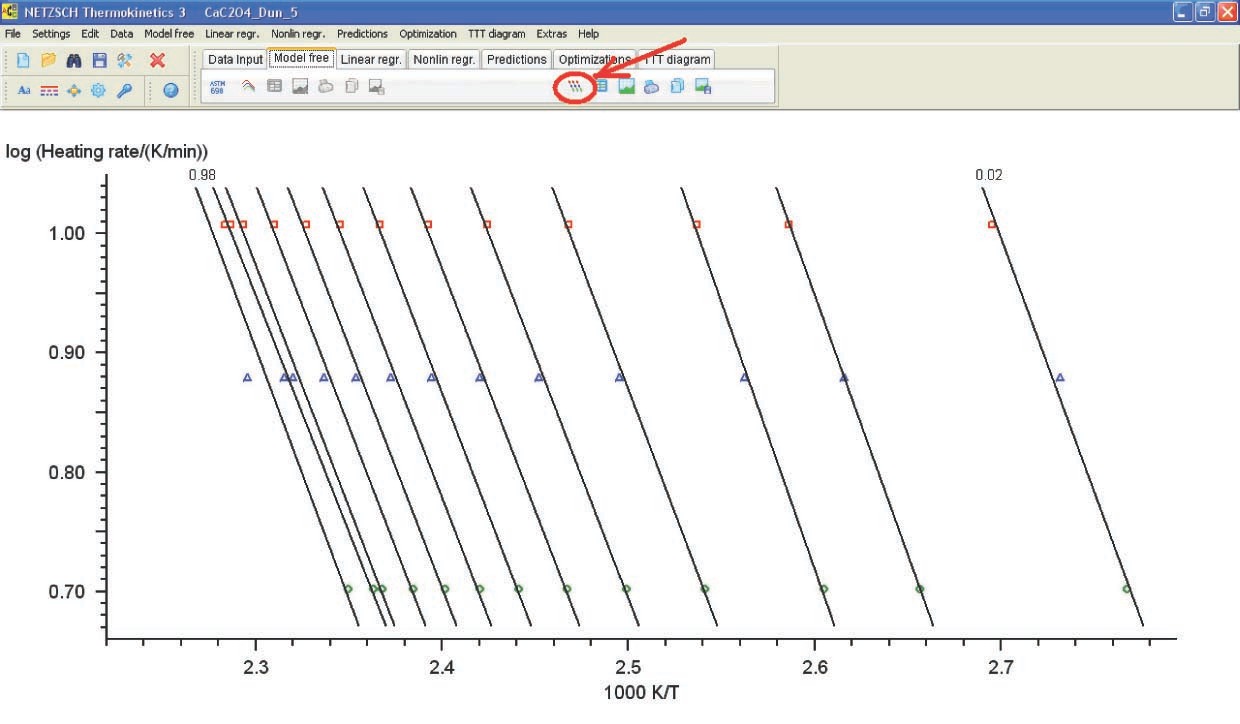
Consideremos los resultados de cómputos obtenidos por el método de regresión lineal para la deshidratación CaC 2 O 4 · H 2 O (Figura 4.19).
La Figura 4.19 presenta los parámetros de Arrhenius y la forma y características de la función que mejor se ajusta a los resultados experimentales (desde el punto de vista estadístico). Para la reacción en consideración, la mejor función de ajuste es la ecuación de Prout-Tompkins con autocatálisis (el código Bna), que se indica en la parte superior izquierda de la tabla. Sin embargo, antes de discutir el significado de los resultados obtenidos, consideremos la ventana F-test: Fit Quality (Figura 4.20).
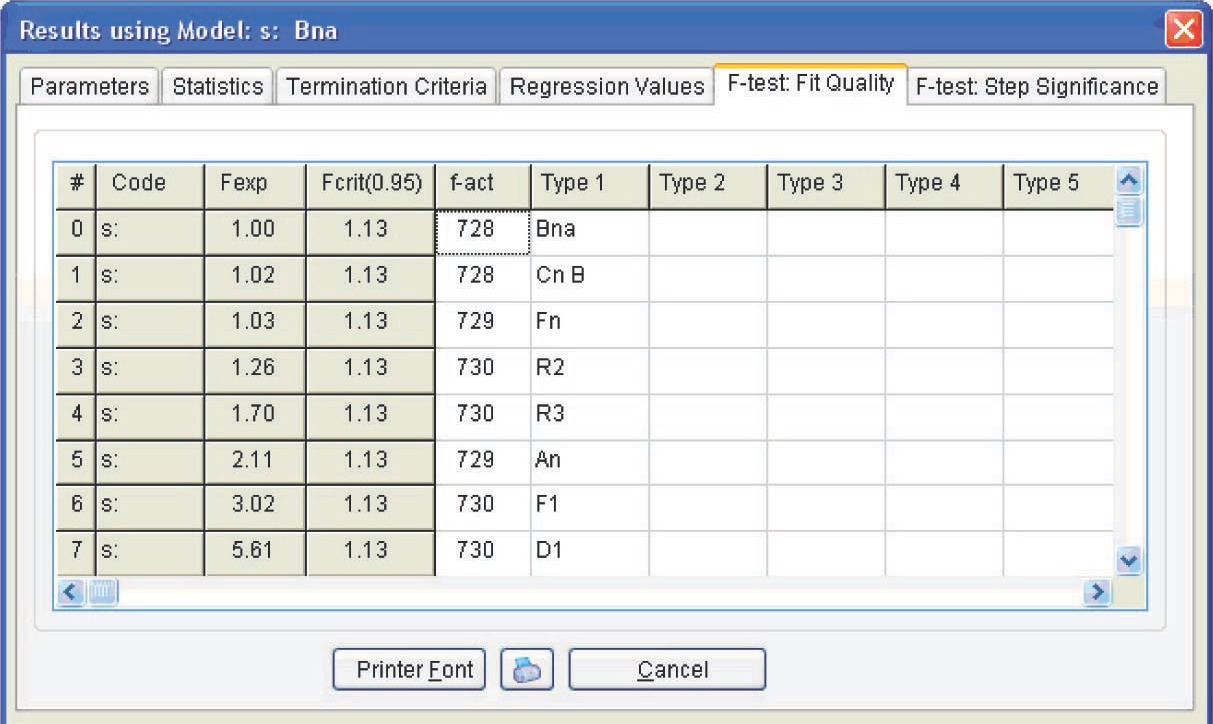
4.3.1 La prueba F: Calidad de ajuste y prueba F
Las ventanas de significancia escalonada presentan el análisis estadístico de la calidad de ajuste para diferentes modelos. Esto nos permite determinar utilizando los métodos estadísticos cuál de los modelos proporciona el mejor ajuste para los datos experimentales.
Para realizar dicho análisis se utiliza la prueba exacta de Fisher. En general, la prueba de Fisher es una relación de varianza que permite verificar si la diferencia entre dos estimaciones independientes de la varianza de algunas muestras de datos es significativa. Para ello, se compara la relación de estas dos varianzas con el valor tabulado correspondiente de la distribución de Fisher para un número dado de grados de libertad y nivel de significancia. Si la relación de dos varianzas excede el valor teórico correspondiente de la prueba de Fisher, la diferencia entre las varianzas es significativa.
En el software Thermokinetics, se utiliza la prueba de Fisher para comparar las cualidades de ajuste aseguradas por diferentes modelos. El modelo de mejor ajuste, es decir, el modelo con la suma mínima de desviaciones cuadradas, se toma como referencia (denotado convencionalmente como modelo 1). Entonces, cada modelo es comparado con el modelo de referencia. Si el valor de la prueba de Fisher no supera el valor crítico, la diferencia entre el modelo actual 2 y el modelo de referencia 1 es insignificante. No hay razón para entonces creer que el modelo 1 proporciona una descripción más adecuada del experimento en comparación con el modelo 2.
El valor de F exp se estima mediante la prueba de Fisher:
\[F_{e x p}=\frac{L S Q_{1} / f_{1}}{L S Q_{2} / f_{2}} \label{4.2}\]
El valor de F exp se compara con la distribución de Fisher F crit (0.95) para el nivel de significancia de 0.95 y el número correspondiente de grados de libertad.
Figura 4.21).
En la columna Const., se establece la opción 'false' para los parámetros que se deben variar y se elige la opción 'true' para los parámetros que permanecen constantes. Las tres columnas a la derecha de esta columna están destinadas a imponer restricciones a los valores seleccionados. Los resultados del cálculo se presentan en la Figura 4.25.
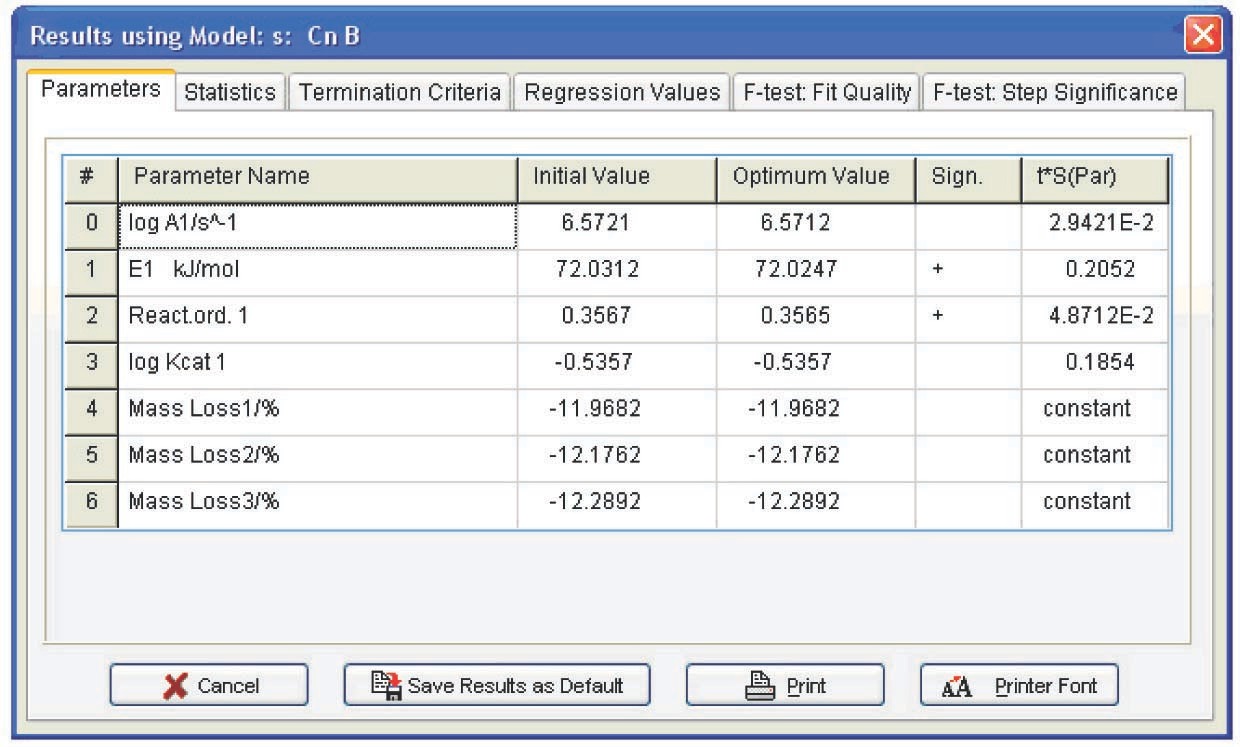
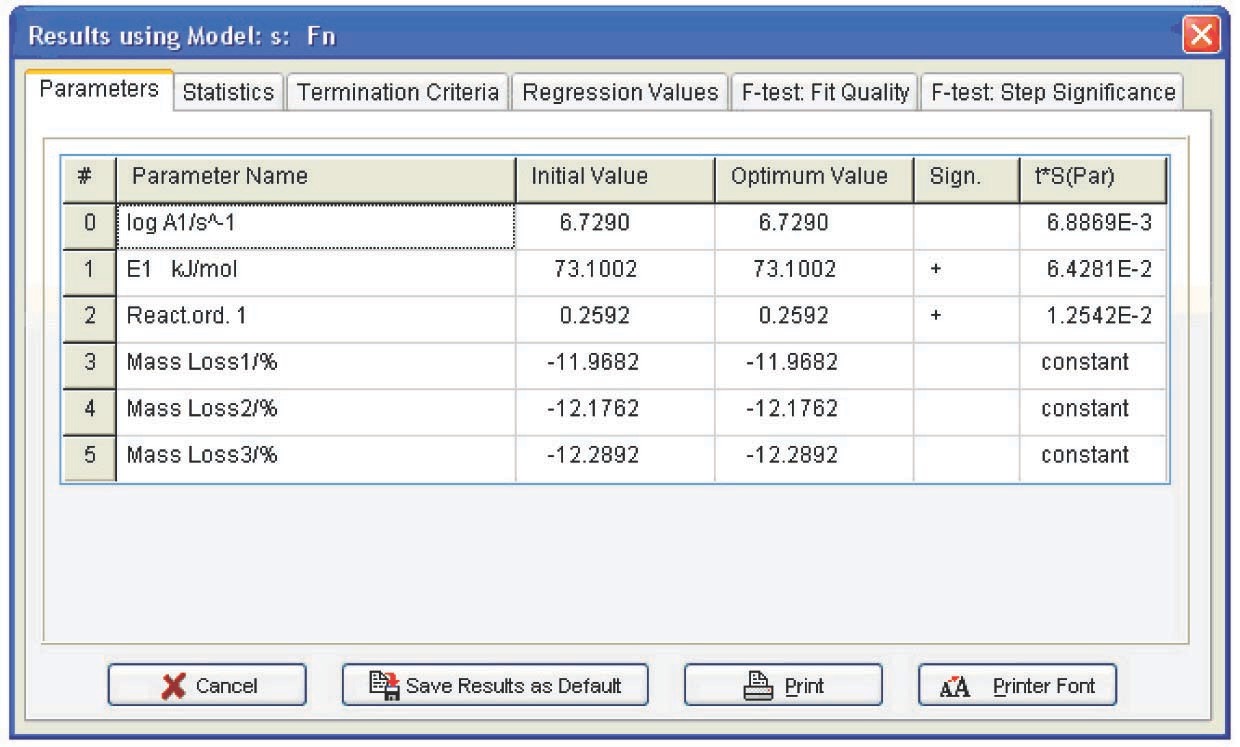
De la Tabla 4.1 se pueden extraer las siguientes conclusiones: primero, los parámetros de autocatálisis para las funciones Bna y CnB son casi nulos, es decir, todos se reducen a la función Fn. Segundo, los errores de los parámetros de Arrhenius para Fn son mínimos. Por lo tanto, la deshidratación del oxalato de calcio se describe mejor por la función de orden n. Se puede considerar que el orden de reacción es 1/3, es decir, el proceso es descrito por la “ecuación de esfera de contracción”. Esto significa que la muestra consiste en partículas esféricas del mismo tamaño y que la deshidratación es un proceso homotético, es decir, las partículas durante la descomposición experimentan una disminución de tamaño autosimilar. Tal mecanismo es inherente a la termólisis de los hidratos cristalinos inorgánicos. Así, el problema de la macrocinética de deshidratación de CaC 2 O 4 ·H 2 O puede pensarse como resuelto.
| Código de función | registro A | E, kJ/mol | Orden de reacción n | log K cat 1 | Exp |
|---|---|---|---|---|---|
| Bna | 6.8±0.6 | 73±6 | 0.34±0.25 | — | 0.06±0.14 |
| CnB | 6,8±1 | 74±8 | 0.41±0.48 | -0.45±1.9 | — |
| Fn | 7.0±0.1 | 75.2±0.8 | 0.34±0.25 | — | — |
El proyecto creado en el software NETZSCH Thermokinetics se guarda haciendo clic en el botón común (Figura 4.27).