¿Qué es la quimiometría y por qué estudiarla?
( \newcommand{\kernel}{\mathrm{null}\,}\)
¿Qué es la Quimiometría?
La definición de quimiometría es evidente en su nombre, donde quimio- significa química y —métrica significa medición; así, la quimiometría es el estudio de las mediciones químicas (y bioquímicas) y es una rama de la química analítica. Ejemplos de aplicaciones quimiométricas incluyen
- asegurar que los datos que recopilamos son adecuados para nuestros fines
- mejorar la calidad de una señal analítica mediante la búsqueda de formas de minimizar la contribución del ruido
- informar sobre un experimento de manera que estime la incertidumbre en sus resultados y nuestra confianza en esos resultados
- construir modelos útiles que predicen los resultados de futuros experimentos
- extraer de datos químicos, información oculta pero analíticamente útil mediante la búsqueda de patrones subyacentes en los datos
Estos temas, y otros, son el foco de este libro de texto.
¿Por qué estudiar quimiometría?
Por qué es importante la quimiometría queda claro cuando consideramos un problema analítico simple: ¿Cómo determinamos la concentración de cobre en una muestra y cómo y por qué ha cambiado con el tiempo el método analítico utilizado para este análisis?
Antes de la década de 1950, la gravimetría y la titrimetría fueron los métodos analíticos más comunes para determinar la concentración de cobre en una variedad de muestras. Ambos métodos se basan en relaciones estequiométricas simples. En un análisis gravimétrico, por ejemplo, llevamos cobre en solución como Cu 2 + (aq), precipitarlo como Cu (OH) 2 (s)
Cu2+(aq)+2OH–(aq)→Cu(OH)2(s)
y aislarlo como CuO (s) después de calentarlo a una temperatura alta.
Cu(OH)2(s)→CuO(s)+H2O(l)
Luego utilizamos la masa de CuO (s) para determinar la cantidad de cobre en la muestra original, teniendo en cuenta la relación estequiométrica simple entre Cu y CuO donde cada mol de Cu produce un mol de CuO.
Puedes leer más sobre gravimetría en el Capítulo 8 del libro de texto Química Analítica 2.1.
En un análisis titrimétrico, llevamos cobre a solución como Cu 2 + (aq) y lentamente agregamos una solución de ácido etlienodiaminetetracético, EDTA, hasta que los moles de EDTA añadidos sean iguales a los moles de Cu 2 + en la muestra original.
Cu2+(aq)+EDTA(aq)→Cu(EDTA)2+(aq)
Si conocemos la concentración de nuestra solución de EDTA, entonces es fácil determinar la cantidad de Cu 2 + en la muestra original usando la relación estequiométrica simple entre Cu 2+ y EDTA. Para ambos análisis, un tratamiento quimiométrico de los datos consiste en poco más que reportar un promedio, una desviación estándar y un intervalo de confianza.
Puedes leer más sobre la titrimetría en el Capítulo 9 del libro de texto Química Analítica 2.1.
La gravimetría y la titulación son métodos analíticos útiles cuando el cobre es un analito mayor (> 1% p/p) o un analito menor (0.01% w/w — 1% w/w), pero menos útil si es un analito traza (10 −7% w/w — 0.01% w/w). Ninguno de los dos métodos permite un análisis rápido, lo que los hace menos útiles si necesitamos analizar múltiples analitos en un gran número de muestras.
Para obtener más información sobre la escala de operaciones para la química analítica, incluyendo las concentraciones relativas de analitos en muestras, consulte el Capítulo 3.4 del libro de texto Química Analítica 2.1.
A partir de la década de 1950 surgieron métodos instrumentales de análisis en los que una señal analítica se relaciona con la concentración del analito, no a través de la estequiometría de una o más reacciones químicas, sino a través de una relación teórica en la que al menos una variable no es conocida por nosotros. Por ejemplo, una solución de Cu 2 + (aq) es de color azul claro porque absorbe la luz en un amplio rango de longitudes de onda entre aproximadamente 600—900 nm, como vemos en la Figura1.
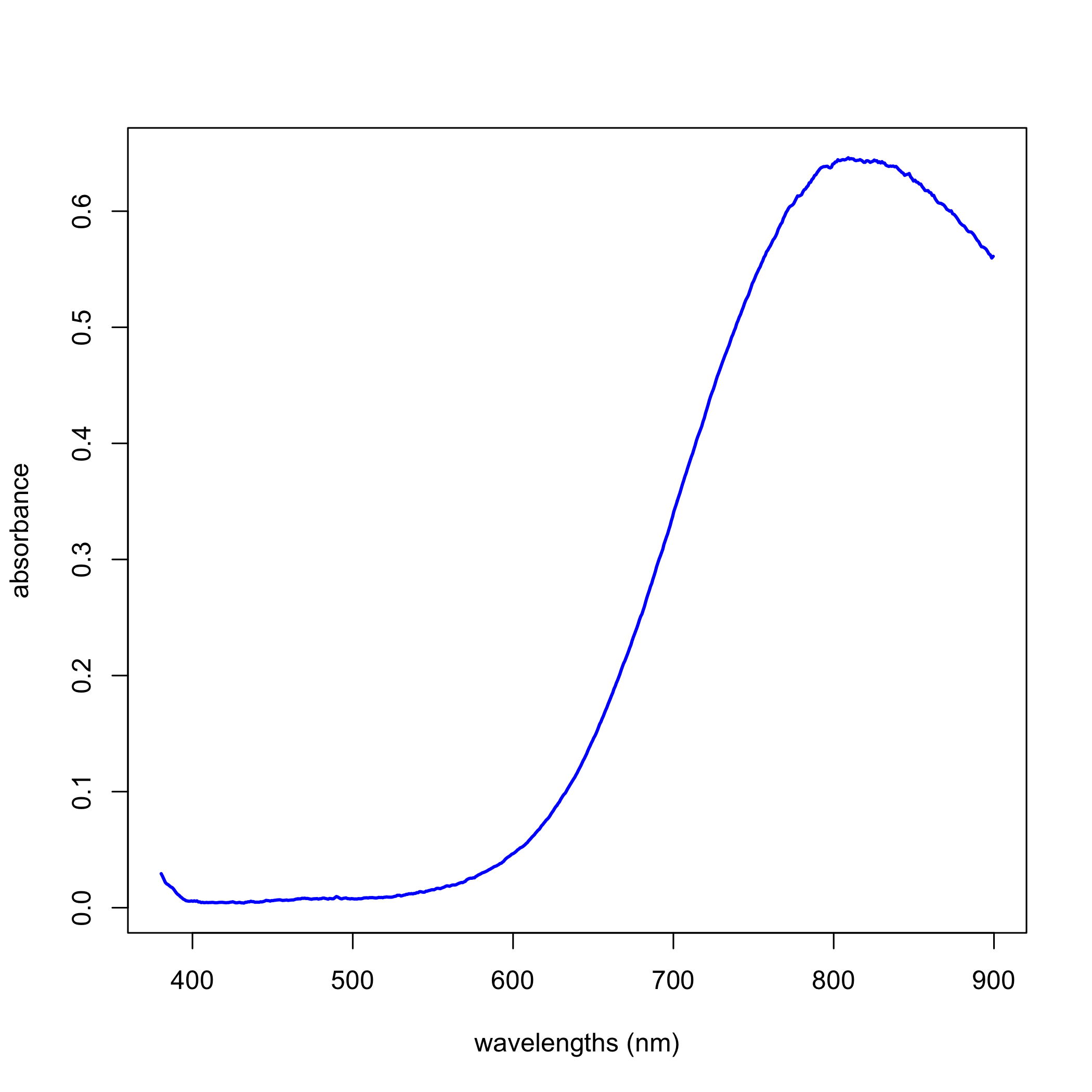
La relación entre la absorbancia de una soluciónAλ, a una longitud de onda específicaλ, y una concentración dada, C, de Cu 2 + (aq) viene dada por la ley de Beer
Aλ=ϵλbC
dondeϵλ es la absortividad molar del analito a la longitud de onda seleccionadaλ, y b es la distancia que la luz recorre a través de la muestra. De estas variables—Aλ,ϵλ, b y C —el valor de no nosϵλ es conocido. Contraste eso con gravimetría y titrimetría donde casi siempre conocemos las relaciones estequiométricas exactas.
Para obtener más información sobre la espectroscopia de absorción visible y la Ley de Beer's, consulte el Capítulo 10.2 en Química Analítica 2.1.
Aunque podemos medirAλ y b, no podemos calcular C sin determinar primero el valor deϵλ, lo cual hacemos usando una solución estándar para la que se conoce la concentración de analito, C std. Si usamos un solo estándar y una sola longitud de onda, que es toda la instrumentación temprana permitido, entonces tenemos
[Aλ,std]1 × 1 = [ϵλb]1 × 1 ×[Cstd]1 × 1
para lo cual podemos resolver exactamenteϵλb. Con este valor en la mano, podemos usar la absorbancia de la muestra para calcular la concentración del analito en la muestra.
Tenga en cuenta que aquí estamos expresando la Ley de Beer usando la notación matricial[ ]r×c, donde r es el número de filas y c es el número de columnas en la matriz. En esta ecuación, cada matriz contiene un solo valor: una absorbancia, un valor paraϵλb, o una concentración. Una matriz con un solo valor es un escalador. Una matriz con una sola columna o una sola fila es un vector. El motivo para expresar de esta manera la Ley de Beer pronto será evidente.
Si usamos estándares c en lugar de un estándar, y si seguimos usando una sola longitud de onda, entonces podemos escribir la ley de Beer de esta manera
[⋯ Aλ,std ⋯]1 × c = [ϵλb]1 × 1 ×[⋯ Cstd ⋯]1 × c + [⋯ E ⋯]1 × c
donde los valores de absorbancia y las concentraciones son vectores con dimensiones de 1× c (1 longitud de onda y c estándares), donde el valor deϵλb es un escalar (una constante), y donde tenemos un vector de errores residuales, E, que da las incertidumbres en nuestro medido valores de absorbancia. ¡Tener múltiples estándares proporciona una nueva fuente de información que nos permite considerar la incertidumbre experimental!
Obsérvese que la ecuaciónAλ,std=ϵλbC está en forma de línea rectay=β0x+β1,, para lo cual un análisis de regresión lineal estándar devuelve valores para las dos constantes: la pendienteβ0, que es equivalente aϵλb y la intercepción yβ1, que es equivalente a la residual error.
Si usamos longitudes de onda r y estándares c, entonces podemos escribir la ley de Beer de esta manera
[⋯⋯⋯⋮Aλ,std⋮⋯⋯⋯]r×c=[⋮ϵλb⋮]r×1×[⋯Cstd⋯]1×c+[⋯⋯⋯⋮E⋮⋯⋯⋯]r×c
donde los valores de absorbancia y los errores residuales están en matrices (con longitudes de onda en filas y estándares en columnas), los valores paraϵλb cada longitud de onda están en un vector, y la concentración del analito en los patrones está en un vector; esta es una forma computacionalmente más difícil de regresión, pero , como aprenderemos en un capítulo posterior, uno que podamos resolver.
¡Pero podemos empujar esto aún más! Tenga en cuenta que laϵλb matriz tiene una columna porque estamos usando una sola longitud de onda, y la matriz C tiene una fila porque asumimos solo un analito. Siempre que el número de analitos sea menor que el menor del número de longitudes de onda o el número de estándares, entonces podemos incluir analitos adicionales. Por ejemplo, si tenemos n analitos, entonces
[⋯⋯⋯⋮Aλ,std⋮⋯⋯⋯]r×c=[⋯⋯⋯⋮ϵλb⋮⋯⋯⋯]r×n×[⋯⋯⋯⋮Cstd⋮⋯⋯⋯]n×c+[⋯⋯⋯⋮E⋮⋯⋯⋯]r×c
donde cada columna de laϵλb matriz contiene losϵλb valores para un analito diferente en una de nuestras longitudes de onda, y cada fila en la matriz C es la concentración de un analito diferente en uno de nuestros estándares; nuevamente, podemos usar regresión lineal para analizar los datos.
Pasar del análisis de un solo analito en un solo estándar usando una sola longitud de onda
[Aλ,std]1 × 1 = [ϵλb]1 × 1 ×[Cstd]1 × 1
al análisis de múltiples analitos utilizando múltiples estándares y múltiples longitudes de onda
[⋯⋯⋯⋮Aλ,std⋮⋯⋯⋯]r×c=[⋯⋯⋯⋮ϵλb⋮⋯⋯⋯]r×n×[⋯⋯⋯⋮Cstd⋮⋯⋯⋯]n×c+[⋯⋯⋯⋮E⋮⋯⋯⋯]r×c
requirió un aumento significativo en el poder computacional y un crecimiento significativo en las capacidades de la instrumentación; no es sorprendente que las nuevas técnicas quimiométricas se apoyen y son impulsadas por los desarrollos en informática y análisis instrumental! A su vez, las nuevas técnicas quimiométricas abren nuevas áreas de análisis y fomentan innovaciones en informática y análisis instrumental. Es por ello que la quimiometría es una parte importante de la química analítica.


