1: Espectroscopia
- Page ID
- 70921
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La espectroscopia generalmente se define como el área de la ciencia relacionada con la absorción, emisión y dispersión de la radiación electromagnética por átomos y moléculas, que pueden estar en la fase gaseosa, líquida o sólida. La radiación electromagnética visible se llama luz, aunque los términos luz, radiación y radiación electromagnética se pueden usar indistintamente. Descubrirás algunas propiedades de la radiación electromagnética en las Actividades 1 y 2.
La espectroscopia jugó un papel clave en el desarrollo de la mecánica cuántica y es esencial para comprender las propiedades moleculares y los resultados de experimentos espectroscópicos. Se utiliza como un “escalón” para llevarnos a los conceptos de la mecánica cuántica y la descripción mecánica cuántica de las propiedades moleculares con el fin de hacer la discusión más concreta y menos abstracta y matemática. Un espectro es una gráfica que muestra la intensidad de la radiación a diferentes longitudes de onda o la respuesta del sistema atómico o molecular a diferentes longitudes de onda de la radiación. Ejemplos de espectros de absorción y fluorescencia se muestran en las Figuras\(\PageIndex{1}\) y\(\PageIndex{2}\).
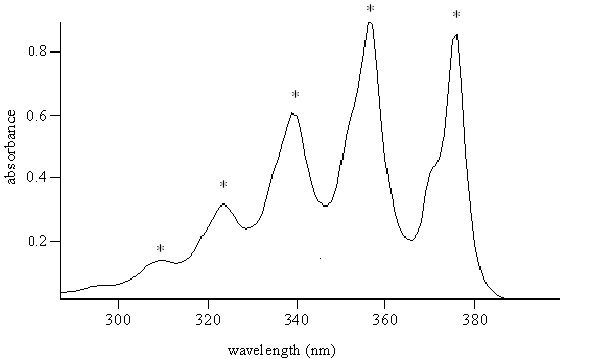
Un espectro de absorción muestra cuánta luz es absorbida por una muestra en cada longitud de onda de la radiación. Los espectros de absorción generalmente se muestran en una de tres formas diferentes: como una gráfica de la transmisión (T), absorbancia (A) o el coeficiente de absorción (ε) en el eje y con la longitud de onda en el eje x. A veces la absorbancia se llama densidad óptica (OD). Si definimos I0 como la intensidad de la luz incidente sobre una muestra, I como la intensidad de la luz transmitida por la muestra, d como el grosor de la muestra, y c como la concentración de las especies absorbentes en la muestra, entonces
\[T = \dfrac {I}{I_0} \label {1.1}\]
\[A = log \dfrac {I_0}{I} \label {1.2}\]
\[\epsilon = \dfrac {1}{dc} log_{10} \left (\dfrac {I_0}{I} \right ) \label {1.3}\]
\(\ref{1.3}\)La ecuación es una forma reorganizada de la ley de Beer, tal como se desarrolló en un Problema al final de este capítulo. Cada una de las cantidades I,\(I_0\), y ε son funciones de la longitud de onda de la luz que se está utilizando.
Se utilizan tres formas diferentes de trazar los espectros de absorción porque cada uno tiene ventajas particulares. La función de transmisión es simple. La absorbancia condensa grandes variaciones mediante el uso de un logaritmo, por lo que las gráficas de tamaño razonable muestran variaciones grandes y pequeñas en la intensidad de la luz. Además, la absorbancia es proporcional a una propiedad fundamental, que es el coeficiente de absorción. El coeficiente de absorción es de interés porque se puede calcular a partir del momento de transición, que es una cantidad mecánica cuántica. En el Capítulo 4, utilizaremos la mecánica cuántica para calcular los momentos de transición para algunas moléculas.
La energía a menudo se libera de átomos, moléculas y sólidos como luz. Esta luz se denomina luminiscencia en general y fluorescencia y fosforescencia en situaciones particulares que se identifican por el tiempo de decaimiento de la luminiscencia y la naturaleza del estado excitado. El tiempo de decaimiento es el tiempo característico que tarda en desaparecer la luminiscencia después de que se elimina o apaga la fuente de energía. La fluorescencia decae rápidamente (en microsegundos o más rápido) y la fosforescencia decae lentamente (milisegundos a minutos). Los conceptos de momento angular y un momento de transición que se desarrollan en otros capítulos te ayudarán a entender por qué estos tiempos de decaimiento son tan diferentes y dependen de la naturaleza del estado excitado. El espectro de fluorescencia en la Figura\(\PageIndex{2}\). muestra cómo la intensidad de la luz emitida por la fluoresceína varía con la longitud de onda. Este espectro es un ejemplo de una función de distribución. Muestra cómo se distribuye la intensidad de fluorescencia en un rango de longitudes de onda.
La idea de una función de distribución es importante que puede haber encontrado anteriormente (por ejemplo, la distribución de velocidad Maxwell-Boltzmann) y volverá a encontrarse. El término espectroscopia también se usa en espectroscopía electrónica y espectroscopía de masas donde la distribución de energía de los electrones y la distribución de masa de iones son las cantidades de interés. Estas distribuciones dan el número absoluto o relativo de partículas con una energía o masa dada. En general, cualquier función que muestre cómo se distribuye alguna propiedad (es decir, una función de distribución) puede llamarse espectro.

En la dispersión, la luz incidente en un sistema atómico o molecular se desvía hacia otra dirección, y en el proceso la longitud de onda de la luz puede cambiar o no. Cuando la longitud de onda no cambia, la dispersión se llama dispersión elástica o Rayleigh, y cuando la longitud de onda sí cambia, se llama dispersión inelástica o dispersión Raman. Los espectros de dispersión muestran la intensidad de la radiación que se dispersa en alguna dirección en función de la longitud de onda de la radiación dispersa. En lugar de trazar la longitud de onda absoluta en el eje x, es común trazar el cambio en el valor del número de onda para la radiación, ya que esta cantidad es proporcional a la energía que queda en la molécula durante el proceso de dispersión.
Los espectros en Figuras\(\PageIndex{1}\) y\(\PageIndex{2}\) se caracterizan por rasgos intensos, que se denominan bandas espectrales o líneas, en algunos puntos del eje x. Los picos de las bandas espectrales están indicados por una estrella en las Figuras\(\PageIndex{1}\) y\(\PageIndex{2}\). Las bandas espectrales se caracterizan por tres cantidades: su ubicación en el eje x, su intensidad o altura, y su anchura o forma. La mecánica cuántica es necesaria para comprender y explicar estas características. A partir de este libro, aprenderás a interpretar y calcular las posiciones de las bandas en el eje x en términos de la estructura de nivel de energía de las moléculas y las intensidades en términos de los momentos de transición. Los anchos y formas de las bandas se deben a efectos dinámicos que lamentablemente están más allá del alcance de este libro.
La discusión anterior de la espectroscopia nos lleva a la pregunta: ¿Qué es la radiación electromagnética? Durante el siglo XIX, las investigaciones en las áreas de óptica, electricidad y magnetismo y la unificación de los conceptos resultantes por parte de Maxwell proporcionaron pruebas convincentes de que la radiación electromagnética consiste en dos campos u ondas sinusoidalmente oscilantes, un campo eléctrico y un campo magnético. En la situación más simple, que es la radiación en vacío, estos campos oscilan perpendiculares entre sí y perpendiculares a la dirección de propagación de la onda.
Se utilizan varias unidades para discutir la radiación electromagnética, y debe estar familiarizado con las conversiones entre ellas. Las tablas 3-5 proporcionan las unidades más utilizadas y sus relaciones. Estas unidades incluyen hercios, julios, electrón voltios, números de onda, Angstroms y nanómetros. Cualquiera de estas unidades, no solo longitud de onda, se puede usar al trazar un espectro.
El espectro electromagnético comúnmente se ve dividido en diferentes regiones. Estas regiones se clasifican por la naturaleza de la instrumentación (fuentes, selectores de longitud de onda y detectores) que se utilizan en los diferentes rangos de frecuencia. Las diferentes frecuencias de radiación corresponden a diferentes tipos de movimientos o grados de libertad dentro de una molécula, por ejemplo, movimiento rotacional (región de microondas), movimiento vibracional (región infrarroja), movimiento electrónico (generalmente visible a través de regiones de rayos X suaves) y movimiento nuclear y de espín electrónico (radio y regiones de microondas). Después de una descripción del desarrollo histórico de la mecánica cuántica y la introducción de algunos conceptos clave asociados a ella, este libro utiliza la mecánica cuántica para dar cuenta de los espectros asociados a estos movimientos e identificar lo que se puede aprender sobre estos grados de libertad de los espectros.
En el Cuadro 2 se enumeran los parámetros que caracterizan la radiación electromagnética. Como puede ver en esta tabla, las letras griegas a menudo se utilizan para representar cantidades físicas. El uso de símbolos hace que escribir ecuaciones y derivaciones y mostrar relaciones sea mucho más corto y rápido que usar palabras, pero pagamos un precio por esta conveniencia. Tenemos que recordar lo que significan los símbolos, y como hay más cantidades que símbolos, incluso con el uso de letras tanto latinas como griegas, algunos símbolos significan más de una cosa. En consecuencia, debemos deducir su significado del contexto. Las tablas al final de este capítulo le proporcionan información sobre las letras griegas y otros elementos como unidades y constantes físicas que te resultarán útiles.
Mientras que los espectros a menudo se representan con la longitud de onda, y a veces con los valores del número de onda o la frecuencia, en el eje x, generalmente se necesita la energía asociada con un fotón a una longitud de onda particular para relacionar los espectros con la estructura de nivel de energía de las moléculas. Las siguientes relaciones convierten la longitud de onda λ, los números de onda\(\bar {\nu}\) y la frecuencia ν en energía fotónica E.
\[E = \dfrac {hc}{\lambda} \label {1.4}\]
\[E = hc \bar {\nu} \label {1.5}\]
\[E = h \nu \label {1.6}\]
donde\(c\) esta la velocidad de la luz en un vacio.
Dado que los números de onda y la frecuencia son proporcionales a la energía, a veces los espectroscopistas miden la energía en estas unidades por conveniencia.


