5.2: El proceso Haber-Bosch
- Page ID
- 79234
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)El Proceso Haber-Bosch es una de las reacciones industriales más importantes del mundo. Proporciona la síntesis de amoníaco directamente a partir del nitrógeno elemental, N 2, e hidrógeno, H 2. Desde su desarrollo a principios del siglo XX, ha llevado a la producción de una enorme cantidad de fertilizantes, incrementando enormemente la producción mundial de alimentos. Como resultado, se estima que una fracción significativa del contenido de nitrógeno en el cuerpo humano típico se deriva en última instancia de este proceso.
En el momento de su desarrollo, el Proceso Haber-Bosch suplantó una creciente dependencia del guano, excrementos de aves marinas, cosechados para enriquecer las tierras de cultivo. A pesar de que este método había sido practicado por los incas durante siglos, la demanda europea a finales del 1800 ejerció una presión creciente sobre los recursos en Perú y el Caribe. Debido a que el nitrógeno es un factor limitante para el crecimiento de las plantas, el tratamiento del suelo con guano rico en nitrógeno y fósforo condujo a una mejora notable en los rendimientos de los cultivos.
A finales de la década de 1700, Henry Cavendish había podido producir nitratos con un arco eléctrico en el aire. Un desarrollo noruego, el Proceso Birkland-Eyde, aprovechó la energía hidroeléctrica disponible en ese país para escalar la hazaña de Cavendish a la producción industrial, pero la reacción seguía siendo terriblemente ineficiente. Fritz Haber pudo desarrollar un procedimiento mucho más exitoso para la producción de amoníaco (el estado reducido, en lugar de los nitratos oxidados), el cual fue adoptado por BASF. Originalmente la local Baden Aniline and Soda Factory, esta compañía alemana es ahora el mayor productor de productos químicos del mundo.
El propio Haber fue una figura fascinante y polémica que esperaba mejorar la condición humana a través de contribuciones industriales a la agricultura; también desarrolló pesticidas. No obstante, fue condenado rotundamente por desarrollar e implementar gas cloro contra las tropas aliadas durante la Primera Guerra Mundial Aunque Haber, quien era judío, murió antes del Holocausto, muchos miembros de su familia extendida fueron asesinados en campos de concentración; en algunos de estos campos, los internos fueron ejecutados por veneno derivado de los pesticidas de Haber.
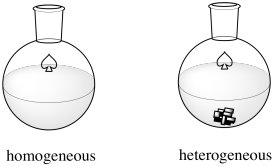
El Proceso Haber-Bosch es un ejemplo de catálisis heterogénea. Muchos catalizadores operan a través de catálisis homogénea, en la que la reacción ocurre en una fase (en solución). En catálisis heterogénea, la reacción ocurre en la interfaz entre dos fases. En este caso, las dos fases son la fase gaseosa y la fase sólida. Los reactivos, hidrógeno y nitrógeno, son ambos gases. Ambos se introducen en un recipiente bajo presión enromática y alta temperatura. El catalizador es un óxido de hierro cuidadosamente preparado soportado sobre una mezcla de otros óxidos metálicos, aunque también se han utilizado variaciones de rutenio y osmio y ofrecen algunas ventajas.
En este caso, la reacción involucra reactivos en fase gaseosa y un catalizador sólido. La reacción tiene lugar en la superficie del catalizador. Podríamos representar tal superficie como una fila de átomos. La reacción tiene lugar solo en la superficie de los átomos (por ejemplo, a lo largo de la parte superior de la imagen de abajo). Las filas de átomos debajo de la superficie no contribuirían necesariamente a la reacción. En la imagen de abajo, la segunda fila de átomos podría no desempeñar ningún papel en la reacción, aparte de proporcionar un lugar para que la fila superior de átomos se asiente.

Podría ser más conveniente pensar en la reacción que ocurre en una superficie plana de metal, ignorando su composición de átomos.
Entonces, las moléculas vienen y reaccionan en esa superficie. Los mecanismos por los cuales las moléculas reaccionan en la superficie pueden ser familiares para nosotros. Podemos encontrar paralelismos en la química organometálica. La superficie está, después de todo, hecha de átomos metálicos.
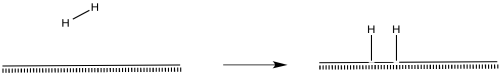
Las moléculas de hidrógeno probablemente se activan a través de la adición oxidativa.
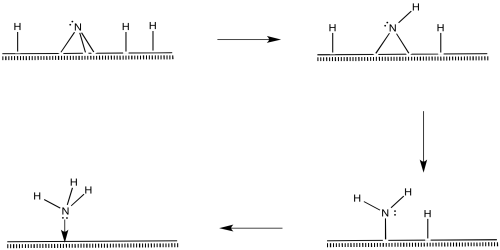
Las moléculas de nitrógeno también deben unirse en la superficie.
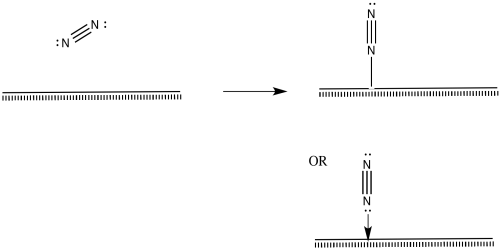
El nitrógeno se representa como “unido al extremo” anteriormente, usando su par solitario para unirse al metal. También es posible que la molécula se incline y se vuelva “unida de lado”.

¿Cómo reaccionan más el nitrógeno y los hidrógenos para hacer amoníaco? Hay diferentes posibilidades. Por ejemplo, una reacción de inserción 1,2-parece posible.
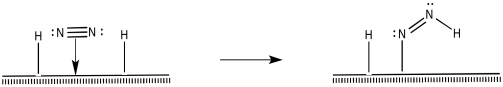
Después de eso, una eliminación reductiva resultaría en la formación de un segundo enlace N-H.
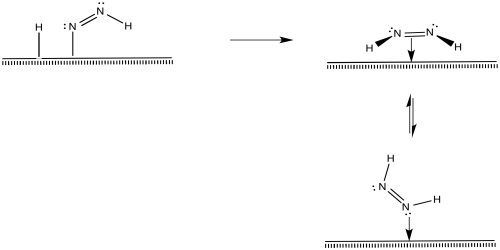
Ese proceso, hasta el momento, da como resultado la conversión de dinitrógeno a diazeno, N 2 H 2. El diazeno podría reaccionar más para producir hidrazina (N 2 H 4) y, en última instancia, amoníaco.
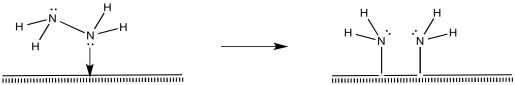
Por supuesto, la reacción también podría ocurrir de otras maneras. Existen estudios superficiales que sugieren la presencia de nitruros, imidas y amidas (M = N, M=NH, M-NH 2). La presencia de nitruros sugiere una serie de adiciones oxidativas comenzando con dinitrógeno, procediendo hasta nitruro, N 3-.
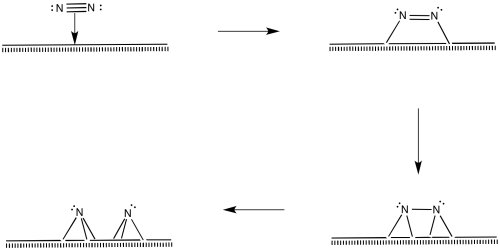
Una vez que el nitruro está en su lugar, los enlaces N-H podrían formarse a través de eliminaciones reductoras. La primera aminación reductora daría como resultado una imida, la segunda produciría una amida y la tercera produciría amoníaco.